植物激素协同螯合剂对蓖麻修复Cd污染土壤的影响
王沛琦,胡学礼,赵明辉,胡尊红,杨 谨,刘旭云,李文昌
(1.云南省农业科学院经济作物研究所,昆明 650205;2.衡水京华化工有限公司,河北 衡水 053000)
【研究意义】镉(Cd)具有极高的生物毒性以及植物可利用性,可对生态系统产生极大的破坏作用[1-2]。随着工业、农业的迅猛发展,尤其是污水灌溉、农药化肥的大量施用和采矿及冶炼产生的尾矿堆经风化、雨淋流出的废液、废渣等使得中国土壤中Cd的点位超标率已达7.0%,成为了目前最突出的土壤重金属污染物,严重威胁粮食生产安全,直接危害人类健康[3-4]。因此,如何对Cd污染土壤进行治理具有重要的研究价值。【前人研究进展】植物修复矿区污染农田是一个漫长的过程,如何提高植物修复效率是目前研究的热点。目前提高植物修复效率的措施主要有添加改良剂、施肥、改善栽培措施以及基因改良等[5]。通过添加螯合剂(EDTA)可以提高植物对重金属Cd的耐性,促进植物对Cd的吸收,但螯合剂存在潜在环境风险,同时对植物的胁迫作用会抑制植物的生长发育[6]。研究发现进行螯合诱导植物提取重金属的同时,施加外源激素可以有效缓解重金属及螯合剂对植物的胁迫作用,促进植物生长发育,提高植物提取效率。Tammam等[7]研究发现,赤霉素(GA3)、吲哚乙酸(IAA)与EDTA联合,缓解了EDTA对植物生长的负面影响,并显著增加了根对铅的吸收量。Jan等[8]研究发现,GA3、IAA与EDTA联合施用,显著促进了豚草的生长和Cd的提取,与对照相比每株豚草Cd含量提高了6.72 mg。陈明威等[9]研究表明低浓度ABA可以促进茴香植株生长,促进其对Cd的吸收。李波[10]研究了EDTA与IAA、萘乙酸(NAA)对龙葵等植物镉富集能力的影响,发现二者联合施用能减缓螯合剂对植物的毒害,同时对植物的镉富集能力有较大的促进作用。【本研究切入点】近些年来,研究者们发现了大批高效吸收、转移和清除Cd的超富集植物,如天蓝遏蓝菜[11]、宝山堇菜[12]、龙葵[13]等,但这些超积累植物往往存在个体矮小、生长缓慢、生物量低、修复周期长等问题,导致修复效果不够明显。蓖麻(RicinuscommunisL.)是一种富集及耐Cd能力强、经济价值高的能源作物,同时具有根系广、生物量大、可宿生的特点及很强的耐旱、耐贫瘠能力,在土壤Cd污染修复及矿区生态恢复中具有很高的应用价值和开发潜力[14-15]。目前有关螯合剂联合植物激素,缓解螯合剂及重金属对植物损伤和强化蓖麻萃取土壤中重金属Cd的研究还未见报道。【拟解决的关键问题】本研究通过盆栽试验,研究螯合剂(EDTA)协同外源激素(IAA、ABA)对蓖麻富集Cd的强化效果,以期为中国Cd污染农田修复提供科学依据。
1 材料与方法
1.1 供试土壤
用于试验的土壤取自云南省农业科学院富民基地耕地表层(0~20 cm)的红壤土,风干后测定其基本理化性质:pH 5.48,有机质36.50 g/kg,全氮0.165%,全磷0.108%,全钾0.329%,水解性氮162.80 mg/kg,有效磷38.06 mg/kg,速效钾371.00 mg/kg,总Cd0.31 mg/kg。
1.2 供试材料
供试的改良剂为植物激素IAA及ABA,螯合剂为EDTA,均购买于赛捷生物科技有限公司。供试植物为宿生蓖麻品种滇蓖2号,来自云南省农业科学院经济作物研究所。
1.3 试验设计
2020年在云南省农业科学院经济作物研究所温室进行盆栽试验。选用直径80 cm、高60 cm的塑料花盆,每盆装过筛、风干土20 kg,以分析纯CdCl2·2.5 H2O为处理剂,试验土壤重金属Cd含量为 100 mg/kg。CdCl2·2.5 H2O与风干土充分混匀装盆后,静置络合20 d。选取成熟饱满的蓖麻种子经次氯酸钠消毒后用温水浸泡24 h,将其播种于不添加Cd的育苗基质中,待蓖麻出苗生长15 d后移入络合好的、Cd含量为100 mg/kg的盆中,30 d后进行不同外源激素协同螯合剂处理,IAA及ABA采用叶面喷施方式,EDTA采用根部施加方式。外源激素IAA、ABA的浓度各采用5、10、20 mg/kg 3个浓度梯度。研究表明高浓度EDTA会严重抑制蓖麻地上部生长甚至导致其死亡,5 mmol/kg EDTA能够提高蓖麻重金属吸收率,达到较好的修复效果[16],故本研究螯合剂EDTA浓度设为5 mmol/kg;以不添加外源激素、EDTA及喷施清水为对照(CK),具体试验设置见表1。共设置10个处理,每个处理重复3次,每个重复1盆,每盆3株植株。处理30 d后收获。
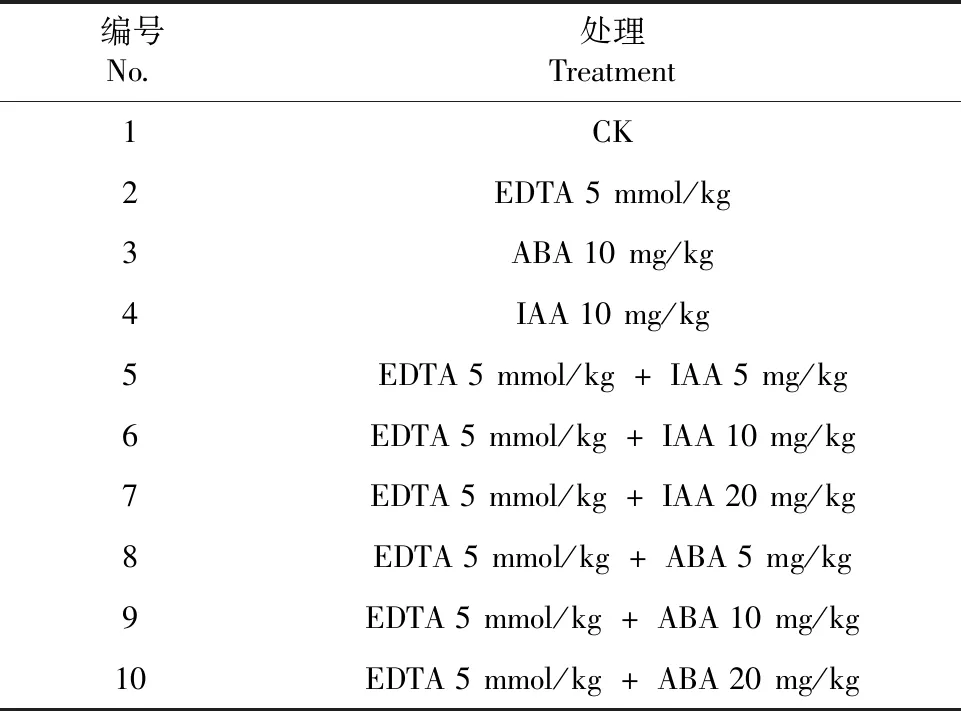
表1 试验处理方案Table 1 Test treatment
1.4 测定方法
1.4.1 生物量测定 对蓖麻株高进行测量,分根、茎、叶采收,先用自来水冲洗,然后用去离子水冲洗干净,滤纸吸干水分,烘箱105 ℃杀青1 h后,75 ℃烘干至恒重并进行蓖麻样品干重称量。
1.4.2 样品Cd含量测定 每个重复取根际土样2 kg,土样自然风干后过筛,待测;植物样品研磨粉碎后过筛,待测。植物样品及土样加入浓硝酸-高氯酸(v∶v=4∶1),采用混合酸湿法消化,消化液中Cd含量采用原子分光光度计火焰吸收法进行测定[17],测定仪器型号为AA240Z(美国安捷伦)。
1.5 数据处理
根据以下公式计算植株Cd积累量及转运系数。
地上部分Cd积累量(mg/株)=地上部分生物量×地上部分Cd含量
根部Cd积累量(mg/株)=根部生物量×根部Cd含量
转运系数=地上部分Cd含量/根部Cd含量
土壤Cd提取率(%)=整株Cd积累量/(污染土壤Cd含量×污染土壤质量)x100
采用Excel 2007进行数据统计及作图,SPSS 20.0对试验数据进行方差分析。
2 结果与分析
2.1 不同处理对蓖麻生长的影响
本研究对不同处理下蓖麻株高和生物量等进行测量,结果如表2所示,与处理1(CK)相比,在单纯植物激素处理下,蓖麻株高及干重增加;与单纯添加EDTA相比,EDTA与植物激素配合施用处理下的蓖麻株高及干重也增加。每个处理对蓖麻株高和生物量的影响不一致,各处理间差异显著,在所有处理中,处理4(IAA 10 mg/kg)的蓖麻株高最高、地下部分及地上部分干重最重,分别较处理1(CK)增加17.88%、16.18%及18.79%;其次是处理3(ABA 10 mg/kg),分别较处理1(CK)增加7.88%、7.99%及5.28%;处理2(EDTA 5 mmol/kg)的株高及生物量最低,分别较处理1(CK)降低14.89%、18.84%及23.11%。
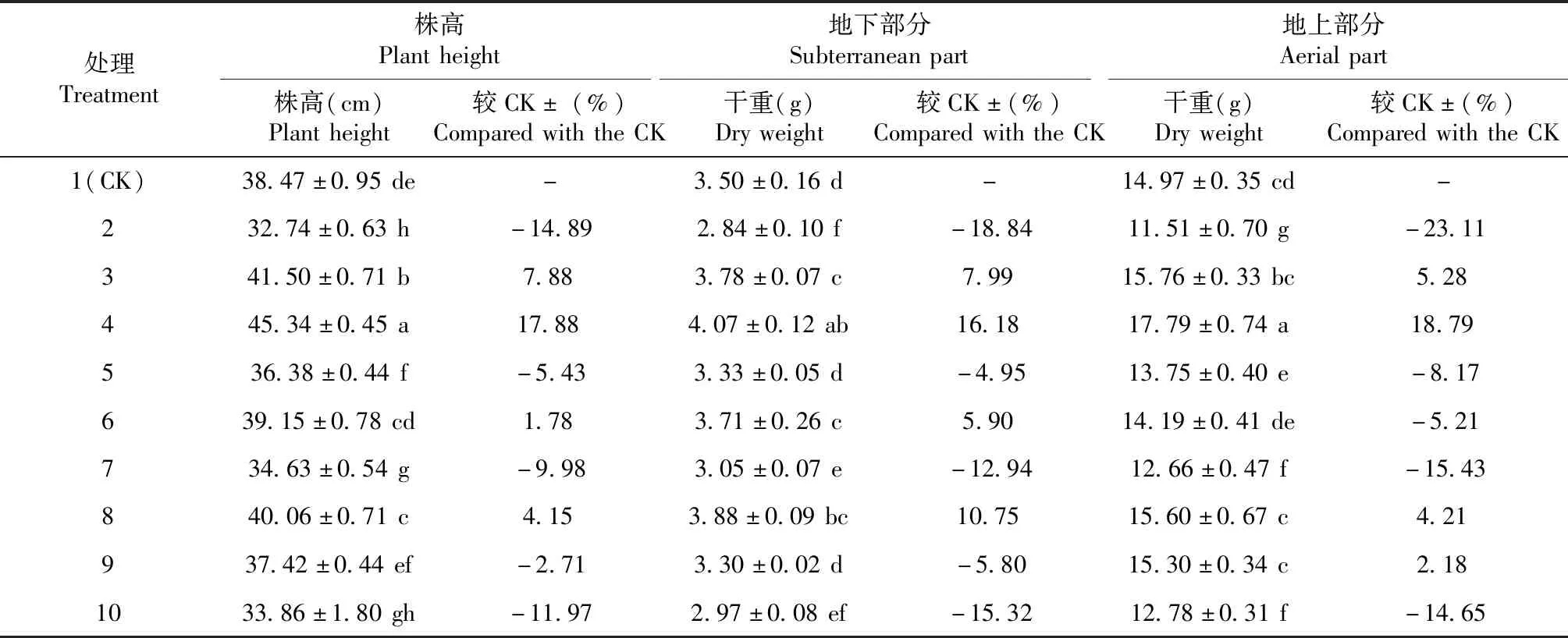
表2 不同处理对蓖麻株高和生物量的影响Table 2 Effects of different treatments on plant height and biomass of R.communis
2.2 不同处理下蓖麻对Cd吸收的影响
由图1可以看出,与处理1(CK)相比,单独添加螯合剂以及螯合剂与植物激素配合施用均能够提高蓖麻植株体内的Cd含量;根、茎、叶中镉积累量的变化范围分别为33.59~69.45、18.99~35.00、5.96~48.23 mg/kg。单独施用EDTA(处理2)时,蓖麻根中Cd含量与处理1(CK)差异不显著,而茎、叶中Cd含量均高于处理1(CK),提高幅度分别为16.01%、279.53%,且茎、叶含量与处理1(CK)相比差异显著(P<0.05);单独施用ABA(处理3)时,蓖麻根、茎、叶中Cd含量与处理1(CK)相比差异不大;单独施用IAA(处理4)时,蓖麻根、茎、叶中Cd含量均高于处理1(CK),提高幅度分别为12.99%、6.84%和26.81%,且根、叶中Cd含量与处理1(CK)差异显著(P<0.05);同时施加螯合剂和植物激素处理时,蓖麻根、茎、叶中Cd含量均高于处理1(CK),与处理1(CK)比较差异显著(P<0.05);其中表现最好的为处理6(EDTA 5 mmol/kg + IAA 10mg/kg),根、茎、叶Cd含量分别为69.45、35.53、48.23 mg/kg,较处理1(CK)分别提高105.90%、76.15%和524.74%。另外,蓖麻各器官对Cd吸收量在处理2、处理5、处理6及处理8下均呈现出根>叶>茎,其余处理均呈现出根>茎>叶。

不同小写字母表示同一指标在不同处理下差异显著(P<0.05)。下同。Different lowercase letters indicate the significant difference in the same index under different treatments (P<0.05).The same as below.图1 不同处理下蓖麻的Cd含量Fig.1 Cd content in R.communisunder different treatments
2.3 不同处理对蓖麻Cd富集能力的影响
从表3可以看出,不同处理下地上部的Cd积累量远远高于根部的Cd积累量。与处理1(CK)相比,处理2(EDTA 5 mmol/kg)的蓖麻地上部分及整株的Cd积累量均显著增加,分别为0.95、1.05 mg/株,而根部Cd积累量显著减少。蓖麻根部、地上部及整株的Cd积累量,处理3与处理1(CK)差异不显著;处理4与处理1(CK)相比显著增加。EDTA与IAA配施、EDTA与ABA配施与处理1(CK)及单一施加EDTA处理相比,Cd积累量总体呈增加趋势,其中处理6(EDTA 5 mmol/kg+IAA 10 mg/kg)的根部、地上部及整株Cd积累量在所有处理中最大,分别为0.26、2.06及2.32 mg/株,较处理1(CK)分别提高116.67%、390.48%和329.63%;其次是处理8(EDTA 5 mmol/kg+ABA 5 mg/kg),分别为0.24、1.85及2.10 mg/株,较处理1(CK)分别提高100%、340.48%和288.89%。综上所述,单施EDTA及EDTA与一定浓度植物激素配施均能增加蓖麻的Cd积累量,且EDTA与一定浓度植物激素配施效果更好。
转运系数可以很好地反映不同处理组合对蓖麻转运Cd能力的影响,转运系数即植物地上部分重金属含量与地下部分重金属含量之间的比值。从表3可以看出,EDTA处理、EDTA协同植物激素处理均显著提高了蓖麻对Cd的转运系数。除处理1(CK)、处理3(ABA 10 mg/kg)、处理4(IAA 10 mg/kg)外,其余处理对镉的转移系数均大于1,其中处理7(EDTA 5 mmol/kg + IAA 20 mg/kg)的转移系数最大,为2.68;处理3(ABA 10 mg/kg)的转移系数最小,为0.74。

表3 不同处理对Cd积累量的影响Table 3 Effects of different treatments on Cd accumulation
2.4 不同处理对Cd污染土壤的净化作用
从图2可以看出,EDTA、IAA单施及EDTA与植物激素配施都不同程度提高了蓖麻对土壤中Cd的提取效率,单施ABA效果不明显。单施IAA(处理4)时,提取率由0.27%增加到0.36%。单施EDTA(处理2)时,提取率由0.27%增加到0.53%。EDTA与IAA配施(处理5、6、7)时,随着IAA浓度的增加,土壤Cd提取率先增加后降低,当IAA浓度为10 mg/kg时提取效率最高,为1.16%;当IAA浓度为5 mg/kg时提取效率最低,为0.65%,3个处理均显著高于处理1(CK)(P<0.05)。EDTA与ABA配施(处理8、9、10)时,随着ABA浓度的增加,土壤Cd提取率逐渐降低,当ABA浓度为5 mg/kg时提取效率最高,为1.05%;当ABA浓度为20 mg/kg时提取效率最低,为0.56%,3个处理均显著高于处理1(CK)(P<0.05)。
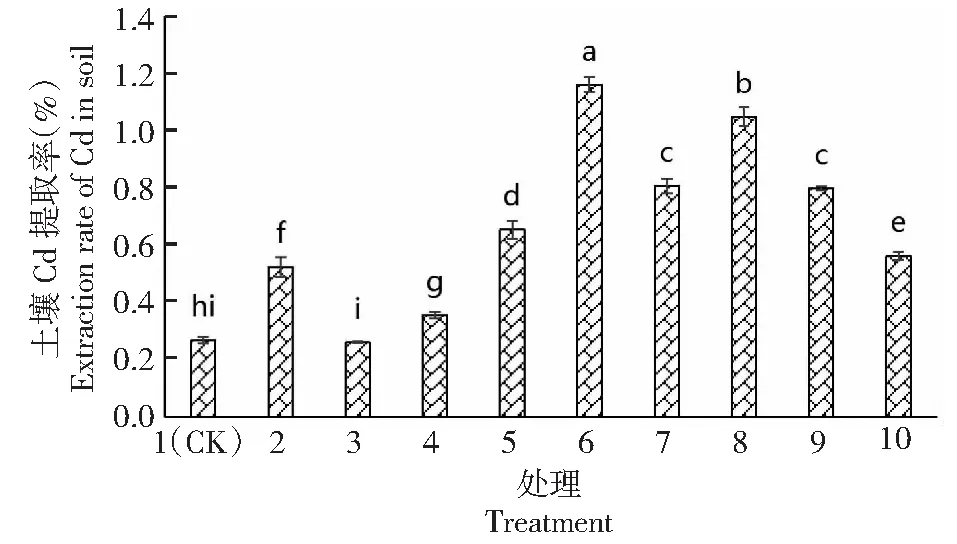
图2 不同处理对污染土壤Cd提取率的影响Fig.2 Effect of different treatments on soil Cd phytoextraction rate
3 讨 论
3.1 IAA、ABA和EDTA对蓖麻生长的影响
生物量是评价植物修复重金属污染能力大小的一个关键因素,主要是株高、干重等指标。本研究对不同处理下蓖麻长势、株高、地下部分及地上部分干重进行观察测量,发现蓖麻在本试验条件下可以正常生长,不同处理间有一定差异,但没有明显的重金属中毒现象;在单纯植物激素IAA或ABA处理下,蓖麻株高及干重均有所增加,尤以IAA处理下的增加最多,这与其施用在东南景天、玉米等作物上的研究结果相一致[18-19],其原因可能是IAA不仅能缓解重金属及螯合剂对植物的毒害,还能促进细胞分化和伸长,而ABA虽然可以增强植物抗逆性、缓解逆境胁迫带来的损伤,但是可能会引起植物气孔关闭及抑制植物生长,从而导致ABA在促进蓖麻生长方面效果没有IAA显著;陈晶[20]研究表明,高浓度植物激素会抑制蓖麻生长,可能是由于过高浓度植物激素会干扰正常的蛋白质和核酸代谢过程,从而使植物生长减缓。在单纯添加EDTA的处理下,较处理1(CK)、单施植物激素及其与植物激素配施,蓖麻生物量有所降低,说明植物激素配施螯合剂可以缓解螯合剂及重金属对植物的损伤,提高植株生物量,这与刘金等[21]对苎麻的研究结果相一致,但与张雅睿等[22]对苍耳的研究结果不一致,这可能与不同物种对螯合剂处理的反应程度不同有关。在所有处理中,处理4(IAA 10 mg/kg)的蓖麻株高最高、地下部及地上部干重最重,分别为处理1(CK)的1.18、1.16和1.19倍。
3.2 IAA、ABA和EDTA对蓖麻Cd吸收的影响
施加适量植物激素及螯合剂,可以提高土壤重金属有效性,增加植物各部位的Cd含量,这已经在许多研究中得到证实[23-24],本研究也得到了相似的结论。单独添加EDTA时蓖麻根部重金属含量稍低于处理1(CK),但地上部含量显著高于处理1(CK),约为处理1(CK)的3倍,这是因为EDTA作为最常用的螯合剂,与金属离子螯合使重金属的溶解度增加,从而增加重金属在根系的扩散范围,提高生物有效性,有利于蓖麻吸收富集重金属,导致地上部分重金属含量增加[25-27]。IAA单独施用或EDTA与IAA联合施用,蓖麻根部及地上部的Cd含量相较于处理1(CK)总体呈现不同程度的提高,这可能是IAA促进了蓖麻组织生长,调节了根形态及根际生态环境,从而影响了土壤中有效态Cd的吸收[28]。
3.3 IAA、ABA和EDTA对蓖麻Cd积累的影响
重金属积累总量与植物对重金属的吸收能力、植物的生物量紧密相关。在本研究中,单施IAA使蓖麻地上部分及地下部分Cd积累量较处理1(CK)提高,但转移系数较处理1(CK)下降,进一步验证IAA促进蓖麻地上部分Cd积累主要是因为IAA促进蓖麻组织生长,而不是提高蓖麻根系向上转运Cd的效率。单施ABA,蓖麻根部Cd积累量较处理1(CK)有所增加,地上部及转移系数较处理1(CK)均有所下降,这表明ABA处理能降低植物地上部Cd的积累,并在一定程度上缓解Cd对蓖麻植株的毒害作用[29-30]。单施EDTA及EDTA与植物激素配施处理均能增加蓖麻地上部分及整株的Cd积累量,但EDTA与植物激素配施效果更好,这与周建明等[31]对玉米的研究结果相似,EDTA协同IAA处理玉米地上部分对重金属Cd的积累效果优于单独施用EDTA。其原因可能是配施的植物激素有利于细胞分裂,可以更好地促进金属螯合物向植物细胞中的液泡和细胞壁移动,在螯合剂促进植物吸收更多重金属时缓解了重金属或螯合剂对植物的毒性,使植物的生长发育不受到明显伤害[32]。同时EDTA处理及EDTA协同植物激素处理也显著提高了蓖麻对Cd的转运系数,这与张玉芬等[33]的研究结果一致。
3.4 IAA、ABA和EDTA对Cd污染土壤的净化
植物对土壤中Cd的提取效率大小可以反映植物对Cd污染土壤的修复效果[34-35]。本研究中EDTA与植物激素配施比单施EDTA或植物激素对蓖麻提取土壤中Cd的强化作用更强,与上述蓖麻对Cd的富集能力研究结果相一致。
综上所述,单独施用螯合剂强化植物修复,虽能显著提高修复效率,但其具有毒性较高、不易降解、价格较贵等缺点;单独施用植物激素强化植物修复,修复效率提高不显著;本研究采用植物激素协同螯合剂强化植物修复的方法,可以将其优缺点互补,在提高植物富集重金属能力的同时缓解螯合剂及重金属对植物的伤害,保证生物量不降低或降低最少,以达到提高重金属总富集量及兼顾环境保护的目的。但本研究还处在实验室模拟阶段,未对机理方面进行深入研究,下一步应加强对土壤田间植物修复及修复机理方面的研究,为植物修复重金属污染土壤技术应用于大规模重金属污染土壤治理提供理论依据。
4 结 论
(1)单独施用植物激素可以促进蓖麻生长,单独施用EDTA对蓖麻生长有一定的抑制作用。
(2)单独施用EDTA、IAA及EDTA与IAA、ABA联合施用可增加蓖麻对土壤中Cd的吸收,其中IAA和EDTA联用的效果比ABA和EDTA联用更好。EDTA与IAA联用处理蓖麻整株Cd积累量较处理1(CK)增加329.63%,EDTA与ABA联用处理蓖麻整株Cd积累量较处理1(CK)增加288.89%。
(3)EDTA单施及EDTA与植物激素配施都不同程度提高了蓖麻对土壤中Cd的提取效率。单施EDTA时,提取率为0.53%。EDTA与10 mg/kg IAA配施时提取效率为1.16%;EDTA与5 mg/kg ABA配施时提取效率为1.05%。植物激素协同螯合剂能有效地提升Cd污染土壤植物修复效率。

