脂酰辅酶A合成酶抑制剂Triacsin C对弓形虫速殖子体内增殖抑制效果的观察
杨晓伟,吴 迪,朱盈名,赵自亮,朱桓奕,冯旭东,王迎平,赵光伟,2* (.西南大学 动物医学学院,重庆 荣昌 402460; 2.重庆三杰众鑫生物工程有限公司,重庆 荣昌 402460)
弓形虫(Toxoplasmagondii)是一种呈世界性分布且严重危害人类健康的人兽共患寄生虫。哺乳动物和禽类均易感,资料显示全世界约有30%的人携带弓形虫,患弓形虫病的孕妇可引起流产、死胎,或生下发育缺陷的患儿,弓形虫现已被列为感染性致畸综合征的主要病原之一[1-2]。此外,弓形虫病也可导致动物流产、弱胎、死胎、生长受阻及死亡,给畜牧业造成巨大的经济损失[3],因此,开展对弓形虫感染的防治具有重要的公共卫生学意义。
当前,控制弓形虫病仍主要依赖于药物治疗,常用的治疗药物主要有3类,第一类是抗生素类,包括大环内酯类、半合成四环素类和林可胺类抗生素,其中大环内酯类药物阿奇霉素的效果最为显著;第二类是化学合成药物,包括磺胺类和喹诺酮类药物;第三类是中药制剂,包括单味中药和复方中药,如青蒿素、甘草酸、黄芩苷以及由黄芪、白术、青蒿等组成的抗弓形虫复方汤等[4]。三类药物均有抑制弓形虫增殖的能力,但也存在复发率高、根治效果差,有一定毒副作用的缺点,对免疫功能缺陷患者治疗效果欠佳[5]。鉴于此,探寻高效、低毒的抗弓形虫药物是十分必要的。
脂酰辅酶A合成酶( Acyl-CoA synthetase,ACS )是在弓形虫能量和脂类代谢中发挥重要作用的一种Ⅱ类脂肪酸合成酶。目前,ACS作为药物靶点在隐孢子虫、球虫上面取得了很大的进展[6],然而在弓形虫的研究中尤其是作为靶点筛选治疗药物方面仍是空白。Triacsin C是一种强效的长链脂酰辅酶A合成酶抑制剂,理论上应该能够干扰弓形虫速殖子脂质的合成,从而抑制其增殖。为验证其是否具有抑制效果,本试验在小鼠体内进行了不同浓度Triacsin C对弓形虫速殖子增殖抑制效果的试验,以期为抗弓形虫感染药物的研发提供参考。
1 材料与方法
1.1 弓形虫虫株弓形虫RH虫株由新乡医学院王帅博士惠赠,在本实验室传代保种。
1.2 主要试剂Triacsin C购自Abcam公司,二甲亚砜(DMSO)购自上海生工生物工程有限公司,磺胺嘧啶(SMZ)购自山东新华制药股份有限公司,阿奇霉素(AZM)购自石药集团欧意药业有限公司,DNA快速抽提试剂盒和TB Green®Premix Ex Taq购自TaKaRa公司等。
1.3 引物和探针基于弓形虫529 bp重复序列(AFl46527)的保守区域,利用软件Primer5.0设计2对引物,TOX-F5′-AGAGTTTGATCCTGGCTCAG-3′,TOX-R5′-TTGTCCGGGTTGTACTCG-TC3′,扩增目的片段大小为529 bp,用于构建弓形虫阳性标准品;qTOX-F5′-CACAGAAGGGCCAGAAGT-3′,qTOX-R5′-CATCACCACGAGGA-AAGC-3′,扩增目的片段大小为252 bp,用于弓形虫荧光定量SYBR GreenⅠ检测方法。引物由华大基因合成。
1.4 试验动物昆明系小鼠120只,体质量(20±2) g,雌雄各1/2,购自重庆国家生物产业基地实验动物中心。
1.5 动物试验分组健康小鼠随机分成12组,每组10只,如表1所示。设立7个感染组,感染组每只小鼠腹腔感染2×105RH株弓形虫速殖子,不感染组小鼠仅注射等量的灭菌生理盐水。参照GUO等[7]研究Triacsin C体内抑制小隐孢子虫的药物剂量,本试验将Triacsin C利用DMSO溶解后稀释,按照1×10-2,2×10-2,4×10-2,8×10-2g/L的剂量(0.1 mL)1次/d灌胃服用(表1),连用3 d;同时设有磺胺嘧啶,阿奇霉素和DMSO对照组。感染后每日观察并记录小鼠发病及死亡情况,连续观察7 d。第8天,通过颈椎脱臼法致死所有存活小鼠用于后续试验。
1.6 小鼠腹水中速殖子计数用75%酒精小鼠全身体表消毒,剪开并剥去腹部皮肤。无菌腹腔注射灭菌的生理盐水液2 mL,随即轻轻按摩腹部,使生理盐水和腹腔液混匀,小心抽取腹腔液(避免针头刺破内脏,以免出血造成污染)装入干燥无菌离心管内。吸取少许腹腔冲洗液,用细胞计数板计数其中的速殖子。
1.7 小鼠肝脏中弓形虫DNA含量的测定小鼠死亡或处死后,无菌剪取肝脏0.5 g,加入1 mL灭菌生理盐水研磨成浆,利用DNA提取试剂盒提取核酸-20℃保存,作为模板备用。
1.7.1弓形虫重组质粒标准品的建立 首先利用弓形虫529重复序列特异性扩增引物进行PCR扩增,反应条件为:94℃预变性7 min,94℃变性1 min,55℃退火1 min,72℃延伸1 min,35个循环;72℃延伸10 min。阳性PCR产物经胶回收试剂盒回收并纯化后连接到pBLUE-T载体,转化进大肠杆菌DH5α感受态细胞,筛选阳性克隆,送华大基因测序。将测序鉴定正确的阳性质粒命名pBLUE-T-Tox,作为重组质粒标准品。采用超微量分光光度计测定标准品浓度,根据公式计算标准品拷贝数。拷贝数=(6.02×1023拷贝/mol)×DNA量(g)/[DNA长度(碱基数)×660 g/(mol·碱基)]。
1.7.2弓形虫SYBR GreenⅠ荧光定量检测方法的建立 反应体系为20 μL,其中TB Green Premix Ex Taq 10 μL,上、下游引物(qTOX)各1 μL,模板2 μL,ddH2O补足20 μL。反应条件为:95℃ 30 s,95℃ 5 s,60℃ 30 s,共40个循环。
1.7.3弓形虫SYBR GreenⅠ荧光定量PCR标准曲线的建立 利用ddH2O将质粒标准品pBLUE-T-Tox连续10倍稀释成1010~100拷贝/μL浓度的质粒标准品,用1.7.2中的反应条件进行实时荧光定量PCR扩增,以log稀释倍数为横轴,以Ct值为纵轴建立标准曲线,每个稀释度设置3个重复孔进行重复性试验,通过计算重复性试验中Ct值的变异系数来评估检测方法的重复性。
1.7.4小鼠肝脏样本弓形虫DNA拷贝数的计算 对每份小鼠肝脏样本进行SYBR GreenⅠ荧光定量PCR检测,其结果(Ct值)经标准曲线换算出弓形虫DNA的拷贝数。
1.8 病理组织学观察小鼠死亡或处死后,迅速剖检,采集心脏、肺脏、脾脏、肝脏、肾脏和脑组织,置于10%的甲醛中固定保存24 h,制备石蜡组织切片[8],HE染色后镜检观察其病理变化。

2 结果
2.1 弓形虫荧光定量检测标准品的构建克隆载体pBLUE-T(2 983 bp)与弓形虫529 bp的PCR产物重组构建成重组克隆质粒,用TOX引物进行PCR鉴定,目的条带与预期一致(图1)。
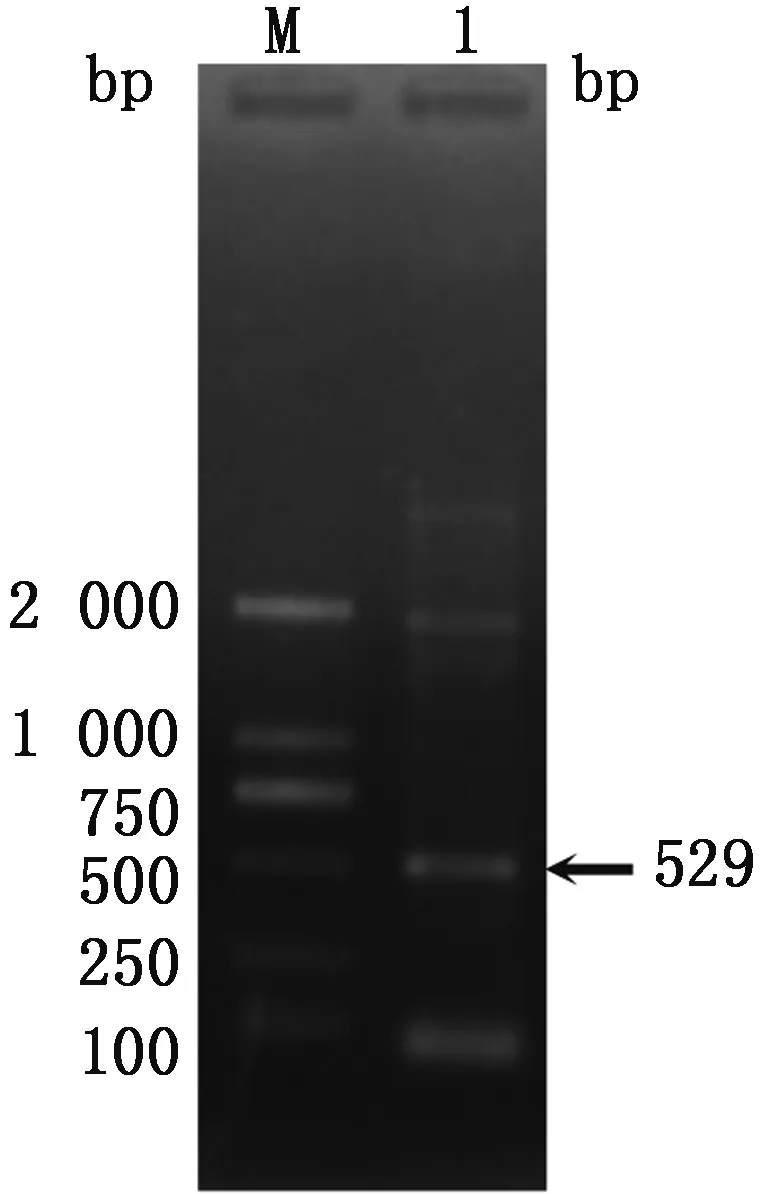
M.DL2000 DNA Marker;1.重组质粒pBLUE-T-Tox
2.2 阳性标准质粒浓度测定及拷贝数计算通过核酸蛋白检测仪测定阳性标准质粒的质量浓度的平均值为148.3 mg/L,利用拷贝数计算公式将该结果换算为拷贝数,最终计算得到构建的阳性标准质粒的拷贝数为3.8×1010拷贝/μL。
2.3 SYBR GreenⅠ荧光定量PCR标准曲线及重复性将质粒标准品以10倍稀释成108~103拷贝/μL浓度的质粒标准品,建立标准曲线如图2所示,标准曲线的方程为y=-2.857x+37.769,相关系数R2=0.998。每个稀释度设置3个重复孔来进行重复性试验,其结果见表2,统计学分析检测重复孔的变异系数为0.344%~1.038%,表明所建立的弓形虫荧光定量PCR检测方法具有良好的重复性和稳定性。

表2 荧光定量PCR检测方法的重复性
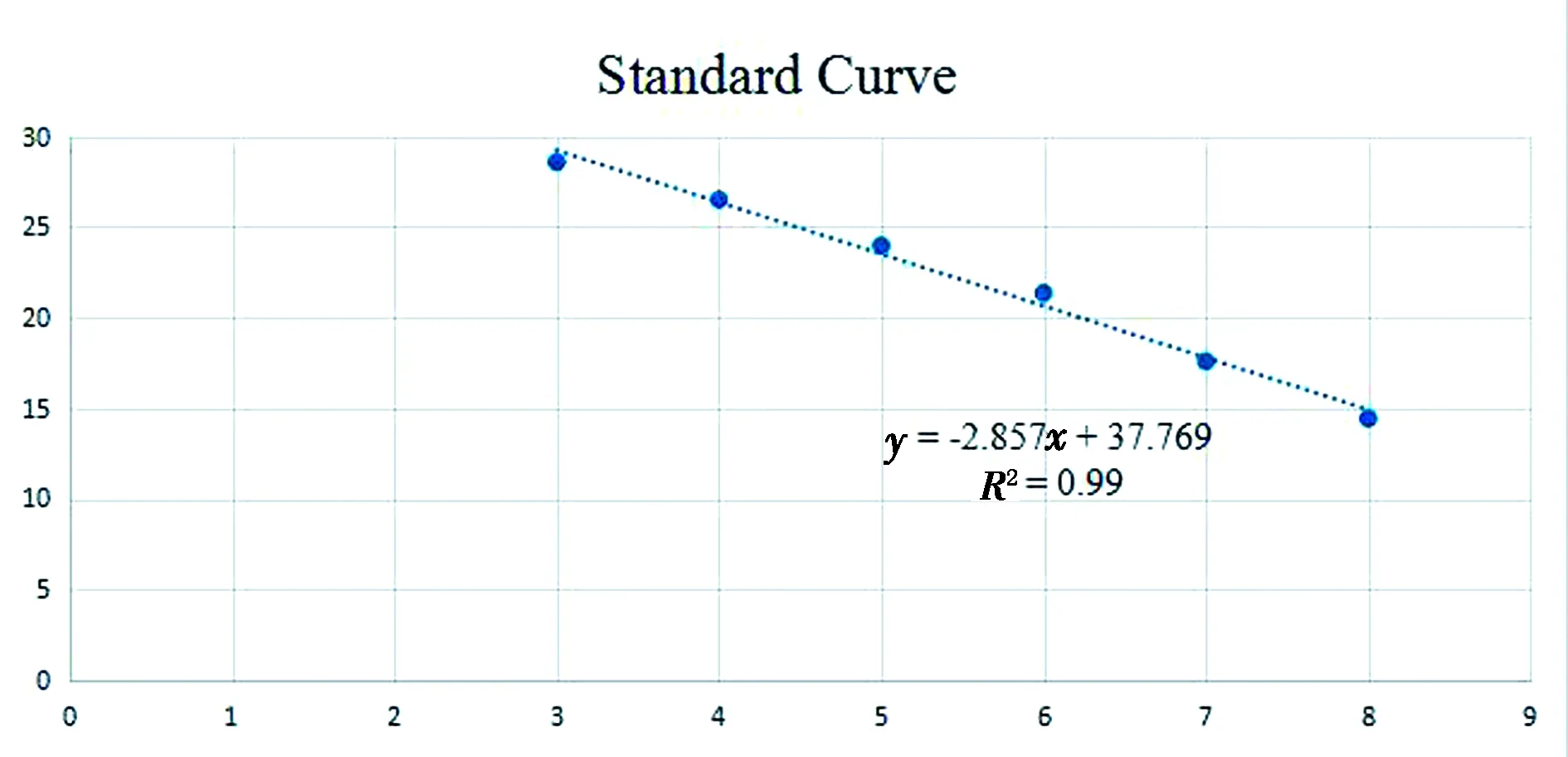
图2 SYBR GreenⅠ荧光定量PCR方法的标准曲线

表3 小鼠存活时间
2.5 小鼠腹腔中速殖子计数收集各组小鼠腹腔冲洗液,采用血细胞计数板对速殖子数量进行计数,计算出每毫升腹水中的速殖子的数量(表4)。统计分析显示感染组中阿奇霉素、磺胺嘧啶和Triacsin C 8×10-2g/L 组均显著低于其余4个处理组,Triacsin C 4×10-2,2×10-2g/L 组显著低于DMSO组和Triacsin C 1×10-2g/L 处理组(P<0.05),Triacsin C 1×10-2g/L 组与DMSO组差异不显著(P>0.05)。
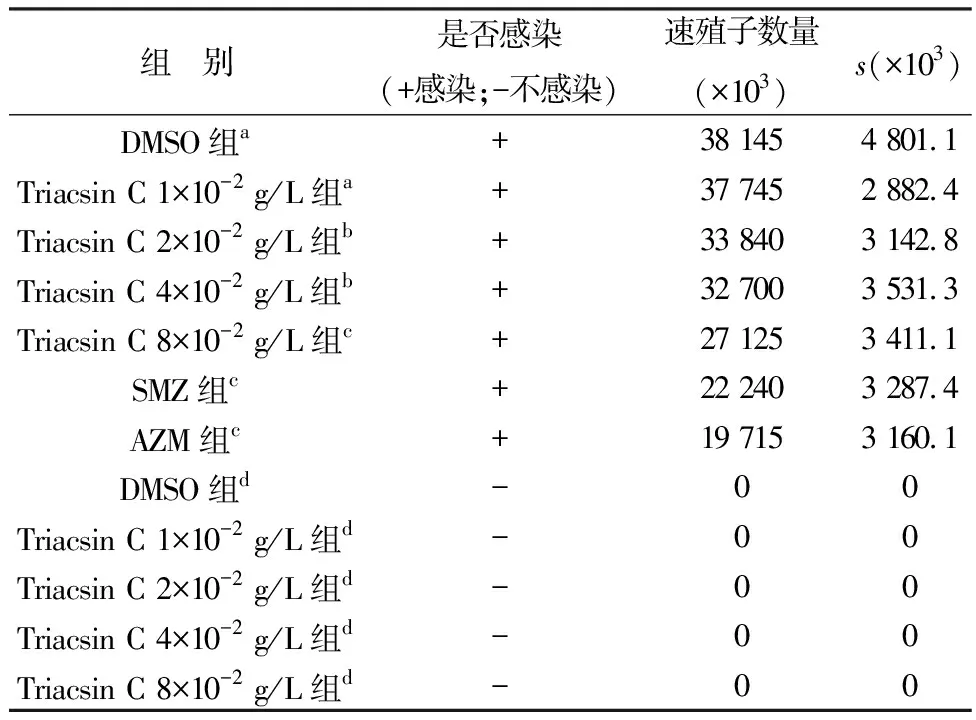
表4 小鼠腹腔中速殖子的数量
2.6 小鼠肝脏中弓形虫DNA拷贝数用所建立的荧光定量PCR方法对各组进行检测,计算出弓形虫DNA的拷贝数(表5)。统计分析显示感染组中阿奇霉素、磺胺嘧啶和Triacsin C 8×10-2g/L组均显著低于其余4个处理组 (P<0.05),3个组之间差异不显著(P>0.05);而Triacsin C 1×10-2,2×10-2和4×10-2g/L 3个剂量组与DMSO对照组之间差异不显著(P>0.05)。

表5 小鼠肝脏弓形虫DNA拷贝数
2.7 组织病理学观察结果对不感染给药组和感染给药组小鼠主要脏器(心脏、肝脏、脾脏、肺脏、肾脏、脑)进行组织病理学观察,发现不感染给药组(1×10-2,2×10-2,4×10-2和8×10-2g/L)小鼠各脏器均无明显病理变化(图3),与DMSO对照组(不感染)无显著差异;感染给药组(1×10-2,2×10-2,4×10-2和8×10-2g/L)小鼠心、脑组织未发现明显病变,与DMSO对照组(感染)无差异,但其他脏器均存在病变(图4)。肝细胞主要表现为边界模糊,染色质边缘化,细胞肿胀,严重者表现为空泡变性、坏死;脾脏中脾索排列出现紊乱,白髓区出血,淋巴细胞核出现肿大、溶解,严重者坏死;肺脏组织腔内均出现毛细血管扩张,出血,黏膜下出现大量红细胞;肾脏结构破坏,近曲小管锥状细胞肿大,远端小管肾细胞脱落,蛋白液渗出,管腔内出现丝网状组织。其结果与DMSO对照组(感染)、SMZ组和AZM组均相似,药物的使用没有显著减轻弓形虫速殖子对组织器官造成的病理损伤。
3 讨论
近年来,随着弓形虫基因组学、蛋白质组学等方面研究的发展,人们对弓形虫的生理结构及代谢途径有了进一步的认识,一些新的药物靶点被不断地发现[9-10]。研究表明,弓形虫为满足新形成的速殖子对生物膜合成的需求,很大程度上要依靠其旺盛的脂质合成途径[11]。同时,WALLER等[12]发现弓形虫尖端复合体内存在的脂肪酸合成酶系统( FasⅡ)与人类和高级动物之间的脂肪酸合成酶系统( FasI)存在很大的差别,因此如果干扰弓形虫的脂肪酶合成酶系统,就能在不影响宿主自身脂肪酸生物合成的条件下阻止弓形虫脂肪酸的生物合成,抑制弓形虫生长,这使得开发选择性抑制FASⅡ的弓形虫药物成为可能。ACS也是在弓形虫能量和脂类代谢中发挥重要作用的一种Ⅱ类脂肪酸合成酶,在脂类的合成过程中催化反应的关键酶,基于此,利用ACS的抑制剂处理弓形虫理论上应具有抑制其增殖的能力。Triacsin C是金黄色葡萄球菌中一种天然的长链脂肪酸酰辅酶A合成酶抑制剂[13],已被证实在纳摩尔水平具有良好的抗小隐孢子虫和弓形虫增殖活性[7,14],且研究中低剂量水平时对小鼠没有毒性[15-16],因而本试验首先将ACS的抑制剂Triacsin C作用于小鼠,以在体内验证其抑制效果。为更好的评估Triacsin C对弓形虫速殖子增殖的抑制作用,体外试验以及对宿主细胞(如uNK细胞、T细胞)的影响正在研究中。
本试验将不同质量浓度时Triacsin C灌胃小鼠,通过小鼠的存活时间、腹腔速殖子数量以及肝脏中弓形虫的拷贝数作为参考指标,发现8×10-2g/L Triacsin C能够显著抑制速殖子的增殖,小鼠的存活时间也相应延长,这与目前应用于弓形虫治疗的阿奇霉素、磺胺嘧啶相比无显著差异,说明该药确实具有抑制速殖子增殖的能力,然而较低的剂量下(1×10-2g/L、2×10-2g/L)其作用效果并不显著。结合小鼠主要脏器的病理变化,发现尽管8×10-2g/LTriacsin C能够减少弓形虫速殖子的增殖,但并不能减轻其对肝脏、肾脏、脾脏、肺脏等脏器的损伤,小鼠仍然由于弓形虫的感染导致死亡,这应与小鼠对弓形虫速殖子感染的高度敏感所致,于恩庶[17]曾报道RH虫株仅需要几个速殖子就能导致小鼠的死亡,因而Triacsin C尽管延长了存活时间,但不能改变感染的结局。
本试验将不同质量浓度Triacsin C灌胃小鼠,在不感染弓形虫的情况下观察药物对宿主实质器官的损伤情况,结果显示1×10-2~8×10-2g/L 的Triacsin C对小鼠的主要脏器均没有产生明显的病理损伤。但在之前的研究中,燕晟[18]报道Triacsin C具有体外抑制HSC-T6 细胞增殖的能力,江泳[19]也曾报道该药能够体外抑制HepG2细胞的增殖,这可能是由于药物作用于体内实质器官,在较短的时间内(7 d)尚不能表现出明显病变有关,与体外试验存在差异。本试验结果为Triacsin C作为药物开发的毒理安全性评价奠定了基础。
综上,Triacsin C对弓形虫速殖子在小鼠体内增殖具有抑制效果,但不能显著减轻速殖子对组织器官的病理损伤,其作为弓形虫病治疗药物仍有待进一步研究。

