乙型脑炎病毒NS1蛋白亚单位疫苗制备及其免疫效果评价
钮俊俊,魏 宁,朱 硕,陈 涛,杜冰洁,周登元,李秋燕,张路平,叶 静,司有辉,曹胜波 (华中农业大学 动物医学学院,湖北 武汉 430070)
乙型脑炎病毒(Japanese encephalitis virus,JEV)是一种人兽共患虫媒性传染病病原,三带喙库蚊是其主要的传播媒介。该病毒感染可引起人和动物严重的神经系统性疾病[1-2]。JEV对人的致死率可高达30%,即使幸存者,也有近50%的几率出现神经性后遗症。同时,JEV也是危害生猪养殖的重要病原,其感染可导致种猪繁殖障碍,主要引起妊娠母猪流产、产死胎,公猪睾丸炎,精液品质下降等[3]。
JEV属于黄病毒科黄病毒属,其基因组为单股正链RNA,长约11 kb,只有1个开放性阅读框(ORF),共编码3个结构蛋白(C、prM(M)和E)和7个非结构蛋白(NS1、NS2A、NS2B、NS3、NS4A、NS4B和NS5)[4]。其中,结构蛋白E是JEV的囊膜蛋白,大小约为53 kDa。该蛋白通过受体结合、低pH介导病毒入侵宿主细胞,是病毒的主要抗原,具有诱导中和抗体、维持病毒结构的稳定和参与复制组装等功能[5]。根据E基因序列的同源性差异,可将JEV分为5个基因型,分别为GⅠ、GⅡ、GⅢ、GⅣ、GⅤ型。5种基因型在地理位置分布、毒力和宿主适应性上具有一定的差异[6]。1949年中国报道的首例乙型脑炎病例属于GⅢ型,在随后的几十年里,GⅠ、GⅢ型JEV在山东、山西、河南等全国各地相继暴发,造成数十万人感染,其中GⅢ型乙脑病毒在流行中占主导地位。而在最近的30年里,我国GⅠ型JEV流行范围逐渐扩大,并且有取代GⅢ型的趋势,成为中国主要流行的基因型[7]。
由于E蛋白在黄病毒中高度保守并且具有较好的免疫原性,使用E蛋白作为靶点的疫苗研究一直都在不断深入。但近些年发现,接种登革热疫苗之后,如再次感染不同血清型的登革热病毒(Dengue virus,DENV)时,会出现严重的ADE(抗体依赖性增强)效应,而E蛋白诱导的抗体是正是黄病毒感染导致ADE现象的主要原因[8]。目前针对JEV感染尚无有效的治疗药物,接种疫苗是最有效的防控措施。目前市售的猪用乙型脑炎疫苗是减毒活疫苗,属于GⅢ型毒株,存在毒力反强的潜在风险[9]。并且随着我国JEV优势基因型的改变,现在的疫苗是否还具有良好的保护效果,也值得研究。因此开发更加安全有效的乙型脑炎新型疫苗具有重要意义。
JEV非结构蛋白NS1是一种分泌型糖基化蛋白,主要参与病毒的复制过程,并影响病毒的毒力[10]。NS1蛋白在黄病毒中高度保守,能够诱导体液和细胞介导的免疫反应,并能通过可溶性补体结合活性来诱导交叉保护,可以有效避免ADE效应[11]。已有研究报道JEV NS1免疫可以诱导机体产生针对西尼罗河病毒(West Nile virus,WNV)的交叉保护,黄热病毒(yellow fever virus,YFV)NS1蛋白可以诱导对不同血清型DENV和蜱传脑炎病毒(tick-borne encephalitis virus, TBEV)的交叉保护效果[12]。此外,NS1蛋白不仅可以引起动物的主动免疫反应,而且被动转移NS1免疫过后的血清也能够对小鼠起到显著保护作用[13]。上述研究表明,黄病毒NS1蛋白是一种疫苗研发的重要靶蛋白,具有开发为黄病毒新型疫苗的巨大潜力。本研究利用杆状病毒表达系统,表达纯化了JEV NS1蛋白并制备亚单位疫苗,利用小鼠模型评价了该疫苗的免疫保护效果,从而为JEV NS1亚单位疫苗研发奠定基础。
1 材料与方法
1.1 毒株、细胞和实验动物JEV P3株、JEV GX株、Sf9细胞、High5细胞及杆状病毒Bac-to-Bac表达系统由本实验室保存。SPF级C57BL/6雌性小鼠购自华中农业大学动物中心。
1.2 主要试剂弗式完全佐剂和不完全佐剂购自Sigma公司;小鼠抗His单克隆抗体、SYBR Green Ⅰ荧光定量染料购自Abclonal technology公司;Ni Sepharose High Performance填料购自GE Healthcare公司;猪用乙型脑炎弱毒疫苗购自武汉科前生物制品有限公司;Sf9、High5无血清培养基购自HyClone公司;免疫组化中小胶质细胞和星形胶质细胞染色所用IBA-1、GFAP单克隆抗体来自Servicebio。
1.3 重组杆状病毒的制备根据JEV GX株的基因组序列设计RT-PCR引物,同时为了提高外源蛋白的表达并分泌到上清中,在设计引物时加入了蜂素信号肽(HBM)以及靠近NS1序列5′端的24个E基因的氨基酸序列(24E),引物由武汉生工生物公司合成,引物序列见表1。上下游引物分别引入EcoRⅠ和XhoⅠ酶切位点(表中上游斜体为信号肽序列,下游斜体为His标签序列)。
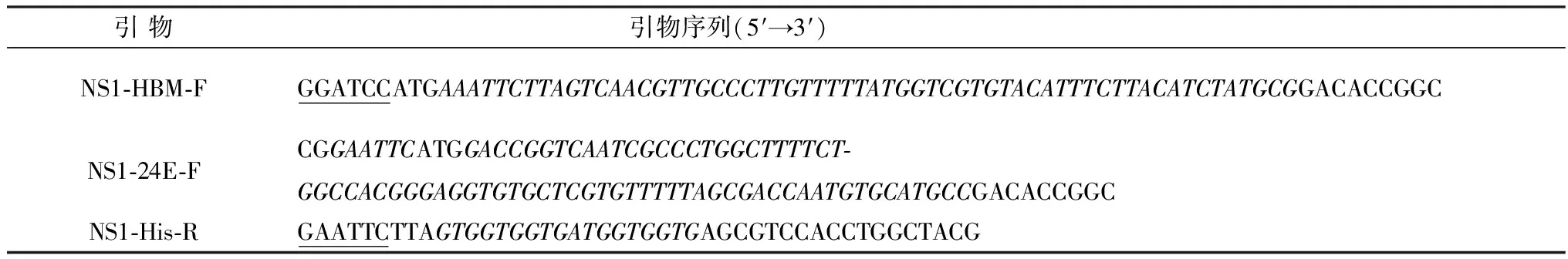
表1 RT-PCR引物序列
用表1中的引物对NS1基因进行RT-PCR扩增,扩增产物和pFastBac载体使用EcoRⅠ和XhoⅠ酶进行双酶切,酶切后使用T4DNA连接酶连接并转化到DH5α感受态细胞中,提取重组质粒,测序后与模板比对正确。将重组质粒转化到DH10α感受态细胞中,通过蓝白斑筛选出转座成功的重组杆粒,之后按照Invitrogen的杆状病毒操作手册,转染Sf9细胞制备重组杆状病毒,根据插入的目的基因不同,将重组杆状病毒命名为rBacmid-JEV-HBM-NS1和rBacmid-JEV-24E-NS1。
1.4 重组NS1蛋白的表达验证
1.4.1Western blot验证 分别收取感染重组杆状病毒后的Sf9细胞和培养基上清,加入Loading Buffer处理后,进行SDS-PAGE电泳,利用电转膜仪将样品转到PVDF膜上,结束后使用1% BSA室温封闭2 h,1∶4 000加入His抗体孵育2 h,PBST洗涤3遍后1∶5 000加入羊抗鼠IgG二抗孵育40 min,洗涤3遍后显色。
1.4.2间接免疫荧光验证 将重组杆状病毒感染Sf9昆虫细胞,同时设置阴性对照,3 d后使用100%甲醇将细胞固定10 min,PBS洗涤3遍,使用2% BSA封闭2 h,1∶4 000加入His抗体孵育2 h,洗涤3遍后1∶5 000加入羊抗鼠488室温孵育40 min,避光洗涤3遍后使用荧光显微镜观察结果。
1.5 NS1蛋白的大量表达与纯化参考Invitrogen杆状病毒操作手册,分泌表达的蛋白在High5细胞中会有更高的表达量。因此,使用High5细胞并感染重组杆状病毒,于27℃振荡培养72 h后,12 000 r/min离心10 min收集培养基上清,使用镍柱亲和纯化方法纯化NS1蛋白。将0.22 μm滤器过滤后的培养基用上样泵均速流过镍柱,上样结束后,使用Bio-Rad蛋白纯化仪对镍柱中的目的蛋白质进行洗脱。于波长280 nm紫外光能够检测流出的样品是否有蛋白出现,并将监测结果和体积相联系绘制出峰图。根据峰图结果收集对应的EP管,取少量样品进行SDS-PAGE及Western blot鉴定,用BSA法测蛋白浓度,分装后放于-80℃保存。
1.6 NS1蛋白亚单位疫苗的制备及小鼠免疫试验将NS1蛋白结合弗式佐剂制成亚单位疫苗,于背部皮下注射4周龄C57BL/6雌性小鼠进行免疫,共免疫2次,每次间隔2周。猪用乙型脑炎弱毒疫苗作为疫苗对照,按照使用说明只进行1次免疫,采用肌肉注射免疫。动物试验共分为5组: NS1蛋白亚单位疫苗组(低剂量组:50 μg/只,10只;中剂量组:100 μg/只,13只;高剂量组:200 μg/只,10只),弱毒疫苗组(猪用乙型脑炎弱毒疫苗,13只),阴性对照组(PBS,13只)。二免2周后每只小鼠腹腔注射6×105PFU乙脑病毒(P3株)进行攻毒。
1.7 ELISA检测免疫动物血清抗体滴度分别采集一免及二免2周后的小鼠血液,用ELISA法检测血清中NS1抗体滴度。酶标板每孔包被100 ng的NS1蛋白,4℃过夜后使用1% BSA常温封闭1 h,PBST洗涤3次后,在第1排孔中加入稀释100倍的小鼠血清,并向第2排孔做倍比稀释,以此类推。室温孵育2 h,洗涤3次后加入羊抗鼠IgG二抗室温孵育40 min;洗涤3次后加入显色液,10 min后加入终止液,测D450nm处的吸光值,每个样品重复3次,取平均值;D值>2.1×阴性平均值的孔判定为阳性,此时的稀释倍数为该血清的抗体滴度。
1.8 脑部组织病理学、病毒载量及炎性因子的检测取小鼠脑组织置于盛有不含血清的DMEM培养液的平皿中清洗1次后,沿正中矢状面垂直横切,其中1/2放入4%多聚甲醛中固定,用于后续的组织病理学检测;另1/2放入盛有1 mL DMEM的EP管中,用于后续的病毒滴度和炎性因子的检测。空斑试验和荧光定量试验检测病毒和炎性因子水平的材料与方法参考本实验室方法[14]。
将脑组织样品研磨后提取RNA并反转录。按照体系进行荧光定量试验,每个样品3个重复,每个基因也进行3个重复,整个反应过程中荧光信号的变化由ABI StepOnePlus实时荧光定量PCR仪检测。在实时荧光定量PCR中,各mRNA的参照基因是β-actin,相对表达水平的定量采用2-△△Ct法(Livak法)计算。
2 结果
2.1 重组杆状病毒的制备根据设计的引物扩增NS1基因(图1A),并将目的基因连接到pFastBac载体上,测序正确后提取重组质粒并转化到DH10α感受态中,72 h后挑取蓝白班筛选平皿上的白色菌株,利用杆状病毒通用引物M13F/R和目的基因引物进行交叉PCR验证(图1B,C),对验证正确的菌株提取重组杆粒并转染Sf9细胞,获取重组杆状病毒rBacmid-JEV-HBM-NS1和rBacmid-JEV-24E-NS1。

A.NS1基因的PCR扩增;B.重组杆粒rBacmid-JEV-HBM-NS1的PCR验证;C.重组杆粒rBacmid-JEV-24E-NS1的PCR验证。M.Marker;1~5.M13上下游引物PCR;6~10.上游引物与M13下游引物交叉PCR验证;11~15.M13上游引物与下游引物交叉PCR验证;C.阴性对照
2.2 重组NS1蛋白的表达验证对重组杆状病毒感染后Sf9昆虫细胞和培养基进行Western blot鉴定,结果显示(图2A),在40~50 kDa出现大小约46 kDa的特异性条带,与NS1蛋白的预期大小一致,说明rBacmid-JEV-HBM-NS1和rBacmid-JEV-24E-NS1均能在Sf9昆虫细胞内表达NS1蛋白并能分泌到培养基中。同时IFA的结果(图2B)也表示出rBacmid-JEV-HBM-NS1和rBacmid-JEV-24E-NS1均在Sf9昆虫细胞内表达了目的蛋白。根据结果对比,最终选择重组杆状病毒rBacmid-JEV-24E-NS1进行后续试验。
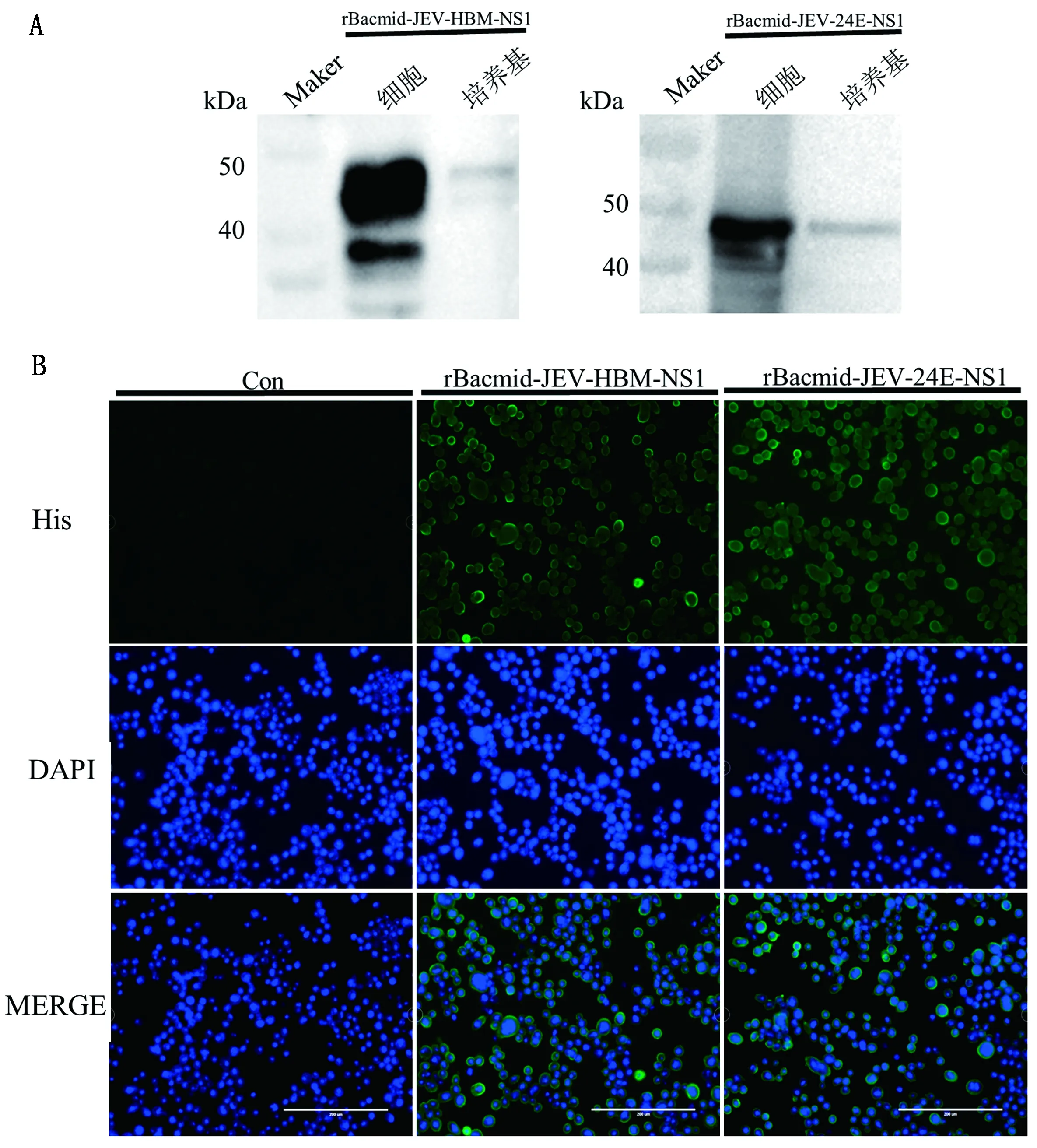
A.Western blot鉴定;B.IFA鉴定
2.3 NS1蛋白的大量表达及纯化将重组杆状病毒rBacmid-JEV-24E-NS1感染High5悬浮细胞,放入27℃培养箱振荡培养72 h后,离心收集培养基进行蛋白纯化,根据波长280 nm检测的峰图结果,收集对应管数进行SDS-PAGE和Western blot验证(图3A)。结果显示纯化了NS1蛋白,并用10 kDa的超滤管浓缩NS1蛋白可在46 kDa左右检测到1条特异性条带,大小和预期相符(图3B)。最后用BSA法测的浓缩后的NS1蛋白质量浓度为1.9 g/L,分装后放-80℃保存。

A.NS1蛋白纯化鉴定;B.超滤管浓缩后鉴定。M.Marker;穿透.上样后的培养基;17~24.收集的EP管数;浓缩.浓缩后NS1蛋白
2.4 ELISA检测免疫动物血清抗体滴度用ELISA检测一免、二免2周后小鼠血清中的NS1抗体滴度,结果显示(图4),在第1次免疫14 d后,所有接种疫苗的小鼠体内都能够检测到NS1特异性抗体,且抗体水平与NS1蛋白免疫剂量呈正相关。二免14 d后,亚单位疫苗组的NS1抗体水平上升到较高的水平,而弱毒苗组的NS1抗体水平变化不大。
2.5 脑组织病毒载量检测机体感染JEV后,病毒会在脑组织内大量复制从而引发致死性脑炎,因此脑内病毒载量和炎症因子水平是评价疫苗保护效果的关键指标。通过空斑试验和荧光定量试验对小鼠脑组织内的JEV进行检测(图5),结果NS1亚单位疫苗(100 μg/只)和弱毒疫苗免疫的小鼠脑内在空斑试验中没有检测到JEV,只在荧光定量的试验中检测到较低水平的病毒基因。结果表明,和未免疫疫苗组相比,接种疫苗能够显著降低小鼠脑内的病毒载量。

A.空斑检测结果;B.荧光定量RT-PCR检测结果
2.6 脑内炎性因子表达水平检测接下来通过相对定量的方法对小鼠脑内的炎症因子IL1-β、IFN-β、TNF-α、CCL5和IL6进行检测(图6),结果与阴性对照组相比,NS1亚单位疫苗(100 μg/只)和弱毒疫苗免疫的小鼠脑组织内炎性因子表达水平显著降低,说明接种疫苗后的小鼠脑部炎症反应明显减弱,这可能是由于接种疫苗后,小鼠对JEV的抵抗能力提高,从而减轻了小鼠脑内的病毒所引起的炎症反应,而阴性对照组的小鼠没有抵抗JEV的能力,脑内的炎症因子水平远高于疫苗免疫组。
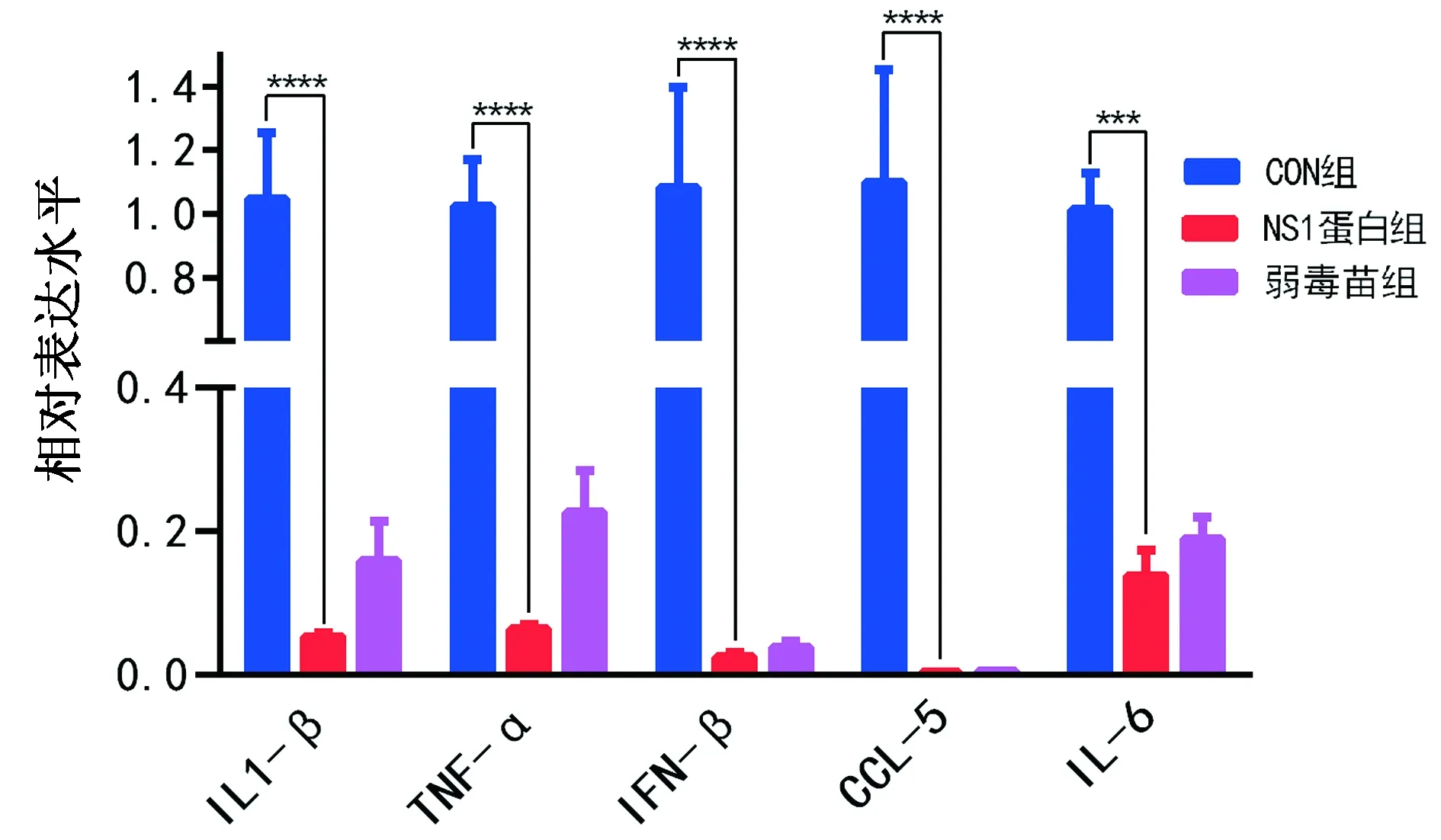
图6 小鼠脑炎症因子检测
2.7 脑组织病理变化检测在攻毒后第7天,Con组小鼠相继出现精神沉郁、行动受阻、后肢麻痹等临床症状,此时对各组小鼠脑组织取样,HE染色的结果显示(图7A),在Con组的小鼠脑组织内,出现乙型脑炎典型组织病理学特征,脑组织各区可以见到广泛的炎性细胞浸润,其中脑膜的炎性细胞浸润最为明显,即脑膜炎症;大脑皮质中的血管周围聚集大量炎性细胞,形成“袖套”现象。而在NS1蛋白(100 μg/只)免疫的小鼠脑内,并没有出现Con组的典型病理变化,这表明NS1蛋白免疫的小鼠产生了针对JEV的免疫保护。同时,在弱毒苗组,小鼠也未出现典型的脑炎病变。
在脑组织中,小胶质细胞和星形胶质细胞在激活时能够释放多种细胞因子和趋化因子,在抵抗病毒的入侵中发挥关键作用,因此两种细胞的数量和状态是评价脑组织炎症反应的重要因素。我们对脑组织内的小胶质细胞和星形胶质细胞进行染色(图7B),结果发现,Con组与NS1蛋白组(100 μg/只)和弱毒苗组相比,小胶质细胞和星形胶质细胞被显著激活,呈现棕色深染的不规则形状,表明疫苗接种的小鼠,在感染JEV时,脑内的胶质细胞的激活和增生显著降低,从而降低炎症反应,并减少小鼠因中枢神经破坏而导致的死亡,证明了NS1蛋白作为亚单位疫苗的保护力。

A.HE染色(40×);B.免疫组化(20×)
2.8 免疫保护率检测对疫苗免疫后的小鼠进行攻毒试验,动物存活率结果显示(图8),注射PBS的小鼠在攻毒后11 d全部死亡,而接种弱毒苗的小鼠全部存活下来,接种JEV NS1蛋白亚单位疫苗的小鼠,低剂量组(50 μg/只)获得了70%的保护,中剂量组(100 μg/只)和高剂量(200 μg/只)组分别获得了80%和90%的保护,说明JEV NS1亚单位疫苗对感染JEV的小鼠起到了保护效果,且保护效果和NS1蛋白的免疫剂量呈正相关。
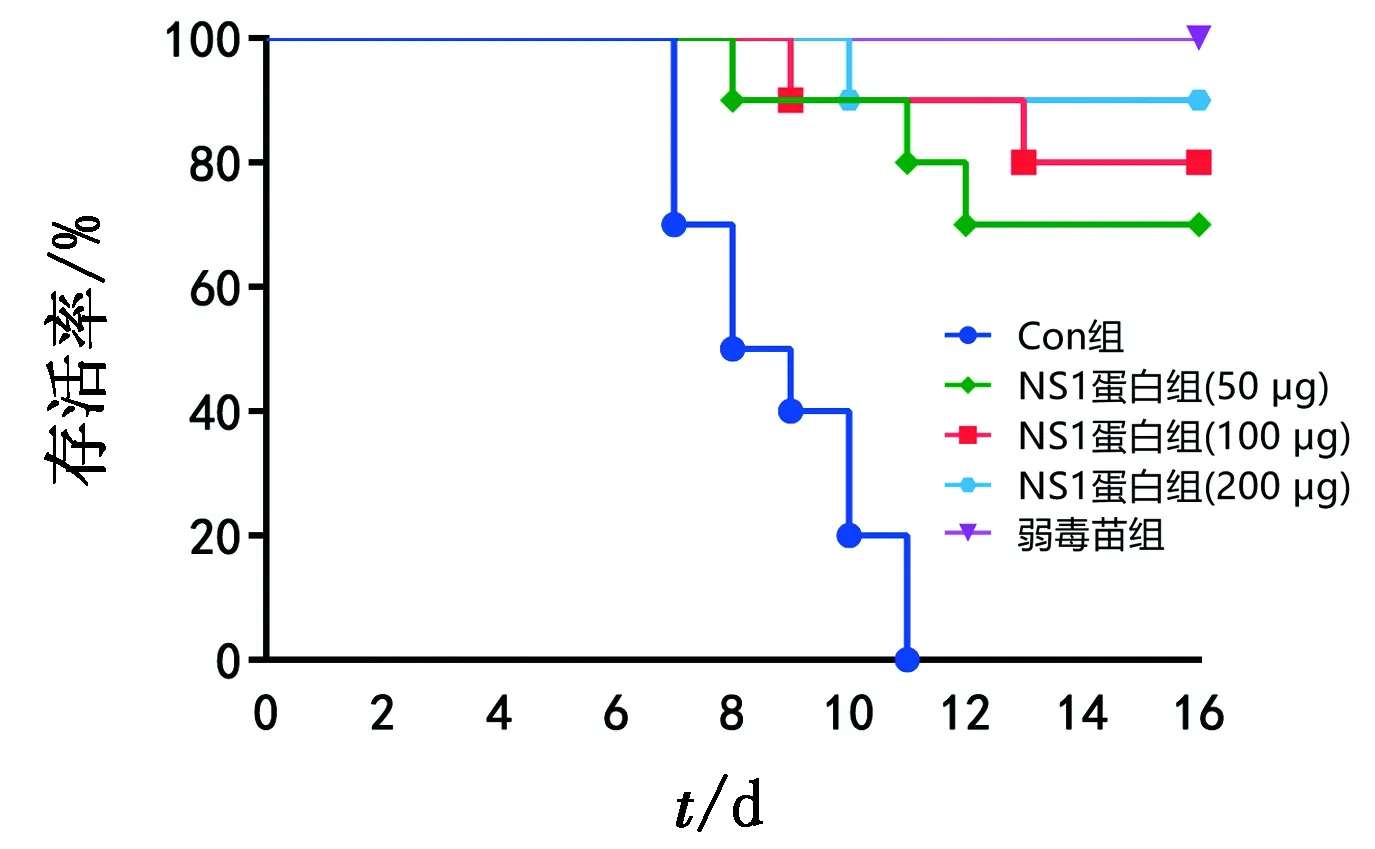
图8 攻毒后动物生存曲线
3 讨论
外源蛋白表达系统在亚单位疫苗的生产中发挥着关键作用,而选择分泌型蛋白来开发疫苗具有诸多优势。首先分泌型蛋白不仅具有接近天然蛋白的生物活性,能产生更好的免疫效果。其次在疫苗生产中,分泌到培养基中的外源蛋白,更有利于蛋白的收集和纯化,从而实现工业化生产[15]。因此在本研究中对NS1蛋白表达时,使用了杆状病毒表达系统,同时为了提高NS1蛋白的分泌表达水平,除了在设计引物时引入了信号肽序列外,还对目的基因进行了密码子优化,使其更有利于在昆虫细胞中表达[16]。通过收集感染重组杆状病毒的High5细胞培养基,纯化了NS1蛋白,并通过动物试验验证了该蛋白具有类似天然蛋白的免疫原性。
亚单位疫苗是利用微生物表达系统表达病毒的主要抗原,结合佐剂制成不含核酸的疫苗。抗原蛋白是亚单位疫苗的主要成分,因此抗原的选择对疫苗效果有很大影响。有研究已经证明一些病毒的非结构蛋白在不诱导中和抗体的情况下能够对感染病毒的机体产生保护力[17]。其中黄病毒的非结构蛋白NS1已经被证明具有保护作用,NS1蛋白诱导的抗体通过FcgR介导的病毒清除、补体介导的细胞毒作用及补体非依赖性吞噬作用等多种机制对多种黄病毒起到保护作用,针对DENV、YFV、寨卡病毒(Zika virus,ZIKV)的NS1亚单位疫苗已经开始了各种尝试,这些都证明了黄病毒NS1蛋白作为疫苗开发的有效性[18]。在本研究的动物试验中,疫苗免疫的小鼠产生了强烈的体液免疫反应。在感染JEV后,相对于PBS对照组,接种疫苗小鼠脑内的病毒载量和炎症因子水平都显著降低,病理变化减轻。最后的攻毒保护试验中,弱毒疫苗的保护率为100%,NS1蛋白亚单位疫苗组的最高保护率达到了90%,最低也有70%的保护。和弱毒疫苗相比,NS1蛋白亚单位疫苗在小鼠保护率上还存在一定的差距,这可能与亚单位疫苗的免疫剂量或所用佐剂有关,若提高NS1蛋白免疫剂量或尝试其他佐剂,对小鼠的保护率可能会有所提升。以上试验充分证明了NS1蛋白对小鼠的保护效果,为未来JEV的防控奠定了基础。

