猪流行性腹泻病毒特异性SIgA 间接ELISA检测方法的建立及初步应用
柏家果,杜 琛,王若木,刘思雨,陆 颖,黄诗婷,余科辰,何贵府,陈 樱,韦祖樟,黄伟坚,欧阳康 (广西大学 动物科学技术学院 传染病实验室,广西 南宁530005)
猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)为尼多病毒目(Nidovirales) 冠状病毒科(Coronaviridae) 冠状病毒属(Coronavirus)第一群成员之一,由PEDV所引起的猪流行性腹泻(porcine epidemic diarrhea,PED)是猪的一种接触性肠道传染病[1],该病的临床表现为呕吐、腹泻及脱水,具有发病急、传播快、病死率高的特点[2]。目前研究表明:猪是PED的唯一易感动物,其主要的传染源为病猪和带毒猪。PEDV主要对1周龄以下的仔猪造成致命性危害,其感染后发病率和病死率高达80%~100%[3],而感染成年猪只时病死率基本为零,通常表现出体温升高,食欲减退和精神沉郁等轻微的症状。PEDV为有囊膜的单股正链RNA病毒,基因组全长约28 kb,其开放阅读框(open reading frame,ORF)包括4个结构蛋白和16个非结构蛋白[4],结构基因M、S、N、E基因分别编码膜蛋白(membrane,M)[5]、纤突蛋白(spike,S)[6]、核衣壳蛋白(nucleocapsid,N)[7]、小包膜蛋白(envelope,E)[8],各个基因在PEDV基因组中的顺序为:5'UTR-PP1a/1b-S-ORF3-E-M-N-3′UTR。S蛋白作为PEDV重要的结构蛋白,由1 383个氨基酸(amino acid,aa)构成,相对分子质量大小为180~200 kDa[9]。根据与其他冠状病毒同源性比对将 PEDV的S蛋白分为S1和S2两个亚基,S1区域主要包括2个亚结构域,即 S1-NTD(21aa-324aa)和 S1-CTD(253aa-638aa)[3]。目前对整个S蛋白结构域划分为:信号肽(1aa-18aa)、N端结构域、跨膜结构域(1334aa-1356aa)和胞内域[10]。S蛋白具有多种生物学功能,主要在病毒入侵过程中介导了受体的结合及膜融合过程,在膜融合过程中,S 蛋白的结构会发生极大变化。不同冠状病毒入侵宿主细胞的基本过程大致相同,S1 蛋白中的 RBD 首先对特定的受体蛋白进行识别并结合,通过PH 值的降低或蛋白酶的水解使S蛋白分解为S1和S2,位于 S2 区域的融合肽(fusion peptide,FP)便嵌入宿主细胞膜,紧接着靠近跨膜区的七肽重复序列 2(heptad repeat 2,HR2)重新折叠到HR1上形成1个六螺旋束(six-helix bundle,6-HB),为S2 融合到细胞膜上的最后构型[10-11]。此外,在病毒入侵机体的过程中,S蛋白表面的多个抗原表位,对刺激机体生成中和抗体有着十分重要的作用,因此S蛋白广泛用于PEDV疫苗的研发以及作为建立检测方法的靶位[3]。
免疫球蛋白A (immunoglobulin A,IgA)分为3种形态:单体、双体和多聚体,7S的单体在血清单体含量中占比最多,为血清中免疫球蛋白总量的1/5,而在分泌物中含量最多的是11S的双体IgA(SIgA)。分泌型免疫球蛋白A(secretory immunoglobulin A,SIgA)是呼吸道黏膜表面主要的抗体,它在病毒、细菌入侵机体时呼吸道黏膜表面进行黏附的过程中起重要的防御作用[12]。有研究表明PEDV具有“肠道-乳腺-SIgA轴”的免疫通路,该理论的提出给PEDV的防控提供了新的思路[13],因此监测乳汁中SIgA的抗体水平对于该病的控制及预防具有重大的意义。SIgA的分子结构由2个IgA单体,l条J链和1条分泌片(secretory piece,SC)组成。SIgA分子中的J链将2个IgA单体接起来,由于每个IgA单体具有2个抗原结合部位,因此每个SIgA抗体有4个抗原结合位点。SC片段是SIgA特有的成分[14],可用于区分SIgA与IgA、dIgA[15],故可以通过SC片段来特异性监测乳汁中SIgA抗体的水平[16]。酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)在疫病的血清学抗体检测中应用十分广泛,该方法具有灵敏度高、特异性强、反应快速、操作相对简单以及可对血清进行批量检测的特点[17]。本研究以截短S蛋白作为包被蛋白,通过表达SIgA的SC片段来制备多抗,并以该多抗为一抗建立监测乳汁中SIgA的ELSIA方法。基于目前相关的灭活苗及弱毒苗都已经成功研发并在养猪业中实现了大规模的接种的现状,本研究建立的检测母猪初乳中抗PEDV特异性SIgA的方法可以用于评价疫苗黏膜免疫效果,为PEDV免疫效果的评价以及免疫程序的优化提供理论依据。
1 材料与方法
1.1 样品来源PEDV阳性乳汁、PEDV阴性乳汁及PEDV阳性血清均由本研究室保存,检测乳汁样品由广西多个猪场采集,由实验室制备并保存。PDCoV、FMDV、PRRSV、AFSV阳性血清均来源于抗体检测试剂盒。
1.2 主要试剂BL21(DE3)pLysS chemically Competent cell、APS、异丙基-β-D-硫代半乳糖苷(IPTG)、SDS-PAGE spacer gel buffer、30% PAGE pre-solution、SDS-PAGE separating gel buffer、proteinfind anti-his mouse monoclonal antibody、proteinfind goat anti-mouse IgG(H+L),HRP conjugate、proteinfind goat anti-rabbit IgG(H+L),HRP conjugate、ELISA包被液、终止液、TMB显色液购自南宁壹棵松生物科技有限公司;T4DNA连接酶、内切酶EcoRⅠ、Hind Ⅲ购自NEB公司;pET-32a和pEGX-4T-1载体为实验室保存;ELISA洗涤液购自上海生工;Ni-agarose resin、His-tagged protein purification kit (inclusion body protein)购自康为世纪;GST标签纯化试剂盒购自碧云天;TaKaRa BCA protein assay kit购自TaKaRa公司。
1.3 引物设计根据NCBI公布的猪PIgR序列(NM-214159.1)设计SC片段引物,根据本研究室已分离获得的17GXCZ-1ORF3d株(登录号:MT547179.1)序列设计S1截短片段引物,并送至上海生工进行合成。引物序列SC-F:CCGGAATTCTGTGGTCTGGGCATTAGC(5′→3′);SC-R:CCCAAGCTTGTTTGTTTCCTTCGGGTT(5′→3′);S1-F: CGGGATCCATGAAGTCT TTAACTTACTTC (5′→3′);S1-R:CCGCTCGAGCACTTTAAGAAAACAATAATAGGG(5′→3′)。
1.4 pET-32a-SC及pEGX-4T-S1的原核表达将测序验证的pET-32a-SC及pEGX-4T-S1转化至E.coliBL21,挑取单克隆,转接至LB培养基(含氨苄青霉素霉)中,37℃、220 r/min 培养过夜。待扩增的菌液D562值为0.6时,按照加入IPTG(终浓度0.8 μmol/L)继续在37℃水平摇床诱导5 h。取超声破碎后离心好的菌液沉淀加入含8 mol/L尿素的溶解液至沉淀完全溶解后,按照His-tagged protein purification kit (inclusion body protein)包涵体纯化试剂盒说明书利用Ni-agarose resin将pET-32a-SC重组蛋白进行纯化并利用TaKaRa BCA protein assay kit试剂盒测定所纯化的重组蛋白的浓度;取超声破碎后的pEGX-4T-S1菌液上清按照GST标签纯化试剂盒纯化并利用TaKaRa BCA protein assay kit试剂盒测定所纯化的重组蛋白的浓度。
1.5 兔抗SC多克隆抗体的制备将纯化好的pET-32a-SC重组蛋白送至上海文渊阁生物科技有限公司进行兔抗SC多克隆抗体的制备。
1.6 间接 ELISA 反应条件的优化分别对S1蛋白包被浓度(800,400,200,100,50和25 ng/孔)、封闭液(1% BSA、5% BSA、1%脱脂奶粉溶液和 5%脱脂奶粉溶液)、乳汁的稀释度(1∶25,1∶50,1∶100,1∶200,1∶400 和1∶800)、SC多抗的稀释度(1∶1 000,1∶2 000,1∶4 000,1∶8 000 和1∶16 000)、山羊抗兔IgG的稀释度(1∶1 500,1∶3 000,1∶6 000,1∶12 000及1∶24 000)、SC二抗及山羊抗兔IgG三抗孵育时间(30,45和60 min)和TMB显色时间(5,10和15 min)等进行优化,确定 ELISA 的最佳反应条件。
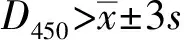
1.8 特异性实验利用建立的间接ELISA方法分别对PEDV、PDcOV、FMDV、PRRSV、AFSV等阳性血清及PEDV阴性血清进行检测,重复测定3次,检测该方法的特异性。
1.9 敏感性试验选取2份PEDV阳性乳汁,进行倍比稀释(1∶10,1∶20,1∶40,1∶80,1∶160,1∶320和1∶640),利用建立的ELISA方法进行检测,评价其敏感性。
1.10 重复性试验选取阴性和阳性血清样品各3份,进行批内和批间ELISA检测,计算批内和批间变异系数,评价该方法的重复性。
1.11 临床应用利用已建立的间接ELISA方法检测来自广西农垦永新畜牧集团良圻原种猪场 26份IgG试剂盒检测为阳性的乳汁及来自其他5个不同猪场的110份乳汁。
2 结果
2.1 原核表达质粒的构建分别以PIgR序列和17GXCZ-1ORF3d株的DNA为模板,利用合成的特异性引物进行PCR扩增,得到840,1 131 bp的NDA片段。利用 EcoRⅠ/HindⅢ酶切位点分别对pET-32a质粒及SC的PCR产物酶切纯化,使用T4连接酶连接后,转至感受态细胞并挑斑纯化,出现了预期中5 900,840 bp大小的片段,利用BamHⅠ/XhoⅠ酶切位点对pEGX-4T-1质粒的S截短基因PCR产物进行酶切纯化,使用T4连接酶连接后,转至感受态细胞并挑斑纯化,出现了预期中约为5 000,1 131 bp大小的片段,表明pET-32a-SC及pEGX-4T-S1重组质粒成功构建(图1)。
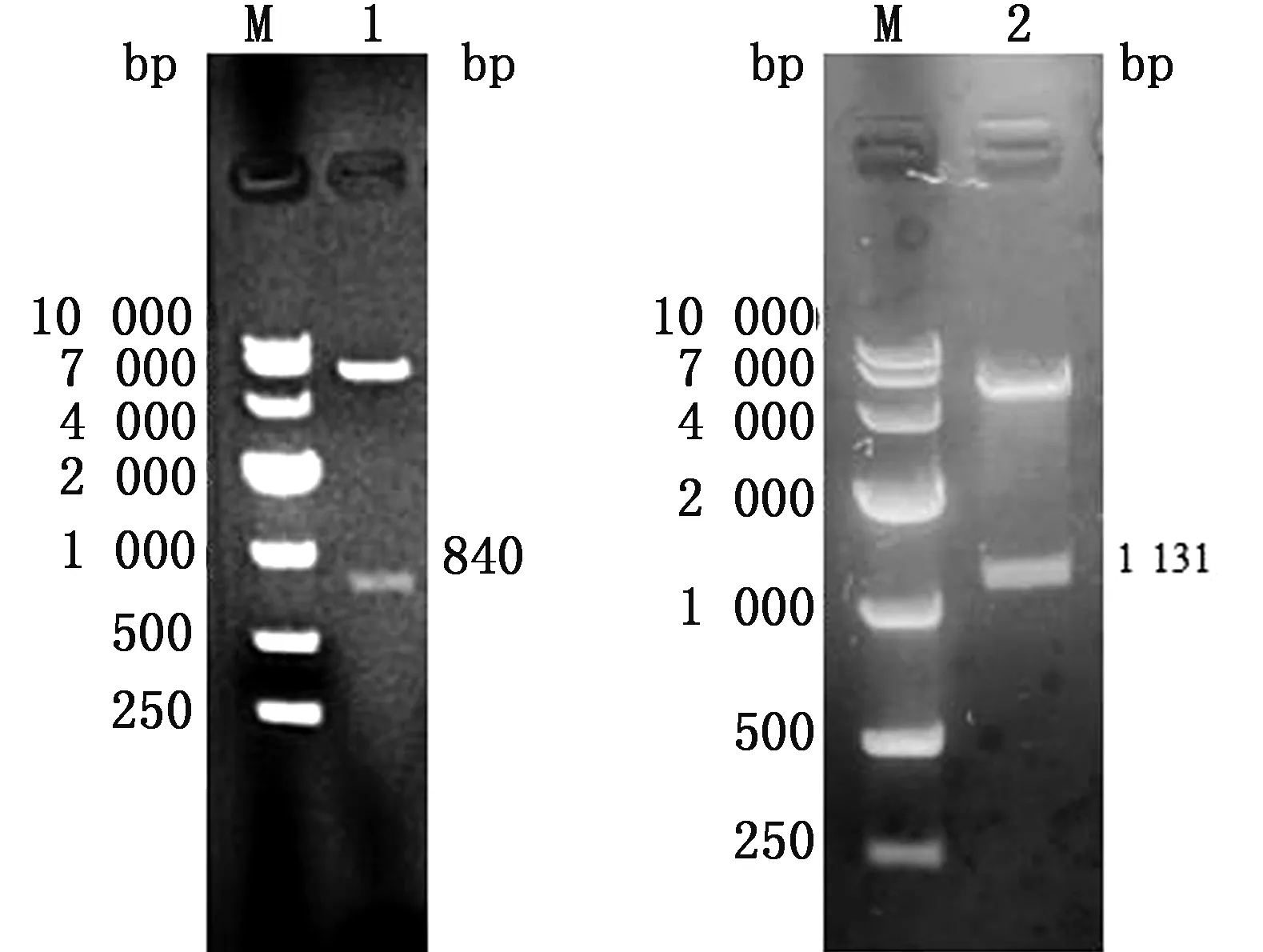
A.pET-32a-SC;B.pEGX-4T-S1;M.DL2000 DNA Marker;1.pET-32a-SC重组质粒扩增产物;2.pET pEGX-4T-S1重组质粒扩增产物
2.2 pET-32a-SC及pEGX-4T-S1的原核表达将诱导表达的蛋白进行SDS-PAGE分析(图2),诱导的重组菌蛋白条带与预期一致,表明成功表达目的蛋白,利用His标签纯化试剂盒及GST标签纯化试剂盒分别对pET-32a-SC及pEGX-4T-S1重组蛋白进行纯化,将纯化后的蛋白分装后于-80℃保存。

A.pET-32a-SC;B.pEGX-4T-S1;M1.蛋白质分子质量标准;1.裂解沉淀;2.裂解上清;M2.蛋白质分子质量标准;3.未诱导菌液;4.已诱导菌液
2.3 间接 ELISA 反应条件的优化通过方阵滴定试验,确定ELISA的最佳条件:最佳抗原包被浓度为50 ng/孔,最佳封闭液为5%BSA溶液,乳汁稀释倍数为1:10,SC多抗的稀释倍数为1∶2 000,酶标三抗稀释倍数为1∶3 000。
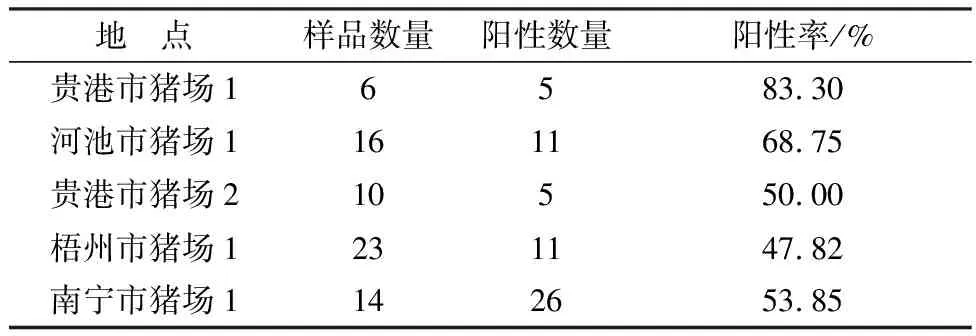
2.4 临界值的确定采用上述优化的间接ELISA方法,对14份阴性乳汁进行测定,结果显示,这14份样品的D450平均值为 0.200,标准差为0.042。由此计算,D450>0.326判定为阳性,D450<0.284判定为阴性,0.326 图3 间接 ELISA 方法的临界值界定 2.5 特异性试验采用本研究所建立的ELISA方法分别检测PEDV、PDcOV、FMDV、PRRSV、AFSV等5份阳性血清,重复测定3次,来对该方法的特异性进行评估。结果显示(图4),PEDV、PDcOV、FMDV、PRRSV、AFSV等阳性血清的D450<0.326,阳性乳汁D450>0.326,达1.151,表明本研究所建立的ELISA方法的特异性较强。 图4 间接 ELISA 的特异性检测 2.6 敏感性试验采用本研究所建立的ELISA方法检测3份分别进行倍比稀释后的PEDV阳性乳汁,来对该方法的敏感性进行评估。结果显示,3份乳汁的稀释比例为1∶640时,ELISA检测结果仍为阳性(D450>0.326),表明本研究所建立的ELISA方法的敏感性较高(图5)。 图5 间接ELISA方法的敏感性鉴定 2.7 重复性试验采用本研究所建立的ELISA方法对6份临床乳汁进行批内和批间检测。结果显示,该方法的批内变异系数为0.79%~10.04%,批间变异系数为2.09%~9.79%,变异系数均<11%,表明所建立的ELISA方法的稳定性好,可重复性高(表1)。 表1 间接ELISA 方法的重复性试验 2.8 临床应用采用所建立的ELISA方法检测136份来自6家猪场的乳汁样品,阳性率为66.91%(91/136)。其中26份来自广西南宁市猪场1的乳汁经试剂盒检测为IgG阳性乳汁,利用本研究建立的方法检测有14份乳汁样品为阳性,阳性率为53.85%(14/26),表2为5个猪场样品的详细信息。 表2 猪场样品的详细信息 份 PED于1971年首次在英国暴发后,欧洲许多国家,如西班牙、匈牙利、捷克共和国等也相继报道了PED[18]。PED在欧洲的第二次流行发生在2014年之后,其中包括德国、法国、奥地利、葡萄牙、比利时、乌克兰和意大利等国家都遭到了PED的危害[19]。在北美洲,美国于2013年暴发了PED,随着PED开始在美国各州流行,周边国家如加拿大和墨西哥也逐渐出现关于PED的报道[19]。1982年日本首次发现PEDV,随着PED在亚洲的流行,1983年在我国上海首次证实了在猪群中流行的传染性腹泻的病原为 PEDV,随后PED便在我国呈零星式暴发,在2010年后呈现出大暴发趋势[20]。2010年后,在我国南方地区出现了高毒力的PEDV变异株[21],随后该变异株便在整个中国迅速流行开来,猪场仔猪发生大规模的腹泻及死亡,即使已经使用经典疫苗株CV777进行免疫以后的猪场也未能幸免[22],截至目前,PEDV已经给中国养猪业造成了巨大的经济损失[23-25]。 PEDV主要通过粪-口途径传播,病毒进入消化道后首先与消化道内壁的黏膜表面结合从而导致猪发病,而黏膜表面主要的防御系统是黏膜免疫系统。黏膜免疫是机体防御的第一道防线,对机体抵御外界病原的侵害具有重要作用,其中,SIgA抗体是黏膜表明抗原特异性免疫的第一道防线,它们在防止病原体与黏膜表面结合的同时还可以清除进入肠道的细菌和病毒[26-27],因此,及时并且有效的对母猪初乳中PEDV 特异性SIgA抗体进行检测对评估母猪黏膜免疫状态以及仔猪通过母乳所获得的先天性免疫的效果都具有极其重要的意义。目前对于PEDV特异性SIgA抗体的检测方法相对较少,因此,建立一种经济有效的方法来监测母猪体内PEDV特异性SIgA抗体水平就显得尤为重要。母猪初乳中含有丰富的抗体,其中SIgA与IgA均为黏膜免疫相关抗体,但其免疫学功能却具有显著差别,因此准确检测SIgA含量的关键是建立一种方法来区分SIgA与IgA。SIgA与IgA在结构上最主要的差别是SIgA含有一个SC结构,该结构为SIgA的特有成分,用SC来检测初乳中的SIgA水平可以有效消除IgA的影响。近年来关于PEDV的特异性SIgA的相关研究日益增多,包括检测初乳中PEDV特异性 SIgA 的快速免疫层析试纸条试验的开发,该方法利用胶体金标记的抗 SIgA 分泌成分 (SC) mAb 探针,可以用于检测猪中的抗 PEDV 特异性 SIgA[28]。朱利塞等[29]将原核表达的S1蛋白作为包被抗原,辣根过氧化物酶(HRP)标记的鼠抗猪IgA作为二抗建立了ELISA方法以检测乳汁中的SIgA。 在本研究中,我们首先通过NCBI已公布的猪SIgA的SC序列,选取其抗原表位较好的区域设计引物,然后成功从母猪初乳中扩增得到所需的目的片段,并将其连接至pET-32a载体上,经测序正确后,将其转化在BL21大肠杆菌感受态细胞中进行表达纯化并成功制备兔抗SC多克隆抗体。随后表达S1截短蛋白作为包被抗原,使用PEDV S截短蛋白进行包被,以SC多克隆抗体为二抗,HRP标记的山羊抗兔IgG为酶标三抗建立并优化了一种检测乳汁中PEDV特异性SIgA抗体的间接ELISA方法。利用该ELISA方法对14份PEDV抗体阴性乳汁进行检测,确定了该方法的阳性临界值为0.326,以此临界值为参考,对该方法的特异性、敏感性和重复性进行了评估。结果显示,该方法检测PEDV、PDcOV、FMDV、PRRSV、AFSV的阳性血清时结果均为阴性,显示出该ELISA方法有较强的特异性;可以检测到阳性乳汁的最低稀释比例为1∶640,显示出该ELISA方法有较高的敏感性;批内和批间的重复变异系数均在0.79%~10.04%之间,重复稳定性较好,说明该ELISA方法有具有良好的临床应用价值。母猪初乳中PEDV特异性SIgA抗体ELISA检测方法的初步建立可以在母猪生产后及时监测母猪初乳中PEDV特异性SIgA抗体的水平,并且能够及时发现因母猪初乳中PEDV特异性SIgA抗体水平低而无法得到有效针对PEDV产生保护的母源抗体的仔猪,从而制定相应的免疫程序来提高仔猪免疫力,以降低仔猪发病死亡风险,减少经济损失,提高养殖效益。同时,该方法的初步建立为进一步探索母猪乳汁中PEDV特异性SIgA抗体的动态变化规律、PEDV黏膜免疫效果的评估以及免疫程序的优化提供了可靠的数据支持,也为哺乳仔猪预防PEDV的免疫方案制定提供科学依据。



3 讨论
