PRRSV感染仔猪腹股沟淋巴结组织病理学观察及转录组分析
苏娜瑛,林正丹,詹存林,金鑫鑫,胡薛英,张万坡,谷长勤,刘晓丽,程国富 (华中农业大学 动物医学学院,湖北 武汉 430070)
猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)于20世纪80年代在美国被首次报道,随后在欧洲及亚洲等地均有报道,严重危害全球养猪业的发展[1-3]。PRRSV感染猪群导致较高的发病率与死亡率,感染母猪造成繁殖障碍[4],感染仔猪主要导致呼吸道疾病[4]。PRRSV可损伤宿主免疫系统造成机体免疫抑制,使得其他病原体更易侵袭动物机体导致继发感染[5-6]。腹股沟淋巴结是重要的外周免疫器官,是免疫系统的重要组成部分,具有感受抗原刺激并产生免疫应答的重要功能[7]。PRRSV感染可导致淋巴结肿胀出血,结构破坏[4-5]。陈曦[8]对不同品种的猪的腹股沟淋巴结中差异表达LncRNA进行研究,探究LncRNA在PRRSV与机体免疫系统相互作用中的相关机制,为培育抗PRRSV种猪提供新思路。梁婉[9]在探究通城猪和大白猪对PRRSV的免疫应答时也以腹股沟淋巴结为研究对象。
转录组分析是基于Illumina测序平台,运用RNA-seq技术对特定组织RNA进行建库测序和生物信息分析的生物学技术,在发掘新基因、探究新功能等方面具有重要作用及广泛应用前景[10-12]。WANG等[13]通过转录组测序技术阐明了HP-PRRSV对猪肺泡巨噬细胞的致病性及免疫逃避相关机制。XIAO等[14]应用Solexa/Illumina的数字基因表达系统,系统地分析了N-PRRSV感染后肺部基因表达谱与病理学之间的关系,为更好地阐明N-PRRSV感染的分子发病机制提供了参考依据。PRRSV感染的转录组分析多聚焦于肺组织[13-16],本研究运用RNA-seq技术对PRRSV感染仔猪的腹股沟淋巴结进行转录组分析,探究PRRSV所致的炎性细胞因子的差异性表达及其对相关炎性信号通路的影响,为阐明PRRSV所致淋巴结炎的相关分子机制提供一定参考。
1 材料与方法
1.1 试验动物从湖北省某猪场选取16头40日龄鄂通猪,检测PRRSV及其抗体为阴性。将16头猪随机分为2组,其中13头作为试验组,按照2.5×105PFU/kg剂量肌肉注射PRRSV WUH3株(由华中农业大学动物科学技术学院刘榜教授馈赠)。3头仔猪作为对照组,按体质量注射生理盐水。期间观察感染仔猪的临床症状,并于感染后第8天进行动物剖检,取新鲜腹股沟淋巴结组织,称体质量,1份保存为固定样品,1份保存为冻存样品。
1.2 石蜡切片的制作及组织病理学观察使用4%多聚甲醛溶液固定新鲜腹股沟淋巴结组织,固定完全后,经二次取材、梯度酒精脱水、二甲苯透明、高熔点石蜡浸润包埋、切片制成石蜡切片,切片厚度为3 μm。组织切片经HE染色,镜检观察,拍照并记录病变。
1.3 免疫组织化学染色石蜡切片经二甲苯脱蜡,枸橼酸盐缓冲液(Ph6.0)进行热修复,阻断剂阻断内源性过氧化物酶,于4℃过夜孵育PRRSV抗体,室温孵育羊抗兔/鼠二抗30 min,DAB显色液显色至阳性信号显现。
1.4 组织总RNA提取、cDNA合成、荧光定量PCR检测按照总RNA提取试剂盒说明书提取腹股沟淋巴结组织RNA,使用反转录试剂盒合成cDNA,采用荧光染料法进行荧光定量PCR检测。
1.5 转录组学分析
1.5.1样品收集和准备 提取腹股沟淋巴结RNA,检测RNA完整性和总量。纯化RNA,构建文库,进行质量检测,再进行Illumina NovaSeq 6000 测序。
1.5.2数据分析 数据质控。对比序列到参考基因组,定量基因表达水平,使用DESeq2 软件进行差异表达分析,通过clusterProfiler (3.8.1)软件实现差异基因富集分析。
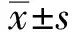
2 结果
2.1 临床症状及剖检病变PRRSV感染仔猪从第3~4天开始体温升高,可达42℃。临床症状主要表现为精神不振、食欲下降、呼吸困难、咳嗽、胸式呼吸等。剖检可见淋巴结肿胀、表面出血(图1B)。测定腹股沟淋巴结质量与仔猪体质量的比值(图2),发现脏器指数极显著增加(P<0.001)。

A.对照组仔猪腹股沟淋巴结;B.PRRSV感染仔猪腹股沟淋巴结
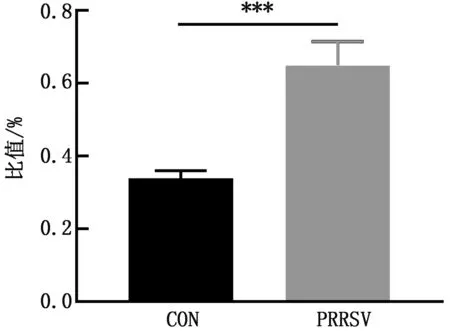
图2 腹股沟淋巴结脏器指数
2.2 组织病理学观察石蜡切片经HE染色,镜检观察可见对照组腹股沟淋巴结结构清晰、淋巴小结完整(图3A)。感染组淋巴结结构模糊(图3B),淋巴细胞减少(图3B,D)伴有出血(图3D)。淋巴小结数目减少、边界不清(图3B),且生发中心大量淋巴细胞坏死(图3C)。

A.对照组腹股沟淋巴结,结构清晰(HE,100×); B.淋巴结结构模糊,淋巴小结数目减少、边界不清(HE,100×);C.淋巴小结生发中心大量淋巴细胞坏死(HE,200×);D.淋巴结出血,淋巴细胞大量减少(HE,200×)
2.3 病毒定位组织切片经免疫组织化学染色,镜检可见PRRSV定位于腹股沟淋巴结巨噬细胞细胞质中(图4)。

A.对照组腹股沟淋巴结(IHC,400×);B.感染组腹股沟淋巴结;→处为PRRSV定位于巨噬细胞细胞质,呈棕黄色(IHC,400×)
2.4 PRRSV定量检测经荧光染料法绝对定量检测,计算可得试验组淋巴结病毒拷贝数为103~106拷贝/μL(图5)。
A.标准曲线;B.对照组及感染组腹股沟淋巴结荧光定量PCR结果;****表示差异极显著P<0.000 1
2.5 转录组分析
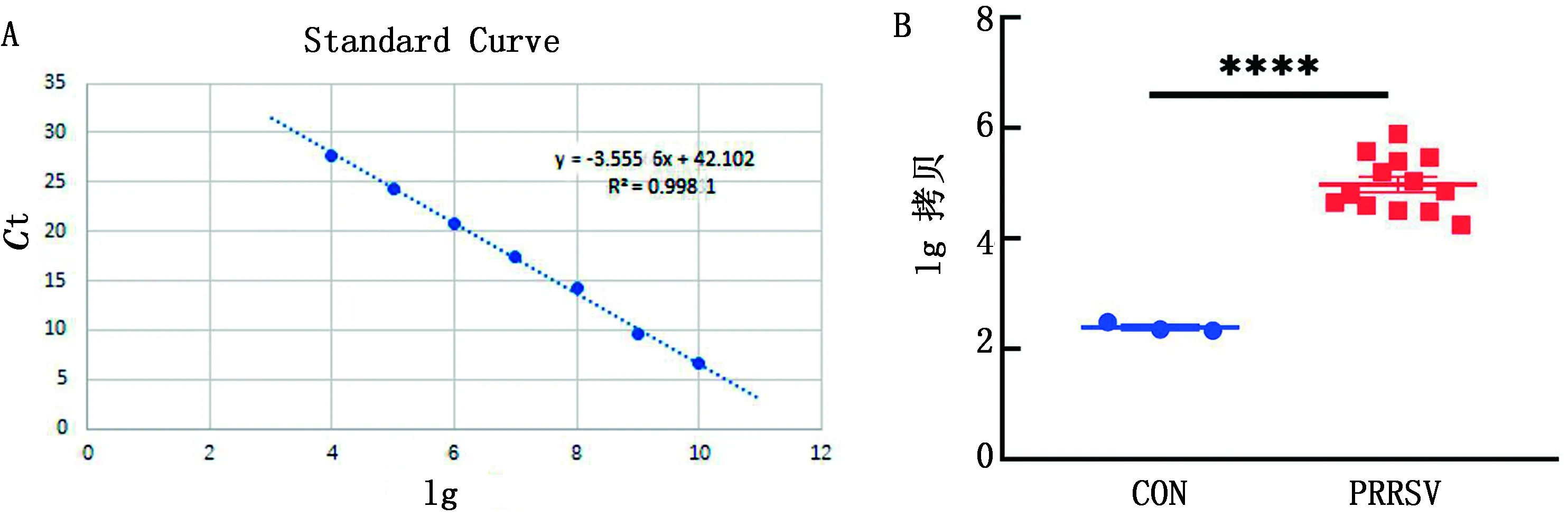
2.5.1基因差异性表达 运用DESeq2 软件对对照组及感染组腹股沟淋巴结进行差异表达分析,发现743个差异基因上调,409个差异基因下调(图6)。
图6 火山图
2.5.2差异性表达基因GO功能富集分析 使用clusterProfile软件进行GO功能富集分析,选取最显著的30个Terms绘制柱状图(图7)。在生物过程(biological process,BP)中主要富集到自然杀伤细胞介导的免疫调节、免疫效应过程等;在细胞组成(cellular component,CC)项目中,主要富集到了细胞表面、免疫球蛋白复合物等;在分子功能(Molecular function,MF)方面,主要富集于趋化因子活性、趋化因子受体活性等。

图7 GO功能富集分析
2.5.3差异性表达基因KEGG功能富集分析 使用clusterProfile软件对差异基因集进行KEGG通路富集分析,选取最显著的20个KEGG通路绘制散点图(图8)。结果显示,差异基因主要富集于炎症通路,主要包括有IL-17信号通路、NK-κB信号通路、Toll样受体信号通路、TNF信号通路等。
2.5.4荧光定量PCR验证 设计引物(表1),随机选取富集到的炎症通路中的差异表达基因进行荧光定量PCR验证。结果显示TLR8、CCL5、CCL8、TNFSF13B、CCR5、CXCL9、IFNG显著性上调(图9),CCL17、CCL26、CCR4、IRF5、MAPK12显著性下调(图9),与转录组分析所得结果趋势相符,说明测序结果准确、可靠。
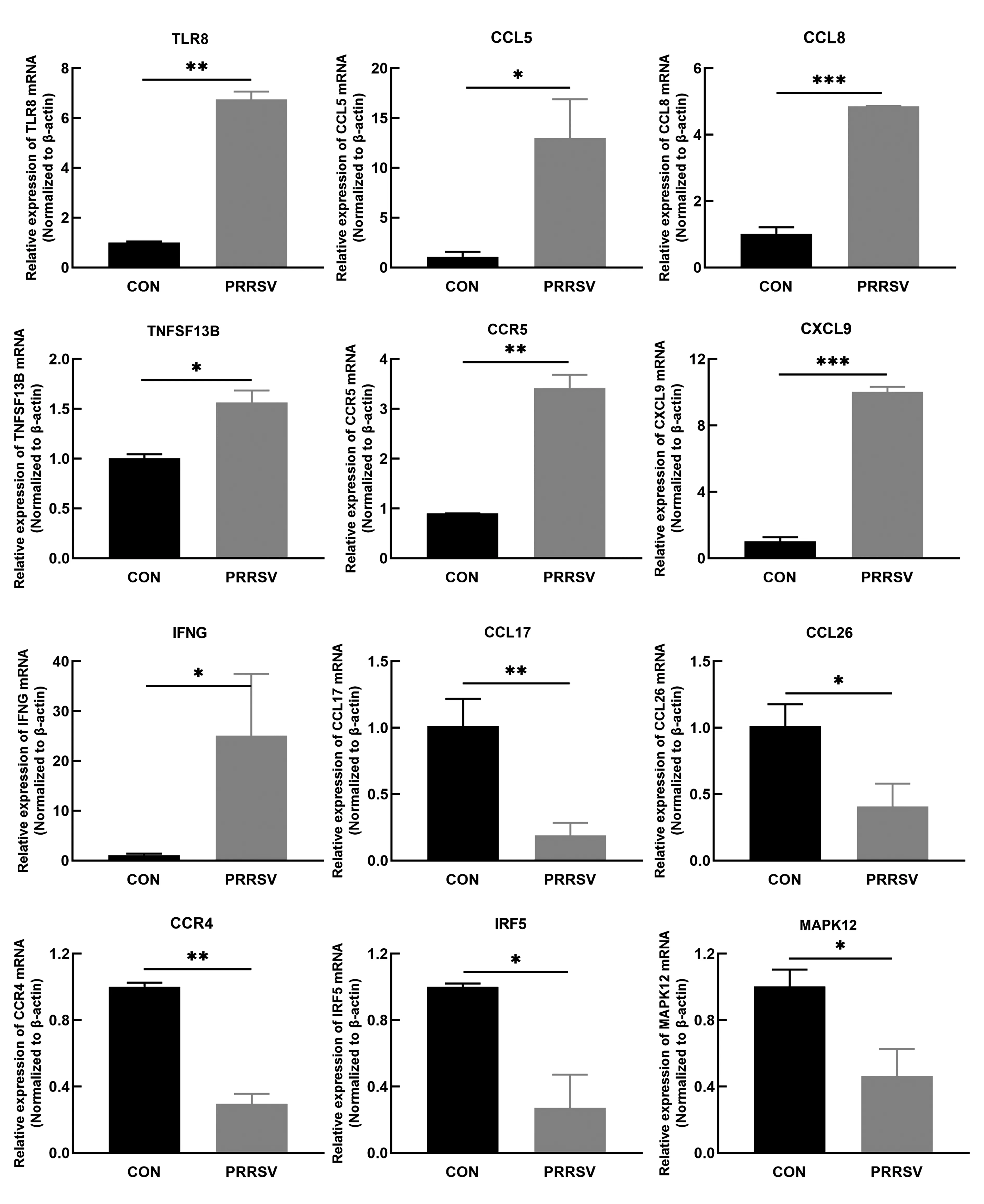
图9 差异表达基因的验证
3 讨论
PRRSV感染仔猪临床症状主要表现为高热、咳嗽、呼吸困难,剖检可见淋巴结肿胀、表面出血,呈红白相间样。镜检可见淋巴结结构模糊,淋巴细胞大量减少伴有出血,部分淋巴细胞坏死,该结果与翟研妮[17]所述一致。淋巴结淋巴细胞大量减少,而脏器指数显著增加,结合病理学观察可知淋巴结肿胀由水肿所致。此外,试验结果表明PRRSV感染的腹股沟淋巴结淋巴小结数量减少、边界不清,且淋巴细胞坏死多发生于淋巴小节生发中心。淋巴小结生发中心与产生高亲和力中和抗体的B细胞密切相关[18],该区域大量淋巴细胞坏死,将影响机体细胞免疫及体液免疫,是PRRSV感染导致仔猪免疫抑制病的影响因素之一。
PRRSV属于动脉炎病毒科、动脉炎病毒属,是一种有囊膜的单股正链RNA病毒[2,19-20],具有严格的细胞嗜性,能够侵染巨噬细胞,其中肺泡巨噬细胞最为易感[21]。此外,PRRSV还感染脾、淋巴结、胸腺等免疫器官的巨噬细胞,破坏动物机体免疫系统,造成免疫抑制[21]。组织切片经IHC染色,镜检发现PRRSV侵染腹股沟淋巴结巨噬细胞,定位于巨噬细胞细胞质中,该结果与叶梦雪等[21]所述一致。
关于PRRSV转录组分析多聚焦于肺部组织及肺泡巨噬细胞,本研究基于Illumina测序平台,对PRRSV感染仔猪腹股沟淋巴结进行转录组测序分析,发现在生物过程中自然杀伤细胞介导的免疫调节、免疫效应过程的相关基因集显著富集,表明淋巴结炎的产生是PRRSV感染与机体免疫反应相互作用的结果。大量炎性因子差异性表达,其中TLR8、CCL5、CCL8、TNFSF13B、CCR5、CXCL9、IFNG等炎性细胞因子显著性上调,CCL17、CCL26、CCR4、IRF5、MAPK12等炎性细胞因子显著性下调。在信号通路方面,梁婉[9]发现通城猪感染PRRSV后NF-κB信号通路被激活,本研究发现PRRSV感染的鄂通猪NF-κB信号通路也被激活,说明NF-κB炎性信号通路在PRRSV感染所致腹股沟淋巴结炎中发挥一定作用。此外,转录组结果表明Toll样受体通路、TNF信号通路等通路也被激活。提示这些炎性细胞因子及炎性信号通路参与PRRSV感染导致的淋巴结炎的病理变化过程。但具体致病机制仍需进一步探究。
