NADC30-like PRRSV和PCV2d共感染与继发感染PCV2抗体阳性断奶仔猪的致病性
王 鹏,张金勇,哈 卓,解长占,张 赫,韩继成,3,谢宇飚,李卓昕,高 岩,陶一墨,何海强,鲁会军*,金宁一,3* (1.吉林农业大学 动物科学技术学院/动物医学学院,吉林 长春 130118;.中国农业科学院 长春兽医研究所,吉林 长春 1301;3.长春中医药大学 院士工作站,吉林 长春 130117)
猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)为动脉炎病毒科(Arteriviridae)动脉炎病毒属(Poratarivirus)单股正链RNA病毒。2013年以来NADC30-like PRRSV逐渐成为我国的流行毒株[1]。目前的商品化疫苗对NADC30-like PRRSV仅能提供部分的保护力,NADC30-like PRRSV对养猪业的危害较为严重[1-2]。PRRSV感染后会导致繁殖母猪出现流产、死胎、木乃伊胎,仔猪出现背毛粗乱、厌食、皮疹和呼吸困难等临床症状[3]。
猪圆环病毒(porcine circovirus,PCV)为圆环病毒科(Circoviridae)圆环病毒属(Circovirus),单股环状DNA病毒。PCV2可引起猪圆环病毒相关疾病(porcine circovirus associated disease,PCVAD),但单独感染PCV2不产生典型的症状,与其他病毒、细菌、支原体等共同感染后会出现明显的发病症状[4]。目前,我国主要的流行基因型为PCV2d[5]。
PRRSV和PCV2的混合感染在临床上较为常见,已有报道混合感染率为21.9%~52.3%[6-7];混合感染可产生更严重的临床症状[8-9]。由于PCV2的广泛存在、疫苗免疫和母源抗体等因素导致大部分猪群PCV2抗体为阳性[10]。为了更贴合临床实际,本研究以PCV2抗体阳性仔猪作为研究对象,对NADC30-like PRRSV和PCV2d共感染和继发感染PCV2抗体阳性断奶仔猪的致病性进行研究,为阐述PRRSV与PCV2d协同致病机制和临床防控奠定基础。
1 材料与方法
1.1 细胞和毒株PK-15细胞、Marc-145细胞、PRRSV(NADC30-like)、PCV2(PCV2d)均由中国农业科学院长春兽医研究所保存。
1.2 主要试剂和仪器TRIzol总RNA提取试剂盒购自上海生工生物公司;DNA提取试剂盒购自天根生物;细胞因子检测试剂盒购自武汉云克隆;PCV2抗体检测试剂盒购自北京金诺百泰;PRRSV抗体检测试剂盒购自武汉科前;M-MLV反转录酶、SYBR GreenⅠ荧光染料购自Promega公司;Primer 9、RNasin、dNTP购自TaKaRa公司;ABI 7500荧光定量PCR仪购自ABI公司。
1.3 感染动物试验设计将30只(PRRSV抗原与抗体双阴性;PCV2抗原阴性、抗体阳性)5周龄断奶仔猪随机分为6组,每组5只,分别为PBS组、PCV2组、PRRSV组、PCV2-PRRSV组、PRRSV-PCV2组和Co-PRRSV-PCV2组,分组情况和攻毒时间见表1。分别以滴鼻和颈部肌肉注射的方式进行攻毒;NADC30-like PRRSV和PCV2d分别滴鼻4 mL,肌肉注射2 mL。攻毒后隔离饲养,每日测量直肠温度、观察临床症状(连续记录21 d);每周称量1次体质量。在攻毒后第3,7,10,14,21,35天分离血清用于特异性抗体和细胞因子检测;剖检后取主要脏器观察其病理变化。
1.4 临床指征分析从体温、临床症状、存活率和平均日增重4个方面对NADC30-like PRRSV和PCV2d共感染与继发感染断奶仔猪的临床指征进行综合评价。对感染后断奶仔猪的采食、呕吐、腹泻、皮疹、消瘦、精神状态和呼吸症状等进行记录.采用3分制进行评分:0分代表无症状;1分代表轻微临床症状;2分代表中度临床症状;3分代表重度症状。
1.5 PCV2和PRRSV特异性抗体检测使用商品化PCV2d抗体检测试剂盒、PRRSV抗体检测试剂盒分别检测PCV2抗体与PRRSV抗体,按照试剂盒说明书进行操作。
1.6 细胞因子检测采用武汉云克隆公司的商品化试剂盒,按试剂盒说明书对猪TNF-α、IFN-γ、IL-4和IL-10进行检测。
1.7 剖检及病理切片单感染组与共感染组在第28天进行剖检,继发感染组于第35天进行剖检,剖检后记录主要脏器的病变,并制作病理切片观察其病变。
2 结果
2.1 临床指征PBS组和PCV2组体温基本保持恒定或仅出现一过性升高;PRRSV、PRRSV-PCV2和Co-PRRSV-PCV2组体温在感染后第3天开始出现升高,并持续10 d左右,PCV2-PRRSV组体温在第10天开始明显升高,并持续到感染后第21天(图1A)。
PBS组未表现出任何临床症状;PCV2组仅出现轻微的临床症状;PRRSV、PRRSV-PCV2、PCV2-PRRSV和Co-PRRSV-PCV2组出现消瘦、咳喘、腹泻、被毛粗乱、精神沉郁和采食量下降等严重的临床症状(图1B)。PCV2-PRRSV组在第20天有1头猪出现死亡,病死率为20%。其余感染组均未出现死亡(图1C)。
PRRSV组的平均日增重最低,共感染组和继发感染组的平均日增重均低于PBS组和PCV2组;PRRSV-PCV2和Co-PRRSV-PCV2组的平均日增重与PRRSV组无明显差异(P>0.05)(图1D)。
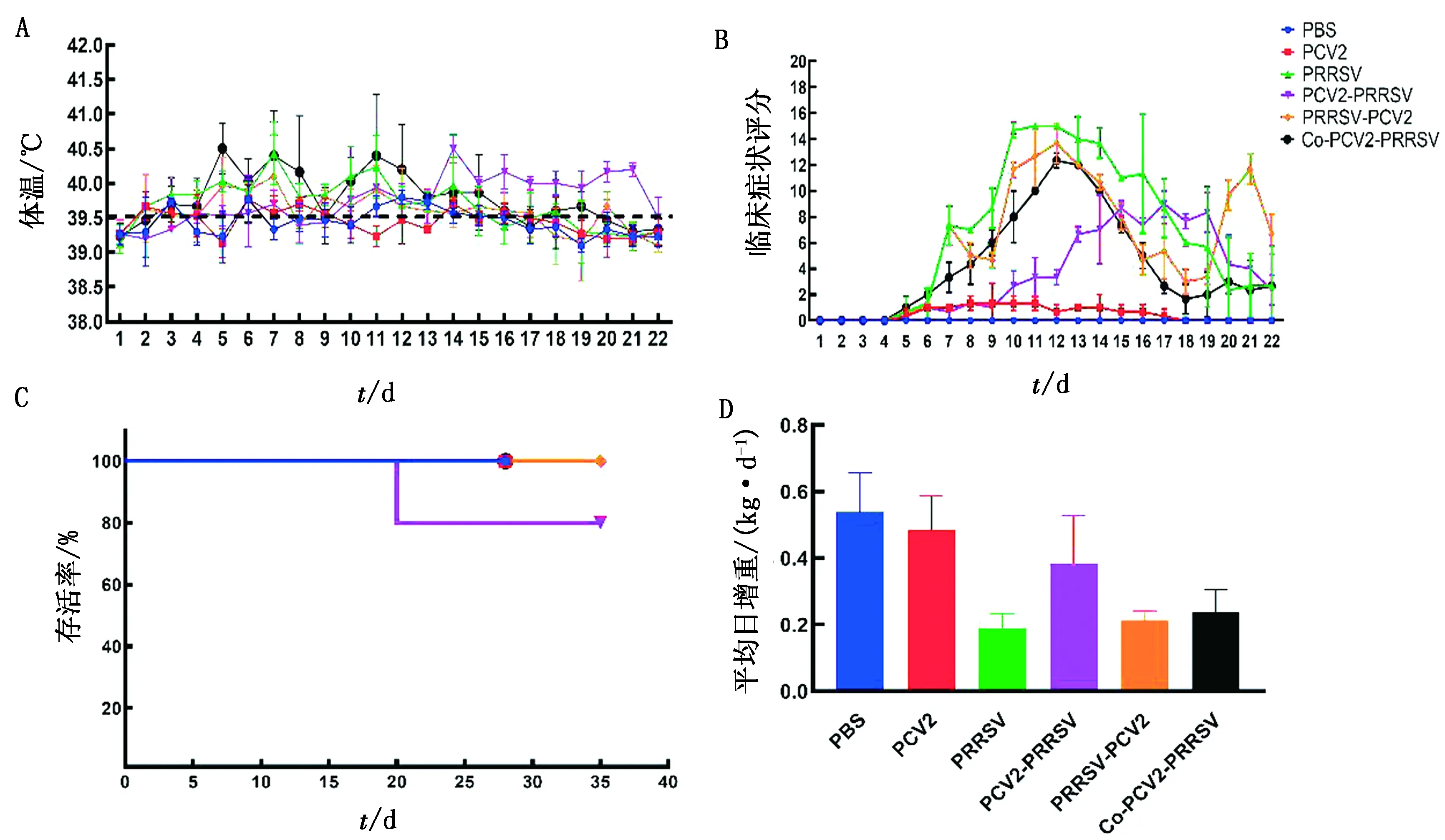
A.体温变化;B.临床症状评分;C.仔猪存活率;D.平均日增重
2.2 PCV2与PRRSV特异性抗体检测结果所有感染组的PCV2特异性抗体在感染初期均出现不同程度下降。PCV2和PCV2-PRRSV组的PCV2特异性抗体在感染PCV2后先出现轻微下降然后开始快速上升,在第21天达到峰值。PRRSV-PCV2和Co-PRRSV-PCV2组在整个感染期间均为PCV2抗体阳性,且同一时间段内两组的PCV2特异性抗体无明显差异(P>0.05)(图2A)。
PRRSV、PRRSV-PCV2和Co-PRRSV-PCV2组的PRRSV特异性抗体均在第7天开始上升,且直至试验结束,在同时间段时3组的PRRSV特异性抗体无明显差异(P>0.05)。PCV2-PRRSV组的PRRSV特异性抗体在第14天开始缓慢上升(感染PRRSV后的第7天),但上升幅度小于其他感染组(图2B)。

A.PCV2特异性抗体;B.PRRSV特异性抗体
2.3 细胞因子检测结果PRRSV组的TNF-α水平在感染后开始出现明显升高,在第14天显著高于其他所有感染组(P<0.05);PRRSV-PCV2和Co-PRRSV-PCV2组的TNF-α水平在感染后出现轻微上升,在第7天即开始出现下降;Co-PRRSV-PCV2组在第28天时达到与PRRSV组相同水平的TNF-α,且高于其他感染组(图3A)。
除PCV2-PRRSV组外,所有感染组的IFN-γ在首次感染病毒后均出现下降,其中PBS和PRRSV组直至试验结束均未出现明显的升高;PCV2组在第14天达到峰值;PRRSV-PCV2和Co-PRRSV-PCV2组在第7天后开始出现上升,并在第21天达到峰值,且Co-PRRSV-PCV2组的IFN-γ浓度略高于PRRSV-PCV2组(图3B)。

A.TNF-α;B.IFN-γ;C.IL-4;D.IL-10
Co-PRRSV-PCV2组的IL-4浓度在第21天出现明显升高且高于其他感染组。PRRSV-PCV2和PRRSV组的IL-4浓度同样在第21天达到峰值并开始迅速下降(图3C)。
PRRSV组的IL-10浓度在第7天开始上升,第14天达到峰值后开始下降,到第28天时降到与其他感染组相同浓度。其余感染组在感染后IL-10水平基本保持不变,PRRSV-PCV2、PCV2-PRRSV和PCV2组的IL-10浓度低于PBS组(图3D)。
2.4 病理变化和病理切片由图4可见,PBS组各脏器基本无肉眼可见病理变化;PCV2组仅部分猪出现轻微的淋巴结水肿;PRRSV组、继发感染组与共感染组的肺脏出现不同程度的出血、淤血、黏连和肉样变,淋巴结出现肿大,部分可见出血点。其中,共感染组和PRRSV-PCV2组更为严重。PRRSV组的病理切片出现轻微的肺间质增宽,共感染组与继发感染组出现肺间质增宽、部分肺泡消失,肺泡壁可见炎性细胞浸润。
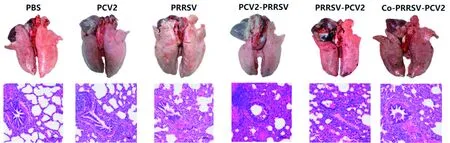
图4 肺部剖检及病理图
3 讨论
目前,已有关于PRRSV和PCV2共感染和继发感染的报道,大多为HP-PRRSV和PCV2a或PCV2b的报道[9,11-14]。由于临床上大多为PCV2抗体阳性猪[10],因此我们选用PCV2抗体阳性仔猪对NADC30-like PRRSV和PCV2d共感染与继发感染的致病力进行评价。
PCV2单感染不能导致明显的临床症状,PRRSV和PCV2共感染则可导致更为严重的临床症状[11,15]。本研究发现即使在PCV2抗体阳性的情况下,NADC30-like与PCV2d共感染和继发感染仍可导致更为严重的临床症状。本研究中PRRSV-PCV2、PCV2-PRRSV和Co-PRRSV-PCV2组出现咳喘、呼吸困难、腹泻、背毛粗乱,但是PRRSV组表现出与共感染组和继发感染组相似的临床症状和更低的平均日增重,我们认为这可能是由于PRRSV引发的细胞因子风暴(高水平TNF-α和IL-10)所导致。整个试验周期内仅PCV2-PRRSV组出现死亡,病死率为20%。病理变化结果表眀共感染组和继发感染组会出现更为严重的病变,本研究中共感染组与继发感染组肺脏的肉样变程度,肺泡壁增厚程度和淋巴细胞浸润均高于PRRSV组。
PRRSV和PCV2体外感染猪肺泡巨噬细胞后可导致IFN-γ大量表达,IFN-γ也可以增强PCV2的复制[16-17]。感染后期,共感染组和继发感染组表达相对高水平的IFN-γ。TNF-α是由单核巨噬细胞产生的一种促炎因子,可以破坏呼吸道上皮细胞的完整性,损伤机体固有免疫应答[18]。本研究中,TNF-α的变化与各组病变的严重程度相关,这可以解释共感染组与继发感染组出现更严重的肺部病变。IL-4和IL-10是适应性免疫应答的两种主要细胞因子[8],可以用来指示病毒入侵后机体免疫系统的反应程度;同时IL-4也可以抑制多种炎症细胞因子的转录活性[19],过量的IL-10则可以引起免疫抑制[20]。本研究中共感染组、继发感染组与PRRSV组在试验中后期时血清中IL-10含量均高于其他感染组,这表明共感染组、继发感染组与PRRSV感染组产生了强烈的适应性免疫应答。本研究通过NADC30-like PRRSV与PCV2d共感染与继发感染PCV2抗体阳性断奶仔猪,发现在PCV2抗体存在的情况下NADC30-like PRRSV与PCV2d共感染或继发感染仍可导致严重的临床症状和病理变化,PRRSV单感染也会表现出严重的临床症状但病理变化相对较轻。

