生长素调控水稻颖花开放的效应研究
何永明 张 芳
生长素调控水稻颖花开放的效应研究
何永明 张 芳*
江西农业大学 / 作物生理生态与遗传育种教育部重点实验室 / 江西省作物生理生态与遗传育种重点实验室, 江西南昌 330045
颖花开放由浆片膨大所启动, 对水稻授粉受精具有直接影响。生长素是调节花药开裂、花粉育性和种子起始等生殖发育过程的重要激素。为阐明生长素在水稻颖花开放中的调控作用, 本研究以粳稻品种中花11为试验材料, 调查了外源生长素及其抑制剂对颖花开放的影响, 以及内源生长素水平和生长素信号通路基因表达的动态变化。结果表明, IAA (10~20 mmol L–1)、NAA (0.05~0.50 mmol L–1)浸穗处理将推迟水稻颖花开放, 其中高浓度(0.5 mmol L–1) NAA能使颖花开放推迟3 d, 并表现出颖花张开时间延长和结实率下降的现象。IAA极性运输抑制剂TIBA及其作用抑制剂PCIB也抑制颖花开放。NAA预处理后, 增施茉莉酸甲酯(MeJA)能有效恢复颖花开放。水稻颖花中IAA含量在自然开放前2 h迅速下降, 比开颖前1 d、2 d分别降低了65.85%、74.27%。与IAA水平变化相对应, 颖花开放时浆片IAA生物合成基因(、)表达下调, 而催化IAA结合失活的酶基因(、)、IAA输出载体基因(、)以及IAA极性运输正向调节因子基因均显著上调表达。此外, 我们也鉴定到13个差异表达的IAA早期响应基因(、、), 其中10个上调表达, 3个下调表达。综上表明, 水稻颖花开放受内源生长素调控, 但提高浆片生长素水平则抑制其开放。
水稻; 颖花开放; 生长素; 抑制效应
水稻是世界重要的粮食作物之一, 其花器官的发育为人类提供了主要的粮食来源。近年来, 我国籼粳亚种间杂种优势利用取得重大突破, 以甬优、春优、浙优等系列为代表的粳型不育系/籼型恢复系(“粳不籼恢”)杂交组合, 杂种优势更强, 发展势头良好[1-2]; 但其亲本在日间开花时间的差异, 导致制种产量低下, 严重制约了籼粳杂交水稻的推广[3-4]。因此, 明确水稻颖花开放调控机制, 解决籼粳品种的“花时不遇”成为提高杂交制种产量的关键。花时是指水稻颖花在1 d中的开放时间, 通常以开花高峰表示。成熟颖花的开放通常发生在09:00—12:00, 但与品种遗传特性(籼稻花时一般比粳稻早)和环境因素(温度、湿度、光照、风力和CO2等)密切相关, 例如增温和CO2处理均可促进水稻开颖, 搓揉稻穗等机械刺激也能引起水稻开花, 田间风速增加会延迟水稻颖花开放[5-7]。
植物激素是植物细胞接受特定环境信号诱导的信号分子, 调控着植物生长发育及环境适应的各个过程。曾晓春等研究发现茉莉酸(JA)及其甲酯(MeJA)对水稻开颖表现出强烈诱导效应, 该效应在雄性不育系表现更明显[8-10]。1 mmol L–1水杨酸(SA)能抑制MeJA诱导的水稻开颖, 而MeJA的再次处理能解除SA的抑制作用[10]。水稻浆片JA生物合成在颖花开放前大幅上升, 闭颖后急剧下降[9,11-12], 水稻JA缺失突变体[13-14]、[15-16]以及JA不足的不育系ZS97A[17]表现出花时分散的现象, 而MeJA在人工改善水稻花时方面具有良好效果[18-20]。脱落酸(ABA)处理可明显加快已开颖花的闭颖过程, 缩短开闭历时[21]。
生长素主要以吲哚乙酸(indole-3-acetic acid, IAA)形式存在于植物体内, 是最早被发现且作用最广泛的植物激素, 对水稻花器官发育的调控发挥着重要作用。水稻控制依赖于色氨酸的生长素合成, 该基因缺失后,突变体胚胎致死, 花器官异常发育[22]。编码的双加氧酶催化IAA不可逆氧化生成OxIAA, 该基因缺失后花药和子房中游离IAA增加, 突变体表现出雄性不育[23]。参与水稻生长素极性运输的调控, 过量表达后, 转基因水稻雄蕊减少, 雌蕊柱头增加, 浆片发育异常[24]。众多研究证明, JA、MeJA能调控水稻花时, 但生长素除了调控水稻花器官的发育外, 是否也参与调控水稻颖花开放?为此, 本研究以中花11为试验材料, 采用生长素及其抑制剂处理开花前的稻穗, 对其进行开花动态调查、内源生长素水平测定和基因表达分析等, 从而摸清生长素对水稻颖花开放的调控效应, 以期进一步揭示水稻颖花开放的内在控制机制, 为水稻花时的人工调节提供理论基础和技术路径。
1 材料与方法
1.1 试验材料与试剂
水稻品种为中花11, 分批种植于江西农业大学科技园, 常规管理, 抽穗期为7月上旬至9月上旬。吲哚乙酸(indole-3-acetic acid, IAA)、萘乙酸(naphthaleneacetic acid, NAA)、三碘苯甲酸(2,3,5-triiodobenzoic acid, TIBA)和对氯苯氧异丁酸(p-chlorophenoxyisobutyric acid, PCIB) (国药集团化学试剂有限公司), 以0.1 mol L–1KOH溶解; 茉莉酸甲酯(methyl jamonate, MeJA)(Sigma公司)以95%乙醇溶解。试剂配成高浓度母液, 避光存放于4℃冰箱, 使用时取母液稀释成相应的施用浓度, 并用0.1 mmol L–1HCl调节生长素类溶液pH至6.5。
1.2 药剂处理和颖花开花动态调查
颖花开花调查试验前1 d下午18:00—19:00, 选择顶部已有少量颖花开放的主穗, 以一定浓度的生长素类(IAA、NAA、TIBA、PCIB)溶液(含0.2‰吐温-20)浸蘸1 min, MeJA溶液在开花调查当天早上08:00处理, 以H2O (含0.2‰吐温-20)作对照。08:30—15:00时间内统计处理稻穗的颖花开放数, 每30 min统计1次, 以记号笔标记已开的颖花, 每处理6穗。单朵颖花的开闭历时调查为在10:00— 13:00之间记录单朵颖花的开放和闭合时间, 每处理记录8朵(2朵穗–1)。
1.3 单穗颖花结实率考查
试验前1 d下午, 选取已抽出1/2左右的主穗, 每株选1穗, 用记号笔标记已开放的颖花(不计入结实率), 然后用一定浓度的IAA、NAA溶液处理稻穗(方法同1.2), 随后套袋, 25 d后考查单穗颖花结实率,每处理8穗。
1.4 颖花取样与IAA测定
根据颖花着生位置和雄蕊长度判断颖花的成熟度。剪取稻穗上开花前不同时间点的颖花, 液氮速冻后保存于–80℃冰箱。颖花样品在液氮中研磨至粉末, 准确称取0.1 g, 放置于1.5 mL离心管, 加入500 μL预冷的激素提取液(甲醇∶水∶乙酸=90∶9∶1), 于避光的4℃平板摇床中剧烈振荡提取24 h, 低温高速离心(4℃, 12,000转 min–1, 15 min), 收集上清液备用; 继续加400 μL提取液重复提取2次(提取时间分别为12 h、6 h), 然后合并3次提取所获上清液于室温下以氮气吹干, 加200 μL甲醇溶解, 再经0.22 μm尼龙滤膜过滤, 保存于–20℃冰箱中待测。按Liu等[25]操作, 利用UFLC-ESI-MS系统测定IAA浓度, 每个样品3次生物学重复。
1.5 基因表达分析
在液氮中剥取自然开放前1 d、0 h浆片, 以Trizol法提取浆片RNA。RNA样品的纯度和完整性经Nanodrop 2000、Aglient 2100检验合格后, 送北京百迈客生物科技有限公司进行RNA测序。测序平台为Illumina公司的HiSeq X-ten高通量测序系统, 测序读长为PE150。测序数据(Reads)与粳稻参考基因组(RGAP7)进行比对, 应用StringTie软件进行组装和定量。基因表达水平采用FPKM (每千个碱基的转录每百万映射读取的碎片)指标定量。应用GO、KEGG数据库对IAA途径差异表达基因进行富集和注释。
用于qRT-PCR分析的植物RNA样品经DNase I (Invitrogen)去除基因组DNA的污染后, 利用M-MLV 逆转录酶(Invitrogen)反转录合成cDNA。qRT-PCR采用SYBR Premix ExII试剂盒(Takara), 反应体系20 µL: SYBR Premix Ex10 µL, 正反向引物各0.4 µL, cDNA模板2 µL, ROX Reference Dye (50x) 0.4 µL, ddH2O 6.8 µL。反应条件为: 95℃ 30 s; 95℃ 5 s, 60℃ 38s, 循环数为40, 以为内参基因[26]。目标基因、的引物序列参考李金涛等[27],、和分别参见Woo等[28]、Du等[29]和Liu等[30], 结果根据2–ΔCt方法计算分析, 每份样品3次重复。
2 结果与分析
2.1 外源生长素对水稻颖花开放动态和结实的影响
从图1-A可以看出, 施用外源生长素(IAA和NAA)后第1天, 水稻颖花开放数均显著降低。相比清水对照, 10 mmol L–1、20 mmol L–1IAA和0.05 mmol L–1、0.2 mmol L–1NAA处理下, 颖花开放数分别下降了33.33%、57.14%和71.43%、89.88%, 而0.5 mmol L–1NAA喷施后未观察到颖花开放。随着时间的推移, 生长素的抑制效应减弱, 水稻颖花逐渐恢复开放, 低浓度生长素(10 mmol L–1IAA、0.05 mmol L–1NAA)施用后, 第2天颖花开放数最多(与对照一致), 而0.2 mmol L–1、0.5 mmol L–1NAA处理的水稻分别在第3天和第4天出现开颖高峰。由此可见, 外施生长素将抑制水稻颖花开放, 抑制效应随施用浓度的增加而显著提升, 且NAA的效果比IAA更加强烈。
通过观察颖花开放最多当天的日开花动态可知, 低浓度生长素(10 mmol L–1IAA、0.05 mmol L–1NAA)处理下水稻花时比对照(花时为11:30)推迟了1 h, 于12:30出现开颖高峰; 而高浓度生长素(0.2 mmol L–1NAA)的施用使颖花开放集中度下降, 花时分散, 在11:30—13:30间的颖花开放数无明显差异(图1-B)。这表明外施生长素将推迟水稻花时, 且推迟效应与生长素浓度正相关。跟踪调查颖花的开闭历时(图1-C), 从中可以看出, 生长素处理显著延长了单朵花开颖的历时(开颖到闭颖的时间), 外施10 mmol L–1IAA和0.1 mmol L–1、0.2 mmol L–1NAA后, 单朵颖花开闭历时分别比对照处理增加了28.91%和24.48%、45.13% (图1-C), 这与Huang等[21]结果一致。
生长素处理可显著推迟颖花开放, 是否影响水稻结实?为此, 本研究调查了各处理下的水稻自交结实率(图2), 10 mmol L–1IAA和0.1 mmol L–1、0.2 mmol L–1NAA施用后, 水稻单穗自交结实率分别比对照处理下降35.84%和48.61%、74.22%。这暗示着生长素处理推迟了颖花开放, 可能造成已发育成熟的雄蕊因未能及时开颖而育性下降, 导致水稻自交结实率显著降低。
2.2 生长素抑制剂对水稻颖花开放动态的影响
为深入阐明生长素对颖花开放的调控作用, 本研究进一步调查了稻穗在施用IAA抑制剂TIBA和PCIB后的开花动态。TIBA、PCIB分别是IAA的极性运输抑制剂和作用抑制剂[31]。结果显示TIBA处理后, 颖花开放的集中度和全天开放总数明显下降, 下降效应随TIBA施用浓度的增加而增强(图3-A)。低浓度PCIB (1 mmol L–1)处理的水稻颖花开放时间及数量与对照基本无异, 高浓度(5 mmol L–1、10 mmol L–1) PCIB的施用虽不推迟花时但抑制颖花开放, 花时开颖数和全天开放总量分别减少27.01%、59.12%和18.86%、43.06% (图3-B)。上述结果说明, 阻碍颖花中IAA的向基运输以及拮抗IAA的生理作用均抑制颖花开放, 进一步表明内源IAA信号介导颖花开放的调控。

图1 不同生长素处理下的水稻颖花开放动态
A: 不同生长素处理后4 d内水稻颖花开放情况。B: 不同生长素处理后水稻颖花开放最多的当天逐时开花情况。C: 不同生长素处理后单朵颖花开闭历时。不同小写字母代表在0.05概率水平差异显著(Duncan’s检验)。
A: the number of opening florets per panicle after different auxin conditions during 4 days. B: the number of opening florets per panicle in one day that has most opening florets under different auxin conditions. C: the opening duration of single florets under different auxin conditions. Different lowercase letters mean significant difference at the 0.05 probability level (Duncan’s test).

图2 不同生长素处理下的单穗自交结实率
不同小写字母代表在0.05概率水平差异显著(Duncan’s检验)。
Different lowercase letters mean significant difference at the 0.05 probability level (Duncan’s test).
2.3 MeJA对生长素抑制颖花开放的解除作用
从图4可以看出, 单一MeJA处理的水稻花时由11:30 (对照)提前至08:30, 全天颖花开放总数比对照高出35.35%, 此结果与前人研究一致, 表明MeJA能诱导水稻开颖。0.1 mmol L–1、0.2 mmol L–1NAA处理后, 颖花开放几乎被完全抑制(与图1结果一致); 而在此处理上增施MeJA, 水稻颖花恢复开放, 且花时分别提早至上午09:00、09:30, 当天颖花开放总数也与对照无明显差异。这表明生长素对水稻颖花开放的抑制效应可被MeJA所逆转, 这也提示外源生长素处理并未损伤颖花内浆片等组织。
2.4 水稻颖花中IAA含量的动态变化
图5显示, 水稻颖花中IAA水平波动较大: 开颖前2 d (BF2d)高水平积累, 含量达到最大值(近90 mg g–1); 而随着开花的临近, IAA含量逐步下降, 且在颖花开放前数小时内快速下降。与BF2d相比, 颖花中IAA在开颖前1 d (BF1d)降低了24.67%, 而在开颖花前2 h (BF2h)降幅高达74.27%, 且含量持续下降, 于颖花开放时(BF0h)达到最低值, 仅为BF2d的19.96% (图5)。这表明水稻花器官发育可能需要高浓度IAA, 于开花前2 d大量积累IAA, 而颖花开放需要低水平IAA, 前期积累于颖花的IAA在颖花开放前2 h内快速下降。

图3 TIBA (A)和PCIB (B)处理下水稻颖花的开放动态

图4 MeJA对生长素抑制水稻颖花开放的影响
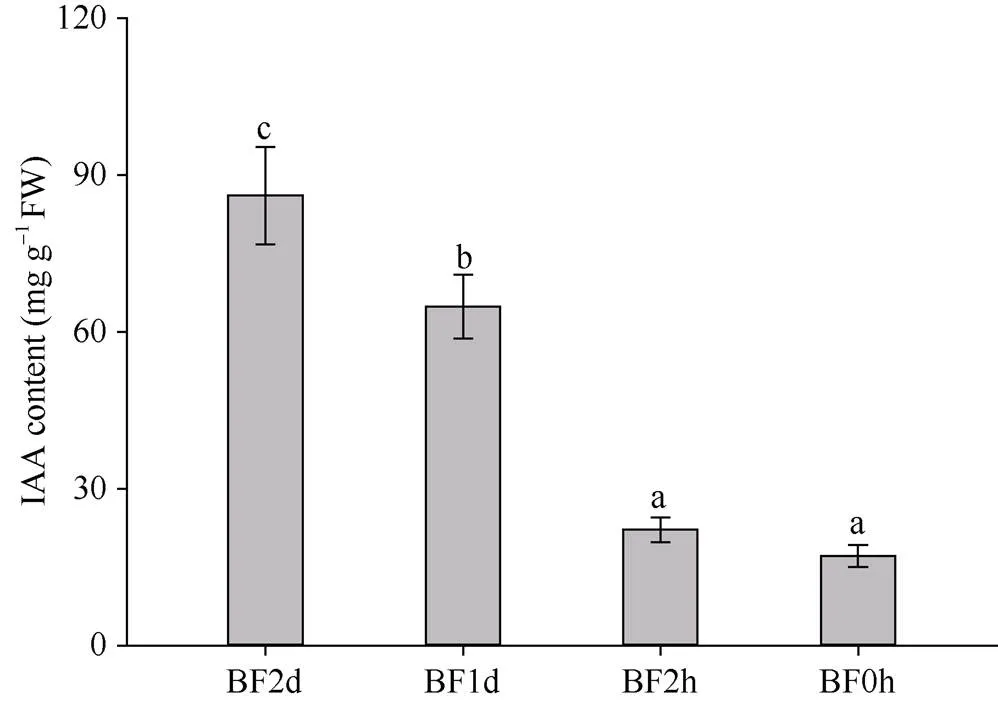
图5 水稻颖花开放前不同时间的IAA含量
BF2d、BF1d、BF2h和BF0h分别表示开花前2 d、1 d、2 h和颖花开放时。不同小写字母代表在0.05概率水平差异显著(Duncan’s检验)。
BF2d, BF1d, BF2h, and BF0h means the time of 2 d, 1 d, 2 h before flowering and floret opening, respectively. Different lowercase letters mean significant difference at the 0.05 probability level (Duncan’s test).
2.5 水稻颖花开放前浆片IAA信号通路变化
颖花基部的一对微小浆片在推动外稃张开过程中发挥关键作用[17], 为进一步揭示水稻颖花开放过程中浆片IAA水平的动态变化, 本研究对浆片进行转录组测序, 并对IAA信号通路差异表达基因进行富集分析(图6-A)。植物体内最基本的生长素合成途径是以色氨酸为前提的吲哚丙酮酸途径, 需要色氨酸氨基转移酶(TAR/TAA)和黄素单加氧酶(YUCCA)的催化[31]。与IAA合成和代谢途径相关的基因, 我们富集到了7个差异基因。与开花前1 d (BF1d)相比, 水稻颖花开放时(BF0h)浆片IAA合成关键基因、均显著下降表达, 但表达上调。IAA的结合态是非活性形式, 催化IAA与氨基酸不可逆结合的GH3蛋白编码基因和[32]表达分别增加了约12和2倍。我们也富集到3个与IAA极性运输有关的差异基因, 介导IAA输出的PIN1蛋白基因和, 以及IAA极性运输正调节因子基因[30]均大幅增强表达。以上基因表达变化表明, 颖花开放前浆片游离态IAA水平会下降, 这与图5颖花IAA水平大幅下降相一致。13个差异表达的生长素信号途径早期响应基因(、、)也被鉴定, 其中10个上调表达, 3个下调表达, 这提示IAA信号介导浆片膨大过程。为进一步验证转录组测序结果, 对其中10个基因的表达水平进行qRT-PCR鉴定(图6-B), 从中可以看出, 这10个基因的差异表达变化与转录组测序结果基本吻合。

图6 浆片中IAA信号通路相关基因的表达分析
A: 水稻颖花开放前1 d和颖花开放时浆片转录组分析。B:,,和等10个选择基因的表达变化值qRT-PCR检测与RNA-Seq的相关性分析。横坐标为qRT-PCR的相对表达水平, 纵坐标为RNA-Seq的差异表达水平, 二者均取log2的对数。BF1d和BF0h分别表示开花前1 d和颖花开放时。
A: transcriptional analysis of rice lodicules at the time of 1 d before flowering and floret opening. B: the correlation analysis on the expression changes of 10 selected genes including,,, andwith the methods of qRT-PCR and RNA-seq. The values of log2for relative expression level of qRT-PCR and differential expression levels of RNA-Seq were as the horizontal and vertical coordinates, respectively. BF1d and BF0h means the time of 1 d before flowering and floret opening, respectively.
3 讨论
生长素作为最重要的植物激素, 参与调控植物生长发育的各个过程[32-33]。然而, 生长素在植物花开放中的调控作用却研究较少。前人发现, 生长素(IAA、NAA)促进鸢尾()和睡莲()的花朵开放, 而其极性运输抑制剂TIBA却抑制开放[34-35]。但是, 外施生长素及极性运输抑制剂(TIBA、NPA)对水稻胚根、拟南芥初生根的生长只表现出抑制作用, 没有促进效应[31,36]。本研究显示, 外源生长素(IAA、NAA)对水稻颖花开放具有明显抑制作用, 抑制效应与生长素浓度正相关(图1-A, B)。这与水稻突变体植株因活性IAA大幅增加而表现出颖花不开和花药不裂的现象[23]相符合。本研究进一步发现, IAA运输、作用抑制剂TIBA、PCIB也显著抑制颖花开放(图3), 而且颖花自然开放前2 h内源IAA含量显著下降(图5)。这些结果表明, 内源IAA介导水稻颖花开放的调控, 但颖花开放时浆片IAA含量已下降至低水平, 提高IAA水平则推迟颖花开放。
已知JA诱导颖花开放, 并且颖花开放前浆片JA水平会显著上升[11,17]。在拟南芥花器官晚期发育以及侧根发育中, IAA信号途径对JA生物合成均存在负调控作用[37-38]。有趣的是, MeJA能有效恢复生长素抑制的颖花开放(图4), 这提示高水平IAA对浆片JA生物合成可能有抑制作用, 两者相互作用的分子机制有待进一步研究。
作为高效的发育信号, 激素必须寿命短并且不能长时间积累, 细胞内IAA稳态(homeostasis)受到合成、代谢、结合和运输等的综合调控[23,32]。YUCCA是催化IPA (吲哚-3-丙酮酸)合成IAA的限速酶, 对生长素的生物合成至关重要, 并在众多植物研究中获得证实。研究表明, 拟南芥YUCCA基因家族11个成员均参与IAA的生物合成[39]; HvYUCCA4特异表达于大麦花粉, 负责活性生长素的合成[40]; 水稻中多数超表达后都导致转基因植株IAA水平显著增加, 并表现出相似的异常表型[41]。本研究中的表达下降, 尤其是, 该基因可能直接调控浆片IAA的生物合成。Lee等[42]研究发现拟南芥中超量表达还能提高植株的抗旱性。本研究结果显示, 颖花开放时浆片表达量显著增加(图6), 但IAA含量(图5)并未积累, 推测颖花开放时柱头和花药暴露在外, 需忍受一定程度的干旱胁迫, 从而诱导了该基因的增强表达。
生长素的分解代谢保证了活性激素的浓度超过最适水平或激素反应完成时活性激素的降解。是生长素早期基因(、和)之一, 编码生长素酰胺合成酶, 催化游离的IAA不可逆降解生成OxIAA, 在IAA的酶促降解以及植株体内IAA稳态调控中起着非常重要的作用。和过量表达导致拟南芥侧根稀少且矮小, 植株体内高水平积累IAA; 而基因敲除后, 突变体对IAA非常敏感[43-44]。Ding等[45]研究发现水稻中GH3.8能催化IAA-氨基酸的合成从而抑制生长素的作用。本研究显示水稻颖花自然开放时, 浆片中和显著增强表达(图6), 表明IAA的不可逆降解增强, 这与颖花中IAA水平低下(图5)相符。
生长素的极性运输依赖于3种载体蛋白: 输入载体AUX1/LAX蛋白、输出载体PIN蛋白和兼有输入与输出功能的ABCB/MDR/PGP蛋白, 植物通过调控这些载体蛋白来调节生长素的极性运输和分布, 进而调控植物的生长发育[30]。本研究发现, 颖花开放时浆片和表达水平上升, 且生长素极性运输正调控因子也上调表达(图6), 表明生长素输出加快, 这与极性运输抑制TIBA推迟颖花开放(图3-A)符合。最新研究表明, ABCB可独立于PIN蛋白作用于生长素外流; 但PIN介导的生长素外流主要是通过ABCB共定位的共依赖外流[46]。研究表明, 在拟南芥中AtABCB1和AtABCB19介导生长素输出[47-48], 而AtABCB4和AtABCB21兼具生长素输出和输入双重运输功能, 运输方向取决于细胞内生长素水平[49-50]。水稻OsABCB14已被证实是生长素输入载体, 并介导铁(Fe)稳态[51]。本研究鉴定到颖花开放时浆片中表达水平显著下调(图6), 其生理功能有待进一步研究。
4 结论
水稻颖花开放需要浆片IAA水平的下降, 外源提高IAA水平则抑制颖花开放, 但这种抑制效应可被MeJA解除。水稻颖花自然开放过程中浆片低水平IAA的形成受到IAA生物合成、结合、极性运输等相关途径的调节。
[1] 宋昕蔚, 林建荣, 吴明国. 水稻籼粳亚种间杂种优势利用研究进展与展望. 科学通报, 2016, 61: 3778–3786. Song X W, Lin J R, Wu M G. Review and prospect on utilization of heterosis betweenrice subspecies., 2016, 61: 3778–3786 (in Chinese with English abstract).
[2] 徐伟东, 蔡金洋, 杨尧城. 水稻籼粳亚种间杂种优势利用研究现状与展望. 中国稻米, 2016, 22(2): 1–7. Xu W D, Cai J Y, Yang Y C. Research progress and prospect on utilization of heterosis betweenrice subspecies., 2016, 22(2): 1–7 (in Chinese with English abstract).
[3] 王胜军, 王广峰, 范俊山, 张春和, 闫双勇, 童继平, 马忠友, 苏京平, 孙林静, 刘学军. 粳型三系杂交稻亲本开花习性研究.贵州农业科学, 2009, 37(12): 12–14. Wang S J, Wang G F, Fan J S, Zhang C H, Yan S Y, Tong J P, Ma Z Y, Su J P, Sun L J, Liu X J. Study on flowering habit of sterile and restorer lines of hybridrice., 2009, 37(12): 12–14 (in Chinese with English abstract).
[4] 林建荣, 宋昕蔚, 吴明国, 程式华. 籼粳超级杂交稻育种技术创新与品种培育. 中国农业科学, 2016, 49: 207–218. Lin J R, Song X W, Wu M G, Cheng S H. Breeding technology innovation of-super hybrid rice and varietal breeding., 2016, 49: 207–218 (in Chinese with English abstract).
[5] 何永明, 曾晓春, 向妙莲, 黄俊宝, 付永琦. 水稻花时调控研究进展. 湖北农业科学, 2014, 53: 1489–1492. He Y M, Zeng X C, Xiang M L, Huang J B, Fu Y Q. Advances on floret opening time of rice., 2014, 53: 1489–1492 (in Chinese with English abstract).
[6] 张萌, 戴冬青, 李西明, 张华丽, 马良勇. 水稻花时性状研究进展. 核农学报, 2016, 30: 267–274. Zhang M, Dai D Q, Li X M, Zhang H L, Ma L Y. Advances on the study of flowering time trait in hybrid rice., 2016, 30: 267–274 (in Chinese with English abstract).
[7] 黄友明, 曾晓春. 多功能调节剂对杂交水稻制种母本颖花开闭和种子生产的影响. 杂交水稻, 2022, 37(3): 87–94. Huang Y M, Zeng X C. Effects of multifunctional regulators on spikelet opening and closing and seed production of the female parent in hybrid rice seed production., 2022, 37(3): 87–94 (in Chinese with English abstract).
[8] 曾晓春, 周燮. 茉莉酸甲酯(MeJA)诱导水稻颖花开放. 植物学报, 1999, 41: 560–562. Zeng X C, Zhou X. Methyl jasmonate induces the opening of spikelets in rice., 1999, 41: 560–562 (in Chinese with English abstract).
[9] 何永明, 林拥军, 曾晓春. 水稻颖花自然开放过程中茉莉酸(JA)生物合成的变化. 作物学报, 2012, 38: 1891–1899. He Y M, Lin Y J, Zeng X C. Dynamic changes of jasmonic acid biosynthesis in rice florets during natural anthesis., 2012, 38: 1891–1899 (in Chinese with English abstract).
[10] 宋平, 夏凯, 吴传万, 包冬萍, 陈丽莉, 周燮, 曹显祖. 雄性不育和可育水稻开颖对茉莉酸甲酯响应的差异. 植物学报, 2001, 43: 480–485. Song P, Xia K, Wu C W, Bao D P, Chen L L, Zhou X, Cao X Z. Differential response of floret opening in male-sterile and male-fertile rices to methyl jasmonate., 2001, 43: 480–485 (in Chinese with English abstract).
[11] 黄俊宝, 何永明, 曾晓春, 向妙莲, 付永琦. 水稻颖花开放前花器官茉莉酸水平变化及浆片茉莉酸信号基因表达分析. 中国农业科学, 2015, 48: 1219–1227. Huang J B, He Y M, Zeng X C, Xiang M L, Fu Y Q. Changes of JA levels in floral organs and expression analysis of JA signaling genes in lodicules before floret opening in rice., 2015, 48: 1219–1227 (in Chinese with English abstract).
[12] 付永琦, 向妙莲, 蒋海燕, 何永明, 曾晓春. 水稻颖花开放前浆片转录组变化. 中国农业科学, 2016, 49: 1017–1033. Fu Y Q, Xiang M L, Jiang H Y, He Y M, Zeng X C. Transcriptome profiling of lodicules before floret opening inL., 2016, 49: 1017–1033 (in Chinese with English abstract).
[13] Biswas K K, Neumann R, Haga K, Yatoh O, Iino M. Photomorphogenesis of rice seedlings: a mutant impaired in phytochrome-mediated inhibition of coleoptile growth., 2013, 44: 242–254.
[14] 潘孝武, 刘文强, 黎用朝, 熊海波, 盛新年, 段永红, 余亚莹, 赵文锦, 魏秀彩, 李小湘. 水稻裂颖突变体的鉴定及基因定位. 中国水稻科学, 2019, 33: 323–330. Pan X W, Liu W Q, Li Y C, Xiong H B, Sheng X N, Duan Y H, Yu Y Y, Zhao W J, Wei X C, Li X X. Identification and genetic analysis of split husk mutant sh1 in rice., 2019, 33: 323–330 (in Chinese with English abstract).
[15] Liao L, Shi C H, Zeng D D, Jin X L, Wu J G. Morphogenesis and molecular basis on the unclosed glumes, a novel mutation related to the floral organ of rice., 2015, 33: 480–489.
[16] Li X H, Wang Y H, Duan E C, Qi Q, Zhou K N, Lin Q Y, Wang D, Wang Y L, Long W H, Zhao Z G, Cheng Z J, Lei C L, Zhang X, Guo X P, Wang J L, Wu C Y, Jiang L, Wang C M, Wan J M. OPEN GLUME1: a key enzyme reducing the precursor of JA, participates in carbohydrate transport of lodicules during anthesis in rice., 2018, 37: 329–346.
[17] Liu L, Zou Z S, Qian K, Xia C, He Y, Zeng H L, Zhou X, Riemann M, Yin C X. Jasmonic acid deficiency leads to scattered floret opening time in cytoplasmic male sterile rice Zhenshan 97A., 2017, 68: 4613–4625.
[18] 林俊城, 田小海, 殷桂香, 汤吉洪, 杨志刚. 人工调节籼型杂交水稻不育系花时的研究. 中国农业科学, 2008, 41: 2474–2479. Lin J C, Tian X H, Yin G X, Tang J H, Yang Z G. Artificial regulation of the flowering time of CMS lines inhybrid rice seed production, 2008, 41: 2474–2479 (in Chinese with English abstract).
[19] 闫志强, 徐海, 马作斌, 高东昌, 徐正进. 籼稻与粳稻花时对茉莉酸甲酯(MeJA)响应的敏感性差异. 中国农业科学, 2014, 47: 2529–2540. Yan Z Q, Xu H, Ma Z B, Gao D C, Xu Z J. Differential response of floret opening to exo-methyl jasmonate between subsp.and subsp.in rice., 2014, 47: 2529–2540 (in Chinese with English abstract).
[20] 王依明, 王冬翼, 顾春军, 吴雪源, 戴国忠. 茉莉酸甲酯喷施时间对粳型水稻不育系花时诱导效应研究. 上海农业学报, 2015, 31(6): 91–94. Wang Y M, Wang D X, Gu C J, Wu X Y, Dai G Z. Effect of methyl jasmonate spraying time on keng rice sterile lines’ flowering habit., 2015, 31(6): 91–94 (in Chinese with English abstract).
[21] Huang Y M, Zeng X C, Cao H P. Hormonal regulation of floret closure of rice ()., 2018, 13: e0198828.
[22] Sazuka T, Kamiya N, Nishimura T, Ohmae K, Sato Y, Imamura K, Nagato Y, Koshiba T, Nagamura Y, Ashikari M. A rice tryptophan deficient dwarf mutant,, contains a reduced level of indole acetic acid and develops abnormal flowers and organless embryos., 2009, 60: 227–241.
[23] Zhao Z G, Zhang Y H, Liu X, Zhang X, Liu S C, Yu X W, Ren Y L, Zheng X M, Zhou K N, Jiang L, Guo X P, Gai Y, Wu C Y, Zhai H Q, Wang H Y, Wan J M. A role for a dioxygenase in auxin metabolism and reproductive development in rice., 2013, 27: 113–122.
[24] Wu H M, Xie D J, Tang Z S.regulates floral organ development by modulating auxin transport and interacts with MADS16 in rice., 2020, 18: 1778–1795.
[25] Liu H B, Li X H, Xiao J H, Wang S P. A convenient method for simultaneous quantification of multiple phytohormones and metabolites: application in study of rice-bacterium interaction., 2012, 8: 2.
[26] 张芳, 陆涵, 何永明. 水稻雄蕊发育晚期赤霉素生物合成特性分析. 江西农业大学学报, 2022, 44(1): 21–28.Zhang F, Lu H, He Y M. Characteristics of gibberellin biosynthesis in late stamen development of rice., 2022, 44(1): 21–28 (in Chinese with English abstract).
[27] 李金涛, 樊海燕, 赵琦琦, 逯丹阳, 杨玉娜, 易庆平, 刘明艳, 贾玉芳, 彭波, 简清梅. 脱落酸对水稻根系生长素合成与运输的调控. 信阳师范学院学报(自然科学版), 2019, 32(1): 39–46. Li J T, Fan H Y, Zhao Q Q, Lu D Y, Yang Y N, Yi Q P, Liu M Y, Jia Y F, Pen B, Jian Q M. Research of abscisic acid modulated auxin biosynthesis and transport in rice root.(Nat Sci Edn), 2019, 32(1): 39–46 (in Chinese with English abstract).
[28] Woo Y M, Park H J, Mukhamad S, Yang J L, Park J J, Back K, Park Y M, An G. Constitutively wilted 1, a member of the ricegene family, is required for maintaining water homeostasis and an appropriate root to shoot ratio., 2007, 65: 126–136.
[29] Du H, Liu H B, Xiong L Z. Endogenous auxin and jasmonic acid levels are differentially modulated by abiotic stresses in rice., 2013, 4: 389–397.
[30] Liu L C, Tong H N, Xiao Y H, Che R H, Xu F, Hu B, Liang C Z, Chu J F, Li J Y, Chu C C. Activation of big grain1 significantly improves grain size by regulating auxin transport in rice., 2015, 112: 11102–11107.
[31] Yin C X, Wu Q R, Zeng H L, Xia K, Xu J W, Li R W. Endogenous auxin is required but supraoptimal for rapid growth of rice (L.) seminal roots, and auxin inhibition of rice seminal root growth is not caused by ethylene., 2011, 30: 20–29.
[32] Wang Y D, Zhang T, Wang R C, Zhao Y D. Recent advances in auxin research in rice and their implications for crop improvement., 2018, 69: 255–263.
[33] 沈卫平, 蔡强, 周锋利, 张建中, 张大兵, 袁政. 植物激素调控水稻花器官发育分子机制的研究进展. 植物生理学报, 2015, 51: 593–600. Shen W P, Cai Q, Zhou F L, Zhang J Z, Zhang D B, Yuan Z. Advances in the molecular mechanism underlying phytohormones function in regulating rice flower development., 2015, 51: 593–600 (in Chinese with English abstract).
[34] van Doorn W G, Dole I, Celikel F G, Harkema H. Opening of Iris flowers is regulated by endogenous auxins., 2013, 170: 161–164.
[35] Ke M, Gao Z, Chen J Q, Qiu Y T, Zhang L S, Chen X. Auxin controls circadian flower opening and closure in the waterlily., 2018, 18: 143.
[36] Staswick P E. The tryptophan conjugates of jasmonic and indole-3-acetic acids are endogenous auxin inhibitors., 2009, 150: 1310–1321.
[37] Cecchetti V, Altamura M M, Brunetti P, Petrocelli V, Falasca G, Ljung K, Costantino P, Cardarelli M. Auxin controlsanther dehiscence by regulating endothecium lignification and jasmonic acid biosynthesis., 2013, 74: 411–422.
[38] Cai X T, Xu P, Zhao P X, Liu R, Yu L H, Xiang C B.ERF109 mediates cross-talk between jasmonic acid and auxin biosynthesis during lateral root formation., 2014, 5: 5833.
[39] Cao X, Yang H L, Shang C Q, Ma S, Liu L, Cheng J L. The roles of auxin biosynthesis in YUCCA gene family in plants., 2019, 20: 6343.
[40] Dhika A, Felix P F, Ulla N, Marine P, Jan Š, Zhang Y J, Chen Z L, Andrea G, Alisdair R F, Karin L, Iván F A. Auxin boosts energy generation pathways to fuel pollen maturation in barley., 2022, 32: 1798–1811.
[41] Zhang T, Li R N, Xing J L, Yan L, Wang R C, Zhao Y D. The YUCCA-Auxin-WOX11 module controls crown root development in rice., 2018, 9: 523.
[42] Lee M, Jung J H, Han D Y, Seo P J, Park W J, Park C M. Activation of a flavin monooxygenase geneenhances drought resistance in., 2012, 235: 923–938.
[43] Staswick P E, Serban B, Rowe M, Tiryaki I, Maldonado M T, Maldonado M C, Suza W. Characterization of anenzyme family that conjugates amino acids toindole-3-acetic acid., 2005, 17: 616–627.
[44] 黄薇, 孙琦, 刘芳, 金玉环, 罗先梅, 黄先忠. 小拟南芥激素相关基因及的克隆与表达. 石河子大学学报, 2019, 37: 323–331. Huang W, Sun Q, Liu F, Jin Y H, Luo X M, Huang X Z. Analysis of hormone-related genes ofand cloning and expression ofgene., 2019, 37: 323–331 (in Chinese with English abstract).
[45] Ding X H, Cao Y L, Huang L L, Zhao J, Xu C G, Li X H, Wang S P. Activation of the indole-3-acetic acid-amido synthetase GH3-8 suppresses expansin expression and promotes salicylate- and jasmonate-independent basal immunity in rice., 2008, 20: 228–240.
[46] Nathan L M, Ute V, Alexander W, George J, Duncan B, Anthony B, Malcolm J B, Markus G, Darren M W, Leah R B. Systems approaches reveal that ABCB and PIN proteins mediate co-dependent auxin efflux., 2022, 34: 2309–2327.
[47] Geisler M, Blakeslee J J, Bouchard R, Lee O R, Vincenzetti V, Bandyopadhyay A, Titapiwatanakun B, Peer W A, Bailly A, Richards E L. Cellular efflux of auxin catalyzed by theMDR/PGP transporter AtPGP1., 2005, 44: 179–194.
[48] Bouchard R, Bailly A, Blakeslee J J, Oehring S C, Vincenzetti V, Lee O R, Paponov I, Palme K, Mancuso S, Murphy A S. Immunophilin-like TWISTED DWARF1 modulates auxin efflux activities ofP-glycoproteins., 2006, 281: 30603–30612.
[49] Cho M, Lee Z W, Cho H T. ATP-binding cassette B4, an auxin-efflux transporter, stably associates with the plasma membrane and shows distinctive intracellular trafficking from that of PIN-FORMED proteins., 2012, 159: 642–654.
[50] Kamimoto Y, Terasaka K, Hamamoto M, Takanashi K, Fukuda S, Shitan N, Sugiyama A, Suzuki H, Shibata D, Wang B.ABCB21 is a facultative auxin importer/exporter regulated by cytoplasmic auxin concentration., 2012, 53: 2090–2100.
[51] Xu Y X, Zhang S N, Guo H P, Wang S K, Xu L G, Li C Y, Qian Q, Chen F, Markus G, Qi Y H, Jiang D A. OsABCB14 functions in auxin transport and iron homeostasis in rice (L.)., 2014, 79: 106–117.
Study of regulating effect of auxin on floret opening in rice
HE Yong-Ming and ZHANG Fang*
Jiangxi Agricultural University / Key Laboratory of Crop Physiology, Ecology and Genetic Breeding, Ministry of Education / Jiangxi Key Laboratory of Crop Physiology, Ecology and Genetic Breeding, Nanchang 330045, Jiangxi, China
Floret opening which is driven by swelling of lodicules has a direct effect on rice pollination and fertilization. Auxin is an essential phytohormone in regulating reproductive development processes such as anther dehiscence, pollen fertility, and seed initiation. To elucidate the role of auxin in floret opening, the effects of exogenous auxin and its inhibitors on floret opening, and dynamic changes of endogenous auxin levels, and gene relative expression levels of auxin pathway in florets and lodicules were investigated incultivar Zhonghua 11. The results showed that the panicles soaked with IAA (10–20 mmol L–1) or NAA (0.05–0.50 mmol L–1) delayed significantly floret opening. Under high concentration of NAA (0.5 mmol L–1), compared with the water-treated panicles, the floret opening was postponed by three days. The prolonged opening duration of single floret and decreased seed-setting rate were also observed after IAA and NAA treatments. Treatments with IAA polar transport inhibitor TIBA and function inhibitor PCIB delayed florets opening as well. Furthermore, the application of methyl jamonate (MeJA) could restore effectively floret opening which was retared by NAA pretreatments. A sharp decline of IAA levels was detected two hours before floret opening in natural condition. Compared to that at 1 d and 2 d before opening, IAA level in florets at 2 hours before opening was decreased by 65.85% and 74.27%, respectively. Corresponding to the changes of IAA levels in florets, the relative expression levels of IAA biosynthetic genes (,) in the lodicules were down-regulated during floret opening, while the expressions of catabolic genes (/) in formation of inactive IAA conjugates, IAA efflux transport genes (,), and its positive regulatorgene were significantly up-regulated. 13 differentially expressed early auxin response genes (,,) were also identified, among which, 10 were up-regulated and 3 down-regulated. In conclusion, rice floret opening was regulated by endogenous auxin, but was inhibited by elevating auxin level in lodicules.
rice; floret opening; auxin; inhibitory effect
10.3724/SP.J.1006.2023.22027
本研究由国家自然科学基金项目(31360295, 31801272)和江西省自然科学基金项目(20212BAB205006, 20202BABL215001)资助。
This study was supported by the National Natural Science Foundation of China (31360295, 31801272) and the Jiangxi Provincial Natural Science Foundation (20212BAB205006, 20202BABL215001).
张芳, E-mail: zhangf0124@126.com
E-mail: hymcom@126.com
2022-05-07;
2022-10-10;
2022-10-26.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20221025.1811.008.html
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).

