单形性嗜上皮肠道T细胞淋巴瘤的临床特征分析
张炼 喻芳 韦菊英 谢万灼 叶琇锦 许改香 俞文娟 佟红艳
原发性胃肠道淋巴瘤少见,且大多来源为B 细胞谱系,T 细胞淋巴瘤仅占13.0%~14.5%。单形性嗜上皮性肠道T 细胞淋巴瘤(monomorphic epitheliotropic intestinal T-cell lymphoma,MEITL)为临床罕见的原发性胃肠道T 细胞淋巴瘤,在胃肠道淋巴瘤中占比低于5.0%,在所有非霍奇金淋巴瘤中占比不到1.0%。2008年WHO 根据流行病学和临床病理学特征的差异,并且被命名为Ⅱ型肠病相关T 细胞淋巴瘤(enteropathyassociated T-cell lymphoma,EATL),在2016 年WHO 淋巴瘤分类标准中被称为MEITL[1]。MEITL 缺乏特异性临床表现、侵袭性强、预后极差,如何正确诊断和治疗均是难题。本研究回顾性分析7 例MEITL 患者的临床表现、组织病理特点、相关的分子生物学特征及诊治过程,并进行相关文献复习,以期帮助临床医生减少对该疾病的漏诊、误治,现报道如下。
1 对象和方法
1.1 对象 选取2020 年1 月至2022 年1 月浙江大学医学院附属第一医院血液科收治的经病理检查确诊的MEITL 患者7 例。患者临床诊断采用1961 年Dawson 等[2]提出的原发性胃肠道淋巴瘤的诊断标准,病理诊断符合2016 年WHO 淋巴瘤分类标准[1]。本研究经医院医学伦理委员会批准。
1.2 方法 回顾7 例患者的基本人口学特征,临床表现、内镜及(或)影像学资料,病理和免疫组化检查,EB 病毒编码mRNA(epstein-barr virus encoded RNA,EBER)原位杂交、T 细胞抗原受体(T cell antigen receptor,TCR)基因重排,基因检测(二代测序),诊断方法,治疗及随访结果。
2 结果
2.1 MEITL 患者临床特征 7 例患者中男2 例,女5例;发病年龄55~67 岁,中位年龄64 岁。患者确诊前起病病程1~6 个月,中位数2 个月;腹痛6 例,低蛋白血症2 例,腹泻合并低钾血症1 例,合并肺部浸润、恶性胸水1 例,体重下降1 例,下降幅度5 kg;无乳糜泻病史。初发部位以小肠多见,累及结肠4 例(局限于结肠1 例),肠梗阻及肠穿孔各3 例,膀胱穿孔1 例,同时合并直肠癌1 例。美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体能评分为2 级2 例,3 级3 例,1 级及4 级各1 例。轻度贫血2 例,粪便隐血阳性2 例,CRP 升高3 例,乳酸脱氢酶升高3 例。肿瘤标志物:鳞状细胞癌抗原SCCA、癌胚抗原和甲胎蛋白均无明显升高,糖类抗原125、糖类抗原19-9 及血清铁蛋白各有2 例有异常升高。7 例均行骨髓学检查,骨髓学检查未显示淋巴瘤受累的证据。行结肠镜检查2 例,其中异常1 例,病变示连续的和明显的深部溃疡,肠壁僵硬感,肠腔狭窄,另1 例肠腔黏膜未见明显异常。7 例均行腹部CT 检查,提示受累肠壁增厚或腹腔肿块、周围淋巴结肿大;3 例在手术前行PETCT 检查,发现受累处18F-氟脱氧葡萄糖(18F-nuomdeoxyglucose,18F-FDG)明显摄取增高,最大标准化摄取值(mximal standardized uptake value,SUVmax)波 动 在15.2~18.46。见表1。
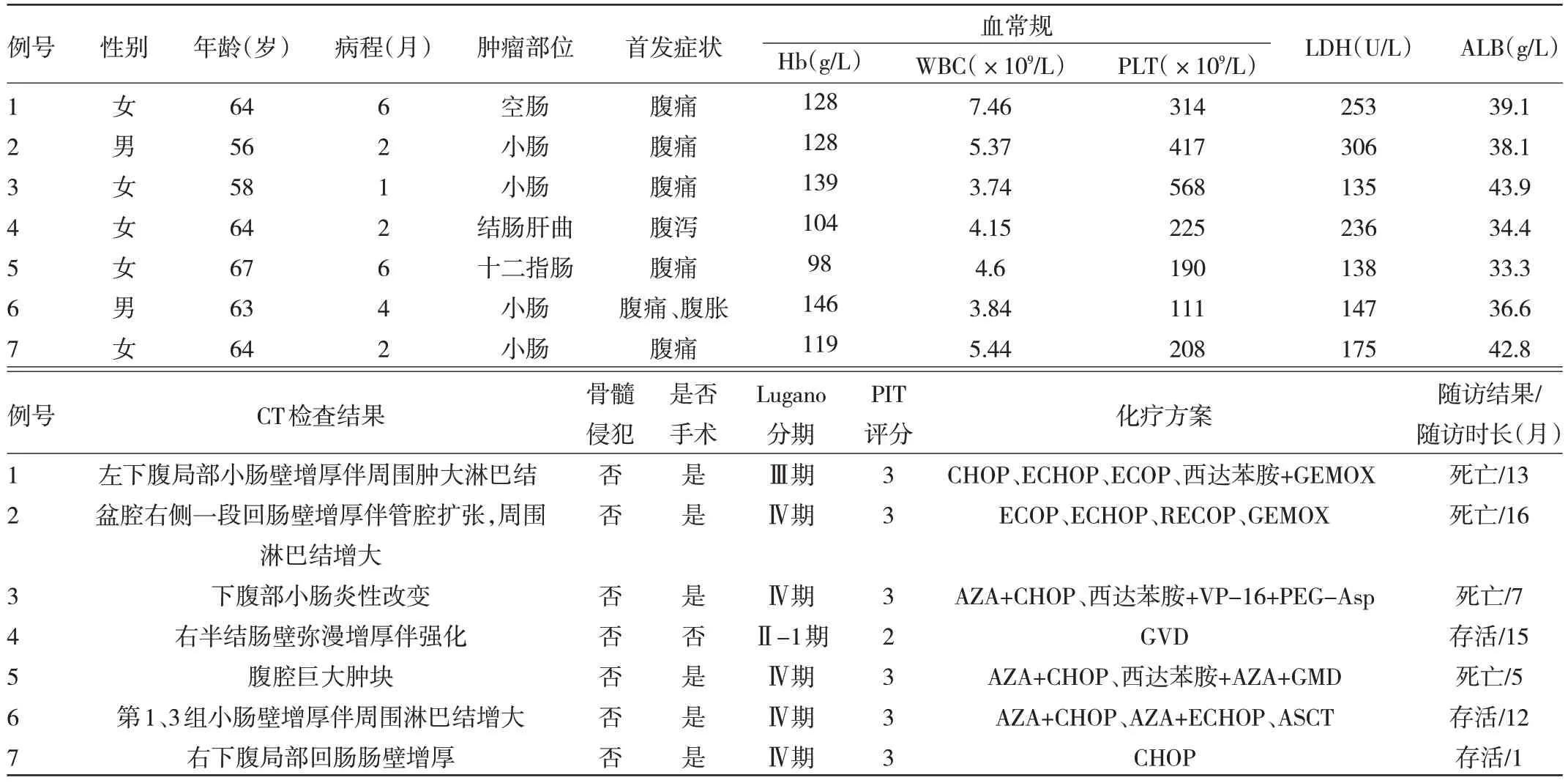
表1 7 例MEITL 患者临床特征
2.2 MEITL 患者病理、免疫组化表型、EBER 原位杂交、TCR 受体基因重排检测及基因检测结果 2 例患者为内镜下的活检病理证实,5 例行外科肿物切除手术病理证实。其中病变肿瘤直径5~10 cm 1 例,直径>10 cm 2 例。光镜观察:镜下7 例均可见大量单一小至中等大小肿瘤细胞浸润;免疫组化表型提示CD3(7/7)、CD8(7/7)、CD56(6/7)、TIA-1(5/7)阳性表达;CD5(6/6)、CD30(5/5)均为阴性表达。EBER 原位杂交检测7 例均为阴性。Ki-67 指数中位数为70%,平均68.6%(50%~80%)。2 例T 细胞受体γ(Tcell receptor γ,TCRγ)和T 细胞受体δ(Tcell receptor δ,TCRδ)基因呈现单克隆性重排,其中1 例初发部位空肠中上段占位、溃疡,外院行小肠镜检查发现,小肠镜下活检病理考虑淋巴瘤可能,经本院病理科会诊,行免疫表型复核、EBER 原位杂交及TCR 受体基因重排证实转入本院,另1 例CD20 反常表达阳性,无乳糜泻病史,TCR 受体基因重排等检测明确MEITL,见表2。1 例行淋巴瘤基因检测:检测到高频的突变基因为KRAS、FAT1、KMT2A、KMT2B、SETD2。突变基因主要以错义突变为主,突变丰度分别为28.6%、27.7%、33.2%、31.6%、45.5%;其中,KMT2A 基因p.P3665T 第30 外显子错义突变、KMT2B 基因p.T1389I 第16 外显子错义突变、SETD2 基因p.V1820E 第12 外显子错义突变,见表3。
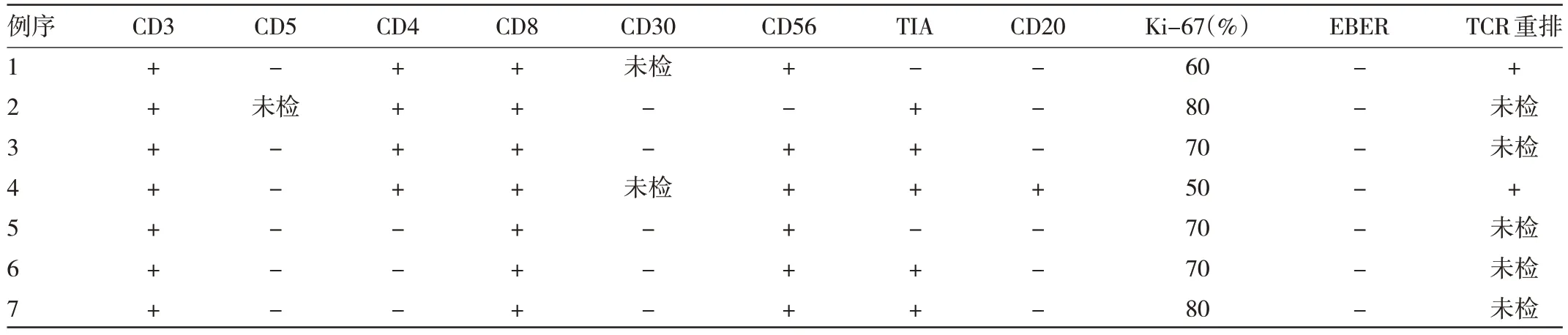
表2 7 例MEITL 患者的免疫表型、EBER 原位杂交及TCR 受体基因重排检测结果
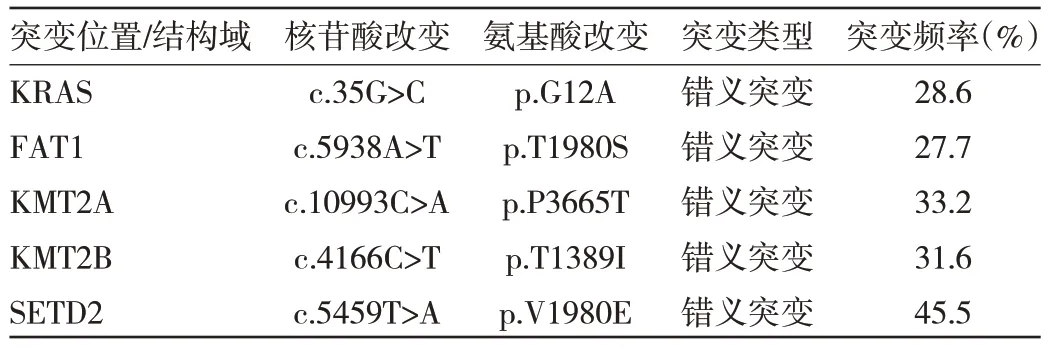
表3 例6 患者的基因检测序结果(高通量测序法)
2.3 患者治疗及随访情况 患者确诊时,Lugano Ⅱ-1 期1 例、Ⅲ期1 例、Ⅳ期5 例;T 细胞淋巴瘤预后指标(prognostic index for T-cell lymphoma,PIT)评分2 分1 例、3 分6 例。6 例行外科手术,其中1 例为初发部位空肠中上段占位,后又因并发肠梗阻行小肠肿物切除手术及肠粘连松解和肠重排手术,1 例同时合并有直肠肿物者,先行内镜黏膜下剥离术切除直肠病变,病理示中低分化腺癌,2 例行剖腹探查+小肠肿物切除及肠粘连松解手术,3 例因继发小肠肠穿孔或梗阻行急诊肠切除、肠粘连松解手术,3 例加结肠病变部分切除手术,加破裂膀胱行部分切除及修补1 例。7 例均行化疗,化疗方案包括:CHOP、ECOP、ECHOP、AZA+CHOP、AZA+ECHOP、GEMOX、GVD 及西达苯胺等联合方案,1 例后续行自体干细胞移植治疗。5 例在手术后及化疗后4~6 个疗程接受PET-CT 检查8 例次,其中3 例提示复发,SUVmax波动在5.7~12.4 ,见图1。本组7 例患者均得到随访(末次随访时间2022 年1 月),死亡4 例(生存时间5、7、13、16 个月)、存活3 例(生存时间1、12、15 个月)。其中3 例死于复发和多重感染及全身衰竭,1 例死于严重消化道出血。
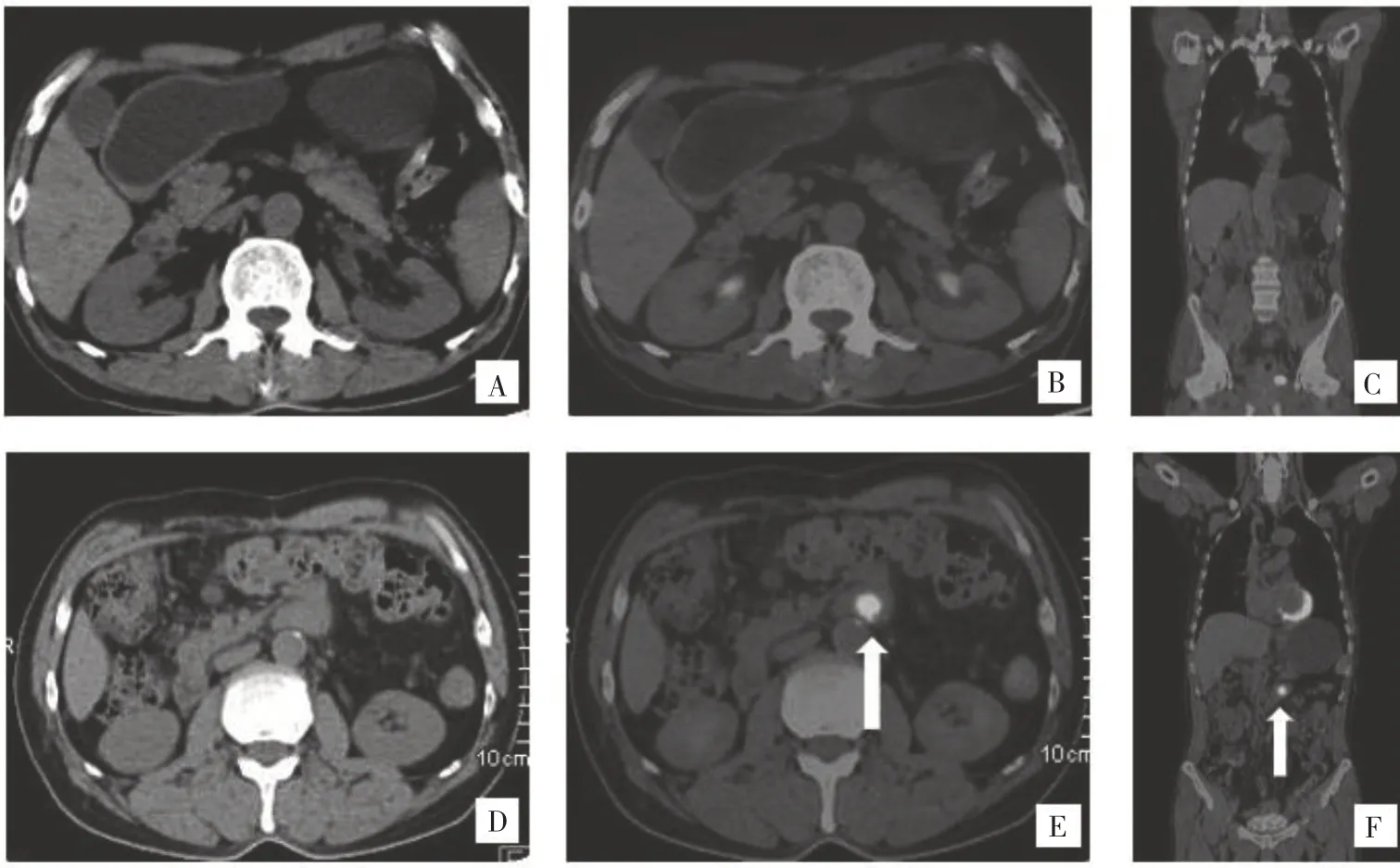
图1 患者术后随访全身18F-FDG PET-CT 扫描所见[腹腔各吻合口肠壁未见明显增厚,放射性摄取未见升高;中腹部小肠后方(空肠起始段)大小1.2 cm×1.4 cm 结节阴影,与肠壁分界不清,放射性摄取增高,SUV 最大值12.4,提示肿瘤复发(白箭头所示);A、B、C 为术后6 个月;D、E、F 为术后11 个月]
3 讨论
虽然原发性结外非霍奇金淋巴瘤(non-hodgkin lymphoma,NHL)好发于胃肠道,但发生于胃肠道的外周T 细胞淋巴瘤(peripheral T-cell lymphoma,PTCL)相对较少。直到上世纪90 年代,肠道PTCL 被认为是长期乳糜泻的后遗症。然而,没有肠病的肠道PTCL 的病例报道表明存在另一种具有不同形态特征的亚型,在2008 年WHO 淋巴瘤分类中,被称为EATL。其中,10%~20%的患者表现为单形的中小型细胞,无肠病,被归类为Ⅱ型变异。与Ⅰ型EATL 相比,免疫表型和分子特征也存在差异。MEITL 是一种新的临床实体,与乳糜泻缺乏关联,MEITL 为在2016 年WHO 淋巴瘤分类中的重新称谓。MEITL 的表型与EATL 不同,MEITL 通常对CD3、CD8、CD56 和TCR-γδ 呈阳性,但对CD30、CD103 和TCR-αβ 呈阴性,具有小到中等大小的细胞。另一方面,大多数EATL 患者是胞质(cy)CD3、CD30、CD103 和TCR-αβ 阳性,但CD8、CD56 和TCR-γδ 阴性,伴有大细胞肿瘤细胞[1,3-4]。MEITL 临床少见,有报道对3 780 例NHL 诊治资料回顾性评估,MEITL 仅占同期诊疗NHL 病例的0.08%[5]。MEITL 原发病变部位主要在小肠、大肠;少见胃[6]、十二指肠,偶见 于 阑 尾[7],或 乳 腺[5]、皮 肤[8]、心 脏[9]等 肠 外 器 官。MEITL 男性多见,本组7 例中女性5 例,与文献不同。MEITL 临床表现不典型,常见有腹痛、腹泻、恶心、呕吐等非特异性胃肠道症状,或有盗汗,体重减轻和其他全身表现,也可因急性肠穿孔或肠梗阻就诊,其他较少报道的表现包括腹水、癫痫发作和精神状态改变、周围神经浸润、阻塞性黄疸、双侧卵巢肿块、肾脏浸润引起的肾功能衰竭、嗜酸性粒细胞增多症、自身免疫性溶血性贫血和噬血细胞性淋巴组织细胞增多症[10],甚至可有扩散至脑、肺[11]。本组MEITL 腹痛6 例,1 例腹泻合并低钾血症,无乳糜泻,与文献报道相同[1,4]。因继发小肠肠穿孔或梗阻行急诊手术3 例。Hong 等[12]认为因该病的罕见性,许多患者(>80%)需要就诊时手术切除,由于阻塞和(或)穿孔,一部分患者(>40%)将手术作为紧急手术进行。
组织学上,瘤细胞单形、小至中等、圆形为主,核仁清晰,胞质稀疏,有核分裂象和坏死,有明显的嗜上皮性和(或)嗜血管表现。免疫表型CD3、CD8、CD56阳性,EBER 阴性,本组7 例患者形态学与文献报道相同[1]。1 例免疫表型为反常阳性表达CD20,其CD3、CD8、CD56、TIA-1 阳性表达,EBER 阴性,没有乳糜泻,TCR 受体基因重排明确MEITL。检索2016 至2021 年文献数据库,MEITL 中文文献15 篇,英文文献77 篇,其中异常表达CD20 阳性MEITL 6 篇仅8 例被报道[13-18]。提示CD20 阳性MEITL 更加少见,极易漏诊、误治[13]。有学者认为MEITL 病例中如出现CD20 阳性的反常表达,应考虑疾病进展或复发,预后相对差[16]。但本组此例随访至今已存活15 个月(GVD 方案化疗,存活时间最长),分析这种情况可能与病变局限于右半结肠,Lugano 分期Ⅱ-1 期有关,也说明MEITL 早发现、及时治疗是预后良好的关键。
由于MEITL 无特异临床表现,病例散发,普通的实验室检测和CT 扫描可无明确提示,MEITL 的诊断有时非常困难,但内镜检查是诊断MEITL 的重要手段,本组2 例行结肠镜检查,1 例肠镜见溃疡深大,病变连续,肠壁僵硬感,肠腔狭窄,另1 例结肠镜检查中受累结肠未发现明显黏膜异常。1 例外院行小肠镜检查发现空肠中上段占位、溃疡,小肠镜下活检病理考虑淋巴瘤可能,经本院病理科会诊,行免疫表型复核、EBER 原位杂交及TCR 受体基因重排明确诊断。舒慧君等[19]报道9 例MEITL 患者,8 例行内镜检查,1 例为溃疡型,其中3 例内镜下黏膜轻微病变,肉眼看似正常,活检证实。这说明MEITL 的内镜下存在着复杂表现,对诊断未明的患者应警惕轻微侵袭性病变的内镜表现,并应在多个部位进行活检。近年来有认为PETCT 检查结果淋巴瘤诊断中起着主要作用,几乎所有淋巴瘤多富含FDG,尤其在侵袭性NHL 对FDG 更高亲和力[20],明显高于胃肠道癌,由于PET-CT 可表示病灶代谢的活动,因此能比常规CT 有更好分辨力[21]。Chan等[22]报道12 例MEITL 患者中PET-CT 影像学特征,认为MEITL 在疾病进展或复发时PET-CT 检查有良好评估价值,并可以清楚地将这种淋巴瘤与经典EATL 区分开来。Li 等[23]报道1 例MEITL 患者,腹部CT 平扫、泌尿系统彩超检查未见异常,而PET-CT 检查发现回盲部、结肠和直肠壁弥漫性增厚,18F-FDG 活性增加和前列腺中的异常高代谢。本组3 例手术前行PET-CT检查,发现受累处FDG 明显摄取增高,SUVmax 波动在15.2~18.46。5 例在手术后及化疗后4~6 个疗程接受PET-CT 检查8 例次,其中3 例SUVmax 波动在5.7~12.4,报告复发。这说明PET-CT 对MEITL 的原发病灶的发现、肿瘤病灶的活跃程度和软组织、器官等远处转移等有独特的临床价值。
由于MEITL 疾病的罕见性和地域性的差异,前瞻性和随机临床试验评估治疗新的药物或新的方案的疗效显得很困难。因此,MEITL 目前还没有有效的标准治疗方法。文献报道CHOP 为MEITL 最常用的化疗方案,但最近有报道它在MEITL 中的效果较差[24]。本组使用CHOP 或CHOP 样方案,与依托泊苷[25]、来那度胺、吉西他滨[26]、西达本胺[27]等联合化疗。有报道CHOP 样化疗联合普拉曲沙治疗MEITL 获得缓解[28]。一些研究表明,使用联合化疗继以自体造血干细胞移植可能有更好的生存率[29],本组有1 例行HSCT,随访至今12 个月存活,也说明HSCT 可能为治疗MEITL 提供新的方向。本组7 例MEITL 均得到随访,死亡4 例(5、7、13、16 个月),其中3 例死于复发和并发多重严重感染及全身衰竭,1 例死于严重消化道出血。文献报道中位总生存期为7 个月[4,30],表明MEITL 为高度侵袭性的恶性淋巴瘤,病死率高,应引起重视。

