右美托咪定通过MAPK/STAT3通路对AD大鼠海马神经元凋亡的影响
张 苗, 董彦海, 崔子慧
阿尔茨海默症(Alzheimer’s disease,AD)是常见的慢性进行性神经变性疾病,临床主要表现为认知功能障碍、记忆力减退,发病机制尚不清楚[1]。越来越多的证据表明,β-淀粉样蛋白(amyloid β-protein,Aβ)在AD发病机制中起关键作用,Aβ的积累及其相关炎症与AD中神经变性和神经元丢失有关[2]。目前有效的治疗药物较少[3]。研究发现右美托咪定(dexmedetomidine,Dex)可以缓解慢性神经病理性疼痛,属于肾上腺素能受体激动剂,保护海马神经元[4]。丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)/信号转导和转录激活子3(signal transduction and transcriptional activators 3,STAT3)通路作为抗炎效应的信号转导通路,与细胞生长密切相关[5]。但Dex通过MAPK/STAT3通路对AD大鼠海马神经元凋亡是否起作用尚不清楚,因此本实验以Aβ1-42复制AD大鼠模型,探究Dex通过MAPK/STAT3通路对AD大鼠海马神经元凋亡的影响。
1 材料与方法
1.1 材 料
1.1.1 实验动物 中国科学院上海药物研究所提供SPF级雄性SD大鼠60只(体重260~280 g,13周龄),许可证号:SCXK(沪)2020-0005。所有大鼠分笼饲养,自由饮水进食,保持笼内自然光照、温度22 ℃~25 ℃、适应性饲养1周后用于实验。本研究已获得实验动物伦理委员批准。
1.1.2 主要仪器及试剂 美国Sigma公司提供Aβ1-42,溶剂为二甲基亚砜,利用生理盐水配置成2 μg/μl的溶液,避光保存于37 ℃恒温箱;新晨制药有限公司提供Dex药物;酶联生物科技有限公司提供ELISA试剂盒[白细胞介素(interleukin,IL)1β、IL-6、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)];美国MCE公司提供colivelin(STAT3激活剂)、Anisomycin(MAPK通路激活剂);碧云天生物技术研究所提供TUNEL试剂盒;珠海贝索生物技术有限公司提供甲醇刚果红染色液;索莱宝科技有限公司提供Nissl染色试剂盒;abcam公司提供p-p38 MAPK(ab60999)、p38 MAPK(ab170099)、p-STAT3(ab32143)、STAT3(ab68153)、B淋巴细胞瘤-2(B lymphocytoma-2,Bcl-2)(ab194583)、激活型caspase-3(cleaved caspase-3)(ab214430)一抗、二抗羊抗兔IgG H&L (HRP)(ab205718)。中国医学科学院药物研究所提供Morris水迷宫(DMS-2);芬兰雷勃公司提供酶标仪(MK3);六一仪器厂提供电泳装置。
1.2 方 法
1.2.1 大鼠分组、造模与给药 大鼠随机分为假手术组、Aβ1-42组、Dex低剂量(Dex-L)组、Dex高剂量(Dex-H)组、Dex-H+Anisomycin组、Dex-H+colivelin组,除假手术组外,其余各组大鼠均给予Aβ1-42复制AD大鼠模型。AD大鼠模型的构建[6]:将所有大鼠用戊巴比妥钠(30 mg/kg)麻醉,大鼠固定于立体定位仪,颅顶备皮、消毒,沿着颅骨中线剪开头皮,暴露颅骨。参照大鼠脑图谱[7],定位前囟后3.8 mm,中线旁±2.0 mm处,磨薄颅骨后用铬针小心穿透,套管进至硬脑膜下2.5 mm,缓慢注射5 μl Aβ1-42溶液,进样器注射速度为0.2 μl/min,为使其充分扩散留针5 min,缓慢退针,对侧进行相同操作,涂医用脑胶,缝合后涂青霉素软膏预防感染。假手术组注射为生理盐水,其余操作同上。造模24 h后,Dex-L、Dex-H组分别以12.5 μg/kg、50 μg/kg Dex腹腔注射[8];Dex-H+Anisomycin组、Dex-H+colivelin组在50 μg/kg Dex-H的基础上分别以5.0 mg/kg Anisomycin[9]、0.5 mg/kg colivelin腹腔注射[10],其余各组注射生理盐水,每天干预一次,连续干预4周。连续给药4周后,进行Morris水迷宫行为学实验,模型组大鼠的逃避潜伏期明显延长,穿越原平台位置的次数明显减少则说明造模成功。
1.2.2 水迷宫实验 大鼠末次给药后的次日进行Morris水迷宫学习训练,严格按照Morris水迷宫实验说明书操作,适应性学习5 d后,第6天开始记录AD大鼠的逃避潜伏期及穿越原平台位置的次数,以逃避潜伏期测试大鼠的学习能力;以穿越原平台位置的次数测试大鼠空间探索能力。
1.2.3 收集样本 水迷宫结束后,各组大鼠经静脉取血,用于ELISA检测;然后麻醉大鼠,快速断头取出海马组织,各组大鼠海马组织的一部分储存于-80 ℃冰箱,用于Western blot检测;另一部分固定于甲醛溶液中,用于Nissl、甲醇刚果红、TUNEL染色。
1.2.4 观察海马组织结构 取1.2.3中适量海马组织,常规脱水、二甲苯透明、石蜡包埋,行Nissl染色,脱水、透明,中性树脂封片,于光学显微镜观察神经元形态学改变。
1.2.5 观察Aβ沉积状况 取1.2.3中适量海马组织,常规固定切片,PBS洗涤3次,加入甲醇刚果红染液浸染15 min,乙醇分化,用苏木素染液复染2 min,脱水、透明,中性树脂封片,观察Aβ沉积状况。
1.2.6 检测血清中炎性因子水平 取1.2.3中静脉血样本,离心15 min(3000 r/min,4 ℃),取血清,按照ELISA试剂盒说明书检测血清中IL-1β、IL-6、TNF-α水平。
1.2.7 检测海马组织细胞凋亡 取1.2.3中适量海马组织,制备海马组织切片,按试剂盒说明书进行TUNEL染色,显微镜下观察凋亡细胞和总细胞数,细胞凋亡率=凋亡细胞/总细胞×100%。
1.2.8 检测海马组织MAPK/STAT3通路相关蛋白表达水平 取1.2.3中储存于-80 ℃冰箱的海马组织,裂解研磨组织并提取蛋白,BCA试剂盒检测蛋白浓度后,电泳分离,转移至PVDF膜上;转膜后加入一抗(p-p38 MAPK、p38 MAPK、p-STAT3、STAT3、Bcl-2、cleaved caspase-3,1∶1500稀释)进行过夜孵育(4 ℃);第2天洗膜后,加入二抗(1∶5000稀释)进行孵育2 h(室温),TBST洗涤后,加入ECL显色、拍照,以β-actin为内参,Image J分析灰度值。
2 结 果
2.1 Dex对各组大鼠空间学习记忆能力的影响 与假手术组相比,Aβ1-42组大鼠逃避潜伏期显著增加,穿越原平台次数明显降低(P<0.05);与Aβ1-42组相比,Dex-L组、Dex-H组大鼠逃避潜伏期显著降低,穿越原平台次数明显增加(P<0.05);与Dex-H组相比,Dex-H+Anisomycin组、Dex-H+colivelin组大鼠逃避潜伏期显著增加,穿越原平台次数明显降低(P<0.05)(见表1)。

表1 各组大鼠空间学习能力的比较
2.2 Dex对各组大鼠海马组织结构、Aβ沉积及神经元凋亡的影响 假手术组未发现神经元坏死状况,细胞形态及结构均完整;Aβ1-42组可观察到海马组织神经元结构疏松,胞体形态异常,数量减少,神经元细胞内、外染色明显加深,Aβ沉积数量增多,神经元细胞凋亡率(3.15%±0.31%)较假手术组(49.36%±4.93%)明显增加(P<0.05);与Aβ1-42组相比,Dex-H组、Dex-L组海马组织神经元细胞形态、数量及结构均得到不同程度改善,神经元细胞内、外染色变浅,其中以Dex-H组染色减轻较为明显,Aβ沉积数量减少,Dex-L组和Dex-H组大鼠神经元细胞的凋亡率(36.48%±3.65%,16.81±1.68)均降低(P<0.05);而Dex-H+Anisomycin组、Dex-H+colivelin组海马组织神经元细胞形态及结构损伤均较Dex-H组严重,神经元细胞内、外染色明显加深,Aβ沉积数量增多,神经元细胞凋亡率(24.35%±2.43%,24.57%±2.46%)明显增加(P<0.05)(见图1~3)。
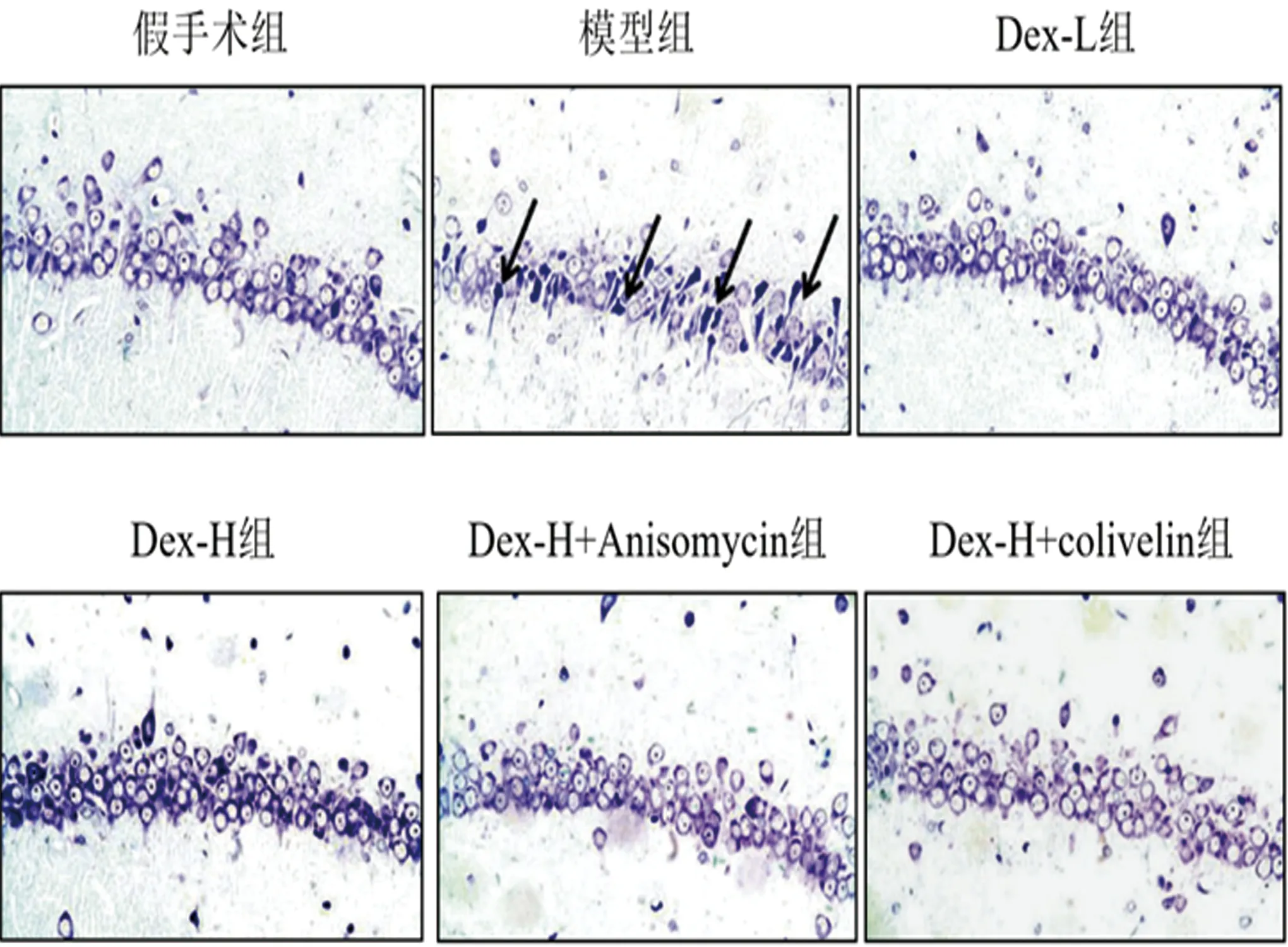
图1 各组大鼠海马组织形态学变化(Nissl,×400),注:黑色箭头示损伤的神经元

图2 各组大鼠海马组织甲醇刚果红染色(×400)

图3 各组大鼠海马组织神经元细胞凋亡变化(×400)
2.3 Dex对各组大鼠血清中炎性因子水平的影响 Aβ1-42组大鼠血清IL-1β、IL-6、TNF-α含量较假手术组均显著增加(P<0.05);与Aβ1-42组比较,Dex-H组和Dex-L组大鼠血清IL-1β、IL-6、TNF-α含量均降低(P<0.05);与Dex-H组相比,Dex-H+Anisomycin组、Dex-H+colivelin组大鼠血清IL-1β、IL-6、TNF-α含量明显增加(P<0.05)(见表2)。
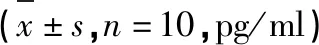
表2 各组大鼠血清中炎性因子水平的比较
2.4 Dex对各组大鼠海马组织MAPK/STAT3通路相关蛋白的影响 Aβ1-42组大鼠海马组织p-p38 MAPK/p38 MAPK、p-STAT3/STAT3、cleaved caspase-3表达较假手术组显著增加,Bcl-2表达显著下降(P<0.05);与Aβ1-42组比较,Dex-L组和Dex-H组大鼠海马组织p-p38 MAPK/p38 MAPK、p-STAT3/STAT3、cleaved caspase-3表达降低,Bcl-2表达增加(P<0.05);与Dex-H组相比,Dex-H+Anisomycin组、Dex-H+colivelin组p-p38 MAPK/p38 MAPK、p-STAT3/STAT3、cleaved caspase-3表达显著增加,Bcl-2表达显著下降(P<0.05)(见表3、图4)。
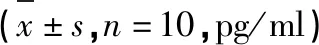
表3 各组大鼠海马组织中MAPK/STAT3通路相关蛋白的比较

注:A为假手术组;B为Aβ1-42组;C为Dex-L组;D为Dex-H组;E为Dex-H+Anisomycin组;F为Dex-H+colivelin组
3 讨 论
AD是一种神经退行性疾病,在全球范围内极其常见,患病率与年龄的增长呈正相关,分别影响3%、32%的65~75岁和84岁以上人群[11]。该疾病的病理特征主要是神经元不同程度的丢失、神经原纤维缠结以及老年斑,即Aβ沉积形成的淀粉样斑块,研究发现Aβ沉积诱导的炎症反应在AD的发展过程中发挥重要作用[12]。本研究采用脑内注射Aβ1-42复制AD大鼠模型,探索Dex对AD大鼠的影响,进而对其相关机制进行分析。
Dex的镇静作用已广泛应用于临床,在神经保护方面的作用也被认可[13]。Hu等[14]研究发现显示Dex可以提高神经认知功能,防止认知衰退。另外,Dex作为麻醉辅助剂[15],保护手术患者的免疫功能,降低炎症和术后并发症,有助于改善临床结果。值得关注的是,Yin等[16]研究发现Dex可缓解盲肠结扎穿孔诱导的大鼠学习和记忆障碍。本研究发现AD大鼠经Dex干预后逆转了Aβ1-42组的各项指标,提示Dex可以降低炎性反应、减少神经细胞凋亡以及Aβ沉积,调节凋亡相关蛋白表达,改善大鼠空间学习能力。炎性反应受多条信号通路的调节,MAPK/STAT3通路被证明参与其中。在糖尿病认知障碍大鼠研究中[17],发现抑制p38 MAPK/STAT3信号通路的活化,可以改善学习记忆能力。
康涛等[18]研究在Aβ1-42诱导的SH-SY5Y细胞中,通过抑制p38 MAPK信号通路的激活,可以提高细胞活性,抑制细胞凋亡,起到保护细胞的作用。在AD小鼠模型中[19],多奈哌通过抑制MAPK、STAT3表达,有效下调Aβ诱导的细胞活化形态。本实验研究发现Aβ1-42诱导的AD大鼠中,p-p38 MAPK/p38 MAPK、p-STAT3/STAT3、cleaved caspase-3表达显著增加,Bcl-2表达显著下降,提示Aβ1-42可能通过提高p38 MAPK、STAT3磷酸化水平,激活MAPK/STAT3信号通路,参与AD的发展过程,经Dex干预后,MAPK、STAT3磷酸化水平显著降低,MAPK/STAT3信号通路得到抑制。为进一步验证该猜想,实验引入MAPK激活剂-Anisomycin和STAT3激活剂-colivelin,结果发现Anisomycin和colivelin均可逆转Dex对AD大鼠的保护作用,提示Dex可通过抑制MAPK/STAT3信号通路,对AD大鼠起保护作用。
综上所述,Dex通过抑制MAPK/STAT3通路的活化,减少Aβ沉积、炎性因子水平和细胞凋亡,保护大鼠海马神经元,为AD的临床治疗提供潜在方案。但是Anisomycin并非MAPK的特异性激活剂,Dex治疗AD疾病的作用机制可能还涉及其他信号通路,尚需深入研究。

