lncRNA NEAT1沉默通过IL-10/STAT3信号通路调节小胶质细胞极化对脑缺血再灌注损伤大鼠的影响
张亚杰, 尹立勇, 董晓娇, 刘宏丽
脑缺血再灌注损伤(cerebral ischemia reperfusion injury,CIRI)是指在血液灌流短期恢复后,缺血缺氧引起的神经损伤进一步加重的病理过程。小胶质细胞作为免疫效应细胞,是中枢神经系统的第一道防线[1]。脑缺血可诱导小胶质细胞活化,激发促炎因子的生成,会对正常组织和细胞进行破坏[2]。M1型和M2型是小胶质细胞不同的极化形式,一些研究表明,CIRI的潜在治疗手段是将M1转化为M2[3,4]。长链非编码RNA(long noncoding RNA,lncRNA)核富集转录体1(nuclear enriched abundant transcript 1,NEAT1)在免疫系统中发挥着重要作用,已被证明其表达水平在缺血性脑卒中患者中显著上调,并与脑卒中严重程度呈正相关[5]。而敲低lncRNA NEAT1可调节小胶质细胞的活化并减少脑缺血再灌注后神经元凋亡。因此,lncRNA NEAT1可能是CIRI治疗干预的新潜在靶点。然而,lncRNA NEAT1调节小胶质细胞活化的分子机制尚不明确。白细胞介素(interleukin,IL)-10/信号传导与转录激活因子3(signal transducer and activator of transcription 3,STAT3)通路介导的抗炎反应代表了一种控制炎症程度和持续时间的重要稳态机制[6]。STAT3是IL-10下游的转录因子,IL-10与其受体结合后可激活STAT3,其中磷酸化的STAT3可诱导小胶质细胞的极化来发挥抗神经炎症作用[7]。因此,笔者推测lncRNA NEAT1可能通过IL-10/STAT3通路调节小胶质细胞极化,进而参与CIRI,并对此展开了研究。
1 材料与方法
1.1 材 料
1.1.1 动物 雄性SD大鼠96只,SPF级,7~8周龄,体重282~312 g,购自青岛博隆实验动物有限公司,许可证号:SCXK(鲁)2021-0007。大鼠饲养于温度21 ℃~24 ℃,湿度52%~60%的环境中,12 h光暗交替,自由饮食进水。本研究经本院伦理委员会批准。
1.1.2 主要试剂 lncRNA NEAT1小干扰RNA质粒(si-NEAT1)及其阴性对照质粒(si-NC)由吉林万孚生物技术有限公司设计合成;HE染色试剂盒、氯化三苯基四氮唑(TTC)试剂、尼氏(Nissl)染色液、RIPA裂解液、逆转录试剂盒、ECL化学发光试剂盒(批号分别为MA5-2772、MA2-2839、MA4-3095、MA1-2390、MA6-1899、MA7-2904)均购自连云港伊势久生物科技有限责任公司;Trizol试剂、BCA蛋白检测试剂盒、PCR试剂盒、白细胞介素(IL)-1β、肿瘤坏死因子-α(TNF-α)、IL-4、IL-10酶联免疫吸附(ELISA)试剂盒(批号分别为T88771、T24909、T40920、T23022、T20950、T50932、T08394)均购自东莞市瀚克生物技术有限公司;鼠源离子钙接头蛋白分子1(Iba1)(小胶质细胞标记物)、巨噬细胞M1型极化标志物(CD86)、巨噬细胞M2型极化标志物(CD206)一抗、羊抗鼠二抗、兔源IL-10、STAT3、磷酸化STAT3(p-STAT3)、β-actin一抗、羊抗兔二抗(批号分别为ZK-13818、ZK-03827、ZK-48298、ZK-02783、ZK-18287、ZK-37422、ZK-38203、ZK-17115、ZK-77392)均购自襄阳凯得尔森生物技术有限公司。
1.1.3 主要仪器 共聚焦显微镜(型号Leica confocal 118 SP5)、光学显微镜(型号DMi1)购自安徽正华生物仪器设备有限公司;荧光定量PCR仪(型号eQ162C)、酶标仪(型号PT-3502C)购自天津金思德生物技术有限公司;凝胶成像系统(型号UVCI 2400)购自厦门洛肯仪器有限公司。
1.2 方 法
1.2.1 CIRI建模及分组给药 采用线栓法构建CIRI模型[8]:戊巴比妥钠麻醉大鼠,随后,以仰卧位固定在手术台上并剃光毛发以暴露颈部,切开皮肤,分离右颈总动脉、颈外动脉和颈内动脉,结扎颈外动脉,将线栓经右颈总动脉插入颈内动脉,直到感觉到轻度的阻力,表明右大脑中动脉闭塞了,这会导致右大脑中动脉提供的区域血流暂时停止,2 h后,取出线栓,以使血液通过右颈内动脉回流(实现再灌注),随后,缝合皮肤,在整个过程中,保持大鼠的体温在37 ℃左右。造模3 h后,采用Zea-Longa评分法[9]对大鼠进行评分,将Zea-Longa评分>1分的大鼠视为CIRI造模成功。将成功造模的72只大鼠随机分成:CIRI组、CIRI+si-NC组、CIRI+si-NEAT1组,每组24只。另取24只大鼠麻醉后进行相同的手术程序,但没有阻断右侧大脑中动脉作为假手术组(Sham组)。建模结束后,CIRI+si-NC组、CIRI+si-NEAT1组大鼠分别给予尾静脉注射100 μl si-NC或si-NEAT1[10];Sham组和CIRI组大鼠尾静脉注射相等体积的生理盐水,每天一次,连续注射7 d。
1.2.2 神经功能缺损评分 末次尾静脉注射给药24 h后使用Zea-Longa评分法[9]进行大鼠神经功能缺损评估:0分为无神经缺陷;1分为提尾时左前爪不能完全伸展;2分为动物走路时向对侧转;3分为行走时向对侧倾斜;4分为没有自发运动活动和意识水平低下。分数越高表示神经功能缺损越严重。
1.2.3 TTC染色检测脑梗死体积百分比 神经功能缺损检测完成后,每组随机选取8只大鼠,处死后迅速断头取脑,-20 ℃环境下迅速冷冻10 min,然后沿冠状切开脑组织,切2 mm厚片,37 ℃环境下置于1%的TTC溶液中避光孵育30 min(期间翻动脑片一次),4%多聚甲醛固定。正常的大脑区域被染成深红色,梗死区域被染成白色。拍照,用Image Pro Plus 6.0软件计算校正水肿后脑梗死体积百分比(%),脑梗死体积百分比(%)=(对侧半球面积-同侧非梗死区域面积)/对侧半球面积×100%。
1.2.4 HE和Nissl染色观察脑组织病理学变化 每组随机选取8只大鼠,麻醉后取缺血侧脑组织,分为两部分,一部分用30%的蔗糖脱水、包埋,制备脑组织冰冻切片;另一部分用4%多聚甲醛固定24 h后,将脑组织脱水,石蜡包埋并切成冠状切片(5 μm)。取脑组织石蜡切片脱蜡、水洗,分别进行HE、Nissl染色,显微镜下观察并评估切片的病理变化。
1.2.5 免疫荧光染色分析小胶质细胞极化 取1.2.4中制备的脑组织冰冻切片,孵育1.5 h,加入鼠源Iba1(1∶750)、CD86(1∶50)或CD206(1∶25),4 ℃孵育过夜。PBS冲洗3次,加入羊抗鼠二抗(1∶1650)后孵育。DAPI复染10 min,使用激光共聚焦显微镜观察大脑皮质Iba1阳性(Iba1+)细胞中CD86和CD206阳性(Iba1+CD86+、Iba1+CD206+)细胞的数量,以Iba1+CD86+代表小胶质细胞M1型极化,以Iba1+CD206+代表小胶质细胞M2型极化,拍照,用Image J软件进行量化。每个切片随机选择6个显微镜视野计算平均值。数据表示为每平方毫米的平均细胞数。
1.2.6 ELISA法检测大鼠脑组织中IL-1β、TNF-α、IL-4、IL-10水平 取各组剩余8只大鼠,取脑组织缺血侧皮质区,分为两部分,一部分-80 ℃冰箱保存备用;另一部分按1∶9的比例加入适量预冷生理盐水,置于冰上研磨,4 ℃下3500 r/min离心13 min,取上清。按ELISA试剂盒的操作方法检测大鼠脑组织中IL-1β、TNF-α、IL-4、IL-10水平。
1.2.7 荧光定量PCR法检测大鼠脑组织中lncRNA NEAT1、诱导型一氧化氮合酶(iNOS)、精氨酸酶-1(Arg-1)、IL-10 mRNA水平 取1.2.6中大鼠脑组织解冻匀浆,Trizol提取总RNA,逆转录合成cDNA,以此为模板,PCR法检测大鼠脑组织中lncRNA NEAT1、iNOS、Arg-1、IL-10 mRNA水平(β-actin为内参),引物由东莞市瀚克生物技术有限公司设计合成,引物序列(见表1)。具体反应环境、条件均参照PCR试剂盒说明书进行配置,2-△△Ct法分析大鼠脑组织中lncRNA NEAT1、iNOS、Arg-1、IL-10 mRNA水平。

表1 引物序列
1.2.8 蛋白印迹法检测大鼠脑组织中IL-10、STAT3、p-STAT3蛋白水平 取1.2.6中大鼠脑组织解冻匀浆,裂解,4 ℃下11 200 r/min离心14 min,取上清,BCA法定量总蛋白,电泳分离后转膜,5%脱脂牛奶封闭2.5 h,加入稀释好的兔源IL-10(1∶720)、STAT3(1∶800)、p-STAT3(1∶1250)、内参β-actin(1∶900)一抗,4 ℃下孵育过夜,加入羊抗兔二抗(1∶2350),室温下孵育2.5 h。ECL化学发光试剂盒显影,Image Pro Plus 6.0软件分析蛋白质条带,计算蛋白相对表达量。

2 结 果
2.1 各组大鼠神经功能缺损评分和脑梗死体积百分比比较 与Sham组相比,CIRI组大鼠神经功能缺损评分、脑梗死体积百分比显著升高(P<0.05);与CIRI组相比,CIRI+si-NC组大鼠神经功能缺损评分、脑梗死体积百分比差异无统计学意义(P>0.05);与CIRI组和CIRI+si-NC组相比,CIRI+si-NEAT1组神经功能缺损评分、脑梗死体积百分比显著降低(P<0.05)(见表2、图1)。

图1 各组大鼠脑组织TTC染色图(×40)
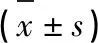
表2 各组大鼠神经功能缺损评分和脑梗死体积百分比比较
2.2 各组大鼠脑组织病理学变化 HE染色显示:Sham组大鼠脑组织神经元正常;与Sham组相比,CIRI组大鼠脑组织神经元水肿、空泡样变性明显,组织间隙较大,核染色较深;CIRI+si-NC组大鼠脑组织神经元上述病变与CIR组相似;与CIRI组和CIRI+si-NC组相比,CIRI+si-NEAT1组大鼠脑组织神经元上述病变得到缓解,神经元水肿、空泡样变性明显减轻,细胞核较清晰,染色较为均匀。
Nissl染色结果与HE染色相似,Sham组大鼠脑组织神经元排列整齐致密,胞体大而蓝染,尼氏体丰富;与Sham组相比,CIRI组大鼠脑组织神经元排列紊乱、核仁消失、空泡样变,尼氏体数量明显减少;CIRI+si-NC组大鼠脑组织神经元上述病变与CIR组相似;与CIRI组和CIRI+si-NC组相比,CIRI+si-NEAT1组大鼠脑组织神经元液泡样变化和核固缩减少,尼氏体数量明显增多(见图2)。
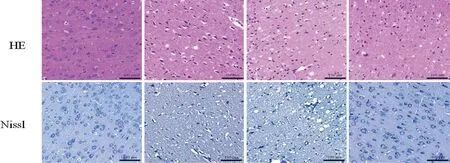
图2 各组大鼠脑组织神经元病理学变化图(比例尺=100 μm,HE、Nissl染色,×200)
2.3 各组大鼠脑组织中小胶质细胞极化比较 与Sham组相比,CIRI组大鼠脑组织中Iba1+CD86+、Iba1+CD206+阳性细胞数量、CD86/CD206比值均显著升高(P<0.05);与CIRI组相比,CIRI+si-NC组大鼠脑组织中Iba1+CD86+、Iba1+CD206+阳性细胞数量、CD86/CD206比值差异无统计学意义(P>0.05);与CIRI组和CIRI+si-NC组相比,CIRI+si-NEAT1组大鼠脑组织中Iba1+CD86+阳性细胞数量、CD86/CD206比值均显著降低(P<0.05),Iba1+CD206+阳性细胞数量显著升高(P<0.05)(见图3、表3)。

表3 各组大鼠脑组织中小胶质细胞极化比较

图3 各组大鼠脑组织免疫荧光染色图(比例尺=100 μm,×200)
2.4 各组大鼠脑组织中IL-1β、TNF-α、IL-4、IL-10水平比较 与Sham组相比,CIRI组大鼠脑组织中IL-1β、TNF-α、IL-4、IL-10水平均显著升高(P<0.05);与CIRI组相比,CIRI+si-NC组大鼠脑组织中IL-1β、TNF-α、IL-4、IL-10水平差异无统计学意义(P>0.05);与CIRI组和CIRI+si-NC组相比,CIRI+si-NEAT1组大鼠脑组织中IL-1β、TNF-α水平显著降低(P<0.05),IL-4、IL-10水平显著升高(P<0.05)(见表4)。

表4 各组大鼠脑组织中IL-1β、TNF-α、IL-4、IL-10水平比较
2.5 各组大鼠脑组织中lncRNA NEAT1、iNOS、Arg-1、IL-10 mRNA水平比较 与Sham组相比,CIRI组大鼠脑组织中lncRNA NEAT1、iNOS、Arg-1、IL-10 mRNA水平均显著升高(P<0.05);与CIRI组相比,CIRI+si-NC组大鼠脑组织中lncRNA NEAT1、iNOS、Arg-1、IL-10 mRNA水平差异无统计学意义(P>0.05);与CIRI组和CIRI+si-NC组相比,CIRI+si-NEAT1组大鼠脑组织中lncRNA NEAT1、iNOS mRNA水平显著降低(P<0.05),Arg-1、IL-10 mRNA水平均显著升高(P<0.05)(见表5)。

表5 各组大鼠脑组织中lncRNA NEAT1、iNOS、Arg-1、IL-10 mRNA水平的比较
2.6 各组大鼠脑组织中IL-10、STAT3、p-STAT3蛋白水平比较 与Sham组相比,CIRI组大鼠脑组织中IL-10、p-STAT3/STAT3蛋白水平显著升高(P<0.05);与CIRI组相比,CIRI+si-NC组大鼠脑组织中IL-10、p-STAT3/STAT3蛋白水平差异无统计学意义(P>0.05);与CIRI组和CIRI+si-NC组相比,CIRI+si-NEAT1组大鼠脑组织中IL-10、p-STAT3/STAT3蛋白水平显著升高(P<0.05)(见图4、表6)。

注:A:Sham组;B:CIRI组;C:CIRI+si-NC组;D:CIRI+si-NEAT1组

表6 各组大鼠脑组织中IL-10、p-STAT3/STAT3蛋白水平比较
3 讨 论
脑卒中是一种具有较高致死率的急性脑血管疾病,常常伴随着脑缺血,脑缺血在血液灌流恢复的过程中易发生再灌注损伤[11]。大量研究证明,CIRI过程中会伴随着神经炎症反应,抑制神经炎症活性是治疗CIRI的手段之一[12,13]。lncRNA NEAT1在调节基因表达中起着至关重要的作用,具有作为促炎因子的潜力,可影响糖尿病、创伤性脑损伤以及癌症等多种疾病的病理生理过程[14]。据报道,氧葡萄糖剥夺/复氧(OGD/R)可诱发脑小胶质细胞神经炎症,而过表达lncRNA NEAT1可加重神经炎症损伤[15]。Ni等[16]的研究也显示lncRNA NEAT1在CIRI损伤后调节小胶质细胞活化并促进神经元凋亡。本研究构建CIRI大鼠模型进行体内实验,结果发现,CIRI大鼠脑组织中lncRNA NEAT1表达升高,提示lncRNA NEAT1可能在CIRI中起重要作用。
当缺血后重新建立血液供应时,炎症会增加。在神经炎症过程中,小胶质细胞通过向不同的表型极化执行不同的功能。其一是M1型激活(激活炎症反应可能对神经细胞产生不利影响);其二是M2型激活(防止过度免疫反应发生,恢复神经元再生,加快脑损伤的恢复)[17]。有报道显示,敲低lncRNA NEAT1诱导OGD/R处理的小胶质细胞从M1向M2转移并抑制炎症反应,为脑卒中治疗的潜在靶点[18]。本研究使用Iba1、CD86(M1标记)和CD206(M2标记)作为生物标志物进行免疫荧光染色,结果显示,CIRI大鼠脑组织Iba1+细胞中CD86+和CD206+的细胞数量显著升高,表明CIRI会引发小胶质细胞活化。随后,对CD86/CD206的比值进行统计,CD68/CD206比值高于1表明小胶质细胞向M1表型极化增多。沉默lncRNA NEAT1后,大鼠脑组织中Iba1+CD86+阳性细胞数量、CD86/CD206比值、TNF-α、IL-1β、iNOS mRNA水平显著降低,Iba1+CD206+阳性细胞数量、IL-4、IL-10、Arg-1水平显著升高,表明沉默lncRNA NEAT1抑制了小胶质细胞向促炎(M1)表型的极化,促进其向抗炎(M2)表型的极化。
IL-10作为一种抗炎因子,可减弱炎症因子活性。有研究显示,IL-10激活STAT3,STAT3被证明在IL-10介导的小胶质细胞抗炎作用中起主要作用[19]。据报道,硫化氢通过调节STAT3通路抑制脂多糖诱导的小胶质细胞促炎反应[20]。本研究结果显示,沉默lncRNA NEAT1后CIRI大鼠脑组织中IL-10、p-STAT3/STAT3蛋白水平显著升高,表明lncRNA NEAT1可能通过激活IL-10/STAT3信号通路调节小胶质细胞极化。
综上所述,沉默lncRNA NEAT1抑制小胶质细胞向促炎(M1)表型的极化并促进小胶质细胞抗炎(M2)表型极化,改善CIRI大鼠脑组织损伤,其作用机制可能与IL-10/STAT3信号通路的激活有关。本研究揭示了lncRNA NEAT1在CIRI后诱导小胶质细胞极化中的作用。但lncRNA NEAT1可能干预的其他信号通路影响小胶质细胞极化,有待深入研究。

