辽宁地区5 株H1N1亚型猪流感病毒分子特征与遗传进化分析
魏 澍,兰德松,张皓淳,孙世宇,刘 立,费东亮
( 1. 辽宁省农业发展服务中心,辽宁 沈阳 110034 ; 2. 内蒙古赤峰市克什克腾旗农牧局,内蒙古 赤峰 024000 ; 3. 锦州医科大学实验动物中心,辽宁 锦州 121001 )
猪流感是由猪流感病毒(SIV)引发的在猪中流行的呼吸道传染性疾病,主要临床症状包括咳嗽、发热、嗜睡、厌食、呼吸困难、流鼻涕等[1]。猪流感一年四季均可发生,其中春秋两季更易发,发病率接近100%,尽管死亡率不高,但仍给养猪业带来了严重经济损失[2]。SIV属于正黏病毒科A型流感病毒属,由8条单股、负链RNA组成,分别编码结构蛋白(PB2、PB1、PA、HA、NP、NA、M1、M2、NEP)和非结构蛋白(NS1、PB1-F2、PB1-N40)[3]。因猪呼吸道上皮细胞内存在α-2,3 唾液酸受体和α-2,6 唾液酸受体,既能够感染人流感病毒,也能够感染禽流感病毒,使猪在流感病毒的变异、重组和跨宿主传播的过程中起到“混合器”的作用。因此SIV也具有重要的公共卫生学意义[4-6]。目前,我国SIV 流行亚型主要以H1和H3亚型为主,其中欧亚类禽H1N1(EA H1N1)在我国猪群中广泛流行并形成了稳定的遗传谱系[7],但辽宁地区猪群中SIV 分子特征和遗传演化规律尚不清楚。本研究对辽宁地区规模化猪场疑似猪流感的病料中分离鉴定的5 株SIV 全基因序列进行系统分析,揭示辽宁地区SIV分离株的分子特征与遗传演化关系,为我国猪流感的分子流行病学调查及科学防控提供参考。
1 材料与方法
1.1 试验材料
5株H1N1SIV:A/swine/Liaoning/972/2017(LN972)、A/swine/Liaoning/977/2017(LN977)、A/swine/Liaoning/995/2017(LN955)和A/swine/Liaoning/1011/2017(LN1011)、A/swine/Liaoning/752/2019(LN752)采自辽宁地区规模化猪场具有猪流感症状的猪肺脏组织,保存于辽宁省动物疫病预防控制中心实验室。9~10 日龄SPF 鸡胚购自辽宁益康生物制品有限公司。
1.2 病毒分离与鉴定
将保存样品按照国家标准GB/T 27536—2011 方法进行处理后,取250 μL上清液接种于10日龄的SPF鸡胚中,置于37 ℃恒温培养箱培养72 h 后收取鸡胚尿囊液,进行血凝试验。提取血凝阳性样品的总RNA,进行RT-PCR反应,对分离毒株进行初步亚型鉴定。其中,SIV反转录通用引物为Uni-12(5'-AGCAAAAGCAGG-3'),SIV 亚型鉴定引物序列均参考农业农村部动物流感重点开放实验室所用序列,由上海生工生物工程有限公司合成。
1.3 病毒的基因序列测定
使用TIANamp Virus DNA/RNA Kit(北京天根生物科技有限公司)提取病毒RNA。参考全国流感监测方案(2017 版)推荐的二代测序通用引物,利用SuperSript Ⅲ One-Step RT-PCR System with Platimum Taq试剂盒(赛默飞公司)对提取的RNA 进行RT-PCR 扩增,获得的特异性扩增产物使用Beads-PCR-250G AxyMag PCR Clean-up Kit(Axygen公司)进行纯化。纯化后产物送至诺禾致源公司,委托其利用Illumina HisSeqTM2500测序平台进行测序。
1.4 病毒分子特征与遗传演化分析
应用NCBI 网站Blast 检索同源性,生信软件Lasergene7.1 进行核苷酸序列分析和同源性比较,通过软件MEGA 7.0 邻接法Neighbor-joining method 和Kimura 2-parameter 模型(参数设置为1 000 replications)与参考序列构建遗传进化树,选择经典型H1N1SIV 参考毒株(A/swine/Guangdong/06/2009)、类人H1N1SIV 株(A/swine/Henan/01/2006)、人H1N1流感病毒参考毒株(A/Michigan/45/2015)、类禽H1N1SIV 株(A/swine/Shanghai/1205/2017)等作为参考序列。通过Net NGlyc1.0(http://www.cbs.dtu.dk/services/NetNGlyc)预测HA基因上潜在的糖基化位点。
2 结果与分析
2.1 分离株HA 基因序列关键氨基酸位点比较分析与遗传进化分析(见表1~表3、图1)
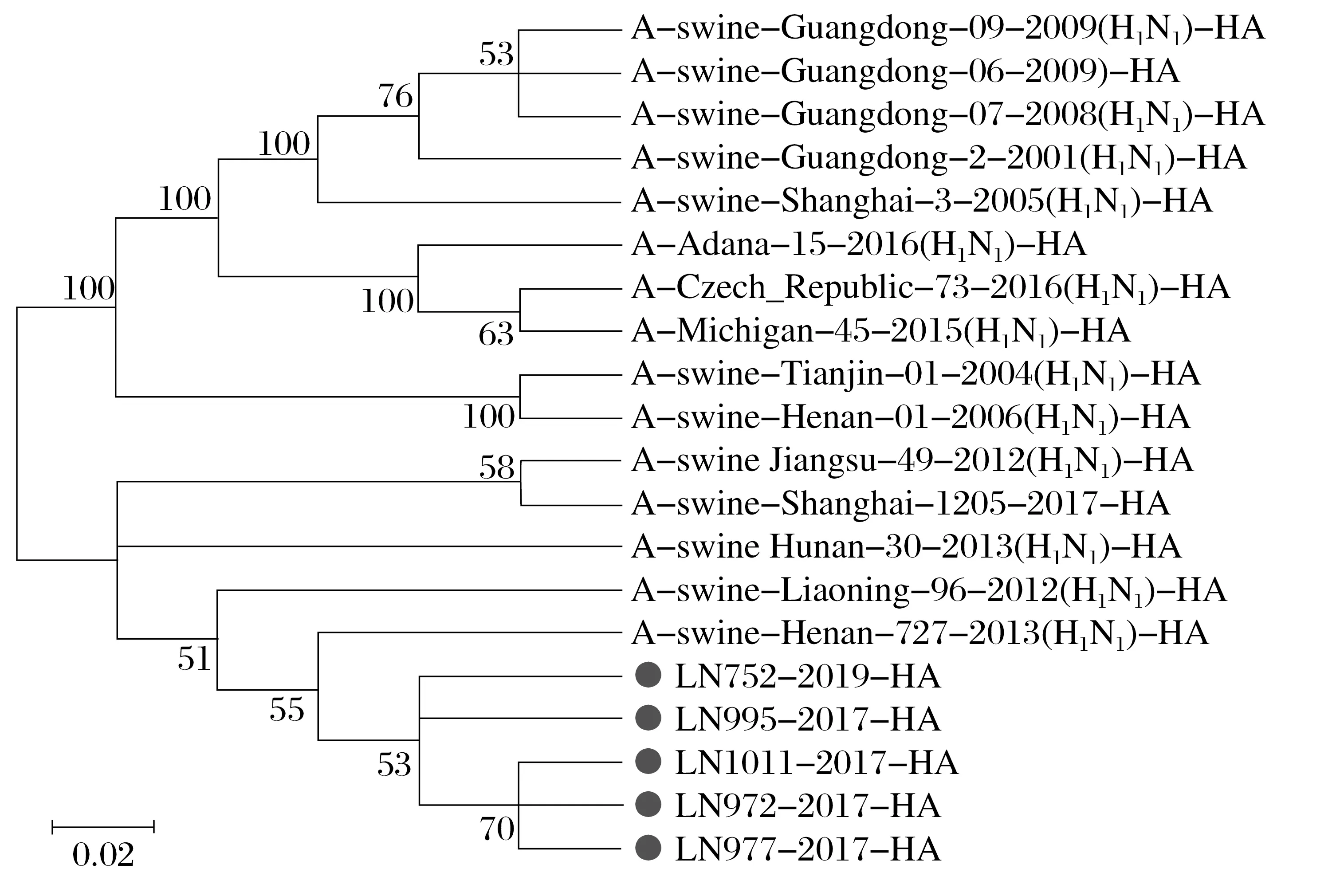
图1 5株H1N1 SIV分离株HA氨基酸序列系统发育分析Fig.1 Phylogenetic analysis of HA amino acid sequence in five H1N1 SIV isolates
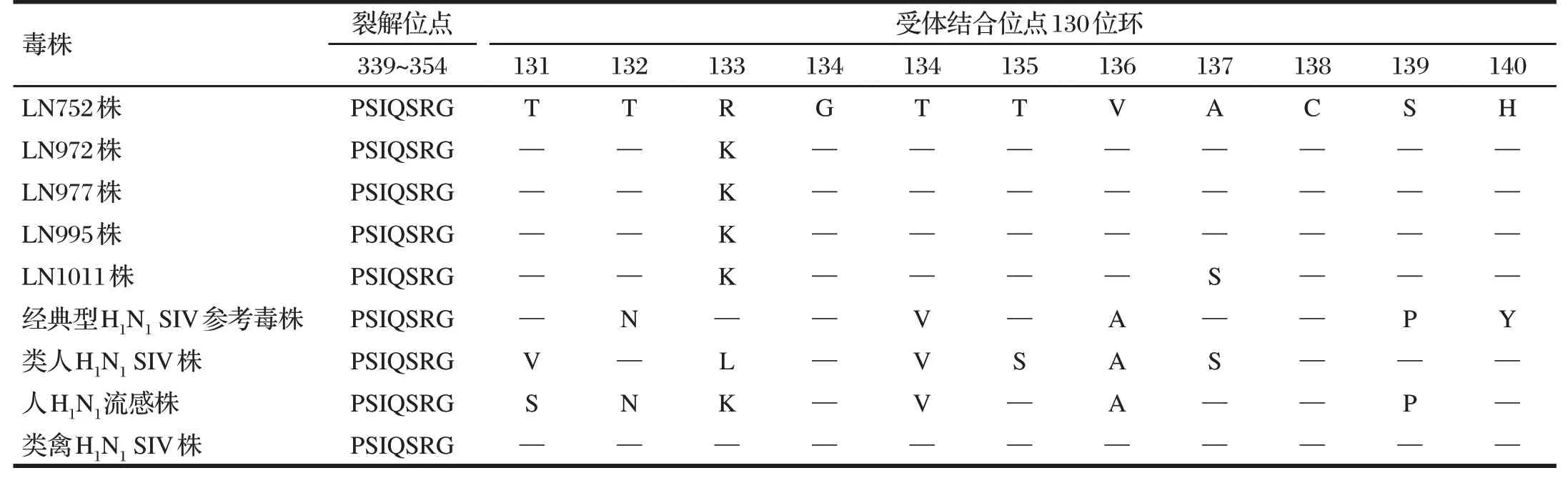
表1 分离株与参考株HA蛋白裂解位点与受体结合位点分析结果(受体结合位点130位环)Tab.1 Analysis results of HA protein cleavage sites and receptor binding sites of isolates and reference strains (130 ring of receptor binding site)
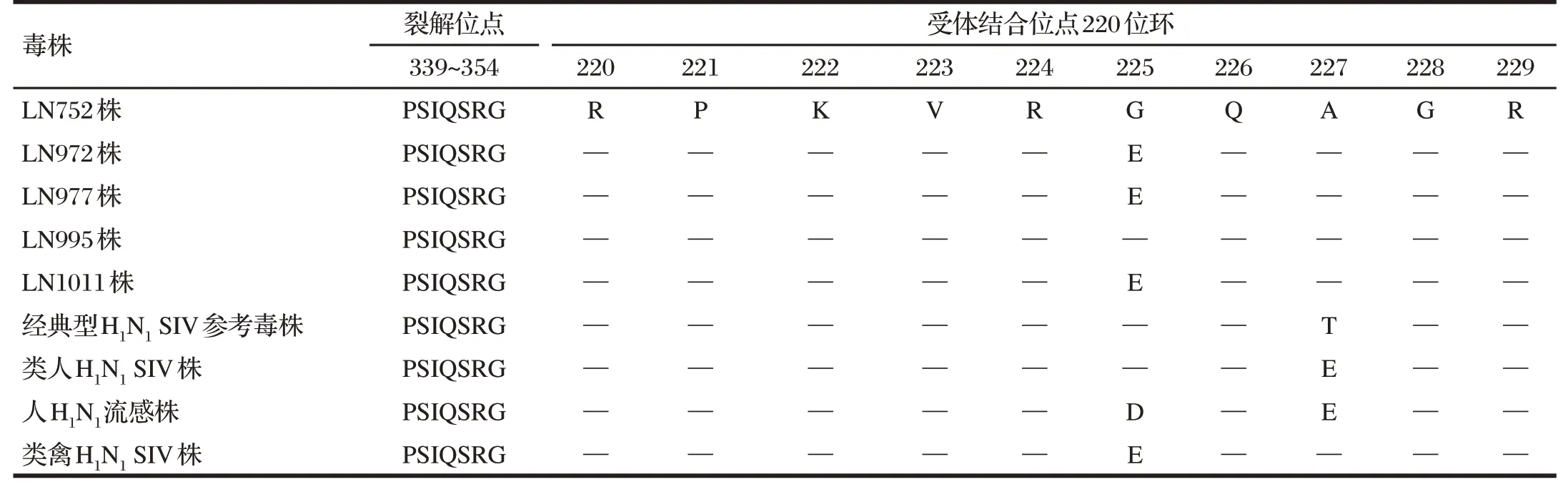
表3 分离株与参考株HA蛋白裂解位点与受体结合位点分析结果(受体结合位点220位环)Tab.3 Analysis results of HA protein cleavage sites and receptor binding sites of isolates and reference strains (220 ring of receptor binding site)
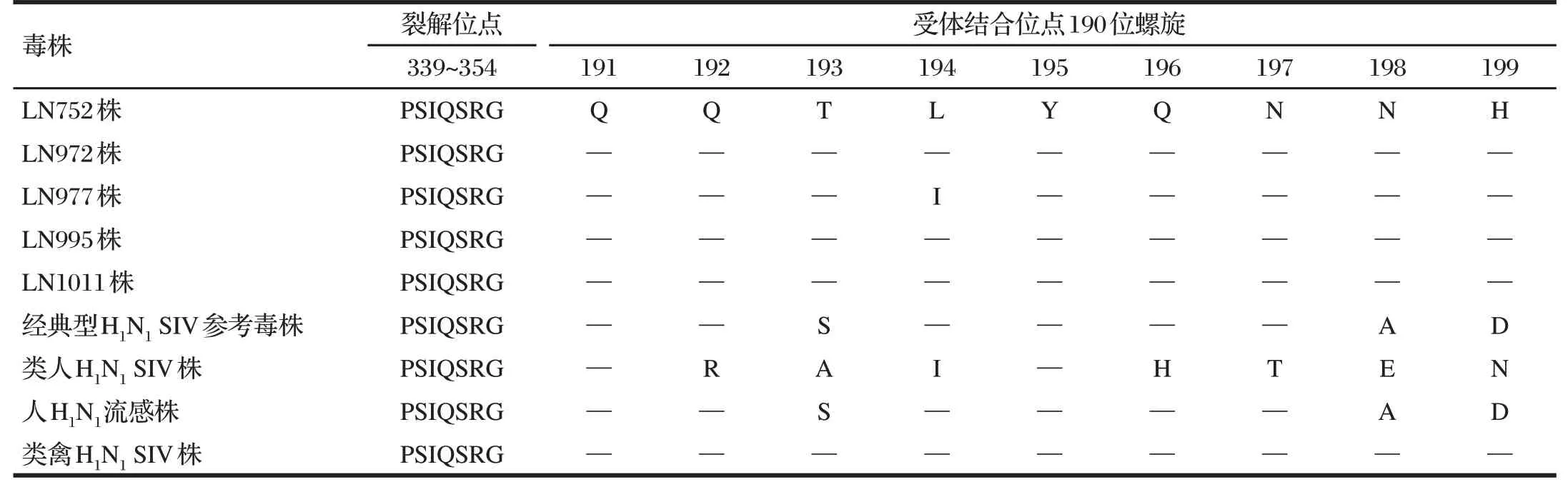
表2 分离株与参考株HA蛋白裂解位点与受体结合位点分析结果(受体结合位点190位螺旋)Tab.2 Analysis results of HA protein cleavage sites and receptor binding sites of isolates and reference strains (190 helix of receptor binding site)
检测结果显示,5 株H1N1亚型分离毒株HA基因ORF长度均为1 701 bp,编码566个氨基酸。5株辽宁地区分离株HA基因核苷酸序列同源性在95.4%~99.7%之间,氨基酸同源性在96.1%~99.3%之间。
由表1~表3 可知,5 株H1N1分离株的HA 裂解位点均为PSIQSR↓G,符合低致病性SIV 特征;参考Graaf 等[8]确定的HA 蛋白受体结合位(RBSs)区域由3 个部分组成:130 位环(131~140)、190 位螺旋(191~199)和220 位环(220~229)。在130 位环区域,分离株与类禽H1N1SIV 参考株最为接近,其中LN752 分离株完全一致,其他4 株在133位由R突变为K。在190位螺旋区域和220位环区域,分离株与类禽H1N1SIV株氨基酸序列高度一致,仅LN977株在194 位由L 突变为I。各分离株之间位点差异很小,252位处LN752株与LN995株由E突变为G。
对分离株HA 基因进行糖基化预测,结果显示,存在27NNS29、40NVT42、212NHT214、291NCT293、498NGT500和557NGS559等6个潜在糖基化位点。
由图1 可知,5 株SIV 分离株与A/swine/Liaoning/96/2012(H1N1)株、A/swine/Henan/727/2013(H1N1)株遗传关系更近,属于类禽SIV分支。
2.2 分离株NA 基因序列关键氨基酸位点比较分析与遗传进化分析(见表4、图2)
5 株H1N1SIV 辽宁分离株NA基因的ORF 全长均为1 410 bp,编码469 个氨基酸。5 株H1N1分离株的NA基因核苷酸序列同源性97.3%~99.8%,氨基酸序列相似性为97.0%~100.0%。
从GeneBank 数据库中下载代表性毒株NA 蛋白氨基酸序列,对其活性中心、红细胞结合位点和抗原决定簇区域关键氨基酸位点分析,结果见表4。
由表4 可知,NA 活性中心氨基酸序列比对发现,5 株分离株与经典型H1NISIV 参考毒株比较,在143 位和149 位氨基酸突变为K 和I;与类人H1N1SIV 株相比,在149 位和157 位氨基酸突变为I 和T;与类禽H1N1SIV 参考株在第155位氨基酸存在差异;在红细胞结合位点上,分离株在369 位和第432 位氨基酸与类人H1N1SIV 株、人H1N1流感病毒参考毒株存在差异;抗原决定簇上,分离株与类禽H1N1SIV参考株一致,与其他参考毒株则均存在差异。
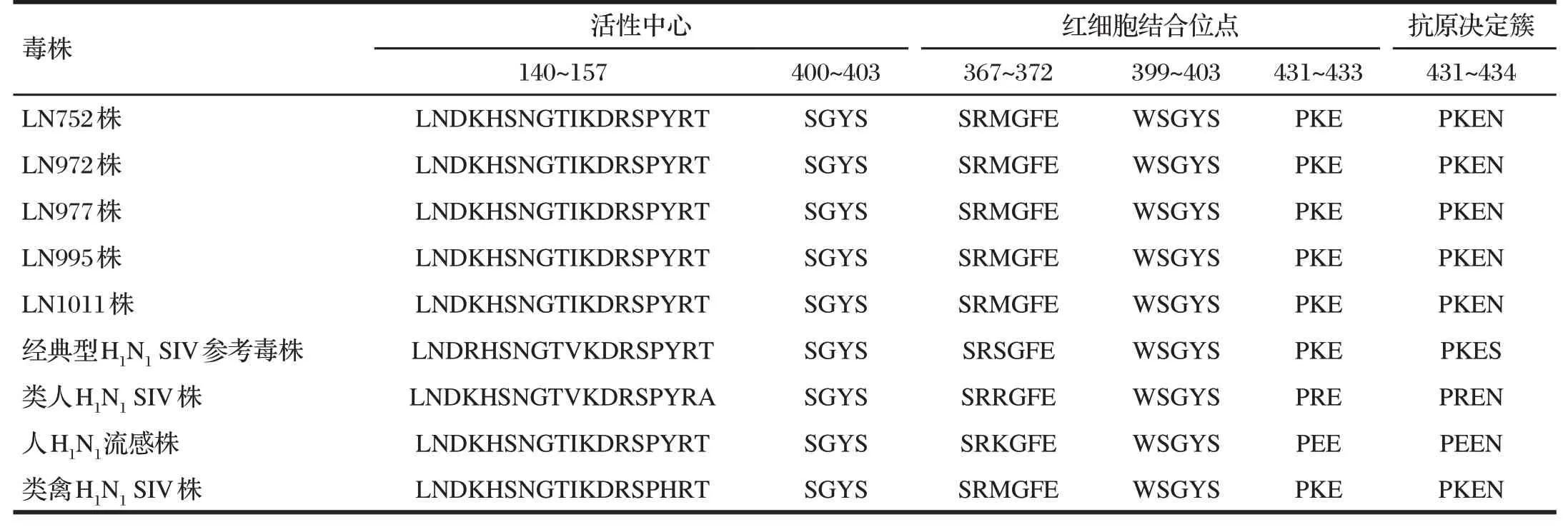
表4 分离株与参考株NA蛋白裂解位点与受体结合位点分析结果Tab.4 Analysis results of NA protein cleavage sites and receptor binding sites of isolates and reference strains
对分离株潜在糖基化预测结果显示,存在5QKI7、83VKL85、216IKS218、346VKG348、362TKS364和431PKE4336 个 潜 在的糖基化位点,与类禽H1N1SIV 参考株一致,比其他参考株糖基化位点多,与A-Swine-Henan-01-2006(H1N1)株差异最大。
由图2可知,通过MEGA 6.0进行系统发育分析显示,5株分离株属于类禽H1N1SIV分支。
2.3 内部基因遗传进化分析(见图3~图8)
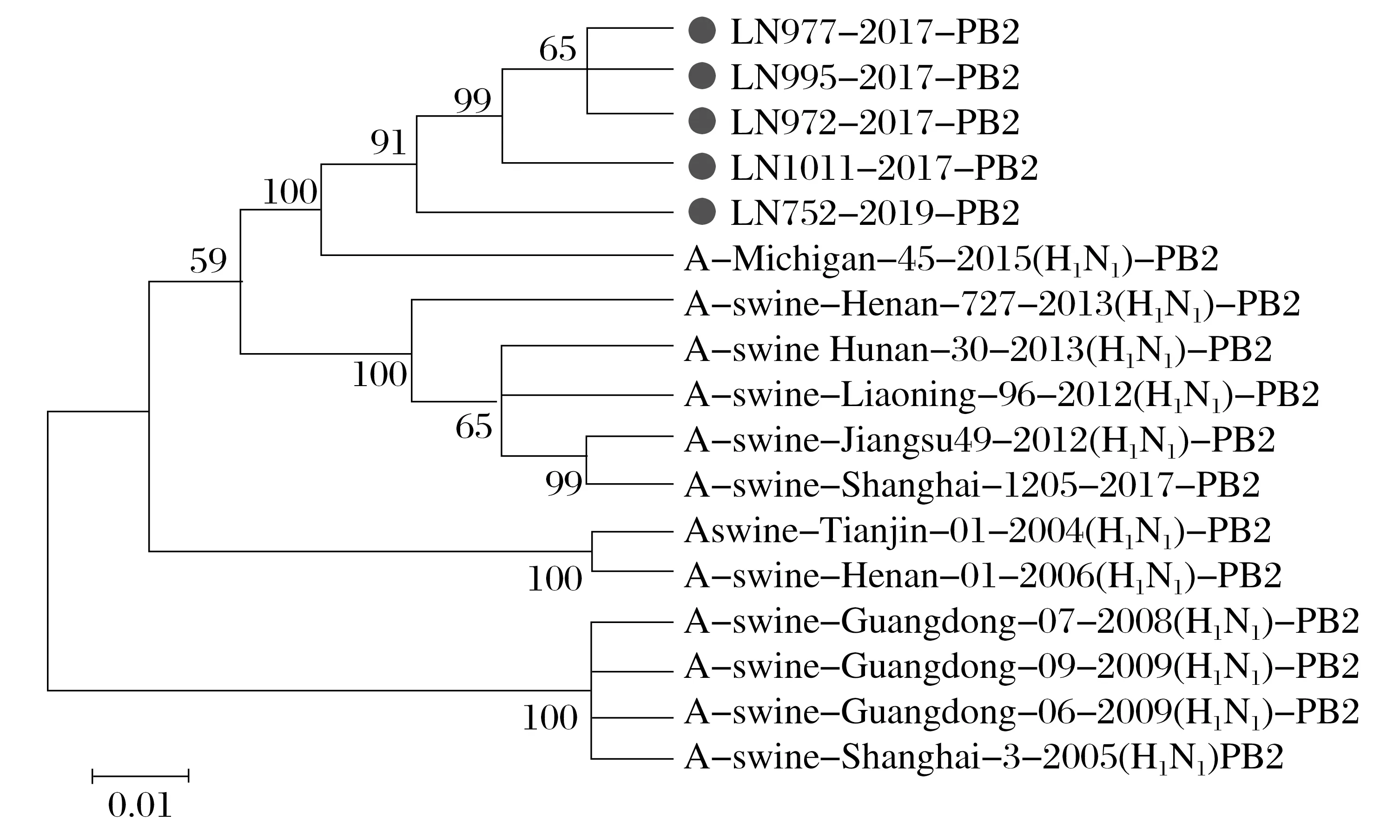
图3 H1N1 SIV的PB2(A)基因的系统发育分析Fig.3 Phylogenetic analysis of PB2 (A) gene in H1N1 SIV
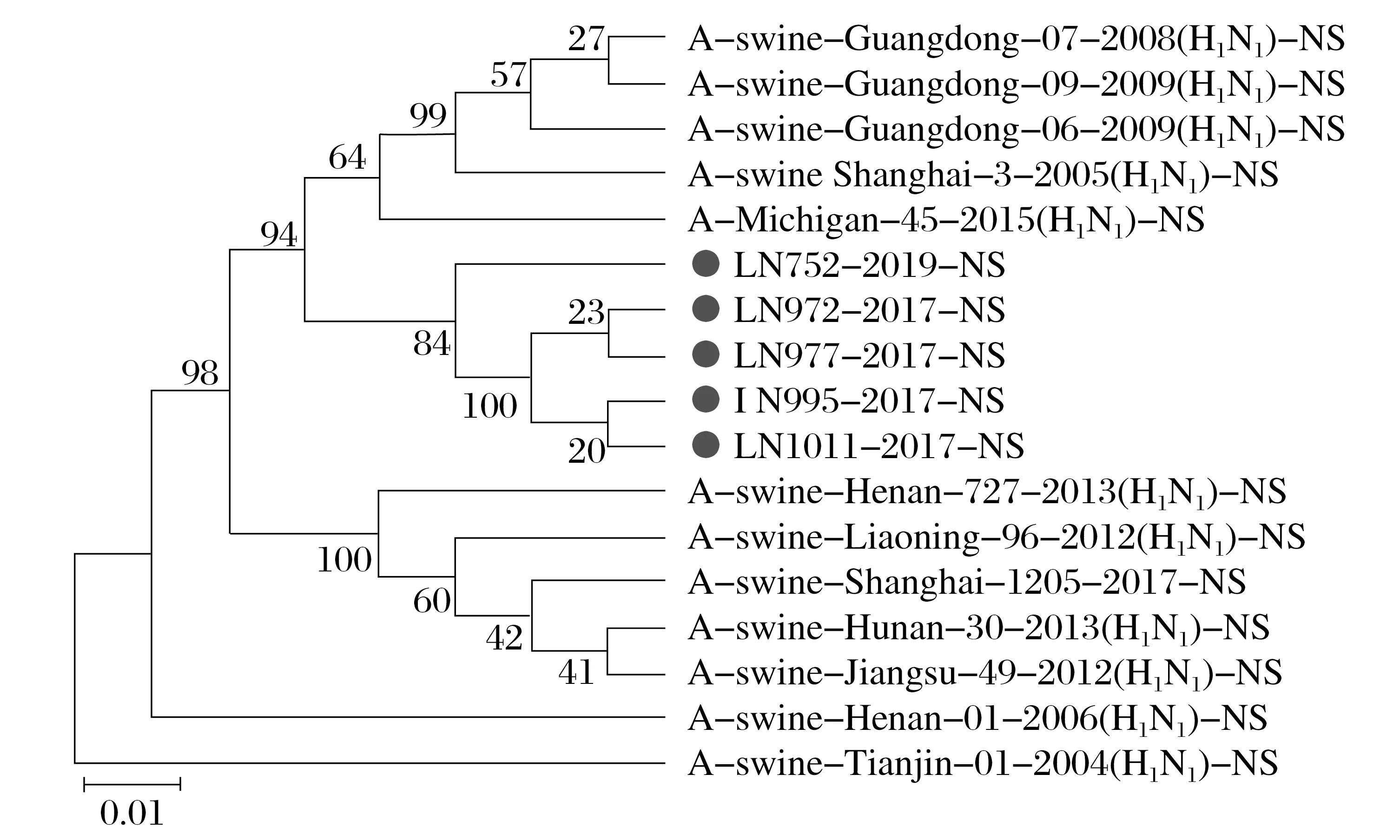
图8 H1N1 SIV的NS(F)基因的系统发育分析Fig.8 Phylogenetic analysis of NS(F) gene in H1N1 SIV
5 株分离株的内部基因的核苷酸序列同源性依次为M 92.6%~99.8%、NP 97.3%~99.1%、NS 96.1%~98.1%、PA 97.7%~99.3%、PB1 97.1%~99.8%和PB2 96.8%~99.2%;氨基酸序列同源性依次为M 97.6%~100.0%、NP 98.2%~99.5%、NS 96.4%~98.7%、PA 96.4%~99.2%、PB1 97.5%~99.7%、PB2 97.2%~98.9%。
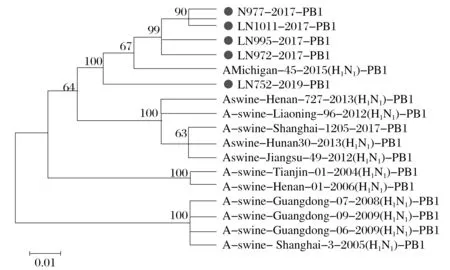
图4 H1N1 SIV的PB1(B)基因的系统发育分析Fig.4 Phylogenetic analysis of PB1 (B) gene in H1N1 SIV
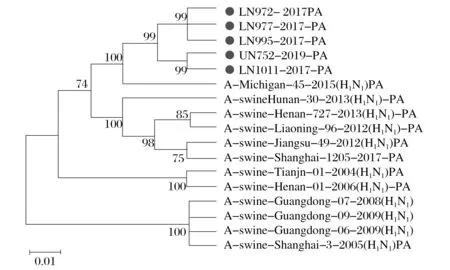
图5 H1N1 SIV的PA(C)基因的系统发育分析Fig.5 Phylogenetic analysis of PA (C) gene in H1N1 SIV
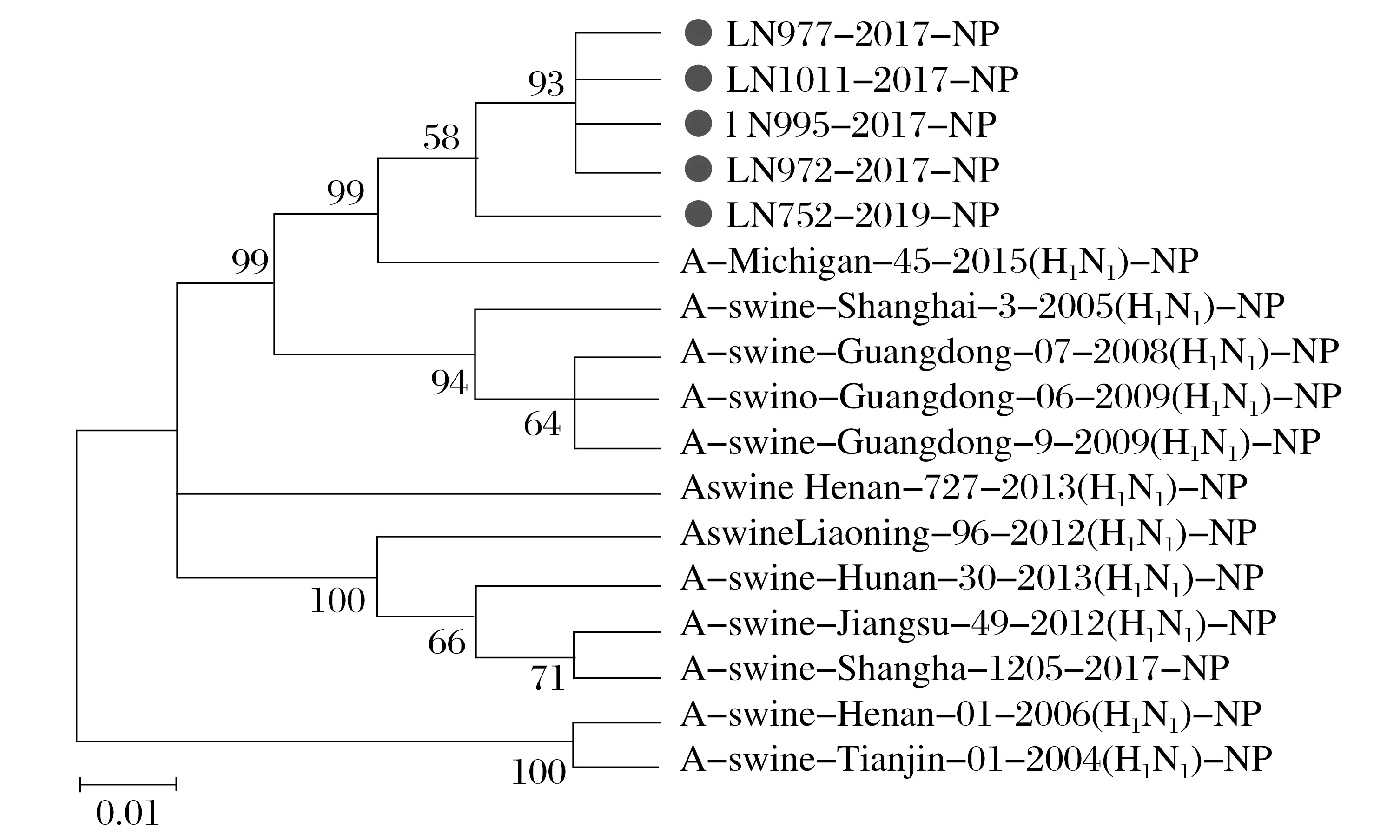
图6 H1N1 SIV的NP(D)基因的系统发育分析Fig.6 Phylogenetic analysis of NP(D) gene in H1N1 SIV
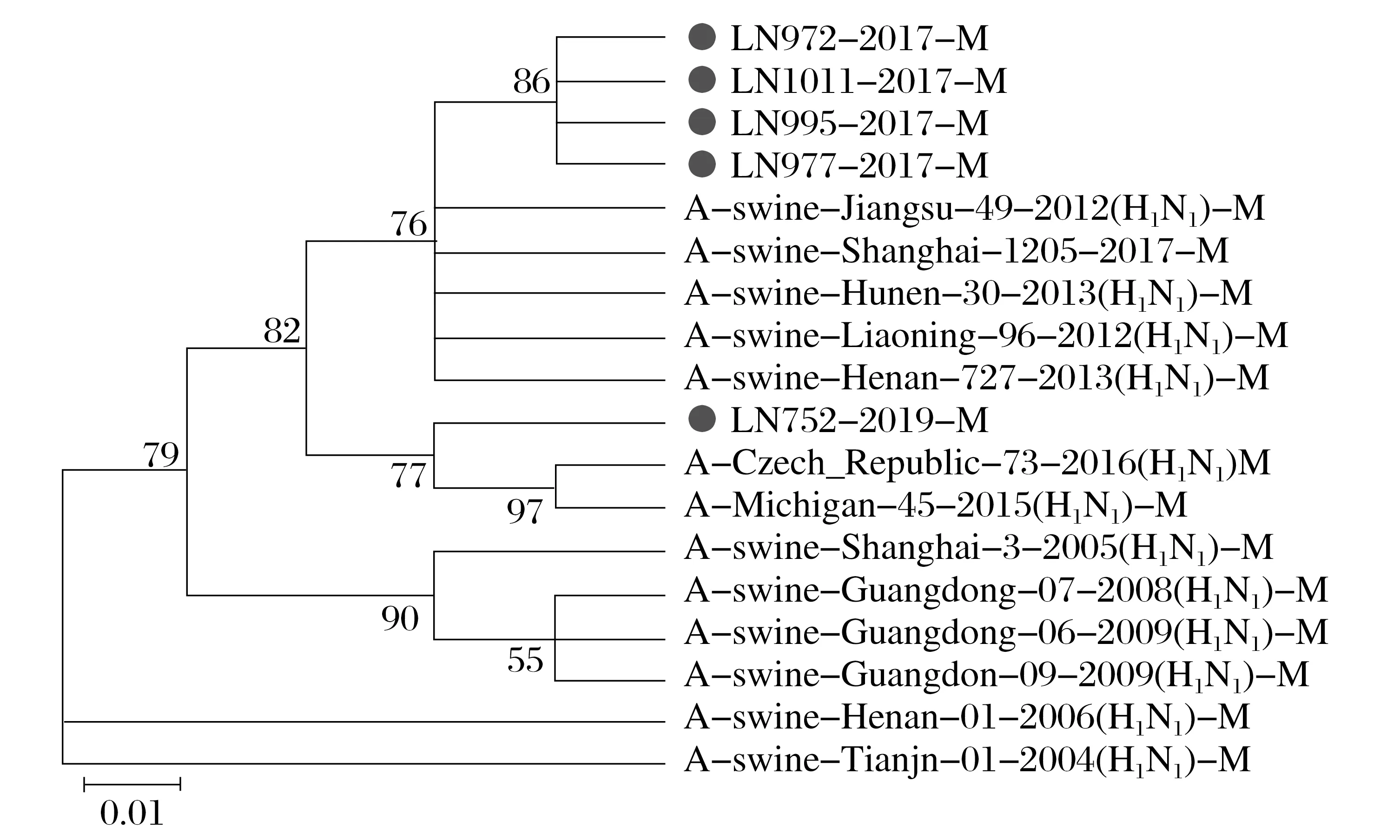
图7 H1N1 SIV的M(E)基因的系统发育分析Fig.7 Phylogenetic analysis of M(E) gene in H1N1 SIV
由图3~图8 可知,5 株分离株的内部基因中,PB2、PB1、PA、NP基因与人H1N1流感参考株遗传关系最近。4 株分离株(LN972 株、LN975 株、LN995 株和LN1011 株)的M基因与类禽H1N1SIV 分支中A/swine/Hunan/30/2013(H1N1)参考株遗传关系较近。而LN752 分离株与人H1N1流感参考株遗传关系最近,NS基因与经典H1N1SIV 参考株处于同一个分支中。
3 讨论
SIV于1930年初次从猪体内分离获得[9]。感染SIV的猪呼吸道上皮细胞中存在SA-α-2,6-Gal(人)和SA-α-2,3-Gal(禽)等两种受体,对人流感病毒和禽流感病毒的敏感性增强[10],可同时感染禽流感病毒和人流感病毒,使不同流感病毒基因之间发生重新组合,从而突破种属障碍,引起流感大流行。因此,猪也被认为是流感病毒的基因混合容器[11-12]。对SIV的研究不仅能够减少SIV对养猪业也造成的损失,同时也具有重要的公共卫生学意义。
目前,针对辽宁地区猪群中SIV流行情况研究还不够深入。本研究收集了近几年从辽宁不同地区猪场收集的5株SIV毒株,在全基因测序的基础上,对各个基因进行了系统分析。5株分离毒株裂解位点均仅含有1个碱性氨基酸(R),属于低致病性流感病毒。由HA基因受体结合位点可知,分离株虽然与类禽型A/swine/Shanghai/1205/2017基本一致,但个别氨基酸位点出现突变,并且在133位氨基酸突变为K;分离株与人H1N1流感株在一位点氨基酸相同,可能预示病毒有利于与人类受体结合。分离株HA蛋白在190位氨基酸为D或V,225位氨基酸为E或G。有研究显示,这类突变能够在增加流感病毒由 SA-α-2,3-Gal 亲和性转变为SA-α-2,6-Gal 亲和性中起关键作用,尤其E190D突变,在禽流感病毒适应哺乳动物宿主(猪和人)转变中起到重要作用[13-14]。
由遗传进化角度分析,分离株HA基因和NA基因与类禽型H1N1SIV 参考株亲缘关系较近。潜在糖基化位点数量和位置变化不仅可能影响蛋白质的折叠、组装和运输等特性和功能,也会改变病毒的抗原性或增强病毒的流行性,从而有助于病毒逃避宿主免疫[15]。分离株HA 蛋白和NA 蛋白潜在糖基化位点也与类禽型H1N1SIV 参考株一致,但比经典型SIV 毒株潜在糖基化位点要多,可能增加了分离毒株结合受体的能力和病毒致病力。
研究表明,PB2 蛋白上的627 位和701 位氨基酸与A型流感病毒宿主范围和病毒复制能力密切相关。本研究中,分离株在627位氨基酸位点为禽源性的627E,而701位氨基酸为人流感的701D,这有助于病毒在哺乳动物宿主内进行复制和传播。分离毒株基因片段不仅与类禽H1N1SIV 同源性较高,部分基因片段与人H1N1流感病毒、河南和广东等经典SIV毒株对应片段高度同源,提示分离株可能是在人流感病毒感染猪以及生猪跨区域流动过程中重组产生,应加强日常对SIV 主动监测。本研究中,通过对5株SIV毒株的分子特征和遗传进化特性进行系统分析,结果显示分离株具有类禽SIV和类人SIV的特征,可能具有感染人的能力。因此,无论从公共卫生安全还是从保障养猪业健康发展角度考虑,均应加强对SIV 的流行监测,密切关注我国猪群中SIV 流行情况,及时掌握其分子遗传进化规律,对保障人类健康和降低养猪业经济损失均具有十分重要的意义。
4 结论
本研究通过对辽宁地区5株SIV毒株进行分子特征及遗传进化分析显示,目前辽宁地区SIV流行毒株具有典型低致病性流感病毒的分子特征,但存在不同基因型流感病毒片段重组现象,应加强对SIV 的流行监测,减少对养猪业造成的损失以及由此引发潜在的公共卫生安全问题。

