芽孢杆菌生物合成纳米硒条件优化及活性评价
朱燕云,王 欣,陈丹艳,马敬泽,朱 宁,靳红梅,
芽孢杆菌生物合成纳米硒条件优化及活性评价
朱燕云1,2,3,王欣4,陈丹艳5,马敬泽5,朱宁1,2,靳红梅1,2,4※
(1. 江苏省农业科学院资源与环境研究所,南京 210014;2. 江苏省有机固体废弃物资源化协同创新中心,南京 210095;3. 农业农村部种养结合重点实验室,南京 210014;4. 南京农业大学资源与环境学院,南京 210095;5. 金陵科技学院园艺园林学院,南京 210038)
作为生防菌的枯草芽孢杆菌XP(subspeciesstrainXP)不仅具有较强的耐硒与耐盐能力,而且还可将毒性较高的无机硒转化为安全性高、生物活性好的纳米硒 (SeNP),然而目前其合成SeNP的效率并不高。为提升菌株XP生物合成SeNP的效率,该研究针对其合成工艺条件做了进一步优化。首先,通过单因素试验,初步筛选出适宜范围量值的初始亚硒酸盐Se (IV)浓度、摇床转速、XP接种量;其次,将这三个因子作为影响因素,以SeNP产量为响应指标,利用Box-Behnken响应面法 (RSM) 进行分析;最终,通过响应面法获得枯草芽孢杆菌XP产SeNP的最优发酵工艺条件。研究结果表明,枯草芽孢杆菌XP合成纳米硒的最佳发酵条件为:初始Se (IV) 3.4 mmol/L、摇床转速157 r/min、菌株XP接种量9.9%,此发酵条件下纳米硒的产量达到1.82 mmol/L,相对优化前提升了60%以上。此外,通过种子发芽试验,进一步证明此工艺条件下合成的纳米硒具有较高的生物活性,可有效提升油麦菜种子活力,促进种子萌发。
菌;发酵;响应面法;枯草芽孢杆菌;纳米硒;生物活性
0 引 言
硒(Selenium, Se)是一种天然微量元素,在维持人体健康和动物机体正常代谢方面发挥着重要作用[1-2]。目前,硒已被广泛应用于众多领域,包括农业、化工以及临床医学等[3-6]。硒虽然是动物和人类必需的微量营养元素,但其过量摄入则会导致机体中毒。研究表明,人体硒的安全摄入范围在40~400 μg/d,过多或过少摄入硒均会导致人体产生严重的健康问题[7]。硒具有四种典型价态,即:硒酸盐[Se(VI)]、亚硒酸盐[Se(IV)]、硒化物[Se(−II)] 和单质硒[Se(0)][4],不同价态之间可以进行相互转化。一些植物可以通过自身代谢过程,将环境中的无机硒或单质硒转化为有机硒储存在植物组织中,人类则可通过食用这些含硒植物间接摄取机体代谢所需的硒。自然界中的硒普遍以无机态存在于水体或土壤中,有机态硒多存在于生物体当中。然而,无机硒易流动,潜在环境风险高,而有机硒因其有效范围狭窄易造成生物毒害,单质硒毒性相对较低,但是生物利用度低[8]。
近年人们通过研究发现一种新型单质态硒—纳米硒(Selenium Nanoparticle, SeNP),并已证明纳米硒相对于无机硒、有机硒和一般的单质硒来说具有生物活性高、毒性小、粒子分散度高、表面积大等一系列更优异的特性[9-12],被视作一种具有广泛应用前景的材料。目前已有的纳米硒合成手段主要包括:化学法、物理法以及生物法,相对于前两者而言,生物法不仅能耗低、环境友好且所得纳米硒的活性更高,更易被机体吸收利用[13]。因此,利用生物法合成纳米硒更受人们青睐。国内外已有研究表明,自然界中的许多微生物能够通过自身代谢过程,将毒性较高的无机硒(硒酸盐或亚硒酸盐)转化为毒性较低的纳米硒[14-16]。这些产纳米硒的微生物中以细菌居多,如:克雷伯氏菌属(sp.)[17]、草螺菌属(sp.)[18]、链酶菌属(sp.)[19]、假单胞菌属(sp.)等[20]。不同种类细菌之间,生物合成纳米硒的能力存在较大差异,这主要是因为种类不同的细菌对底物硒酸盐/亚硒酸盐的耐受能力不同,且参与纳米硒合成的代谢途径不同[21]。此外,相同菌株在不同的生长环境下,其代谢硒酸盐/亚硒酸盐的能力也有所不同,对底物的利用度以及转化能力也会表现出较大差异[22]。因此,筛选耐受硒胁迫能力强的菌株,并确定其培养的最佳条件参数,从而有效提升纳米硒的合成效率,这对推动纳米硒的实际生产应用十分关键。
枯草芽孢杆菌作为一种生防菌,在食品加工和保鲜、生物发酵以及绿色有机农产品生产中具有潜在的应用价值。此外,枯草芽孢杆菌也是微生态环境中的优势种群,不仅具有植物促生等优势,其繁殖力和理化性质稳定性也优于大部分生防菌株。本团队通过前期研究已筛选到一株耐高盐且耐受硒能力较强的菌株—枯草芽孢杆菌菌株XP(subspeciesstrain XP),并明确了其合成纳米硒的基本规律[23]。为了满足纳米硒后续实际生产应用的需求,菌株XP合成纳米硒的工艺条件参数还需进一步优化。本研究主要通过单因素试验与响应面试验相结合的方法,对菌株XP合成纳米硒的主要条件参数进行优化。不仅有效提升了生物纳米硒产量,而且进一步对其生物活性进行了评价,这将为后续耐硒枯草芽孢杆菌菌株功能的开发以及生物纳米硒在富硒作物生产与环境修复中的应用提供有力支撑。
1 材料和方法
1.1 试验菌株与供试植物种子
将枯草芽孢杆菌XP(subspeciesstrainXP)作为本研究的供试菌株,此前由本实验室工作人员分离于废弃生物质的厌氧发酵产物中,菌株XP在此用于纳米硒的生物合成。供试蔬菜种子为油麦菜(品牌为四季香,购自绿宝种业)。
1.2 主要试剂与培养基
1.2.1 试剂
Na2SeO3(98%, Sigma-Aldrich) 固体粉末用于配制亚硒酸盐母液(1 mol/L);Na2S(≥98%,上海凌峰化学试剂有限公司)用于配制硫化钠溶液(1 mol/L);NaCl (≥99.5%,西陇科学股份有限公司)用于配制生理盐水(0.85%,/)及培养基的制备;酵母提取物和胰蛋白胨均为赛默飞世尔科技公司OXIOD品牌,用于配制培养基;丙三醇、NaOH、盐酸及其他常规试剂均为国药集团试剂,分析纯;试验所用水均为去离子水。
1.2.2 培养基
Luria-Bertani (LB) 液体培养基成分:NaCl 10 g、胰蛋白胨10 g、酵母提取物5 g、去离子水1 000 mL,pH值7.0~7.3,121 ℃条件下高压蒸汽灭菌20 min,晾至室温后用于菌株的活化。含硒LB液体培养基:将灭菌的LB液体培养基置于超净工作台上,用移液枪吸取上述无菌亚硒酸钠母液(Se(Ⅳ)=1 mol/L),加至LB液体培养基中,使Se(IV)初始浓度达4 mmol/L,作为菌株XP合成纳米硒的发酵培养基。
1.3 主要仪器
桌面式冷冻离心机(5424R,Eppendorf,德国)、生化培养箱(DNP-9162,精宏,中国)、恒温摇床(HZQ-F160,华美,中国)、水浴锅(HH-3A,国华,中国)、超低温冰箱(DW-HL528,美菱,中国)、酶标仪(EPOCH 12,Bio Tek,美国)、旋涡振荡器(VORTEX-5,其林贝尔,中国)、真空冷冻干燥仪(Alpha 2-4 LSCbasic,CHRIST,德国)、烘箱(DHG-9076Y,精宏,中国)、pH计(FE28,Mettler Toledo,瑞士)。
1.4 试验方法
1.4.1 菌株活化与扩大培养
将–20 ℃低温保存的芽孢杆菌XP甘油管于4 ℃条件下解冻,之后置于超净台上备用。按照1%(体积分数)的接种比将解冻后的菌株XP菌液接至5 mL的 LB培养基中,180 r/min、35 ℃恒温培养过夜;次日,再将菌液转接至50 mL的LB培养基中,相同转速与温度条件恒温培养至对数生长期(OD600≈0.8),此时的菌液用于后续试验。
1.4.2 纳米硒生物合成及其含量测定
纳米硒生物合成:基于1.2.2的方法配制LB培养基,将其事先分装至250 mL三角锥形瓶中(100 mL/瓶),灭菌后添加亚硒酸钠,获得无菌含硒(Se(Ⅳ)= 4 mmol/L)LB培养基;于超净工作台上,用移液枪吸取活化好的枯草芽孢杆菌XP菌液,按照1%(体积分数) 的接种量加至上述含硒LB培养基中,不加硒的为对照组;每个处理设置3个重复。将所有样品放置于恒温摇床上,180 r/min、35 ℃恒温连续培养48 h[23],之后分析发酵液中的纳米硒含量。
发酵液中纳米硒含量测定采用改进的Biswas[24]。具体步骤如下:1)从每个锥形瓶中各取发酵液6 mL分装至3个2 mL离心管中,即每个生物学样品对应3个技术重复;2)将上述装有样品的离心管置于离心机中,4 ℃、8 000 r/min离心10 min,用移液枪轻轻吸出上清,得到沉淀;3)向上述沉淀中加入1 mol/L的Na2S溶液各1 mL,盖上管盖,轻轻振荡以使沉淀充分溶解,室温静置,期间手动振荡一次;4)静置1 h后离心收集上清,加入到96孔板中,200 μL/孔,置于酶标仪上测定500 nm 处的吸光值。同时,按照文献[24]所述绘制标准曲线并得到标准曲线方程。最后,将样品测定的吸光值代入标准曲线方程,计算出原供试发酵液中纳米硒的含量。
1.4.3 合成纳米硒的单因素试验
本团队通过前期研究[23]已明确耐盐枯草芽孢杆菌菌株XP生长的最佳pH值以及培养温度依次为pH值7.2和35 ℃。此外,底物初始Se (IV) 浓度、摇床转速、菌株XP接种量也是影响纳米硒产量的三大主要因素,至今这3个因素各自的最优区间尚不清楚。为此分别设置底物Se (IV) 不同初始浓度水平 (1、2、4、6、8 mmol/L)、不同摇床转速(120、150、180、200 r/min)、XP不同接种量(0.5%、1%、2.5%、5%、10%,/)进行培养,以48 h时发酵液中的纳米硒含量为标准,分别评价这3个因素(初始Se (IV) 浓度、摇床转速、菌株XP接种量)对菌株XP生物合成纳米硒的影响。考察单一因素时,其余因素的量值固定为:摇床转速180 r/min、菌株XP接种量1%、底物Se(IV) 浓度4 mmol/L。
1.4.4 响应面优化试验设计
基于单因素试验结果,确定每个因素的最优区间,依据Box-Behnken试验设计原理,进一步运用Design-Expert 12 软件设计多因素正交组合试验。选择以上三个因子(初始Se (IV)浓度、摇床转速、接种量)作为变量,试验因素及水平编码如表1所示,A、B、C分别表示初始Se(IV)浓度、摇床转速、接种量3个变量。以SeNP产量为响应值,获得多元二次回归模型,求解产SeNP发酵条件参数的最优组合。采用三因素三水平的响应面法对培养条件进一步优化,从而获得菌株XP生物合成SeNP的最佳发酵工艺条件。

表1 Box-Behnken试验因素与水平
1.4.5 模型验证
根据响应面模型优化得到菌株XP合成SeNP的最佳发酵工艺条件,按照初始Se (IV) 浓度、摇床转速和接种量的最优值再次进行发酵试验合成纳米硒,设置4组重复。发酵温度35 ℃,48 h后测定发酵液中的纳米硒含量,将其与模型预测值对比,从而验证响应面预测模型是否合理。
1.4.6 纳米硒活性分析
通过种子萌发试验对优化工艺条件下合成的纳米硒生物活性进行评价[25]。挑选籽粒饱满大小均一的油麦菜种子,用3%的双氧水消毒后再用去离子水冲洗4次,滤纸吸干种子表面水分后备用。设置含不同浓度纳米硒(0.25、0.5、1、2.5、5、10 mmol/L)的种子培养液,发芽试验方法参照呼凤兰等[25]的研究。准备无菌培养皿(12 cm),皿内铺垫2~3层滤纸,每个皿中放入40粒种子,按照不同处理加入相应浓度的纳米硒培养液10 mL,等量水做对照组,盖上皿盖。每个处理设置3个重复,培养皿置于(25±1) ℃的恒温培养箱中,次日开始统计种子发芽个数,以油麦菜种子吐白1 mm为标准。连续3 d无新增发芽种子则视为不发芽,连续观察和记录,7 d后统计油麦菜的发芽势(GE)和发芽指数(GI)。GE/%=(发芽高峰期种子数/40)×100;GI/%=∑(G/D)×100,其中G为第天当天的发芽数,D为发芽时间。
1.5 数据处理
本研究中涉及的所有试验没有特殊说明的均设置3个重复,所得数据采用软件SAS 9.4进行统计学分析,利用origin 2021分析作图,利用Design-Expert 12.0进行Box-Behnken试验设计。
2 结果与分析
2.1 枯草芽孢杆菌XP生物合成纳米硒工艺条件单因素试验
2.1.1 底物Se(IV)初始浓度对纳米硒产量的影响
底物浓度是影响生物发酵过程目标物质产量的主要因素之一。不同初始Se(IV)浓度条件下,菌株XP合成纳米硒的结果如图1所示。由图1可知,随着发酵体系中的底物Se(IV)浓度逐渐增加,纳米硒的产量随之呈先增加后降低的趋势,当Se(IV)浓度为2 mmol/L时,纳米硒产量最高为0.73 mmol/L。李严等[26]研究了1~4 mmol/L亚硒酸盐Se(IV)条件下,产碱杆菌(sp.)和普罗菲登斯菌(sp.)合成纳米硒的能力,发现了类似的规律,推测是由于Se(IV)浓度过高会对菌株产生毒性作用,从而造成菌株还原Se(IV)的能力降低。BORAH等[27]通过研究发现,拟蕈状芽孢杆菌()在1.25~10 mmol/L亚硒酸盐Se(IV)条件下,合成纳米硒的效率和底物Se(IV)初始浓度密切相关,表现为硒初始浓度越高纳米硒合成效率逐渐降低。因此,选择合适的初始Se (IV) 添加量,对于维持菌株XP的正常代谢生长和纳米硒的高效合成至关重要,基于图1结果,确定1~4 mmol/L作为下步Box-Behnken试验的Se(IV)初始浓度范围。
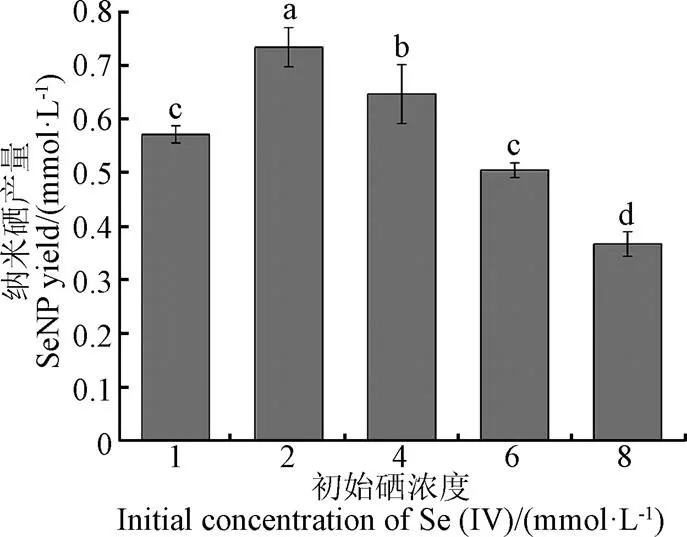
注:考察单一因素时,其余因素的量值固定为:摇床转速180 r·min-1、菌株XP接种量1%、底物Se(IV) 浓度4 mmol·L-1,不同字母表示差异明显(P<0.05),下同。
2.1.2 摇床转速对纳米硒产量的影响
除底物浓度之外,摇床转速对菌株代谢产物的合成过程也至关重要。转速对枯草芽孢杆菌菌株XP合成纳米硒的影响结果如图2所示,在120~200 r/min范围内,菌株XP发酵产纳米硒的量在0.88~0.57 mmol/L之间。当摇床转速为150 r/min时,发酵液中纳米硒含量最高(0.88 mmol/L);摇床转速增加至200 r/min,发酵液中纳米硒的含量最低(0.57 mmol/L)。任玉文等[28]的研究表明,转速过快会对培养体系中的菌体产生一定程度的机械损伤,从而造成菌体衰亡,抑制代谢产物的合成;王宏浩等[29]在对枯草芽孢杆菌进行发酵时,发现转速过慢则易致使发酵体系中的溶解氧含量降低,导致好氧菌株生长繁殖变缓,甚至使培养基发生沉淀,造成代谢产物合成量大幅降低。因此,摇床转速过高或过低都不利于微生物的生长及代谢物的合成,选择合适的转速对于促进菌株XP生物合成纳米硒至关重要。基于图2结果,确定120~180 r/min作为下步Box-Behnken试验的摇床转速范围。
2.1.3 接种量对纳米硒产量的影响
发酵过程中,菌株的接种量过高或过低均会对整个发酵过程产生不利影响。菌株XP接种量对纳米硒合成量的影响结果如图3所示。当菌株XP接种量在0.5%~10%之间时,纳米硒产量随接种量增加而增加;当接种量为5%时纳米硒合成量最高,为1.04 mmol/L;当接种量增加到10%时,纳米硒产量有轻微下降,但与5%接种量处理组相比无显著性(>0.05)差异,纳米硒合成量保持在相对恒定的水平。孙雨佳等[30]的研究表明,接种量过高,会导致发酵体系溶解氧快速消耗殆尽,进而抑制菌株自身的生长以及代谢产物的合成。张羽竹等[31]通过研究植物乳酸杆菌还原亚硒酸盐产纳米硒,发现适宜的接种量(2%~4%)可使纳米硒合成效果维持在较高的水平,接种量过低会显著降低纳米硒的合成量。合成同一目标产物的最适接种量会因菌株种类的不同而表现出较大的差异,明确菌株XP的最适接种量将能有效提升菌株XP发酵产纳米硒的量。基于图3结果推测菌株XP最佳接种量在5%附近,虽10%处理与5%处理之间无显著性差异,但二者之间差值较大,最佳值也可能位于5%~10%之间,综合考量最终选定2.5%~10%作为下步Box-Behnken试验的接种量范围。
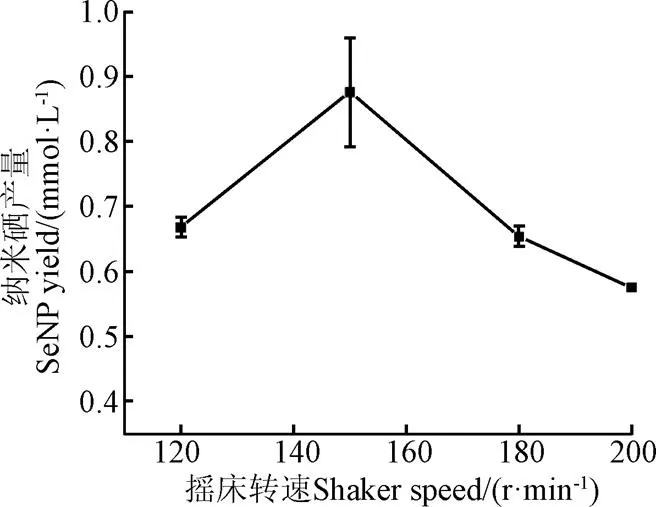
图2 摇床转速对纳米硒产量的影响

图3 枯草芽孢杆菌XP接种量对纳米硒合成的影响
2.2 响应面优化试验
2.2.1 响应面试验设计及其结果
运用Design-Expert 12 软件对发酵体系初始Se (IV) 浓度、摇床转速、菌株XP接种量进行三因素三水平的Box-Behnken试验,结果见表2。
2.2.2 回归方程及方差分析
运用Design-Expert 12 软件中“Analysis”对表2中的数据进行分析。得到初始Se (IV) 浓度()、摇床转速()、接种量()之间的二次回归方程=1.767 1+ 0.516 6–0.091 8+0.130 7+0.049 5+0.001 2+ 0.185 6–0.419 92–0.270 52–0.075 32。由表3中的二次回归模型方差分析结果可知,此回归模型极显著(= 0.000 4<0.01),失拟项不显著(=0.057 1>0.05),说明方程模拟较好,可用此模型对纳米硒产量进行分析与预测;该模型的决定系数2=0.961 2,信噪比13.311 1>4,表明模型可信度较高;模型一次项极显著(<0.01)、显著(<0.05),交互项显著(<0.05),二次项2、2极显著(<0.01)。
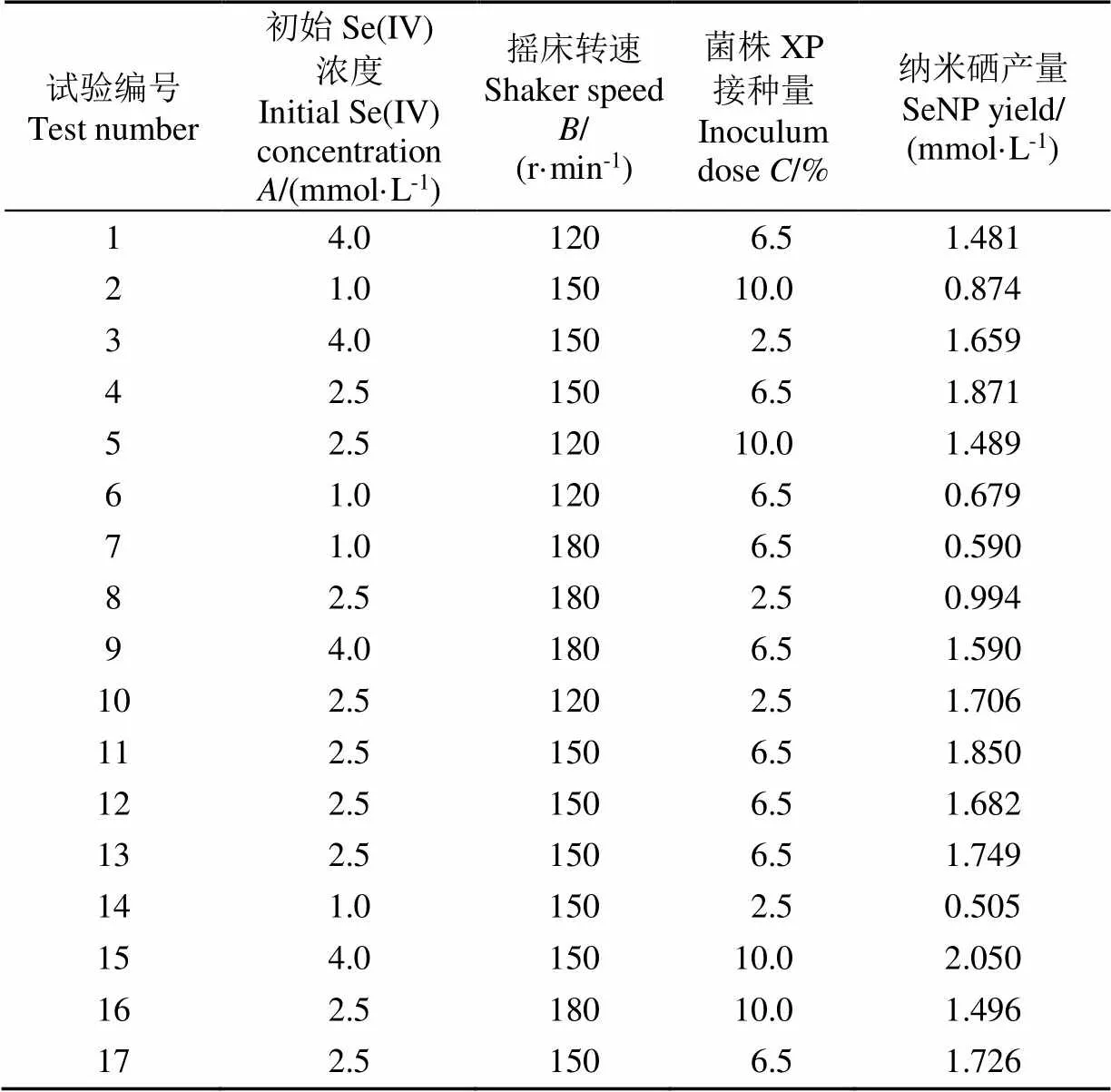
表2 Box-Behnken试验设计及其结果
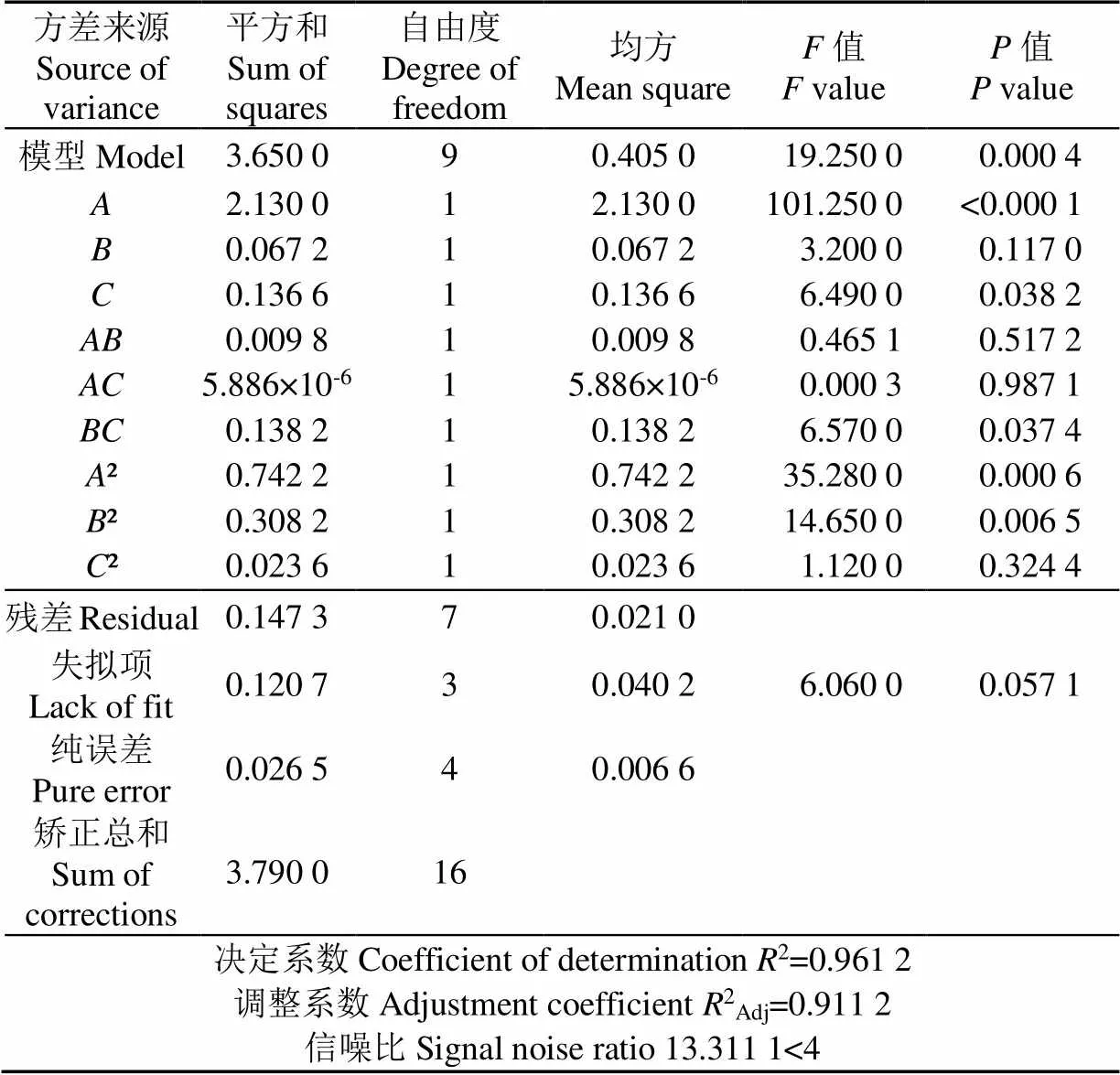
表3 二次回归模型的方差分析
2.2.3 响应面立体图分析
根据回归方程所得的响应面立体图如图4所示,主要反映了初始Se(IV)浓度、摇床转速、XP接种量三者之间的相互作用,通过2.2.2中的回归方程可知,二次项系数为负值,表明方程具有最大值。利用Design-Expert 12.0 分析求解得到模型最大值,最优产纳米硒的发酵条件为:初始Se(IV) 3.4 mmol/L、摇床转速157 r/min、菌株XP接种量9.9%,此时由模型预测的SeNP产量为1.99 mmol/L。

图4 初始Se(IV)浓度、摇床转速与菌株XP接种量交互作用对纳米硒产量影响的响应面图
2.2.4 模型预测纳米硒合成量的试验验证结果
根据上述模型优化的结果,设置菌株XP合成纳米硒的实际发酵条件为:初始Se (IV) 3.4 mmol/L、摇床转速157 r/min、菌株XP接种量9.9%,发酵温度35 ℃,发酵时间为48 h。对模型优化的结果进一步验证,试验设置3个重复,最终结果取平均值。最终,试验结果表明菌株XP发酵液中SeNP的含量为 (1.82±0.25) mmol/L,接近理论预测值,表明上述优化的模型可靠。
2.3 不同浓度生物纳米硒对种子活力的影响
优化条件下发酵产物中菌体和纳米硒的形态如图5a所示(箭头所指为纳米硒颗粒),分离去除细胞得到的纯纳米硒颗粒形态如图5a中的小图所示。通过种子发芽试验,对已去除细胞的纯纳米硒生物活性做进一步分析。如图5b所示,当SeNP处理浓度在0.25~1 mmol/L范围时,油麦菜种子的发芽势和发芽指数呈上升趋势;当SeNP浓度达到1 mmol/L时,发芽势与发芽指数均显著(<0.05)高于无硒对照组(Control),分别为66%和31%。这说明0.25~1 mmol/L SeNP处理对油麦菜种子的萌发具有促进作用,1 mmol/L的SeNP处理最有利于油麦菜种子的萌发。ANTONY等[32]用纳米硒处理硬皮豆()种子,发现适宜浓度的纳米硒可以增强种子的生命力,原因是由于纳米硒处理促进了种子快速萌发所需的H2O和O2的摄入。此外,纳米材料也可以通过降低植物种子内脱落酸的含量,从而提高赤霉素含量,改变种子的休眠周期[33]。通过纳米硒处理后的种子具有较强的抗病能力,可以进一步提升幼苗期耐受环境污染的能力,促进种子的萌发、幼苗的生长以及后续植株的发育[34-36]。

图5 纳米硒扫描电镜图像和不同浓度SeNP对油麦菜种子活性的影响
3 结 论
本研究针对枯草芽孢杆菌菌株XP生物合成纳米硒的发酵条件进行了优化,并对优化条件下发酵产生的纳米硒生物活性做了进一步分析。首先通过单因素试验,解析了“初始Se (IV) 浓度、摇床转速、菌株XP接种量”3个主要因素对纳米硒合成的影响规律,确定了后续试验这3个因素的范围值依次为1~4 mmol/L、120~180 r/min、2.5%~10%。基于此,进行了三因素三水平正交试验,并利用响应面Box-Behnken试验建立了二次多项式回归模型。最终,确定菌株XP合成纳米硒的最佳发酵条件为:初始Se(IV) 3.4 mmol/L、摇床转速157 r/min、菌株XP接种量9.9%。进一步通过实际试验验证优化工艺下纳米硒产量(1.82 mmol/L)比优化前的(1.04 mmol/L)提高了60%以上。在此条件下合成的纳米硒可以有效提升蔬菜种子的活力,促进种子萌发。本研究采用的发酵工艺优化技术大大提升了目前芽孢杆菌产纳米硒的效率,有效解决了微生物合成纳米硒产率低这一瓶颈问题。研究结果不仅为今后生物纳米硒的规模化生产提供了理论参考,而且也为后续耐硒菌株的功能开发、纳米硒的绿色高效合成及其在富硒农作物安全生产中的应用推广提供了有力支撑。
[1] EHUDIN M A, GOLLA U, TRIVEDI D, et al. Therapeutic benefits of selenium in hematological malignancies[J]. International Journal of Molecular Sciences, 2022, 23(14): 7972.
[2] RAYMAN M P. The importance of selenium to human health[J]. Lancet, 2000, 356(9225): 233-41.
[3] WEN C, HE X, ZHANG J, et al. A review on selenium-enriched proteins: Preparation, purification, identification, bioavailability, bioactivities and application[J]. Food and Function 2022, 13(10): 5498-5514.
[4] YIN H, QI Z, LI M, et al. Selenium forms and methods of application differentially modulate plant growth, photosynthesis, stress tolerance, selenium content and speciation inL[J]. Ecotoxicology and Environmental Safety, 2019, 169: 911-917. https://doi.org/10.1016/j.ecoenv.2018.11.080
[5] NANCHARAIAH Y V, LENS P N L. Selenium biomineralization for biotechnological applications[J]. Trends in Biotechnology, 2015, 33(6): 323-330.
[6] BERGER S B, ENCK R C, SCHARFE M E, et al. The application of selenium and its alloys to xerography[M]. Berlin : Gerlach E & Grosse P, 1979, 13: 256-266. https://doi.org/10.1007/ 978-3-642-81398-6_40
[7] DINH Q T, CUI Z, HUANG J, et al. Selenium distribution in the Chinese environment and its relationship with human health: a review[J]. Environment International, 2018, 112: 294-309.
[8] WANG H, ZHANG J, YU H. Elemental selenium at nano size possesses lower toxicity without compromising the fundamental effect on selenoenzymes: comparison with selenomethionine in mice[J]. Free Radical Biology and Medicine, 2007, 42(10): 1524-1533.
[9] BANACH M, PULIT-PROCIAK J. Proecological method for the preparation of metal nanoparticles[J]. Journal of Cleaner Production, 2017, 141: 1030-1039.
[10] BISHT N, PHALSWAL P, KHANNA P K, et al. Selenium nanoparticles: a review on synthesis and biomedical applications[J]. Materials Advances, 2022, 3(3): 1415-1431.
[11] KUMAR A, PRASAD K S. Role of nano-selenium in health and environment[J]. Journal of Biotechnology, 2021, 325: 152-163.
[12] HOSNEDLOVA B, KEPINSKA M, SKALICKOVA S, et al. Nano-selenium and its nanomedicine applications: A critical review[J]. International Journal of Nanomedicine, 2018, 13: 2107-2128.
[13] WADHWANI S A, SHEDBALKAR U U, SINGH R, et al. Biogenic selenium nanoparticles: Current status and future prospects[J]. Applied Microbiology and Biotechnology, 2016, 100(6): 2555-2566.
[14] BORAH S N, GOSWAMI L, SEN S, et al. Selenite bioreduction and biosynthesis of selenium nanoparticles bySP3 isolated from coal mine overburden leachate[J]. Environmental Pollution, 2021, 285: 117519.
[15] SHIRSAT S, KADAM A, NAUSHAD M, et al. Selenium nanostructures: microbial synthesis and applications[J]. RSC Advances, 2015, 5(112): 92799-92811.
[16] FARIQ A, KHAN T, YASMIN A. Microbial synthesis of nanoparticles and their potential applications in biomedicine[J]. Journal of Applied Biomedicine, 2017, 15(4): 241-248.
[17] FESHARAKI P J, NAZARI P, SHAKIBAIE M, et al. Biosynthesis of selenium nanoparticles usingand their recovery by a simple sterilization process[J]. Brazilian Journal of Microbiology, 2010, 41(2): 461-466.
[18] XU X, CHENG W, LIU X, et al. Selenate reduction and selenium enrichment of tea by the endophyticsp. strain WT00C[J]. Current Microbiology, 2020, 77(4): 588-601.
[19] TAN Y, YAO R, WANG R, et al. Reduction of selenite to Se(0) nanoparticles by filamentous bacteriumsp. ES2-5 isolated from a selenium mining soil[J]. Microbial Cell Factories, 2016, 15(1): 157-157.
[20] KORA A J, RASTOGI L. Biomimetic synthesis of selenium nanoparticles byATCC 27853: An approach for conversion of selenite[J]. Journal of Environmental Management, 2016, 181: 231-236.
[21] JIN P, REN B, WANG X, et al. Mechanism of microbial metabolic responses and ecological system conversion under different nitrogen conditions in sewers[J]. Water Research, 2020, 186: 116312.
[22] WELLS M, STOLZ J F. Microbial selenium metabolism: A brief history, biogeochemistry and ecophysiology[J]. FEMS Microbiology Ecology, 2020, 96(12): 209.
[23] 朱燕云,孔祥平,吴娥娇,等. 耐高盐枯草芽孢杆菌 XP 合成球形纳米硒及其抑制草莓病原真菌生物活性[J]. 生物工程学报,2021,37(8):2825-2835.
ZHU Yanyun, KONG Xiangping, WU Ejiao, et al. Biosynthesis of spherical selenium nanoparticles with halophilicsubspeciesstrain XP for inhibition of strawberry pathogens[J]. Chinese Journal of Biotechnology, 2021, 37(8): 2825-2835. (in Chinese with English abstract)
[24] BISWAS K C, BARTON L L, TSUI W L, et al. A novel method for the measurement of elemental selenium produced by bacterial reduction of selenite[J]. Journal of Microbiological Methods, 2011, 86(2): 140-144.
[25] 呼凤兰,周淑萍. 不同植物生长调节剂对冰菜种子萌发的影响[J]. 种子,2021,40(6): 112-115.
HU Fenglan, ZHOU Shuping. Effects of different plant growth regulators on seed germination of[J]. Seeds, 2021, 40(6): 112-115. (in Chinese with English abstract)
[26] 李严,杨婧,吴炜泽,等. 细菌共培养体系合成纳米硒特性[J]. 应用与环境生物学报,2022,28(2):379-386.
LI Yan, YANG Jing, WU Weize, et al. Biosynthesis of selenium nanoparticles by a bacteria co-culture system[J]. Chinese Journal of Applied and Environmental, 2022, 28(2): 379-386. (in Chinese with English abstract)
[27] BORAH S N, GOSWAMI L, SEN S, et al. Selenite bioreduction and biosynthesis of selenium nanoparticles bySP3 isolated from coal mine overburden leachate[J]. Environmental Pollution, 2021, 285:117519.
[28] 任玉文,任媛媛,刘雅祯. 抗植物软腐病枯草芽孢杆菌的高密度发酵优化[J]. 河北科技大学学报,2020,41(5):433-441.
REN Yuwen, REN Yuanyuan, LIU Yazhen. Optimization of high-density fermentation forresistant to plant soft rot[J]. Journal of Hebei University of Science and Technology, 2020, 41(5): 433-441. (in Chinese with English abstract)
[29] 王宏浩,张高瑜,逯梦凡,等. 枯草芽孢杆菌ZX-11培养条件及抑菌性能研究[J]. 中国酿造,2022,41(7):138-143.
WANG Honghao, ZHANG Gaoyu, LU Mengfan, et al. Culture conditions and antibacterial property of Bacillus subtilis ZX-1[J]. China Brewing, 2022, 41(7): 138-143. (in Chinese with English abstract)
[30] 孙雨佳,黄辉,刘长根,等. 植物乳杆菌NCU137培养基成分与培养条件的优化[J/OL]. 中国食品学报,[2022-08-15]. http://kns.cnki.net/kcms/detail/11.4528.TS.20220727.1818.002.html
SUN Yujia, HUANG Hui, LIU Changgen, et al. Optimization of medium composition and culture conditions ofNCU137[J/OL]. Journal of Chinese Institute of Food Science and Technology, [2022-08-15]. http://kns.cnki.net/kcms/detail/11.4528.TS.20220727.1818.002.html (in Chinese with English abstract)
[31] 张羽竹,王冰宜,曾梓敖,等. 植物乳杆菌还原形成不同粒径纳米硒的培养条件及其生物活性分析[J]. 食品科学,2020,41(22):119-126.
ZHANG Yuzhu, WANG Bingyi, ZENG Ziao, et al. Effect of culture conditions on the formation of selenium nanoparticles with different particle sizes by microbial reduction usingand their bioactivity evaluation[J]. Food Science, 2020, 41(22): 119-126. (in Chinese with English abstract)
[32] ANTONY D, YADAV R, KALIMUTHU R. Accumulation of pyto-mediated nano-CeO2and selenium doped CeO2on(horse gram) seed by nano-priming to enhance seedling vigor [J]. Biocatalysis and Agricultural Biotechnology, 2021, 31: 101923.
[33] 薛琳,孙宇彤,盛明悦,等. 纳米材料对作物种子萌发及生长发育的影响[J]. 中国农学通报,2020,36(21):33-39.
XUE Lin, SUN Yutong, SHENG Mingyue, et al. Nanomaterials: effects on seed germination and growth and development of crop[J]. Chinese Agricultural Science Bulletin, 2020, 36(21): 33-39. (in Chinese with English abstract)
[34] NANDINI B, HARIPRASAD P, PRAKASH H S, et al. Trichogenic-selenium nanoparticles enhance disease suppressive ability ofagainst downy mildew disease caused byin pearl millet[J]. Scientific Reports, 2017, 7: 2612. https://doi.org/10.1038/ s41598-017-02737-6
[35] ADHIKARY S, BISWAS B, CHAKRABORTY D, et al. Seed priming with selenium and zinc nanoparticles modifies germination, growth, and yield of direct-seeded rice (L.)[J]. Scientific Reports, 2022, 12(1): 7103.
[36] EL-BADRI A M, BATOOL M, WANG C, et al. Selenium and zinc oxide nanoparticles modulate the molecular and morpho- physiological processes during seed germination ofunder salt stress[J]. Ecotoxicology and Environmental Safety, 2021, 225: 112695. https://doi.org/10.1016/j.ecoenv.2021.112695
Optimization and bio-activity evaluation of nano-selenium biosynthesis bysp.
ZHU Yanyun1,2,3, WANG Xin4, CHEN Danyan5, MA Jingze5, ZHU Ning1,2, JIN Hongmei1,2,4※
(1.210014,; 2.210095,; 3.,210014,; 4.210095,; 5.210038,)
Nano-selenium, as a kind of new functional nanomaterials, has attracted wide attention from all over the word. Compared with inorganic selenium, organic selenium or elemental selenium, nano-selenium has a lot of outstanding features, including high biological activity, low toxicity, and large surface area. Biosynthetic process is regarded as a relatively efficient and environment-friendly pathway to produce nanomaterials. Our previous study found thatsubspeciesstrainXP, as a biocontrol bacteria strain, not only had strong resistance to selenium or salt, but also had strong ability of transform inorganic selenium with higher toxicity into selenium nanoparticle (SeNP) with higher bioactivity and safety. Furthermore, the strain XP has been confirmed to have higher safety and bioactivity compared to those identified strains. But so far, the SeNP yield from selenite reduction by strain XP metabolism is inefficient, which seriously hinders the wide application of this technology. As we all known, fermentation process parameters have great influence on the selenite reduction and SeNP yield. Choosing appropriate parameters can increase in the SeNP production, as well as reduce the cost of SeNP synthesis. Response surface methodology (RSM) has been considered to be an effective method of process parameter optimization. In this study, the synthesis conditions (e.g., selenite concentration, speed of cultivation, dosage of inoculation) were further optimized to improve the biological efficiency of SeNP synthesis by strain XP. The fermentation conditions were optimizedby single factor test, Box-Behnken design (BBD), and response surface methodology. Firstly, the effects of different initial Se (IV) concentrations (1-8 mmol/L) in the culture medium, shaker speeds (120-200 r/min), and the amounts of strain XP inoculation (0.5-10%) on SeNP production were tested by single factor experiment. The production of SeNP increased first and then decreased with gradual increase of initial Se (IV) concentrations. With the shaking speed going up from 120 r/min to 200 r/min, SeNP production also increased first and then decreased. When the inoculum amount of strain XP was between 0.5% and 10%, the yield of SeNP enhanced rapidly along with the increase of inoculum amount. The results showed that each selected experiment parameter had a strong influence on the SeNP production within their scopes: 1-4 mmol/L Se(IV), 120-180 r/min, and 2.5%-10%, respectively. Based on it, the optimal range of each indicator was confirmed. Meanwhile, the above three factors were taken as the influencing factors and SeNP production was used as the response index. Secondly, the Box-Behnken response surface methodology (RSM) was applied to optimize the fermentation conditions of strain XP used for SeNP biosynthesis. Finally, the optimal theoretical value of fermentation condition obtained through response surface experiments were verified by actual experiments. The results indicated that the optimal fermentation condition for SeNP biosynthesis byXP were as follows: initial Se (IV) concentration of 3.4 mmol/L, shaker speed of 157 r/min, and inoculum amount of 9.9%. The SeNP production was 1.82 mmol/L under the optimum condition, which was increased by more than 60% over that under normal condition. Moreover, the seed germination experiment was conducted for confirming the bio-activity of SeNP biosynthesis under optimized culture condition. Application of SeNP could effectively stimulate the Indian lettuce seed vigor and promote the germination process.
bacteria; fermentation; response surface methodology;; nano-selenium; bio-activity
10.11975/j.issn.1002-6819.202208144
S2
A
1002-6819(2023)-01-0269-08
朱燕云,王欣,陈丹艳,等. 芽孢杆菌生物合成纳米硒条件优化及活性评价[J]. 农业工程学报,2023,39(1):269-276.doi:10.11975/j.issn.1002-6819.202208144 http://www.tcsae.org
ZHU Yanyun, WANG Xin, CHEN Danyan, et al. Optimization and bio-activity evaluation of nano-selenium biosynthesis bysp.[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2023, 39(1): 269-276. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.202208144 http://www.tcsae.org
2022-07-28
2022-12-02
国家自然科学基金青年科学基金项目(42107026);江苏省农业科技自主创新资金(CX(20)3078);江苏省重点研发计划(社会发展)项目(BE2022788)
朱燕云,博士,助理研究员,研究方向为纳米硒的生物合成机制以及纳米硒在环境修复方面的应用研究。Email:yyz_leo@126.com
靳红梅,博士,研究员,研究方向为新型污染物的迁移转化及产地投入品污染防控研究。Email:hmjin@jaas.ac.cn

