西瓜蔓枯病菌的分离与鉴定及种质资源抗性评价
徐楚臻,刘金鑫,王喜庆,闫 闻,付永凯,李永刚
(1.东北农业大学植物保护学院 哈尔滨 150030;2.黑龙江省农业科学院园艺分院 哈尔滨 150069)
西瓜[Citrullus lanatus(Thunb.)Matsum.]是葫芦科西瓜属植物,也被称为夏瓜、寒瓜等,原产于非洲,自西域传入中国[1]。西瓜是世界上重要的园艺经济作物,而中国是世界上第一大西瓜生产国,占全球总产量的70%左右[2]。近年来,我国种植业不断发展,西瓜栽培面积日渐扩大,尤其是随着设施瓜类栽培技术的逐渐推广,导致许多瓜类病虫害的大范围流行,降低了西瓜的品质和产量[3]。西瓜蔓枯病(Gummy stem blight)是一种真菌性土传病害,发生范围广,且在整个生育期均可发病,可危害叶片、茎蔓和果实,其中茎蔓受害最为严重。据报道,西瓜蔓枯病发病率一般为15%~25%,严重时在60%~80%,病害流行时可使瓜田减产15%~30%,严重时可达80%,对西瓜的产量和品质以及我国的瓜类产业发展造成极大影响[4-6]。
国际上多认为蔓枯病菌有性态为Didymellabryoniae,无 性 态 为Stagonosporopsis cucurbitacearum[7],也有学者认为在大多蔓枯病菌寄主植物上可同时发现无性孢子与有性子实体,所以划分有性型和无性型意义不大[3]。2015 年,Stewart 等[7]明确,亚隔孢壳属病菌由S.cucurbitacearum、S.caricae和S.citrulli3 个亲缘关系相近的种组成,其中危害最广的病原菌为S.cucurbitacearum。如今国际使用Stagonosporopsisspp.作为蔓枯病菌的学术名称[8-9]。当病原菌侵染幼苗的茎部时,起初呈水渍状斑,迅速向上、下扩展,随后病斑可环绕茎部,迅速导致幼苗死亡。成株多于茎基部与节间发病,初期呈水浸状灰绿色病斑,形状多为棱形、椭圆及条形,后发展成黄白色凹陷病斑,病部龟裂,有时可见分泌形成的黄褐色胶状物。后期病斑表面散生黑色小颗粒,环境湿度高时,病部腐烂,维管束外露,呈现麻丝状[10-11]。
目前,瓜类蔓枯病的防治仍以化学防治为主,但该病害一般于中后期发病较重,西瓜是直接入口食物,化学杀菌剂的使用会对环境和人体健康造成较大危害,同时也极易导致病原菌产生抗药性。因此,选育抗病品种是防治瓜类蔓枯病最经济有效且安全的方法,而抗病种质资源的筛选与鉴定是抗病育种工作的基础。中国抗蔓枯病西瓜品种相对数量较少[3]。笔者对黑龙江省西瓜蔓枯病菌进行了分离与鉴定,并对31 份西瓜种质材料接种蔓枯病以鉴定其抗性,以期筛选出较为优良的资源,为西瓜蔓枯病的抗病育种提供资源、技术方法及理论依据。
1 材料与方法
1.1 材料
1.1.1 供试西瓜品种 供试31 份西瓜种质资源以及致病性测定试验中所选用的西瓜品种龙盛佳星,其中,WG-12、WG-16 和WG-31 为中果型,其他种质为大果型,31 份西瓜种质均由黑龙江省农业科学院园艺分院国家西甜瓜产业技术体系哈尔滨试验站提供。
1.1.2 供试病原菌 于2022 年7-8 月从黑龙江省农业科学院园艺分院试验地发病严重的地块采集症状典型的西瓜蔓枯病病样。
1.2 方法
1.2.1 病原菌的分离与鉴定 采用组织分离法[12],于病健交界处切取组织块,依次用70%乙醇消毒30 s、1.5%次氯酸钠处理5 min,无菌水漂洗3 次后置于无菌滤纸吸干水分。随后将组织块摆放于加入50 μg·mL-1链霉素的PDA 培养基平板上,26 ℃培养2~3 d 后挑取边缘菌丝进行纯化,使用纯化后的菌株进行单孢分离,将所获菌株转移至试管斜面培养,于4 ℃保存备用。通过观察菌落形态和孢子形态特征等方式对获得的单孢株进行初步鉴定。
为了进一步明确病原菌的种类,将所有单孢株于PDA 平板上培养5 d,刮取适量病原菌菌丝,利用真菌基因组DNA 提取试剂盒(上海生工有限公司)提取DNA,采用通用引物细胞核核糖体DNA 内转录间隔区(internal transcribed space,ITS)进行扩增,引物序列见表1。使用PCR 扩增仪(GeneAmpPCRSystem9700)进行扩增,扩增体系(50 μL)为:2×TaqMaster Mix 25 μL,上游引物2 μL,下游引物2 μL,DNA 模板2 μL,ddH2O 19 μL。反应程序为:94 ℃预变性5 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸40 s,30 个循环;72 ℃延伸10 min,4 ℃保存。扩增产物由上海生工有限公司进行纯化及测序,使用Blast 对测序结果进行同源性比对,使用MEGA 7.0 通过Neighbor-joining 法构建ITS 基因的系统发育树,校验参数设置为Bootstrap1000 次重复[13]。

表1 所用引物序列
1.2.2 病原菌的致病性测定 遵循柯赫氏法则[14]进行致病性测定,参照Li 等[15]的方法,将单孢株在25 ℃培养7 d,诱导S.cucurbitacearum产生分生孢子并将其刮到无菌水中,经3 层灭菌纱布过滤,通过血球计数板将滤液稀释为1×106个孢子·mL-1的菌悬液,备用。
选取健康且生长一致的西瓜幼苗(3 片真叶期),采用孢子悬浮液喷雾法接种幼苗至植株饱和状态,对照组用无菌水代替。接种后置于温室(23±3)℃用塑料布保湿培养,每个处理15 株幼苗,3 次重复,采用完全随机区组的试验设计。接种后观察发病情况,待植株发病充分且相对稳定后进行调查,参照张学军等[16]的病害分级标准,并稍作调整。分级如下:0 级,无病斑;1 级,零星的小病斑;3 级,连续的小病斑或大病斑(没有绕茎);5 级,大病斑(绕茎);7 级,茎部失水萎缩但植株并未死亡;9 级,茎部失水萎缩且全株死亡。
病情指数=Σ(各级病株数×各级代表值)/(调査总株数×最高级代表值)×100。
致病力评价指标:强致病力菌株(S),病情指数>60;中等致病力菌株(M),50<病情指数≤60;弱致病力菌株(W),病情指数≤50。
1.2.3 西瓜种质资源的蔓枯病抗性评价 选取31份西瓜育种资源,在温室内利用育苗钵(8 cm×8 cm×5 cm)培养至3 片真叶期,选用1.2.2 中致病力最强的菌株作为接种的目标病原菌,依据1.2.2的方法配制孢子悬浮液,采用喷雾接种法对31 种不同的种质资源进行病原菌接种,对照组采用无菌水代替孢子悬浮液。接种后置于温室(23±3)℃用塑料布保湿培养,每个处理15 株幼苗,3 次重复,采用完全随机区组的试验设计。待植株充分发病且相对稳定后调查,病害分级标准同上。
以病情指数作为评价依据,将不同品种划分为6 个抗性等级[17],分别为:免疫(IM),DI=0;高抗(HR),0
1.3 数据分析
采用SPSS 26.0 软件,通过Duncan 法对试验数据进行单因素方差分析。
2 结果与分析
2.1 西瓜蔓枯病菌的分离与鉴定
2022 年7-8 月在黑龙江省农业科学院园艺分院西瓜试验地中发现较多茎蔓上疑似蔓枯病症状的西瓜植株(图1)。采用组织分离法,从16 个西瓜植株上分离得到16 株形态学一致的真菌分离物,菌落正面呈灰白色,边缘稀疏中间稠密,老化后出现不同层次的同心轮纹,菌落背面可见墨绿色轮圈,打开培养皿时可闻到“灰土味”(图2)。分生孢子呈圆柱形或椭圆形,大小为(2.45~8.02)μm×(1.35~3.60)μm,大部分无隔膜,少数单隔膜(图3-A,箭头1)和双隔膜(图3-A,箭头2)。依据形态学初步鉴定16 株分离物为S.cucurbitacearum。

图1 西瓜蔓枯病田间发病症状

图2 16 株来自西瓜茎部真菌分离物的菌落形态
选取代表性菌株XG2,提取DNA,对内转录间隔区(ITS)进行PCR 扩增,所得片段大小为535 bp。将序列上传 Genebank 数据库,登录号为OP930948,利用Blast 进行同源性比较,显示菌株XG2 与S.cucurbitacearumS2-5(MZ057819.1,ITS)的同源性为99.80%。使用MEGA 7.0 软件进行系统发育树的构建,结果如图3-B 所示,XG2 与S.cucurbitacearumR-J10(GU045303.1)、S.cucurbitacearumLHG-8(KM216012.1)、S.cucurbitacearumS2- 5(MZ057819.1)、S.cucurbitacearumZE(HQ914649.1)的亲缘关系接近,相似性达99.00%,属于同一进化枝,同为S.cucurbitacearum。

图3 来自西瓜茎部真菌分离物代表性菌株XG2 的分生孢子及系统发育树
基于形态学、分子生物学鉴定和系统发育树分析,结果表明,分离得到的代表性菌株XG2 为力强弱分为3 个等级。由表2 可以看出,菌株XG2、XG8、XG26、XG28 为强致病力菌株(S),4 个强致病力菌株的病情指数间均存在显著差异,其中XG2 致病力最强,为96.00%;XG29、XG9、XG1、XG5、XG30、XG10、XG7、XG15 为中等致病力菌株(M),其中XG29 致病力最强,且病情指数仅与XG9、XG1 无显著差异,与其他5 个菌株均存在显著差异;XG11、XG21、XG12、XG13 为弱致病力菌S.cucurbitacearum。

表2 16 株西瓜蔓枯病菌的致病力测定
2.2 分离物的致病力测定
将得到的16 株真菌分离株,采用喷雾法接种至3 片真叶的西瓜幼苗上,发病幼苗均显示出与田间发病株相同的症状,且从病斑上均能再次分离纯化出相同的真菌分离物,根据柯赫氏法则明确了16株真菌分离物均为西瓜蔓枯病菌。依据病情指数分级标准(图4)进行调查,将真菌分离物按照致病株(W),其中XG13 致病力最弱,病情指数为37.33%,与其他3 个菌株间存在显著差异。

图4 西瓜蔓枯病病情指数分级标准
2.3 31份西瓜种质资源的蔓枯病抗性评价
由表3 可以看出,31 份西瓜种质资源对西瓜蔓枯病菌的抗性表现为高感(HS)至抗病(R)水平。抗病 材 料 有5 份(16.13%):PI 189225、WG-15、WG-27、PI 482307、WG-7,其中PI 189225 的抗性最强,病情指数为39.26,5 份抗病材料间病情指数无显著差异;中抗材料有6 份(19.35%):PI 271775、WG-31、龙盛619、WG-23、WG-20、雷首,其中PI 271775 抗性为中抗材料中最强,病情指数为51.11,且与WG-31、龙盛619 间差异不显著,但与WG-23、WG-20、雷首间差异显著;感病材料有10份(32.26%):WG-8、Calhoun Gray、WG-4、WG-14、WG-1、中野2 号、WG-12、WG-21、WG-3、W22-59,其中感病最弱的材料为WG-8,病情指数为64.44,与其他9 份材料间均存在显著差异;高感材料有10份(32.26%):PI 299379、PI 635712、WG-6、WG-30、WG-22、WG-29、WG-26、WG-16、WG-28、WG-24,其中WG-24 病情指数为97.04,感病性最强,与同级别材料中WG-28 差异不显著,与其他8 份材料均差异显著。
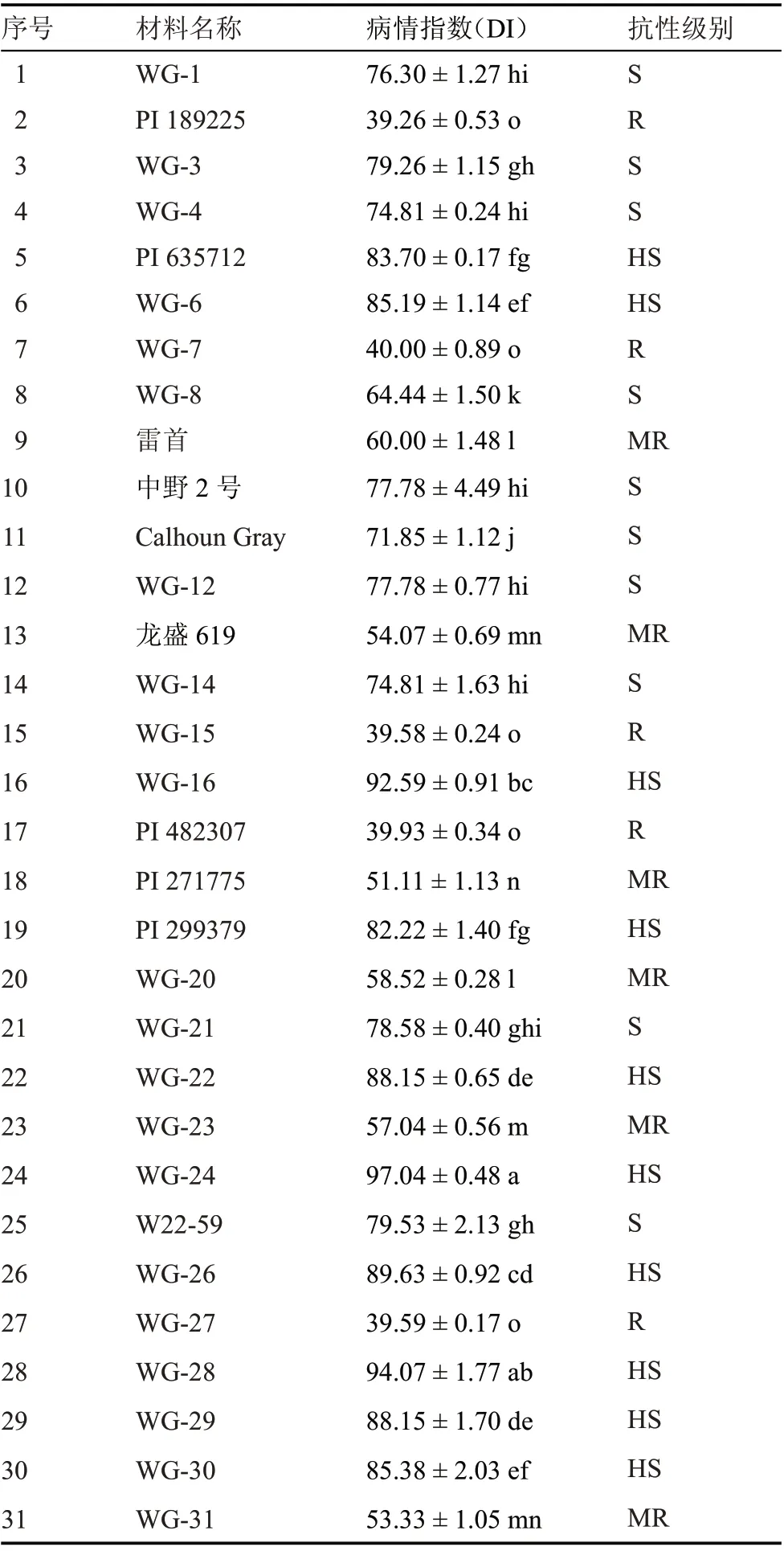
表3 31 份西瓜种质资源抗蔓枯病菌的评价
3 讨论与结论
蔓枯病菌是危害葫芦科作物的重要真菌病原物,主要危害西瓜、甜瓜、黄瓜、苦瓜、丝瓜等作物。近年来随着气候条件的改变,蔓枯病在全国范围内迅速流行起来,发病速度之快导致该病害极难防治,严重影响了我国乃至世界的瓜类产业。西瓜蔓枯病的致病菌为S.cucurbitacearum、S.citrulli和S.caricae3 种[18],因形态学特征相似,难以将它们区分,所以需要借助分子生物学方法来准确鉴定蔓枯致病菌[7-8]。因此,笔者采用真菌鉴定通用引物ITS,结合形态学特征及系统发育树分析最终确定分离得到的西瓜蔓枯病致病菌均为S.cucurbitacearum。
西瓜蔓枯病是世界范围内西瓜栽培中发生最为严重的病害之一,解决该病害最安全、经济有效的途径是选育并栽培抗病品种,抗性评价是抗性种质资源筛选以及创新工作中的关键一环。我国西瓜种植区域广,且各地区气候差异极大,而环境条件突变可导致西瓜品种抗病性的丧失,因此选育适宜在当地栽培种植且综合性状优良的抗蔓枯病品种仍是今后的研究重点与难题[9,19]。
针对西瓜种质资源抗蔓枯病的评价工作开展得较少,徐彦刚等[2]对不同地域来源的80 份西瓜种质资源进行抗亚隔孢壳菌(S.citrulli)鉴定,没有发现免疫资源,筛选到高抗材料2 份,抗性材料19份,中抗材料21 份,感病材料24 份,高感材料14份,抗性材料的占比达到33.34%。宋荣浩等[20]对收集引进的42 份西瓜品种资源进行了大田成株期及室内苗期蔓枯病抗性的人工接种鉴定,没有发现免疫和高抗品种,筛选出了8 个蔓枯病抗性较强同时兼具优良农艺性状的品种材料。
总的说来,西瓜种质资源缺乏对蔓枯病免疫和高抗的材料,但存在一定数量的中等抗性资源。通过对这些资源的抗性评价,为下一步抗病品种的培育及抗病机制的研究等提供了良好的材料和理论依据。笔者选取黑龙江地区分离得到的强致病力菌株XG2 作为接种真菌,对供试种质资源进行西瓜蔓枯病的抗性评价。从31 份西瓜种质资源中筛选到5 份抗病材料和6 份中抗材料,10 份感病材料和10 份高感病材料,抗病与中抗材料的总占比为35.48%,其中抗性最强的西瓜材料为PI 189225。

