腺苷预处理的脑缺血再灌注大鼠脑损伤程度及IL-1β、IL-6、COX-2表达观察
姚静静,谭军
新乡医学院第三临床学院,河南新乡 453003
缺血性脑卒中病情重、预后差,严重影响患者生活质量[1]。早期开展静脉溶栓或血管内介入治疗、恢复脑缺血部位血供是缺血性脑卒中首选的治疗方法[2]。然而缺血再灌注可能引起脑损伤,导致更广泛的神经功能障碍。研究发现,炎症反应是引发脑缺血再灌注损伤的关键因素[3-4]。脑缺血时,缺血核心区脑细胞急性死亡触发炎症因子过度表达和炎症介质释放,大量炎症细胞聚集在脑缺血半暗带产生细胞毒性,导致血脑屏障功能破环,出现脑水肿,此时即便大血管恢复血供,缺血半暗带区的微循环依然“无复流”,继发性神经元损伤不断扩大[4]。炎症因子白细胞介素(IL)1β、IL-6及炎症介质环氧化酶2(COX-2)在炎症反应中发挥重要作用[5-6]。腺苷是天然存在的内源性嘌呤核苷,有助于维持细胞和组织稳态。通常情况下,腺苷在细胞外浓度极低,但在病理状态(如癫痫、缺血、疼痛、炎症和恶性肿瘤等)、代谢需求增加或缺氧的情况下,腺苷水平会显著升高[7]。本课题组前期研究发现,在脑缺血前进行腺苷预处理能够通过抑制炎症因子TNF-α、NF-κB 的表达[8],减轻脑缺血再灌注损伤。2021 年10 月—2022年10月,本研究构建大鼠大脑中动脉缺血再灌注模型,通过观察腺苷预处理的脑缺血再灌注大鼠脑损伤程度及IL-1β、IL-6、COX-2 表达变化,探讨腺苷对脑组织的保护作用机制。
1 材料与方法
1.1 实验动物与主要材料 雄性SPF级SD大鼠85只,体质量250 ~ 300 g,由新乡医学院动物实验中心提供,饲养于SPF 级环境中,自由饮食,室内温度控制在(23 ± 2)℃。腺苷购自北京索莱宝科技有限公司,TUNEL 染色试剂盒购自江苏凯基生物技术股份有限公司,即用型免疫组化试剂盒购自福州市迈新生物技术开发公司,ELISA 试剂盒购自武汉伊莱瑞特生物科技股份有限公司。线栓的制备:将长约5 cm、直径0.26 mm 的尼龙线顶端烧烫为光滑圆球,用硅胶润滑脂包被头端5 ~ 6 mm,距膨大端20 mm处用防水笔做记号,75%乙醇浸泡消毒后,置于肝素生理盐水中备用。
1.2 模型制作与分组处理 将85 只大鼠随机分为空白组10 只及假手术组、模型组、腺苷组各25 只。模型组、腺苷组采用线栓法制备大鼠脑缺血再灌注模型,参考KOIZUMI 等[9]的方法加以改良:用10%水合氯醛3 mL/kg 腹腔注射麻醉,将麻醉成功的大鼠消毒备皮后,颈正中切口切开,分离大鼠右颈总动脉(CCA)、颈外动脉(ECA)和颈内动脉(ICA);结扎CCA 近心端及ECA,在ICA 近分叉处使用微动脉血管夹将血管夹闭,在CCA 近分叉处留置一打好单结但不收紧的丝线;在CCA 的两线间用眼科剪作“V”形微切口,插入膨大的线栓头端,线栓沿CCA 经ICA送入颅内,当头端插入18 ~ 20 mm 遇到轻微阻力感时,停止进线;收紧CCA 远心端的线结,消毒缝合切口,2 h 后,在大鼠麻醉状态下将线栓轻轻向外拔出1.0 cm 左右。术中、术后注意维持大鼠体温。腺苷组造模前连续3 d 腹腔注射1.5 mg/kg 的腺苷溶液2 mL,假手术组和模型组造模前连续3 d 腹腔注射生理盐水2 mL。假手术组术中不插入线栓。空白组不予任何处理。将缺血性脑损伤症状典型(神经功能缺损评分1 ~ 3 分)的大鼠纳入后续实验,将无脑损伤症状和神经功能严重受损(评分为0、4分)的大鼠排除实验。因剔除大鼠致样本量减少时,随机选择同一批次、同等条件下饲养的SD大鼠重新进行模型制备,补足样本量。假手术组、模型组及腺苷组分别于再灌注后6、12、24、48 h 各取5 只大鼠脱臼取脑;空白组不分时间点,随机取5 只大鼠脱臼取脑。将大鼠脑组织沿冠状面切开,将靠近额极的一半缺血半暗带脑皮质层(空白组、假手术组取同部位脑组织)用于ELISA 检测;另一半脑组织置于4%多聚甲醛溶液中固定后,脱水,透明,石蜡包埋,从顶叶端沿冠状面切成厚4 μm的组织切片,用于免疫组化检测。各组剩余5只大鼠进行脑组织TTC染色,计算脑梗死体积。
1.3 神经功能缺损评价 于再灌注后24 h 进行神经功能缺损评分。神经功能正常计0 分,提尾时大鼠左前肢屈曲计1 分,大鼠于光滑平面上行走时左侧转圈计2 分,大鼠静止状态下向左侧倾斜计3 分,大鼠意识减退、肢体无自发活动计4分。
1.4 脑梗死体积测算 各组于再灌注后24 h 各取5 只大鼠取脑,在全脑视交叉及其前后各2 mm 处作冠状切4 刀,将脑标本切成5 片,置于5 mL 含有2% TTC 的磷酸缓冲溶液中,37 ℃避光温孵20 min。用数码相机拍照,之后用眼科镊分离缺血区(苍白色)和非缺血区(红色),采用Image pro plus6.0 软件分析并计算脑梗死面积占比。脑梗死体积占比=缺血区体积/(缺血区体积+非缺血区体积)×100%。
1.5 脑细胞凋亡率测算 制备好的脑石蜡切片脱蜡水化后,滴加100 μL 的Proteinase K 工作液,37 ℃反应30 min,浸入3% H2O2封闭液中室温封闭10 min,每个样本上滴加50 μL 的TdT 酶反应液,37 ℃避光反应60 min,DAPI 复染细胞核。激光共聚焦显微镜下观察,随机选取3 个脑皮质区缺血半暗带在高倍镜(400×)视野下拍照,计算细胞凋亡率。细胞凋亡率=凋亡细胞数/视野内总细胞数×100%。
1.6 病灶脑组织IL-1β、IL-6 检测 将脑组织剪碎,按照1∶9 体质量体积比加入PBS,冰上匀浆,4 ℃ 3 500 r/min 离心10 min,取上清进行检测。在酶标板上每孔加入100 μL 的标准品或待测样品,之后依次加入生物素化抗体工作液、洗涤液、酶结合物工作液、底物溶液、终止液,酶标仪检测450 nm 波长处的光密度值,计算样本浓度。
1.7 病灶脑组织COX-2 检测 将制好的石蜡切片脱蜡,水化,采用HE 染色,按照试剂盒说明书操作。使用相差显微镜在高倍镜(400×)视野下随机选取3个脑皮质区缺血半暗带视野拍照,计算COX-2 表达指数。COX-2 表达指数=COX-2 染色平均阳性细胞数/视野内总细胞数×100%
1.8 统计学方法 采用SPSS26.0 软件进行统计分析。符合正态分布、方差齐性的计量资料以±s表示,多组间比较采用单因素方差分析、两两比较采用LSD 检验,重复测量资料采用重复测量的方差分析;非正态分布的计量资料以M(IQR)表示,采用Mann-WhitneyU检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠神经功能缺陷评分比较 空白组、假手术组、模型组、腺苷组神经功能缺损评分分别为0.0(0.0,0.0)、0.0(0.0,0.0)、3.0(2.0,3.0)、1.0(1.0,2.0)分,模型组、腺苷组神经功能缺损评分高于空白组和假手术组,腺苷组神经功能缺损评分低于模型组(P均<0.05)。
2.2 各组大鼠脑梗死体积占比及脑细胞凋亡率比较 空白组及假手术组大鼠未出现神经功能障碍,脑TTC 染色未见梗死灶。空白组、假手术组、模型组、腺苷组脑梗死体积占比分别为0、0、44.68% ± 2.80%、29.71 ± 2.39%,脑细胞凋亡率分别为4.84% ± 1.87%、6.30% ± 1.48%、51.00% ± 4.70%、32.51% ± 4.86%。模型组、腺苷组大鼠脑梗死体积占比及脑细胞凋亡率高于空白组和假手术组,腺苷组脑梗死体积占比及脑细胞凋亡率低于模型组(P均<0.05)。
2.3 各组大鼠脑组织IL-1β、IL-6 表达比较 模型组、腺苷组脑组织中IL-1β、IL-6 表达在再灌注6、12 h逐渐上升,于再灌注24 h时最高,48 h后开始下降。再灌注后12、24 h,假手术组大鼠脑组织IL-1β表达高于空白组(P均<0.05);模型组、腺苷组再灌注6、12、24、48 h脑组织中IL-1β、IL-6表达高于空白组和假手术组,腺苷组IL-1β、IL-6 表达低于模型组(P均<0.05)。详见表1、表2。
表1 各组大鼠再灌注后不同时点脑组织IL-1β表达比较(pg/mg,± s)

表1 各组大鼠再灌注后不同时点脑组织IL-1β表达比较(pg/mg,± s)
注:与空白组相比,aP<0.05;与假手术组相比,bP<0.01;与模型组相比,cP<0.01。
组别腺苷组模型组假手术组空白组n 5 5 5 5 IL-1β 48 h 95.26 ± 3.49abc 123.46 ± 6.87ab 49.32 ± 4.71 44.94 ± 1.63 6 h 73.32 ± 2.69abc 87.44 ± 5.15ab 47.46 ± 3.26 44.94 ± 1.63 12 h 92.86 ± 4.50abc 108.34 ± 6.67ab 51.42 ± 4.23a 44.94 ± 1.63 24 h 103.54 ± 5.87abc 134.26 ± 6.48ab 51.52 ± 2.55a 44.94 ± 1.63
表2 各组大鼠再灌注后不同时点脑组织IL-6表达比较(pg/mg,± s)
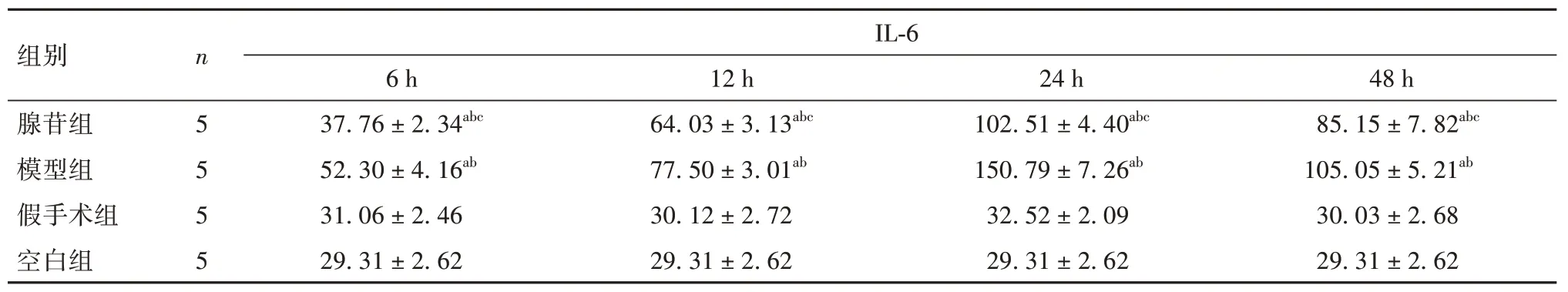
表2 各组大鼠再灌注后不同时点脑组织IL-6表达比较(pg/mg,± s)
注:与空白组相比,aP<0.05;与假手术组相比,bP<0.01;与模型组相比,cP<0.01。
组别腺苷组模型组假手术组空白组n 5 5 5 5 IL-6 48 h 85.15 ± 7.82abc 105.05 ± 5.21ab 30.03 ± 2.68 29.31 ± 2.62 6 h 37.76 ± 2.34abc 52.30 ± 4.16ab 31.06 ± 2.46 29.31 ± 2.62 12 h 64.03 ± 3.13abc 77.50 ± 3.01ab 30.12 ± 2.72 29.31 ± 2.62 24 h 102.51 ± 4.40abc 150.79 ± 7.26ab 32.52 ± 2.09 29.31 ± 2.62
2.4 各组大鼠脑组织中COX-2 表达比较 模型组、腺苷组脑组织中COX-2 表达在再灌注6、12 h 逐渐上升,于再灌注24 h 时最高。再灌注后24 h,假手术组脑组织COX-2 表达高于空白组,差异有统计学意义(P<0.05);模型组、腺苷组再灌注后6、12、24、48 h 脑组织COX-2 表达均高于空白组和假手术组,腺苷组COX-2 表达低于模型组,差异有统计学 意义(P均<0.05)。见表3。
表3 各组大鼠再灌注后不同时点脑组织COX-2表达比较(± s)
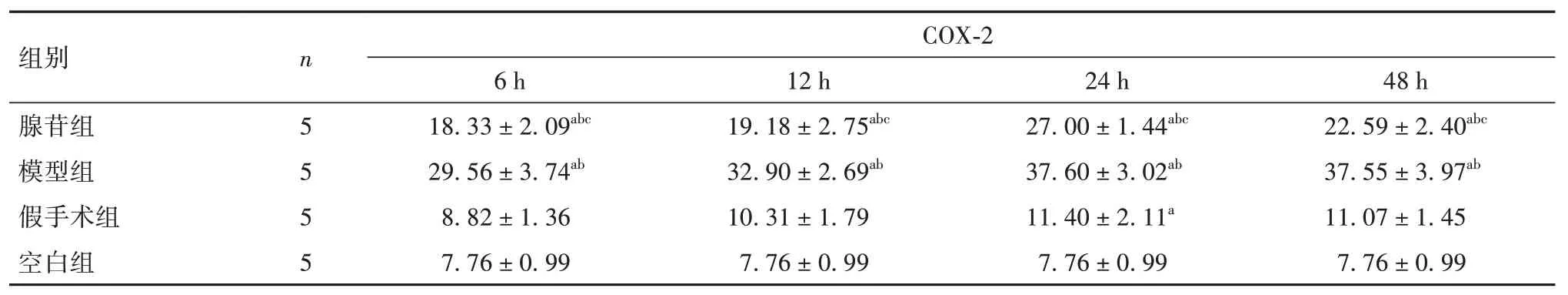
表3 各组大鼠再灌注后不同时点脑组织COX-2表达比较(± s)
注:与空白组相比,aP<0.05;与假手术组相比,bP<0.01;与模型组相比,cP<0.01。
组别腺苷组模型组假手术组空白组n 5 5 5 5 COX-2 48 h 22.59 ± 2.40abc 37.55 ± 3.97ab 11.07 ± 1.45 7.76 ± 0.99 6 h 18.33 ± 2.09abc 29.56 ± 3.74ab 8.82 ± 1.36 7.76 ± 0.99 12 h 19.18 ± 2.75abc 32.90 ± 2.69ab 10.31 ± 1.79 7.76 ± 0.99 24 h 27.00 ± 1.44abc 37.60 ± 3.02ab 11.40 ± 2.11a 7.76 ± 0.99
3 讨论
建立脑缺血再灌注动物模型是研究脑缺血再灌注损伤病理生理机制和治疗方案的重要方法。本研究中,模型组和腺苷组大鼠造模后出现明显的神经功能障碍,症状特点与临床上观察到的大脑中动脉梗死患者相似。脑TTC 染色结果显示,模型组及腺苷组大鼠右侧大脑出现典型的染色缺失区,染色缺失区主要为大脑皮层及纹状体区域,与大脑中动脉支配区域相符。于大鼠脑缺血再灌注24 h 时进行TUNEL 染色发现,模型组和腺苷组缺血半暗带脑细胞凋亡率较假手术组增多,表明在缺血脑组织中,即便在短时间内进行再灌注,缺血半暗带脑细胞仍然发生了不可逆转的损害,脑细胞出现进行性凋亡。
大脑预处理是指预先将大脑暴露于某些亚致死性刺激,诱发较短暂的内源性保护机制,以此来提高大脑对该因素的耐受性或适应性[10]。在大脑预处理中,腺苷是内源性神经保护作用的重要介质。GENG 等[11]研究发现,电针预处理可通过激活腺苷A1受体,保护缺血再灌注损伤的神经元。唐伟等[12]研究认为,针刺预处理的脑保护作用机制与增强内源性腺苷含量密切相关。本研究中,经过腺苷预处理的大鼠在脑缺血再灌注24 h后精神状态明显好于模型组,脑梗死体积缩小,神经细胞凋亡减少,神经功能缺损评分降低,再次验证了腺苷预处理能减轻脑缺血再灌注损伤。
在缺血脑组织重建血流可能会触发一系列直接或间接的神经元凋亡、血脑屏障破坏、脑水肿和出血性转化等继发性损伤,这与缺血脑组织内大量促炎细胞因子释放触发的神经炎症级联反应密切相关[13]。IL-1β和IL-6是最常见的促炎细胞因子,脑缺血时IL-1β、IL-6等促炎性细胞因子过度释放在可加剧脑水肿,促进神经细胞死亡,引发炎症反应[14]。在脑缺血损伤中,活化的神经胶质细胞、白细胞、血管内皮细胞大量表达IL-1β和IL-6,进一步促使趋化因子和黏附分子表达增强,这使得更多炎症细胞在缺血区毛细血管末端发生聚集、黏附,脑血流速度进一步降低,加重脑水肿;募集的炎症细胞还能合成继发性损伤相关的细胞因子如白三烯、前列腺素等,导致毛细血管内皮细胞结构和功能损伤,血脑屏障破坏[15-16]。本研究结果显示,再灌注后12、24 h,假手术组大鼠脑组织IL-1β 表达高于空白组,而在术后48 h,假手术组IL-1β表达接近空白组,表明IL-1β为较为敏感的炎症因子,暴露血管的手术操作引起大鼠体内IL-1β 水平发生一定程度的变化,但在术后48 h 能基本恢复至正常水平。模型组、腺苷组再灌注6、12、24、48 h后脑组织中IL-1β、IL-6表达高于空白组和假手术组,腺苷组IL-1β、IL-6 表达低于模型组,进一步表明IL-1β 与IL-6 参与了脑缺血再灌注损伤,腺苷预处理能在脑缺血再灌注损伤急性期发挥抗炎作用。我们还发现,模型组、腺苷组脑组织中IL-1β、IL-6 表达于再灌注6、12 h 逐渐上升,于再灌注24 h时最高,48 h后开始下降,这为进一步研究抗炎治疗时间窗提供了依据。
COX-2 在脑缺血时被大量诱导表达,是炎症反应的标志,与神经元凋亡及坏死密切相关[17]。在脑缺血缺氧时,神经细胞膜电位失衡,大量Ca2+内流,激活降解神经细胞膜磷脂的磷脂酶A2,大量的花生四烯酸(AA)由神经细胞膜降解而来[18]。COX-2 是AA 经酶促代谢中的关键酶,AA 在COX-2 的催化下分解出大量氧自由基、前列腺素和血栓素等[19],导致血管内皮细胞损伤,血管收缩,血小板活化,炎症反应进展。方晓艳等[20]使用免疫组化染色法观察大鼠脑组织中COX-2 阳性表达情况,发现COX-2 存在于大鼠缺血侧脑额顶叶神经元的胞质中。本实验中,四组大鼠脑皮质层中均出现COX-2 阳性细胞,COX-2 定位于细胞质,与之前报道一致。假手术组再灌注后24 h 脑组织中COX-2 表达高于空白组,提示手术操作可能引起了一定程度的COX-2 表达增强,但在可控范围内。模型组COX-2 表达在缺血半暗带脑皮质区显著增多,于再灌注24 h达到高峰,这与IL-1β、IL-6 表达升高时间相似,推测IL-1β、IL-6表达升高与COX-2 表达上调具有相互促进作用,共同促进炎症反应进展。腺苷预处理后各时间点,大鼠脑组织COX-2 表达均低于模型组,提示腺苷预处理的脑保护作用也与降低脑内COX-2表达有关。
综上所述,腺苷预处理能够减轻脑缺血再灌注后大鼠脑损伤,腺苷可能通过调节IL-1β、IL-6、COX-2表达从而发挥神经保护作用。以上实验结果为临床应用腺苷预处理防治脑缺血再灌注损伤提供了参考。

