响应面优化贝莱斯芽孢杆菌(Bacillus velezensis)菌株YH-18产芽孢培养基和培养条件
石慧敏,叶建仁*,王 焱,陆蓝翔,史纪武
(1.南京林业大学林学院,南方现代林业协同创新中心,江苏 南京 210037;2.上海市林业总站,上海 200072)
农林业生产中常施用大量化肥促植物增产,而过度的化肥使用会导致土壤养分结构失调,微生物活性降低[1-2]。随着人们对生态环境和可持续发展的重视,一些化学药剂在许多地区已被限制使用,无污染高效率的微生物制剂逐渐被重视起来[3]。微生物制剂是指一类含有活性微生物的生物产品,有促生增产、改善生态、抗虫抗病的效果[4]。随着生产研究的深入,微生物制剂的需求量急剧上升,但有效活菌数少、产品储存时间短、发酵成本高等问题,严重限制了微生物制剂的快速发展。芽孢杆菌隶属芽孢杆菌科芽孢杆菌属(Bacillus),是一类能产生内生芽孢的革兰阳性菌。该菌能产生壁厚、含水量低、抗逆性强的休眠芽孢,以此度过不良逆境[5],因而得到广泛开发利用。在现有微生物制剂中,80%以上为芽孢杆菌属制剂。贝莱斯芽孢杆菌(Bacillusvelezensis)是一类有良好应用价值的芽孢杆菌,其分泌的酶、抗生素或抗菌蛋白等活性物质能够广泛抑制植物病原真菌和细菌的活性,减少植物病害;且具有解磷、解钾、固氮,产生植物生长因子等作用,可促进植物养分吸收[6]。Vardharajula等[7]发现贝莱斯芽孢杆菌能够影响作物渗透调节,从而缓解玉米幼苗干旱胁迫负效应,提高植物生长量。Chowdhury等[8]研究发现贝莱斯芽孢杆菌菌株FZB42的生防作用的主要机制可能是其代谢产物对植物诱导抗性的刺激,从而保护植物免受病原菌、病毒和线虫的攻击。Fu等[9]研究发现,生防贝莱斯芽孢杆菌菌株NJN-6能够有效防止香蕉枯萎病,降低尖孢镰刀菌的丰度,且贝莱斯芽孢杆菌还具有安全、抗逆性强、稳定性好、耐储存、复活率高、易定殖等优势[10]。因此,研究开发具有促生抗病作用的贝莱斯芽孢杆菌菌株具有广阔应用前景。
贝莱斯芽孢杆菌菌株YH-18是从樱花枝干中分离出来的1株具有固氮、耐盐、解磷、可提高植物抗性和促生增产的有益微生物,能有效预防樱花、桃树、葡萄等植物的根癌病,防效达80%以上[11-12]。本研究以提高发酵液中的芽孢数和延长储存时间为目标,通过优化菌株YH-18的培养基组分和培养条件,降低发酵生产成本,提高发酵液有效活菌数,为贝莱斯芽孢杆菌的工业化扩大生产和推广应用提供理论依据和技术参考。
1 材料与方法
1.1 培养基与菌株
细菌活化、种子液和单因素基础培养基为LB液体培养基。菌落计数培养基为LB固体培养基。
贝莱斯芽孢杆菌菌株YH-18,前期从樱花枝干中分离筛获,保藏于南京林业大学森林保护实验室。根癌农杆菌(Agrobacteriumtumefaciens)菌株C58,为山东农业大学生命科学学院周传恩教授惠赠。
1.2 菌株活化、种子液的制备及活菌数、芽孢数和芽孢率计数方法
采用平板划线法将根癌农杆菌菌株C58、贝莱斯芽孢杆菌菌株YH-18原菌液接种在LB固体平板上,在28 ℃细菌培养箱中培养24 h得到单菌落。
挑取划线长出的单菌落,转接于装液20 mL的LB液体培养基中,在28 ℃、200 r/min恒温摇床中培养18 h,得到一级种子液。将活化后的一级种子液以1%(体积分数)的接菌量接种于相同条件下培养18 h后得到的菌液作为后续种子液。
活菌计数采用稀释涂布平板法[13]。
芽孢数统计时,先将待测菌液于80 ℃水浴15 min,使菌体失活,再使用稀释涂布平板法,确定发酵液中芽孢数量[14]。
1.3 单因素优化试验
1.3.1 最适培养基组分优化
参照洪鹏等[15]、叶云峰等[16]的研究方法,分别选择几种供试碳源(葡萄糖、蔗糖、可溶性淀粉、玉米粉、牛肉膏、酵母提取物、糖蜜)、氮源[豆粕、豆饼、玉米浆干粉、生豆粉、蛋白胨、胰蛋白胨、大豆蛋白胨、NH4Cl、(NH4)2SO4、尿素]和无机盐[氯化钠(NaCl)、磷酸氢二钠(Na2HPO4·12H2O)、磷酸氢二钾(K2HPO4·3H2O)、碳酸钙(CaCO3)、硫酸镁(MgSO4)、硫酸锌(ZnSO4·7H2O)],等量替换基础培养基中的相应组分。在50 mL三角瓶装液量40%(后同)、接菌量1%(体积分数、后同)、转速200 r/min、28 ℃的条件下,摇培72 h后计数,测定每毫升活菌数和芽孢数并计算芽孢率,确定最佳碳源、氮源和无机盐种类。筛选各组分在不同浓度(质量分数)时对菌株YH-18产孢的影响,以此确定后续添加浓度。
1.3.2 最适培养条件优化
使用优化后的培养基组分,以接菌量1%,初始pH 7.0、装液量40%、温度28 ℃、转速200 r/min为初始(常规)培养条件。分别对发酵温度、初始pH、接菌量、装液量、转速等5个因素的不同设置值依次进行单因素试验,考查YH-18发酵液中的芽孢数和芽孢率的变化情况,以确定后续发酵条件的控制范围。
1.4 响应面优化试验
1.4.1 Plackett-burman(PB)试验
参照胡升等[17]、张丽霞[18]的研究方法,在单因素优化试验结果基础上,利用Design expert 10.0.1制定PB试验方案,每个变量设置1个低水平和1个高水平,每组试验均设3次重复。以菌株YH-18发酵液芽孢数为响应值,筛选出对芽孢数量影响显著的因素。
1.4.2 最陡爬坡试验
根据PB试验结果筛选出影响产孢比较显著的因素,并确定爬坡方向和步长,快速逼近最佳区域,以此得到box-behnken design(BBD)的中心点。
1.4.3 BBD试验
依据PB试验和爬坡试验筛选出的变量及浓度设计BBD试验,使用Design expert 10.0.1软件对试验结果进行分析处理。
1.5 优化发酵液去菌体滤液抑菌能力检测及储存时间检测
将未使用优化配方(LB培养基、初始培养条件)的发酵液和使用优化配方的发酵液5 000 r/min离心10 min,取上清液过细菌滤膜。随后将根癌农杆菌菌株C58种子液以0.2%(体积分数)接种于两种(优化与未优化)分别添加了0.5%(体积分数)发酵液去菌体滤液的LB培养基中,使用全自动微生物生长曲线分析仪,观察48 h内根癌农杆菌的生长情况。
在100 L发酵罐中采用常规发酵,即使用NA培养基(60%体积分数装液量)、2%(体积分数)种子液接种量、200 r/min、pH 7.0~7.2、初始通气量50 L/h、温度28 ℃条件下,发酵24 h后得到未优化配方发酵液。另在100 L发酵罐中采用优化后的培养基和培养条件进行发酵,且保持后续溶氧在50%以上的条件下,待发酵液芽孢率在80%以上后停止发酵,得到优化配方发酵液。将使用未优化配方和优化后配方发酵得到的发酵液同时保存在4 ℃冰箱内,每隔4个月检测其发酵液内活菌数和芽孢数量。

不同小写字母表示同一指标不同处理间差异显著(P<0.05)。下同。Different lower case letters indicate significant differences of the same index among different treatments at 0.05 level.The same below.图1 不同碳氮源及其质量分数对贝莱斯芽孢杆菌菌株YH-18活菌数、芽孢数和芽孢率的影响Fig.1 Effects of different types of carbon and nitrogen sources and concentrations of carbon and nitrogen sources on the number of viable bacteria,spores and spore rate of Bacillus velezensis strain YH-18
1.6 数据分析与处理
利用SPSS 22.0软件进行方差分析和Duncan多重比较(α=0.05),采用Origin 8.5进行制图。
2 结果与分析
2.1 贝莱斯芽孢杆菌菌株YH-18产芽孢培养基成分筛选
2.1.1 不同碳源对菌株YH-18产芽孢的影响
分析可知,在不同碳源中贝莱斯芽孢杆菌菌株YH-18的芽孢数由高到低为葡萄糖>糖蜜>酵母提取物>可溶性淀粉>玉米粉>蔗糖>牛肉膏(图1A)。葡萄糖为碳源时,活菌数和芽孢数最多,为8.89×108和5.44×108cfu/mL,芽孢率达61.25%。因此宜选择葡萄糖作为YH-18产芽孢的最适碳源。由图1B可知,芽孢数和活菌数在不同质量分数葡萄糖处理下数量不同,芽孢数和芽孢率都是当葡萄糖质量分数为1.0%时达到最高值,活菌数和芽孢数达4.96×108和4.78×108cfu/mL,芽孢率为96.37%。因此,选择质量分数1%的葡萄糖作为YH-18产芽孢发酵的后续碳源浓度。
2.1.2 不同氮源对菌株YH-18产芽孢的影响
分析(图1C)可知,菌株YH-18以植物源材料(豆粕、豆饼、玉米浆干粉、生豆粉)为氮源时活菌数和芽孢数普遍较高,以无机氮源[NH4Cl、(NH4)2SO4、尿素]为氮源时活菌数和芽孢数都非常低,以蛋白胨、胰蛋白胨、鱼蛋白胨、大豆蛋白胨等有机氮源作为氮源时活菌数和芽孢数介于两者之间。当以玉米浆干粉作为氮源时,活菌数和芽孢数最多,分别为1.54×109和1.34×109cfu/mL,芽孢率为87.30%。因此,选择玉米浆干粉为菌株YH-18产芽孢的最适发酵培养基氮源。由图1D可知,虽然活菌数总体是随玉米浆干粉质量分数增加呈现逐步升高趋势,但芽孢数则是在玉米浆干粉质量分数为1.0%时,YH-18的芽孢数最多,达1.35×109cfu/mL,此时芽孢率为77.19%。因此,选择1.0%的玉米浆干粉作为YH-18产芽孢发酵培养的后续氮源浓度。
2.1.3 不同无机盐对菌株YH-18产芽孢的影响
经分析可知(图2A),在7种不同的无机盐中,以磷酸氢二钾(K2HPO4·3H2O)、碳酸钙(CaCO3)或硫酸镁(MgSO4)为无机盐时,菌株YH-18产芽孢数相对较多,分别是1.02×109、1.12×109和1.00×109cfu/mL,芽孢率分别为89.20%、51.42%和85.90%。虽然硫酸锰(MnSO4)的芽孢数也较多,但由于锰离子易造成土壤污染,故不选择硫酸锰作为后续无机盐。考虑到不同无机盐种类可以提供不同的生长和产孢作用,因此选择磷酸氢二钾、碳酸钙、硫酸镁三者混合使用作为供试菌株发酵培养基的无机盐。由图2B-2D可知,当碳酸钙质量分数为0.4%时,芽孢数最多,活菌数和芽孢数分别为1.11×109和1.11×109cfu/mL,芽孢率为99.85%。当硫酸镁质量分数为0.2%时,芽孢数最多,活菌数和芽孢数分别为2.10×109和1.46×109cfu/mL,芽孢率为69.18%。当磷酸氢二钾质量分数为0.4%时,芽孢数最多,活菌数和芽孢数分别为1.60×109和1.50×109cfu/mL,芽孢率为93.34%。因此,选择0.4%碳酸钙、0.2%硫酸镁、0.4%磷酸氢二钾为后续培养基中无机盐添加量。

图2 不同种类无机盐及其质量分数对贝莱斯芽孢杆菌菌株YH-18活菌数、芽孢数和芽孢率的影响Fig.2 Effects of different types of inorganic salts and different concentrations of inorganic salts on the number of viable bacteria,spores and spore rate of Bacillus velezensis strain YH-18
2.2 贝莱斯芽孢杆菌菌株YH-18产芽孢的培养条件筛选
由培养转速筛选结果(图3A)可知,当转速为200 r/min时,菌体数和芽孢数最高,分别为1.53×109和1.16×109cfu/mL,芽孢率为75.54%,活菌数和芽孢数均显著优于其他处理。因此,选择菌株YH-18产芽孢发酵后续培养转速为200 r/min。
由装液量筛选结果(图3B)可知,当装液量为20%时,虽然芽孢率可达100%,但菌体数和芽孢数都较低。当装液量为40%时,菌体数和芽孢数最高,分别为1.80×109和1.30×109cfu/mL,芽孢率为72.52%。因此,选择菌株YH-18产芽孢发酵的后续培养装液量为40%。
由初始pH的筛选结果(图3C)可知,活菌数和芽孢数在pH为6.4~7.9范围比较合适,其中当pH为7.3时,菌体数和芽孢数达最高,分别为1.83×109和1.52×109cfu/mL,芽孢率为83.21%。较低和较高pH都不太适合大量活菌和芽孢产生。因此选择菌株YH-18产芽孢后续培养的pH为7.3。
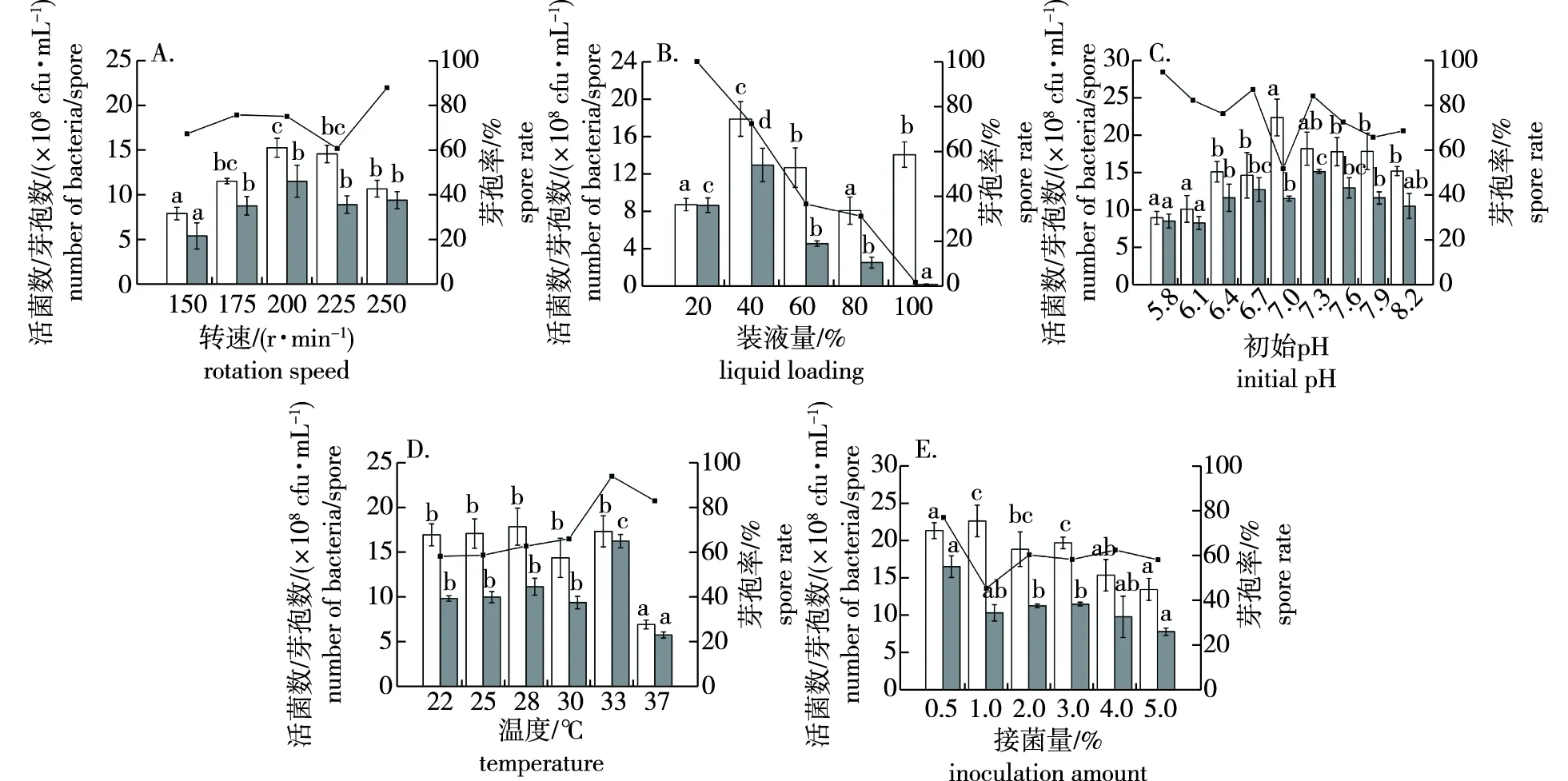
图3 不同培养条件对贝莱斯芽孢杆菌菌株YH-18活菌数、芽孢数和芽孢率的影响Fig.3 Effects of different incubation conditions on the number of viable bacteria,spores and spore rate of Bacillus velezensis strain YH-18
由培养温度筛选结果(图3D)可知,菌株YH-18在22~37 ℃温度范围均可生长繁殖,菌体数、产芽孢数和芽孢率在不同温度下有明显变化。当培养温度为33 ℃时,活菌数和芽孢数均达到最高值,分别为1.73×109和1.62×109cfu/mL,芽孢率为93.74%。因此,选择YH-18产芽孢发酵的后续培养温度为33 ℃。
由接菌量筛选结果(图3E)可知,当接菌量为0.5%时,活菌数和芽孢数最高,分别为2.14×109和1.65×109cfu/mL,芽孢率为77.36%。当接菌量超过0.5%时,芽孢数降低。因此,选择菌株YH-18产芽孢发酵的后续培养接菌量为0.5%。
2.3 贝莱斯芽孢杆菌YH-18产芽孢培养的响应面优化
2.3.1 PB试验
运用Design expert 10.0.1软件设计PB试验,结果与分析见表1。


表1 PB试验各因素方差分析Table 1 Analysis of variance for each factor in the PB trial
2.3.2 最陡爬坡试验
由PB试验可知,氮源(玉米浆干粉)和装液量具有负效应,在爬坡试验中应逐渐减小,接菌量具有正效应,应逐渐增大。经分析可知(表2),菌株YH-18发酵液芽孢数最高值出现在试验4,应选择试验4的条件作为响应面试验因素水平的中心点,即0.8%质量分数玉米浆干粉、1.1%接菌量、32%装液量。

表2 最陡爬坡试验Table 2 Steepest climb test
2.3.3 BBD试验
将最陡爬坡试验中的氮源质量分数、接菌量和装液量分别标记为A、B、C,BBD试验结果与分析见表3。模型R2=90.68%,R2adj=78.70%,P<0.01,失拟项P>0.05,说明该模型可靠,可用于分析与预测响应值。A、A2、B2、C2对YH-18发酵产芽孢有极显著影响(P<0.01),C、A×C有一定影响但不显著(P>0.05)。通过Design expert 10.0.1软件分析试验结果,并拟合出响应值与试验因子的二次回归方程为:芽孢数=-83.311 50+50.185 25A+34.943 63B+2.935 37C-0.143 75AC-0.44500AB-0.034 53BC-21.819 69A2-15.091 56B2-0.040 12C2。
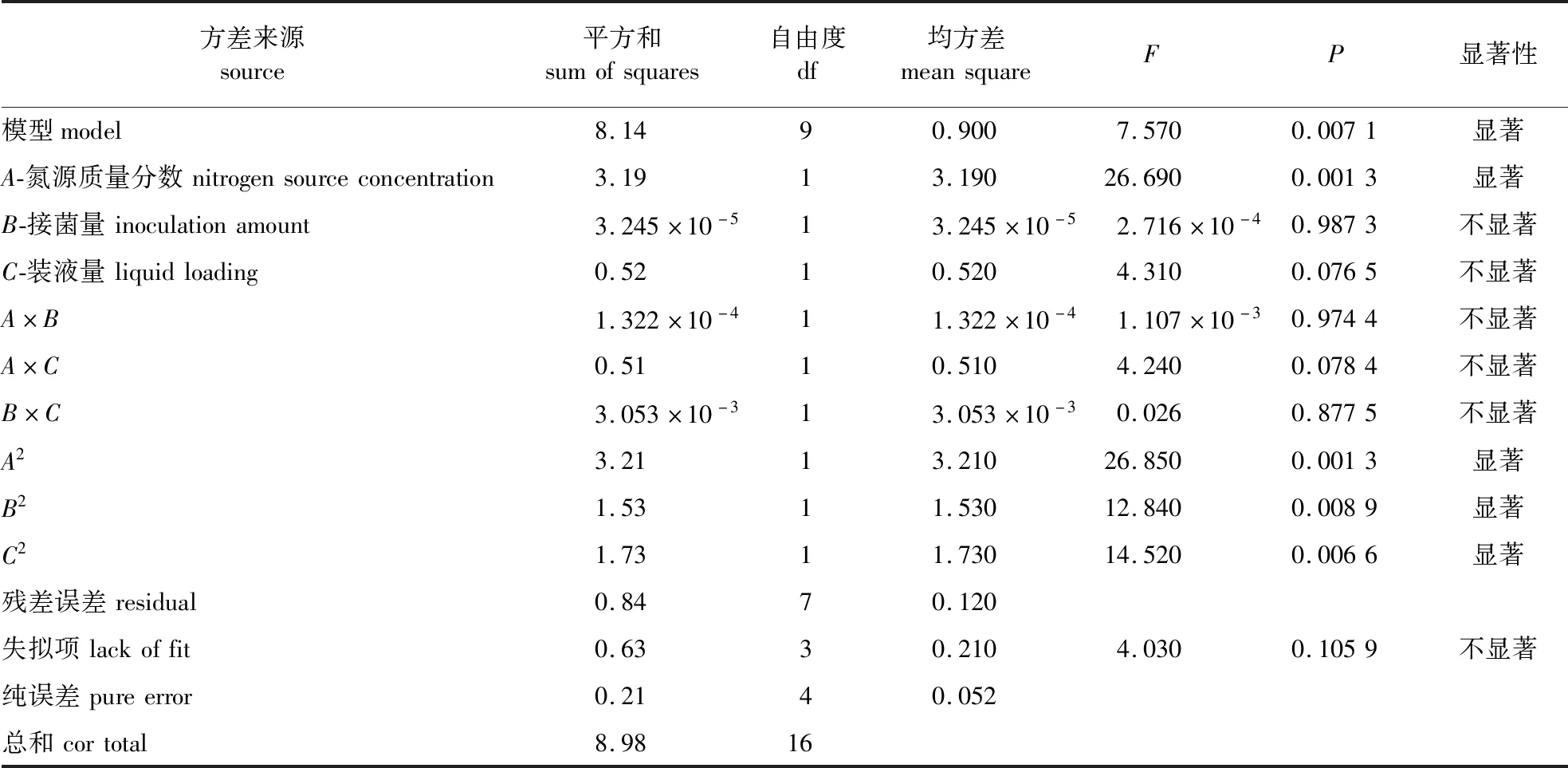
表3 BBD方差分析结果Table 3 BBD ANOVA results
根据回归方程绘制等高线图和3D曲面图,结果见图4。结果表明,氮源质量分数和装液量交互效应的等高线图呈椭圆形,3D曲面图陡峭,交互作用最强;接菌量和装液量交互效应的等高线图呈圆形,3D曲面图平稳,交互作用相对较弱。
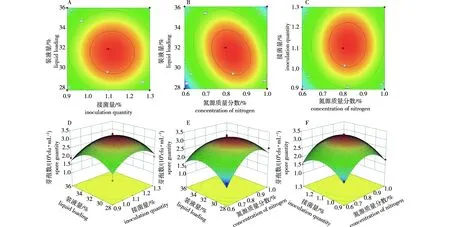
A.装液量与接菌量对菌株YH-18 芽孢产量交互效应等高线图contour plot of the interaction effect of liquid loading and inoculation amount on spore yield of strain YH-18;B.装液量与氮源(玉米浆干粉)质量分数对菌株YH-18 芽孢产量交互效应等高线图contour plot of the interaction effect of liquid loading and nitrogen (dried corn steep liquor powder) concentration on spore yield of strain YH-18;C.接菌量与氮源玉米浆干粉质量分数对菌株YH-18 芽孢产量交互效应等高线图contour plot of the interaction effect of inoculation amount and nitrogen (dried corn steep liquor powder) concentration on spore yield of strain YH-18;D.装液量与接菌量对菌株YH-18 芽孢产量交互效应3D曲面图 3D curred surface graph of the interaction effect of liquid loading and inoculation amount on spore yield of strain YH-18;E.装液量与氮源(玉米浆干粉)质量分数对菌株YH-18 芽孢产量交互效应3D曲面图 3D curred surface graph of the interaction effect of liquid loading and nitrogen (dried corn steep liquor powder) concentration on spore yield of strain YH-18;F.接菌量与氮源(玉米浆干粉)质量分数对 YH-18 芽孢产量交互效应3D曲面图 surface of the interaction effect of inoculation amount and nitrogen (dried corn steep liquor powder) concentration on spore yield of strain YH-18图4 影响贝莱斯芽孢杆菌菌株YH-18芽孢数的相应等高线图和曲面图Fig.4 Corresponding contour and 3D surface affecting spore quantity of Bacillus velezensis strain YH-18
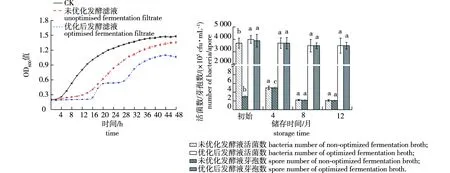
不同小写字母表示同一处理在不同时间上差异显著(P<0.05)。Different lowercase letters at the same treatments indicate significant difference among different times at 0.05 level.图5 优化前后发酵滤液抑制根癌农杆菌菌株C58生长情况(A)及优化前后发酵液储存时间情况(B)Fig.5 Inhibition of growth of Agrobacterium tumefaciens strain C58 by fermentation filtrate before and after optimization(A) and shelf life of fermentation broth before and after optimization(B)
2.4 培养基质和条件优化前后相应产生的发酵液抑菌能力和储存时间比较
使用优化后的培养基和培养条件发酵产生的发酵液对根癌农杆菌菌株C58生长的抑制作用明显比优化前发酵产生的发酵液去菌体滤液更强(图5)。
由图5可知,发酵液能在前16 h明显防止根癌农杆菌菌株C58生长,且优化后的发酵液去菌体滤液在48 h后仍为较好的抑制效果。将优化后的发酵液和平时使用NA发酵24 h的发酵液同时保藏在4 ℃条件下,优化后的发酵液储存时间明显更长,且在1年后活菌数和芽孢数仍为初始发酵液的87.5%和89.74%。而未优化的发酵液在第4个月时活菌数就急剧减少,仅为初始菌体的0.06%,芽孢数反而有所增加,但仅为2.08×105cfu/mL,远低于初始活菌数。
3 讨 论
不同菌株对于培养基营养成分的偏好各不相同[19]。本试验表明贝莱斯芽孢杆菌菌株YH-18偏向植源性氮源,这与王继雯等[20]优化巨大芽孢杆菌(Bacillusmegatherium)菌株C2氮源时的结果一致。认为可能是由于菌株YH-18分离自樱花枝干[21],对植源性氮源的敏感程度较高,而无机氮源不利于菌株YH-18的生长和产孢;也可能由于植物源的氮源营养成分远高于普通有机氮源和无机氮源,在质量分数1.0%时更适合菌株YH-18的生长和产孢。因此,以葡萄糖作为速效碳源,以农副产品玉米浆干粉为氮源有利于菌体的快速生长,而高密度细胞培养是合理提高芽孢产量的有效途径之一。此外,培养基中的C/N对菌体的生长和代谢也具有重要影响[22-23],本试验对碳氮源浓度进行筛选时,发现较低或较高的碳氮源浓度都会减少芽孢数量,且过高的氮源浓度还会导致产孢缓慢。说明培养基养分不足不利于菌体和芽孢的大量繁殖,而过高的葡萄糖或玉米浆干粉浓度不仅造成材料的浪费,也会使菌体衰老自溶,造成不产孢或产孢缓慢现象,发酵液芽孢数量低[24]。这些结果对于后续发酵罐扩大性生产的培养投料量确定和补料量具有重要参考作用。
适宜的培养条件有利于菌体的快速繁殖和产孢。菌株YH-18产孢需要较高转速和较低装液量,说明YH-18是1株耗氧能力较强的菌株,可以通过在对数生长期和芽孢形成期采用较大通气量和较高转速来提高芽孢形成率[25]。周向平等[26]研究报道贝莱斯芽孢杆菌菌株Xe01最佳pH为7.0,最适温度为30 ℃。王朝恩等[27]发现短小芽孢杆菌(Bacilluspumilus)菌株HR10在温度37 ℃、pH 7.0条件下生物量最多。菌株YH-18与大部分研究芽孢杆菌的培养温度、转速相近。有研究表明,接菌量过多会导致前期生长快,后期营养不足而影响最终菌体量,过少则会造成发酵延滞,发酵周期长[28]。枯草芽孢杆菌(Bacillussubtilis)菌株HG-15的最佳接种量为10%[29],枯草芽孢杆菌菌株SR096最适接菌量为3%[30],解淀粉芽孢杆菌(Bacillusamyloliquefaciens)菌株CQN-2最适接菌量为3%[31]。但在本研究中,菌株YH-18的最适接菌量相较于其他芽孢杆菌最适接菌量少,可能会导致发酵时间延长。所以,在后续发酵罐发酵中可适当增加接菌量,缩短发酵时间,节约用电成本。不同培养条件的筛选表明,不同菌株之间最适培养条件存在较大差异,开发优良菌株时需对特定菌株进行培养条件优化。微生物制剂除了严格要求发酵液中的菌体数量,菌株产生的抑菌物质也会严重影响菌剂的作用效果[32]。优化后配方发酵液抑菌能力增强,进一步说明了优化配方的使用可行性。使用优化配方的发酵液储存时间明显优于未优化发酵液,这主要是由于未优化配方的发酵液芽孢率低,菌体到后期衰老死亡,而优化后配方芽孢率高,抗逆性的芽孢更耐存储。这些优良条件为菌株YH-18液体制剂推广应用奠定了基础。

