干旱胁迫对大鳞副泥鳅免疫指标的影响
黄 梅,吴梦晓,商泽昊,尤 昆,米 笛,王光毅,张云龙
(安徽农业大学动物科技学院,合肥 230036)
环境胁迫会打破水生动物与环境之间的平衡与协调,影响机体正常的生理生化和免疫功能,导致水生动物生长减慢[1]、免疫抑制[2]、氧化应激[3,4]和细胞凋亡[5]等生理损伤,甚至可能会对水生动物产生致死性的伤害。免疫系统是鱼类维持机体平衡的重要防御机制,由于鱼类的特异性免疫系统还不完善,所以当受到外界应激源的刺激时,鱼体组织常会分泌抗菌蛋白(如溶菌酶、补体蛋白)、抗体(如免疫球蛋白)、免疫细胞因子(如肿瘤坏死因子、白细胞介素)和热休克蛋白等非特异性免疫因子,以减轻应激造成的机体损害[6]。
鱼类在现代集约化养殖、拉网和运输过程中常受到各种理化应激,对多数鱼类而言,空气暴露是一种极端的干旱环境胁迫。然而,泥鳅(Misgurnusanguillicaudatus)[7]、黄鳝(Monopterusalbus)[8]和大鳞副泥鳅(Paramisgurnusdabryanus)[9]等气呼吸型鱼类常养殖于水量较少的稻田中,易遭遇周期性干旱[10];在成鱼捕捞过程中,养殖户常采用排干池水的方法捕捞。此外,为了降低成本,商业化的气呼吸型鱼类在短途运输中广泛采用半干法,仅泼洒少量水保持皮肤湿润,这些都意味着气呼吸型鱼类经常会遭遇干旱胁迫。作为一种环境因子,干旱会对鱼类先天免疫系统造成影响,并增加机体对病原的易感性;以往关于鱼类在干旱条件下的研究大多集中在抗氧化方面[11-13];关于免疫反应,特别是免疫相关指标的变化方面的研究仍然十分匮乏。
大鳞副泥鳅(P.dabryanus)是东亚地区重要的水产养殖品种之一。据《2021中国渔业统计年鉴》统计,2020年我国泥鳅(包括泥鳅和大鳞副泥鳅)的养殖产量达36.74万吨[14]。作为一种典型的气呼吸型鱼类,大鳞副泥鳅除了可以用鳃呼吸以外,还能在缺氧条件下通过皮肤和肠道进行呼吸,因此比其他鱼类具备更高的耐旱能力[15]。鱼类,特别是气呼吸型鱼类在养殖与运输过程中常不可避免会遭遇短时干旱胁迫,但干旱条件下的鱼类的生理机理和免疫反应仍知之甚少。本研究以空气暴露模拟大鳞副泥鳅所经历的干旱胁迫,检测其血清与肝脏免疫因子的变化趋势,旨在研究干旱胁迫对鱼类免疫相关因子的影响与适应机制,为鱼类无水运输和养殖策略提供基础资料。
1 材料和方法
1.1 实验鱼类与材料
实验用大鳞副泥鳅[(20.1±3.2) g,(15.3±2.9) cm)]购于合肥的水产市场。实验开始前将鱼转移至实验室中,暂养于5个60 L的养殖箱中,每个暂养箱盛水50 L,养殖30~50尾,放置3个充气石。养殖用水是经过曝气24 h以上的自来水,水温保持在(23.0±1.0) ℃。在暂养7 d期间,每日换水30%,投喂2次配合饲料(粗蛋白35%,粗脂肪7%)。实验前24 h停止投喂,且实验期间不投喂。
总蛋白(TP)测定试剂盒(A045-2-2)、白蛋白(ALB)测定试剂盒(A028-1-1)、溶菌酶(LZM)测试盒(A050-1-1)、免疫球蛋白M(IgM)测试盒(H109-1-1)、补体C3测试盒(H186-1-2)、补体C4测试盒(H186-2-2)、热休克蛋白70(HSP70)测试盒(H264-2)、热休克蛋白90(HSP90)测试盒(H264-3)、肿瘤坏死因子-α(TNF-α)测试盒(H052-1)、白介素-1β(IL-1β)测试盒(H002)、白介素-6(IL-6)测试盒(H007-1-1)、白介素-12(IL-12)测试盒(H010),均购于南京建成生物工程研究所。
1.2 空气暴露实验
随机挑选4尾规格相近的鱼放置于圆形塑料盆(直径35.5 cm,高度15.5 cm)中,盆中加一层很薄的蒸馏水(100 mL),保持室内温度(25.0±1.0) ℃(空调控温),实验时间为12、24、48、72和96 h。盆中的蒸馏水每8 h完全更换一次,以确保整个暴露期间的恒定湿度。以实验开始时的鱼(0 h)作为基础水平的指标,以养殖在10 L曝气自来水中的鱼作为对照组。每个组(空气暴露组和对照组)每个暴露时间点各设置3组平行,每个平行4尾实验鱼,共72尾。
1.3 样品采集
每个暴露时间(12、24、48、72和96 h)结束后进行样品采集,使用MS-222对实验鱼进行麻醉,并通过尾静脉迅速取血,然后在4 ℃下,4 000g下离心30 min,以收集血清。解剖收集肝脏,以玻璃匀浆器匀浆后,按照体积质量比9 ∶1加入预冷(4 ℃)的生理盐水,并在4 ℃下,10 000g离心20 min,得到上清液用于后续的生化分析。所有样品均由平行组的4尾实验鱼合并而来,并保存于-80 ℃的冰箱中待测。
1.4 生化分析
根据ROBINSON等[16]的方法,使用牛血清白蛋白作为标准品,对血清中的总蛋白含量进行定量。以牛血清白蛋白作为标准品,采用考马斯亮蓝法测定肝脏样品中的可溶性蛋白含量[17]。通过溴甲酚绿方法测定血清白蛋白水平[18]。血清球蛋白浓度按下式计算:球蛋白=总蛋白-白蛋白。溶菌酶活性[19]通过比浊法测定。免疫球蛋白M(IgM)、补体C3(C3)、补体C4(C4)、热休克蛋白70(HSP70)、热休克蛋白90(HSP90)、肿瘤坏死因子α(TNF-α)、白细胞介素1β(IL-1β)、白细胞介素6(IL-6)和白细胞介素12(IL-12)通过酶联免疫吸附(ELISA)方法测定。
1.5 数据分析
所有数据均以平均值±标准误表示。先进行正态性和Levene′s方差同质性检验,随后进行单因素方差分析(ANOVA)和LSD多重比较检测结果的显著性水平,显著性水平α=0.05。t检验分析比较同一时间的空气暴露和对照之间的差异显著性。使用SPSS软件(SPSS Inc.Chicago,IL,USA)进行统计分析。
2 结果
空气暴露后大鳞副泥鳅血清总蛋白、白蛋白和球蛋白含量都呈先增后降的趋势,并均在暴露48 h时达到峰值(图1)。血清白蛋白含量增加速度较快,暴露24 h和48 h时显著高于对照组(图1B)。血清总蛋白(图1A)和球蛋白(图1C)含量在48 h显著高于对照组。血清IgM实验期间始终与对照组差异不显著(图1D)。

图1 空气暴露对大鳞副泥鳅血清总蛋白(A)、白蛋白(B)、球蛋白(C)和免疫球蛋白M(D)含量的影响
空气暴露对大鳞副泥鳅血清与肝脏溶菌酶活性、IgM、补体C3和C4含量的影响见图2、图3。实验期间血清与肝脏溶菌酶活性均无显著性变化(图2A,图3A)。血清C3和C4含量于暴露48 h时达到峰值;其中,补体C3变化幅度较小,与对照组始终差异不显著(图2B)。与补体C3相比,C4增殖速度更快,48 h与对照组差异显著(图2C)。与对照组相比,空气暴露12 h肝脏中IgM、C3和C4含量就出现了显著的上升,并在24 h迅速下降。在整个暴露期间,肝脏与血清当中补体C3和C4含量的变化呈相反的趋势,当肝脏补体C3和C4在实验48 h达到最低值时,血清中的补体C3和C4上升至最高值。
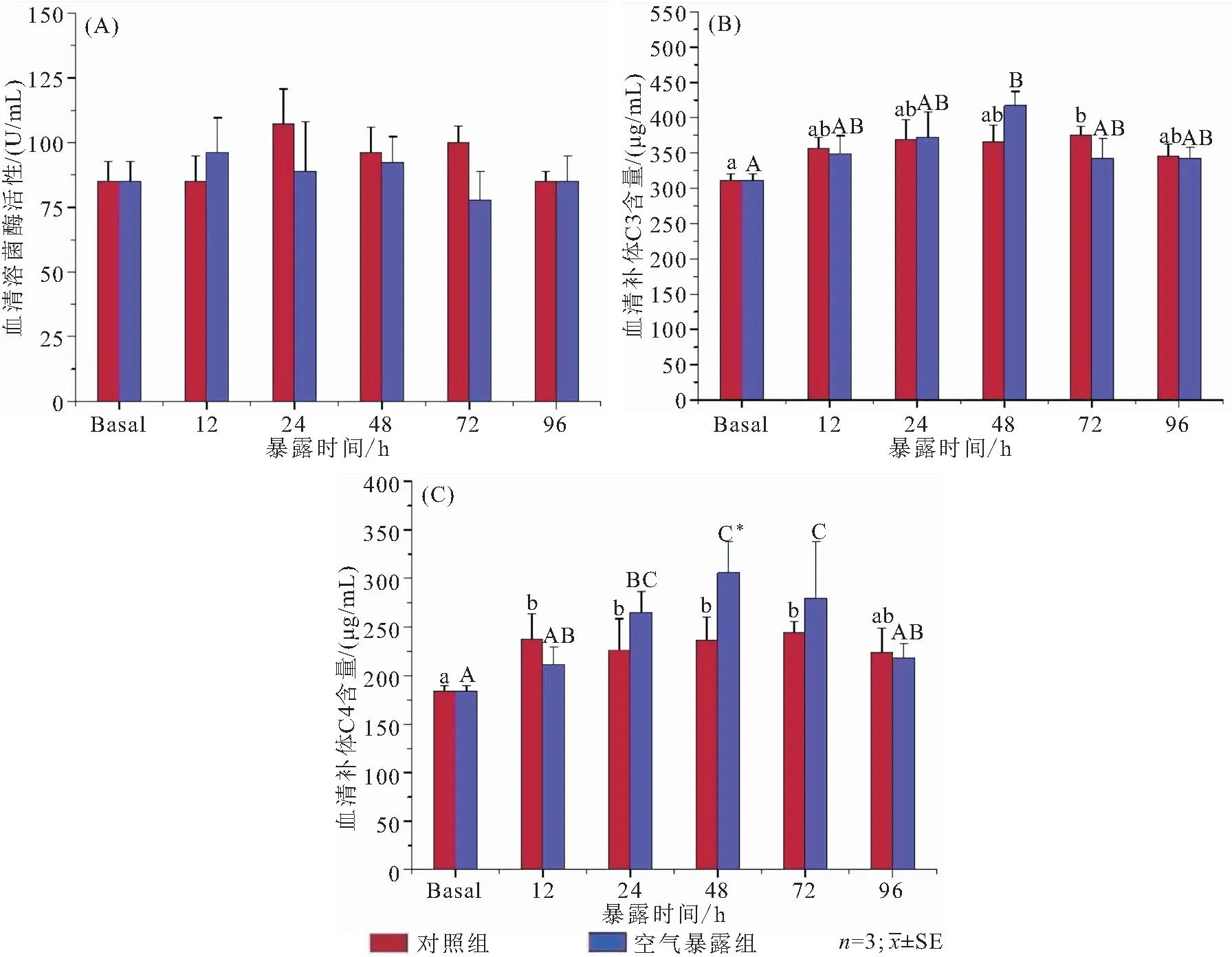
图2 空气暴露对大鳞副泥鳅血清总溶菌酶(A)活性、补体C3(B)和补体C4(C)含量的影响
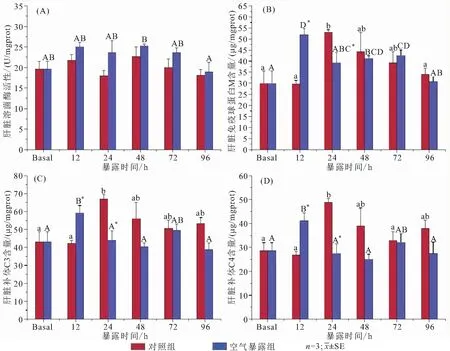
图3 空气暴露对大鳞副泥鳅肝脏溶菌酶(A)活性、IgM(B)、补体C3(C)和补体C4(D)含量的影响
比较空气暴露后大鳞副泥鳅血清和肝脏HSP70和HSP90含量的变化(图4、图5)。空气暴露48 h,血清HSP70和HSP90显著升高到最大值,分别达到基础水平的3.3倍和2.0倍。48 h后两者都开始下降,但血清HSP70回归速度较HSP90慢。相较于血清,大鳞副泥鳅肝脏HSP70和HSP90含量变化更加迅速,仅空气暴露12 h就达到了峰值,且显著高于对照组。在实验中后期(24~96 h),血清HSP70和HSP90呈高于对照组的趋势,而肝脏HSP70和HSP90则低于对照组。
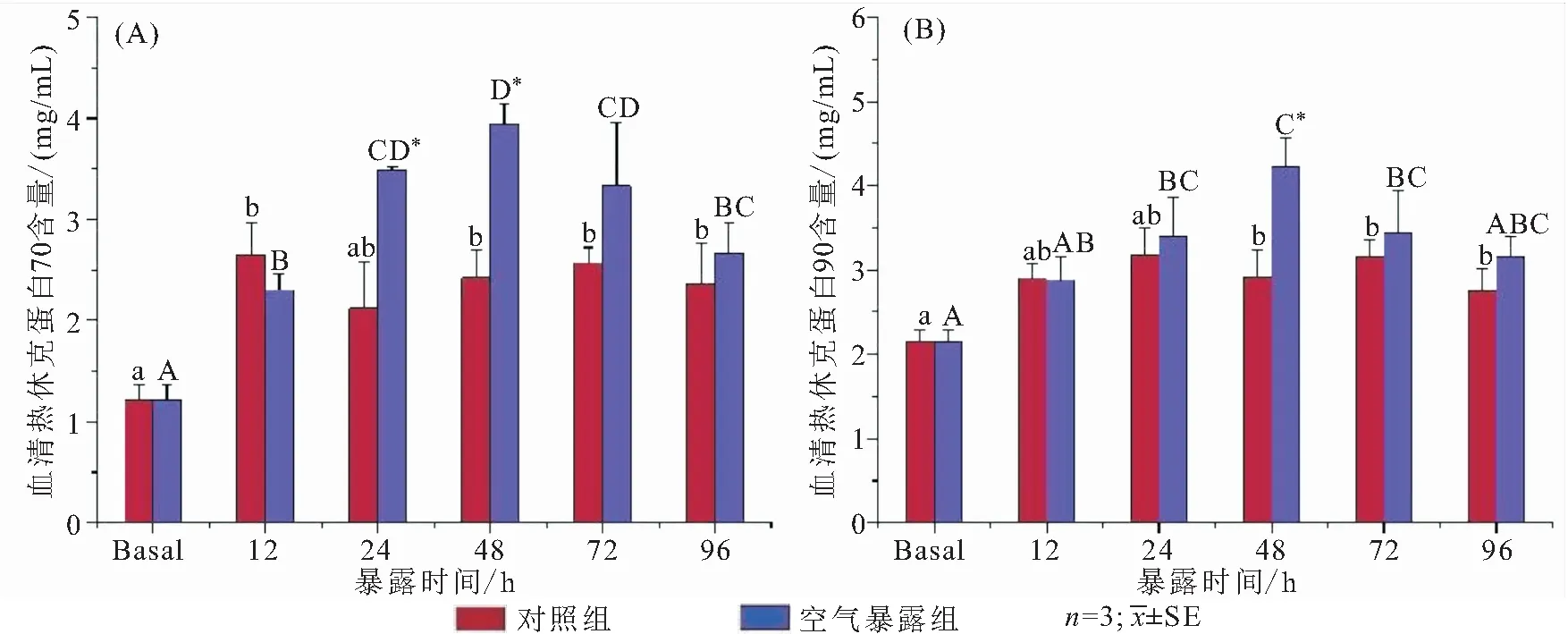
图4 空气暴露对大鳞副泥鳅血清HSP70(A)和HSP90(B)含量的影响

图5 不同空气暴露时间对大鳞副泥鳅肝脏HSP70(A)和HSP90(B)含量的影响
大鳞副泥鳅血清和肝脏中TNF-α、IL-1β、IL-6、和IL-12含量受空气暴露的影响见图6和图7。所有测定的血清炎症细胞因子都呈现相似的变化模式,先显著升高后降低,所有峰值均出现在空气暴露48 h,并且明显高于对照组(IL-1β除外)。实验结束时炎症细胞因子指标均已回归至正常水平。空气暴露12 h,肝脏炎症细胞因子达到峰值,TNF-α和IL-1β增加至基础水平的1.4倍;IL-6和IL-12增加至基础水平的1.5倍,均显著高于对照组(图7)。

图6 空气暴露对大鳞副泥鳅血清TNF-α(A)、IL-1β(B)、IL-6(C)、和IL-12(D)含量的影响

图7 不同时期空气暴露对大鳞副泥鳅肝脏TNF-α(A)、IL-1β(B)、IL-6(C)和IL-12(D)含量的影响
3 讨论
血清生化参数是评估鱼类机体健康状况的常用指标[4],当水产动物受到恶劣环境因子胁迫时,血清生化参数通常会出现不同程度的波动。暴露于火电厂废水中的翠鳢(Channapunctatus),其血清总蛋白和白蛋白含量出现急剧增加,但球蛋白含量减少[20]。经过铜和镍处理后的鲤(Cyprinuscarpio)血清总蛋白和球蛋白含量显著增加,血清白蛋白则有所下降[21]。本研究中,空气暴露条件下大鳞副泥鳅血清总蛋白、白蛋白和球蛋白含量显著增加。其中,球蛋白水平的显著上升可能是大鳞副泥鳅为了减轻机体在应激条件下的病原易感性而做出的免疫调节策略。然而,腹腔注射醋酸铵会显著降低鲫(Carassiusauratus)[9]和黄颡鱼(Pelteobagrusfulvidraco)[4]血清总蛋白、白蛋白和球蛋白含量。这种结果的差异可能是由于实验设计不同而造成的,鱼类普遍难以耐受高氨毒性,醋酸铵导致的严重氨中毒使得鱼体免疫系统调节失衡,进一步导致了免疫蛋白的减产;而短时间的空气暴露则激发了大鳞副泥鳅的免疫应答,诱导了相关蛋白的增殖。除此之外,实验期间,黄颡鱼每天投喂两次而大鳞副泥鳅在此期间不投喂,对能量的需求大大高于黄颡鱼;由于鱼类在受到环境应激时的能量需求增加,大鳞副泥鳅白蛋白和总蛋白含量增加也可能是作为干旱胁迫期间的能量来源。
当受到抗原刺激时,硬骨鱼B细胞会释放出大量IgM,并通过激活补体系统,发挥溶菌、杀菌及中和病毒等免疫作用[22]。CUESTA等[23]对大西洋鲷(Sparusaurata)进行短时间(2 min)的空气暴露后血清IgM水平无显著影响;但随着胁迫持续至6 h时,大西洋鲷鳃、肠道和皮肤组织中IgM水平均出现显著增加[24]。肝脏是鱼类蛋白质代谢和免疫因子合成的重要器官,大鳞副泥鳅肝脏中IgM含量在实验的第一个时间段(12 h)就出现了显著性增加;但在下一时间段(24 h)就迅速下降至基础水平;上述大西洋鲷多个组织的IgM水平同样在空气暴露24 h出现骤降[24]。IgM水平的急剧增减和其特性有关,作为机体接触外源性抗原后产生的第一抗体,IgM通常在应激的早期就会出现大量累积;但由于半衰期短,所以在体内维持时间短,消失快。
溶菌酶能够破坏革兰氏阳性菌细胞壁中的肽聚糖层,从而溶解入侵的致病菌;除此之外其还具有增强补体活性、强化免疫应答、抗肿瘤等作用,广泛参与了各种防御机制[24]。在空气暴露期间,大鳞副泥鳅血清和肝脏中溶菌酶活性并无明显变化。沈凡等[25]的研究表明低氧胁迫下黄颡鱼血清溶菌酶活力变化也不显著。而虹鳟(Oncorhynchusmykiss)和大西洋鲷在经历同样的干旱胁迫后皮肤表面溶菌酶却有显著上升的现象[23]。这可能是溶菌酶在鱼体组织中的差异性分布造成的,作为鱼类先天性免疫系统的第一道防线,溶菌酶主要分布在鱼类体表黏液和肾脏中,而血清和肝脏中溶菌酶含量较少[26,27]。另外,本实验中其他免疫因子的协同作用也可能是大鳞副泥鳅溶菌酶无显著变化的原因。急性干旱胁迫已被证明对大西洋鲷和斑马鱼(Daniorerio)肝脏的先天免疫因子的激活具有刺激作用,能够使补体蛋白水平增加[28]。补体是鱼类先天性免疫中的辅助系统,活化后具有酶活性、可介导免疫应答和炎症反应。空气暴露后,大鳞副泥鳅血清中的补体含量达到峰值时,肝脏补体达到最低值。肝脏补体含量的下降或是因为体液循环将其运输到血液和其他组织当中。本研究中,补体C3和补体C4含量的增加是对恶劣环境的一种适应性策略,表明了大鳞副泥鳅补体系统的激活。
热休克蛋白(HSPs)又称应激蛋白,在高温、缺氧、病原体感染、有机污染物和氧化等应激条件下,HSPs的合成速度会迅速增加[29]。其中,HSP70和HSP90在鱼类先天性免疫和适应性免疫中起关键作用,包括激活先天免疫系统细胞[30]、介导体液和细胞免疫反应[31]以及作为膜结合配体来激活免疫系统[32]等。干旱条件下拟穴青蟹(Scyllaparamamosain)[33]和黄金鲈(Percaflavescens)[12]体内HSP70和HSP90的含量有所增加。海参(Apostichopusjaponicus)[13]与大鳞副泥鳅中HSP90和HSP70在干旱胁迫过程中都呈现先升高后降低的变化趋势。其中大鳞副泥鳅血清中HSP70相较于HSP90具备增殖速度快,作用时间长的免疫应答特点;说明了HSP70在提高大鳞副泥鳅的抗应激能力和增强机体免疫中发挥着更大的作用。然而,由于HSPs诱导的树突细胞和巨噬细胞活化会促进组织相容性复合体(MHC)的成熟,所以HSPs的过度增值会对鱼类机体产生损害作用[34]。另外,罗东林等[35]指出,动物应激后高表达的HSP70可能会影响糖皮质激素发挥抗炎功能,从而导致创伤后继发性肝损伤。也就是说气呼吸型鱼类可能会以免疫抑制来保护自身免于干旱胁迫的应激作用。本研究中,空气暴露48 h后,机体HSP70和HSP90含量的下降也进一步支持了这一观点。
作为鱼类免疫系统的关键调节因子,炎症或环境污染物均可引起炎症细胞因子的变化[36]。在本研究中,不同时间的空气暴露后,大鳞副泥鳅血清和肝脏中炎症细胞因子(TNF-α、IL-1β、IL-6和IL-12)水平均呈现显著升高的趋势。大西洋鲷和斑马鱼空气暴露后,肝脏当中TNF-α、IL-1β和IL-10等炎症因子也呈现上调趋势[37]。在氨胁迫下,暗纹东方鲀[38]和黄颡鱼[4]中也发现了TNF-α、IL-1、IL-6、IL-8和IL-12转录水平的显著增加,这与本实验结果一致。此外,前期研究还发现HSPs的合成会导致TNF-α、IL-1β和IL-12转录水平的明显上调[28,39]。干旱胁迫后,肝脏中各炎症细胞因子指标的上升和回归速度都十分迅速。这与肝脏炎症细胞因子的双重效应关系密切,一方面,TNF和IL作为肝细胞刺激因子,在发生应激反应以及其它情况的急性炎症反应过程中可快速生成,并可诱导急性期反应蛋白的合成以维持内环境稳定、提高机体抗病力。另一方面,炎症细胞因子也是肝脏坏死的重要因素,多项研究表明TNF-α、IL-1β、IL-6和IL-12等可诱导肝脏细胞的凋亡[40-42]。因此,肝脏中炎症细胞因子的快速清除可能是大鳞副泥鳅为了保护肝脏免受损伤做出的负反馈调节,是机体为维持内环境稳定做出的免疫调节机制。
4 结论
综上所述,空气暴露显著诱导了大鳞副泥鳅血清和肝脏总蛋白、白蛋白、球蛋白、IgM、补体成分、热休克蛋白和炎症细胞因子等免疫因子的增殖。肝脏作为鱼类蛋白代谢和合成场所,其免疫因子通常在实验早期就出现大量累积,反应速度较血清快。本实验早期(0~48 h)大鳞副泥鳅的各项免疫指标均呈上升趋势,说明短时间的空气暴露刺激了鱼体的免疫应答。实验后期(48~96 h)多数上升的免疫指标逐渐下降,表明干旱和缺氧诱导的免疫刺激已开始转变为免疫抑制作用。

