牛蛙背部肿胀病的病原菌分离与鉴定及药敏实验
梁延达,杨美玲,徐 斌,黄俊旗,于 辉,杨 映
(1.佛山科学技术学院 ,广东省动物分子设计与精准育种重点实验室,广东佛山 528231;2.佛山科学技术学院生命科学与工程学院,广东佛山 528231;3.广东海兴农集团有限公司,广州 511400)
牛蛙(Ranacatesbeiana)原产于北美洲地区,在上世纪50年代从古巴引入中国养殖,属于两栖纲(Amphibian)无尾目(Anura)新蛙亚目(Neobatrachia)蛙科(Ranidae)[1]。在我国牛蛙的养殖分布在全国各地,2020年淡水养殖蛙产量137 999 t,增长幅度为28.55%[2]。牛蛙肉质鲜美,营养丰富,富含铜、锌、锰和铁等多种微量元素,其肌肉脂肪含量仅有2.1%,而蛋白质含量高达18.90%,深受消费者的青睐[3]。养殖牛蛙易发生多种病害 ,如布韦不动杆菌(Acinetobacterbouvetii)和变形杆菌(Proteus)导致的腐皮病[4-5],铜绿假单胞菌(Pseudomonasaeruginosa)导致的红腿病[6],浅黄假单胞菌(P.luteola)导致的歪头病[7],洛菲不动杆菌(Acinetobacterlwoffii)导致的腹水病[8]等。在病害治疗期间,由于养殖户没有针对性地使用抗生素,导致病原出现耐药性。
2021年9月广东番禺某牛蛙养殖场爆发疾病,发病蛙表现为精神不济、行动迟缓、食欲不振且背部和腹部出现肿胀,随着病情加重,背部皮肤因积液过多发生破裂,最终死亡。本实验室从牛蛙养殖场用保温箱带回5只具有相同症状且濒临死亡的牛蛙,解剖发现其背部、肝脏、脾脏肿大,腹腔中出现血红色的积液,从病变部位进行细菌的分离纯化出优势菌,并通过革兰氏染色、16S rRNA基因扩增测序、进化树构建、生化鉴定和人工感染回归实验等方法对细菌进行鉴定,进行细菌药敏实验确定其对于各种抗生素的敏感性。期望能明确该病的致病原因,为牛蛙细菌性疾病的预防和治疗提供方向和依据。
1 材料与方法
1.1 实验材料
在广东番禺某养殖场采集5只濒死的牛蛙,均质量为(150.0 ± 1.0)g,加上冰袋装进泡沫箱带回实验室。健康蛙均重为(160.0 ± 3.0)g,与患病蛙取自同一养殖场,在实验室水箱中暂养7 d,暂养水温在(28 ± 1)℃,每日投喂两次,喂食量为体重的1%,未见任何发病状况。在人工回归感染实验之前随机抽取三只健康蛙解剖观察,并取其内脏组织涂板于BHI营养琼脂上进行细菌检测,确定是否有感染病原菌。
SuperMix溶液、核酸染料和DNA Marker购于北京全式金生物技术有限公司;营养肉汤培养基和微量生化鉴定管购于青岛海博生物技术有限公司;革兰氏染色试剂盒购于北京索莱宝科技有限公司; 药敏片购于杭州微生物试剂有限公司。
1.2 病原菌的分离和培养
无菌操作取病蛙的肝脏、脾脏和背部积液,接种于普通营养琼脂平板上,置于恒温培养生化箱37 ℃下培养24 h后,选取优势菌落进行重复划线纯化,得到形态大小一致的两种纯菌落,分别为GPY923和GPX924。然后取纯化菌株用普通营养肉汤在37 ℃的气浴恒温摇床培养16 h,每种分装10只2 mL的EP管中加入甘油进行保种,放在- 20 ℃冰箱备用。
1.3 16S rRNA与系统发育树分析
使用裂解法提取两种细菌的总DNA作为模板,采用16S rRNA的引物进行PCR扩增,PCR反应条件:94 ℃预变性10 min,94 ℃ 变性30 s,56 ℃ 退火30 s,72 ℃延伸 90 s,35个循环,72 ℃ 终延伸5 min;PCR反应体系:14 μL 2x Easy Taq Super Mix ,1 μL 10 mmol/L正向和反向引物,2 μL模板DNA,ddH2O 32 μL共50 μL。16S rRNA的引物序列如下,F:5′-AGAGTTTGATCCTGGCTCAG-3′,R:5′-TACGGCTACCTTGTTACGACTT-3′。阴性对照将细菌模板替换成无菌水。扩增产物经电泳和凝胶成像系统后在1 500 bp位置得到目的条带后,送去上海生工测序。
1.4 革兰氏染色及生理生化特性鉴定
将之前备用的纯化细菌涂在BHI平板上,在生化培养箱37 ℃重新培养18 h后观察菌落形态,再选取单个菌落进行革兰氏染色,染色完毕后用光学显微镜观察菌体形态及颜色,判断细菌属性。然后将平板上的单菌落按照说明书要求进行生化鉴定。
1.5 人工回归感染实验
将40只健康牛蛙随机分为4组,3个实验组(GPY923细菌感染组、GPX924细菌感染组、GPY923和GPX924混合细菌感染组。) ,1个对照组。实验组注射病原菌的无菌PBS缓冲液重悬液,浓度为1.0×108cfu/mL,每只注射剂量为0.3 mL,对照组注射等量无菌PBS缓冲液,均在背部的肌肉进行注射。注射后连续14 d观察并记录牛蛙的死亡数量、死亡时间,并对濒死的蛙进行细菌分离鉴定。
1.6 肝脏切片观察
分别取濒死牛蛙的肝、脾和溃烂的皮肤与健康牛蛙的肝、脾和皮肤,固定于多聚甲醛固定液常温固定24 h,制作石蜡切片,经苏木精—伊红法染色后用光学显微镜观察。
1.7 药物敏感实验
将两种细菌用比浊法调浓度至1.0×108cfu/mL的病原菌涂布于BHI平板上,然后用无菌的镊子将林可霉素、丁胺卡那、红霉素、氯霉素、多西环素、恩诺沙星、头孢他啶、头孢呋辛、头孢氨苄、卡那霉素、阿奇霉素、氨苄西林、青霉素、环丙沙星、新霉素、羧苄西林、氟苯尼考、阿莫西林、四环素、利福平、庆大霉素、磺胺异噁唑、苯唑西林和麦迪霉素共24种不同的药敏片贴附于平板上,37 ℃培养24 h后测量并记录抑菌环的直径。根据说明书推荐的判断标准判断细菌对于药物的敏感程度。每种药敏片重复操作3次。
2 实验结果
2.1 发病牛蛙的临床症状
自然发病牛蛙初期(图1-a)和中期(图1-b)出现背部隆起和背部出血的症状,随着背部的积液增多,皮肤逐渐变薄,最终破裂(图1-c)。在这期间,牛蛙食欲不振,神情呆滞,行动缓慢,体色变黑。解剖死蛙发现其肝脏出现花斑且呈棕色,脾脏肿大变黑,胆囊发黑,腹部出现红色的积液且肌肉出现出血的现象(图1-d)。

图1 自然发病牛蛙感染初、中、末期及解剖图
2.2 16S rRNA基因序列分析
将测序结果在NCBI的GenBank中进行Blast比对,初步鉴定菌株GPY923为嗜水气单胞菌(Aeromonashydrophila),菌株GPY924为海豚链球菌(Streptococcusiniae),然后用MEGA10的N-J法构建系统发育树。两株细菌的系统进化树构建结果如图2与图3所示,菌株GPY923与嗜水气单胞菌、GPY924与海豚链球菌亲缘关系最近,聚在同一枝上,置信度分别为97%和100%。

图2 菌株GPY923系统进化树构建结果
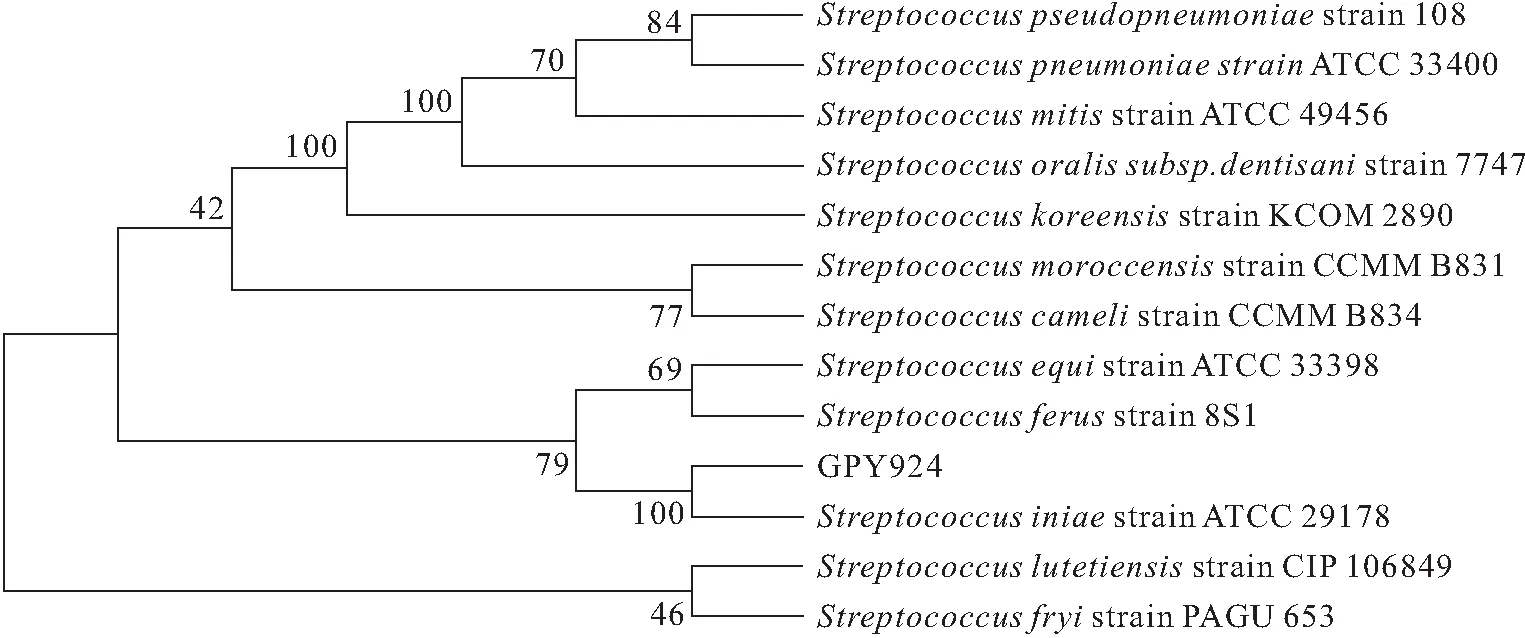
图3 菌株GPY924系统进化树构建结果
2.3 革兰氏染色与生理生化特性结果
从患病牛蛙的背部积液、肝、脾的部位分离纯化出两株细菌,革兰氏染色后用光学显微镜进行观察,GPY923为革兰氏阴性短杆菌,GPX924为革兰氏阳性球菌(如图4和图5所示)。在普通营养琼脂上培养24 h后观察到,GPY923菌落为中央凸起圆形,颜色呈灰白色;GPX924菌落则为短链状白色小圆点。再将两株细菌接种在血琼脂平板上,菌落周围均出现透明的溶血环,为β型溶血。根据分离的两株细菌的形态颜色及生理生化特性结果,结合《常见细菌系统鉴定手册》[9]和《伯杰氏系统细菌学手册》[10]判断菌株GPY923为嗜水气单胞菌,GPX924为海豚链球菌。分离菌株的生理生化鉴定结果如表1所示。
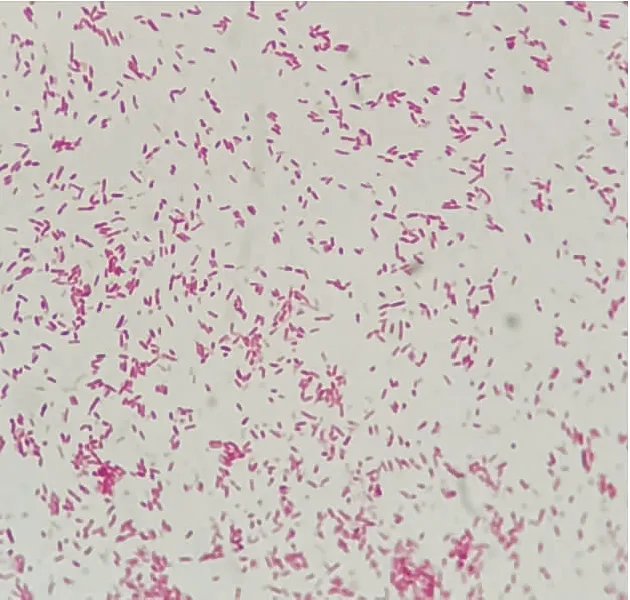
图4 GPY923革兰氏染色结果

图5 GPY924革兰氏染色结果

表1 分离菌株的生理生化鉴定结果
2.4 组织病理学观察
组织病理学观察结果显示,所有病蛙的肝脏中均出现肝细胞局灶性裂解坏死现象,图6-g坏死程度最大,图6-a和图6-d部分出现黑色素巨噬细胞。病蛙的脾脏出现不同程度炎症细胞浸润和红髓细胞间隙增宽现象,部分细胞出现核固缩,图6-b中细胞裂解坏死残存细胞碎片。图6-c、 图6-f和图6-i的皮肤纤维细胞均有损伤,图6-c和图6-i的纤维细胞结构排列疏松,出现断裂,真皮层下的组织也发生断裂。

图6 人工感染牛蛙组织学观察
2.5 人工回归感染实验结果
3个实验组在感染的第3 d后,出现精神萎靡,食欲不振,背部注射部位肿胀的现象,而对照组正常。第7 d,混合细菌感染组的背部肿胀程度比其他两个实验组更严重,其背部皮肤变薄,出现了死亡现象。第14 d,混合细菌感染组只剩下两只濒死牛蛙;GPY923细菌感染组和GPX924细菌感染组死亡数均为6只,其余牛蛙状态萎靡。16 d后实验组牛蛙均死亡。对照组状态正常,未出现死亡。将濒死牛蛙解剖观察,GPY923和GPX924混合细菌感染组与自然感染的特征一致;而GPY923细菌感染组背部肿胀程度小于GPX924细菌感染组,其内部器官亦呈现出不同程度的充血和出血现象。
2.6 药物敏感实验结果
结果如表2中所示,菌株GPY923对丁胺卡那、头孢他啶、头孢呋辛、青霉素和氟苯尼考敏感,对红霉素、多西环素、头孢氨苄、卡那霉素和新霉素中度敏感,对林可霉素、氯霉素、恩诺沙星、阿奇霉素、氨苄西林、环丙沙星、羧苄西林、阿莫西林、四环素、利福平、庆大霉素、磺胺异噁唑、苯唑西林和麦迪霉素不敏感。菌株GPY924对丁胺卡那、红霉素、氯霉素、多西环素、恩诺沙星、头孢氨苄、卡那霉素、阿奇霉素、氨苄西林、青霉素、环丙沙星、新霉素、羧苄西林、氟苯尼考、阿莫西林、四环素、利福平、庆大霉素、磺胺异噁唑、苯唑西林和麦迪霉素敏感,对头孢他啶中度敏感,对林可霉素和头孢呋辛不敏感。
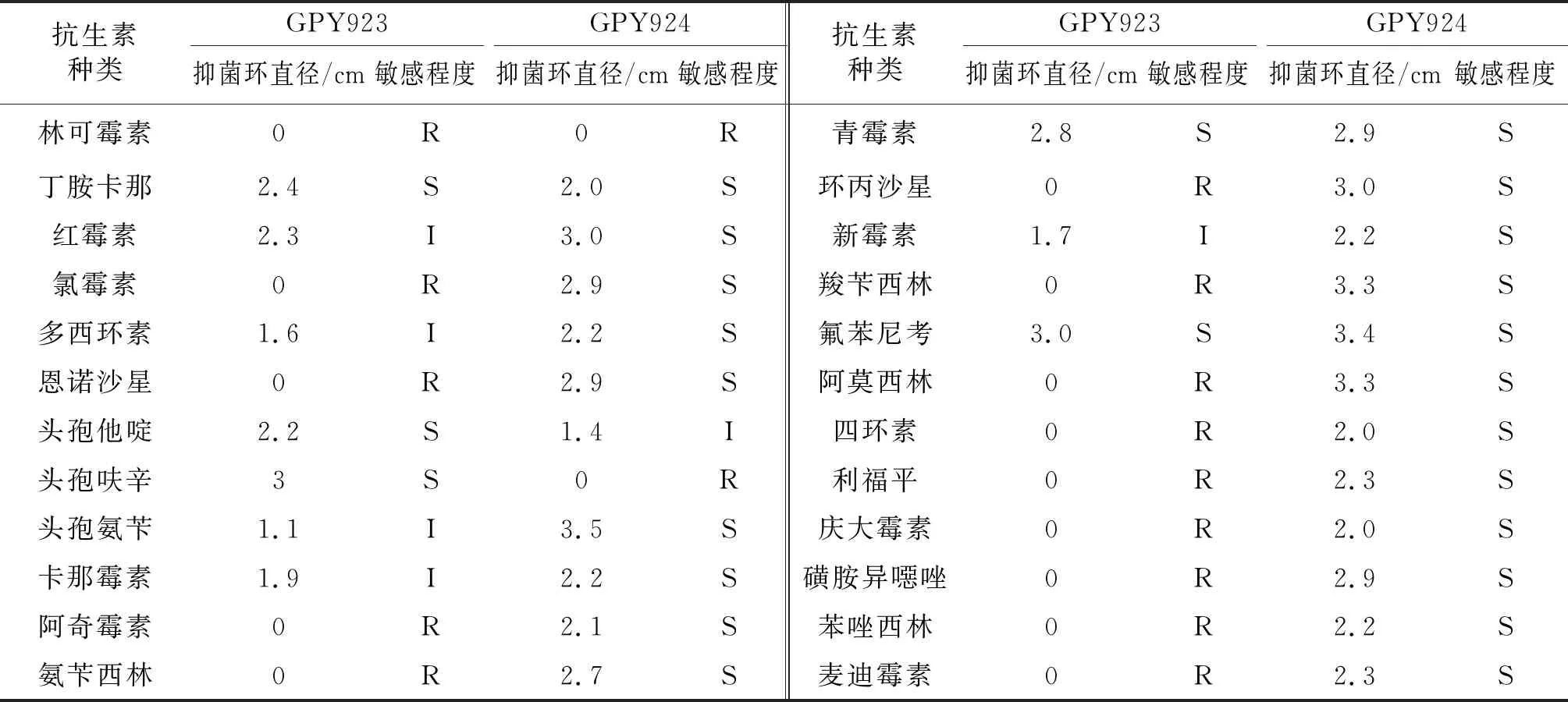
表2 牛蛙分离菌的药物敏感性试验
3 讨论
嗜水气单胞菌属于革兰氏阴性短杆菌,广泛存在于水体环境中,能感染多种生活在水体环境的动物,包括草鱼(Ctenopharyngodonidella)、罗非鱼(Oreochromismossambicus)、黄鳝(Monopterusalbus)和中华鳖(Pelodiscussinensis)等[13-16]。感染动物主要特征为局部皮肤发生溃烂和肌肉或内脏充血出血,本试验的人工感染试验患病牛蛙症状与之一致。本研究中嗜水气单胞菌接种在血琼脂平板时产生β型溶血环证明其有较强的溶血性,推测其原因为分离出的嗜水气单胞菌能产生外毒素中的溶血素导致动物内出血[17]。海豚链球菌为革兰氏阳性球菌,感染动物包括罗非鱼和鲟(Acipensersinensis)等[18-19],感染的临床症状为肝、脾、肾肿胀出血,体表出血溃疡,海豚感染则表现为皮肤脓肿[20]。海豚链球菌感染其它物种的典型特征与本研究中患病牛蛙相符,其部分不同特征产生的原因推测可能是物种的差异性导致的。海豚链球菌在溶血试验中出现β型溶血环,证明此致病菌有较强的溶血性。广东南部地区夏秋季的水温偏高,普遍在25 ℃以上,非常适宜嗜水气单胞菌和海豚链球菌的快速繁殖,并且牛蛙的养殖模式为高密度养殖,在摄食斗争或求偶时容易导致体表损伤继而引发感染。有学者研究表明[21]嗜水气单胞菌是抑制蛙类的自身免疫力的重要因素,当牛蛙感染了嗜水气单胞菌后,自身免疫力下降,使其更容易感染海豚链球菌。海豚链球菌则在牛蛙的背部产生脓肿,加重牛蛙的病情,使牛蛙加速走向死亡。海豚链球菌和嗜水气单胞菌都有较强的溶血性,两者协同使牛蛙死于败血症。
本研究中患病牛蛙在背部出现肿胀症状,在牛蛙常见的腐皮病、腹水病、红腿病和消化道疾病中尚未发现此症状。本试验药敏试验结果表明嗜水气单胞菌对丁胺卡那、头孢他啶、头孢呋辛、青霉素和氟苯尼考敏感,对多种药物耐药;海豚链球菌对林可霉素和头孢呋辛耐药,对头孢他啶中度敏感,其余药物均敏感。嗜水气单胞菌的药敏实验中使用了24种抗生素只有6种抗生素为敏感,接近3/4的抗生素耐药。嗜水气单胞菌的耐药程度非常高,其可能与人们长期滥用和盲目使用抗生素有关。为了避免以后无药可用的情况发生,学者们需极力寻找抗生素的替代品。有研究表明中草药能有效防治细菌性疾病,并减少环境的污染,如诃子和秦皮能抑制和杀死嗜水气单胞菌,抑菌环直径达到20 mm以上[22]。黄连和黄柏等药物对抑制海豚链球菌较强[23]。
综上所述,本实验确定海豚链球菌和嗜水气单胞菌为牛蛙患病的主要病原,综合感染后可导致牛蛙背部肿胀,多个器官病理损伤,最后因严重的出血和功能障碍死亡。其中的嗜水气单胞菌对多种抗生素产生耐药性,对头孢类药物敏感;但海豚链球菌对头孢类药物有耐药性,综合两者特性,在药物的选择上要使用丁胺卡那、红霉素和氟苯尼考等抗生素或使用中草药进行抑菌杀菌。

