蒲公英水提物对临床常见肠道有害菌体外抑菌作用的研究
张维华,王 翠,窦建卫,吴晓康
(1.西安交通大学医学部,陕西 西安 710061;2.陕西省人民医院血液内科,陕西 西安 710068;3.陕西省人民医院检验科,陕西 西安 710068;4.西安交通大学第二附属医院检验科,陕西 西安 710004)
蒲公英(Taraxacum mongolicum Hand-Mazz)属为菊科多年生草本植物,广泛分布于我国各省区。蒲公英是药食两用的植物,具有抗菌、保肝利胆、免疫促进、抗内毒素及抗胃损伤等作用。蒲公英中含有多种生物活性成分,主要包括黄酮类、萜类、生物碱类、香豆素、芪类、酯类、甾醇类等,这些物质具有较强的抗菌消炎、抗氧化等生物活性[1],临床上主要用于治疗疖痈、痤疮、急性结膜炎、急性扁桃体炎、急性乳腺炎、急性支气管炎、急慢性阑尾炎、鼻炎、咽炎、胃炎、消化性溃疡、胆囊炎、胆石症、肝炎、泌尿系统感染、阴道炎、盆腔炎、骨髓炎、流行性腮腺炎以及癌症等多种疾病[2,3],特别是近年来报道其对乳腺癌具有显著的抗癌活性[4-6]。肠道菌群是人体内最为复杂,且数量最高的共生微生物生态系统,肠道菌群的代谢作用相当复杂,与人体的健康和疾病密切相关。正常情况下,人体肠道菌群按一定的比例组合,各菌种之间互相依存并互相制约。在种类和数量上存在一定的动态平衡,一旦这种平衡被打破,便会造成肠道菌群失调。近年多项研究表明[7,8],肠道菌群失调,尤其是肠道有害菌的数量及占比的增高,与多种疾病的发生发展有密切关系。临床常见的肠道有害菌包括拟杆菌属、梭菌属、芽孢杆菌属等。本试验主要探究蒲公英对从粪便标本分离临床常见肠道有害菌的体外抑菌作用,旨在为临床预防和治疗菌群失调提供一定的理论依据。
1 材料与方法
1.1 蒲公英水提物 称取中草药蒲公英200 g,以8倍量水浸泡40 min 后煮沸,小火煎煮1.5 h,倾出药液,经8 层纱布过滤。再向蒲公英中加入6 倍量水,煮沸后小火煎煮1 h,倾出药液,经8 层纱布过滤。将两次药液混合后置于冰箱,4 ℃沉淀过夜。次日取上清煮沸,小火浓缩药液至100 ml,将上清转移至无菌杯。-20 ℃保存。实验中每毫升蒲公英药液相当于2 g 蒲公英原药材,即蒲公英药液浓度为2 g/ml。
1.2 菌株
1.2.1 标本选取 临床送检的粪便标本中选取性状异常的标本,分离得到菌株,且每位患者体内同一种菌株只采集1 株,重复者不予计算。
1.2.2 接种培养 临床送检粪便标本,挑取性状异常部位接种于2 个血琼脂平皿,分别置于空气和厌氧环境,次日观察细菌生长情况。
1.2.3 鉴定分离 采用基质辅助激光解析串联飞行时间质谱仪(MALDI-TOF)对分离出的菌株进行鉴定。
1.2.4 菌株选取 选取产气荚膜梭菌5 株,脆弱拟杆菌5 株,蜡样芽胞杆菌5 株。
1.3 培养基 每3 g TRYPTONE SOYA BROTH(TSB)(OXOID)琼脂粉加入100 ml 纯水,混匀加塞,放入高压锅121 ℃,0.11 MPa 高压灭菌30 min。
1.4 肌红蛋白 50 ng/ml 肌红蛋白(BECKMAN COULTER)作为参照蛋白。
1.5 萃取及检测试剂 甲酸(ThermoFisher Scientific)、乙腈(SIGMA-ALORICH)、乙醇(LiChrosolv)、HCCA基质液(Bruker)、纯水、三氟乙酸(SIGMAALORICH)。
1.6 仪器设备 35 ℃培养箱(上海博迅实业有现公司医疗设备厂,SPX-250B-Z)、比浊仪(BD,Phoenix Spec)、移液器(Thermo Scientific,FINNPIPETTE F3)、离心机(湖南湘仪实验室仪器开发有限公司,H1650-W)、涡旋仪(上海舍岩仪器有限公司,VMD)、厌氧发生袋(MITSUBISHI GAS CHEMICAL CO.,INC,0102MJ-1)、基质辅助激光解析串联飞行时间质谱仪(Bruker,MALDIBIOTYPER)。
1.7 菌液配制 配制0.5 麦氏浓度的菌悬液,菌液浓度约为1×108CFU/ml。
1.8 蒲公英不同浓度药液配制 无菌操作条件下,取7 支10 ml 无菌试管并编号。所有试管中分别加入2 ml 已灭菌的TBS 培养基,第1 管加入浓度为2 g/ml蒲公英药液2 ml,充分混匀后取出2 ml 药液稀释液加入第2 管。重复上述操作稀释至第6 管,第6 管需取出2 ml 弃去。第7 管未加蒲公英作为生长阳性对照。配制蒲公英药液浓度依次为:1.0、0.5、0.25、0.125、0.06、0.03、0 g/ml。
1.9 最低抑菌浓度及最低杀菌浓度测定 采用二倍稀释法,分别测定蒲公英对肠杆菌的最低抑菌浓度(minimum inhibitory concentration,MIC)及最低杀菌浓度(minimum bactericidal concentration,MBC)。
1.9.1 不同浓度蒲公英药液干预细菌 取0.5 麦氏浓度的菌悬液10 μl,分别加入含不同浓度蒲公英药液试管。另取1 支试管,仅加入2 ml TBS 培养基,作为阴性对照。将产气荚膜梭菌、脆弱拟杆菌置于厌氧环境,蜡样芽胞杆菌置于空气环境,37 ℃培养箱中培养24 h。
1.9.2 检测干预后细菌生长情况 将培养后的含菌培养液混匀,取10 μl 采用连续划线方法接种于血琼脂平皿。同样将产气荚膜梭菌、脆弱拟杆菌置于厌氧环境,蜡样芽胞杆菌置于空气环境,37 ℃培养箱中培养24 h 后观察血琼脂平皿细菌生长情况并计数菌落数。
1.9.3 判断结果 MIC 为可抑制某种细菌生长、繁殖的最低药液浓度。与阳性生长对照组比较,抑制80%细菌生长的最低药液浓度即为受试菌MIC[9]。MBC 为杀死某种菌株的药物最低药液浓度。与阳性生长对照组比较,杀死99.9%(降低3 个数量级)活菌的最低药液浓度即为受试菌MBC[9]。
1.10 细菌蛋白表达的变化 通过MALDI-TOF 质谱仪检测干预后细菌蛋白表达种类及含量。
1.10.1 不同浓度蒲公英药液干预细菌 根据细菌生长情况选择不同浓度蒲公英药液干预细菌:产气荚膜梭菌选择0、0.03、0.06、0.125 g/ml;脆弱拟杆菌选择0、0.03、0.06 g/ml;蜡样芽胞杆菌选择0、0.03、0.06、0.125、0.25 g/ml。向含不同浓度蒲公英药液试管中分别加入0.5 麦氏浓度菌液10 μl。另取1 支试管加入TBS 培养基2 ml 作为阴性对照,将产气荚膜梭菌、脆弱拟杆菌置于厌氧环境,蜡样芽胞杆菌置于空气环境,37 ℃培养箱中干预24 h。
1.10.2 甲酸萃取法提取细菌样本 取1 ml 培养后的含菌培养液,13 000 rpm 离心2 min,弃去上清,加入1 ml 生理盐水,涡旋混匀1 min 后离心2 min,弃去上清。沉淀中加入300 μl 超纯水,涡旋混匀1 min,加入900 μl 无水乙醇,涡旋混匀1 min,13 000 rpm离心2 min,弃去上清,沉淀中加入50 μl 70%甲酸水溶液,反复吹打并涡旋实现彻底混合,加入50 μl乙腈,吹打混匀,13 000 rpm 离心2 min,将1 μl 细菌萃取物上清液移取至MALDI 靶板上,同时用牙签沾取少量肌红蛋白涂抹至同一位置,与上清液混匀,待干后取1 μl 基质溶液涂敷在每个样本上,待干后将靶板插入MALDI-TOF 质谱仪。
1.10.3 质谱仪基质液配置 选择α-氰基-4-羟基肉桂酸(HCCA)作为质谱样品处理基质,用V(超纯水)∶V(乙腈)∶V(三氟乙酸)=19∶20∶1 的比例配置溶剂。向含有2.5 mg HCCA 基质干粉中加入250 μl 溶剂,配成浓度为10 g/L 的基质溶液,溶解后的基质溶液现配现用。
1.10.4 MALDI-TOF 质谱仪状态 离子解析电离源脉冲激光为337 nm,离子加速电压19.98 kV,质谱扫描范围m/z 1960~20 137,飞行时间质量分析器的工作压力<5×10-8mbar,采用正离子线性模式,质谱信号为多次累加扫描。
1.10.5 检测干预后细菌蛋白表达情况 采用Flex-Control 2.0 软件检测样品,每个样本经过质谱仪激光打靶检测后生成图谱。图谱中横坐标为质核比(m/z),纵坐标为峰强度(Intens.)。应用FlexAnalysis 3.0软件分析图谱及参数。
1.10.6 判断结果 MALDI-TOF 质谱图谱横坐标m/z可以反应蛋白分子量,离子m/z 个数或峰数量可体现蛋白种类的丰富程度。细菌峰强度与内参蛋白峰强度比值为相对峰值,相对峰值可反应相应蛋白含量。
2 结果
2.1 蒲公英对3 种细菌生长的抑制作用 计算每毫升培养液中所含菌量公式为:菌量(CFU/ml)=血琼脂平皿菌落数×100,计算结果见表1,产气荚膜梭菌在蒲公英药液0.06 g/ml 时生长明显抑制,在0.25 g/ml时无细菌生长;脆弱拟杆菌在蒲公英药液浓度0.03 g/ml 时生长明显抑制,在0.125 g/ml 时无细菌生长;蜡样芽胞杆菌在蒲公英药液浓度0.125 g/ml时生长明显抑制,在0.5 g/ml 时无细菌生长。将不同浓度蒲公英药液干预后的细菌生长与不含蒲公英药液对照组相比较,得到3 种细菌分别的MIC 及MBC值,见表2,结果显示中药蒲公英的水提物对产气荚膜梭菌、脆弱拟杆菌、蜡样芽胞杆菌均有很好体外抑菌作用。

表1 不同浓度蒲公英药液干预后每毫升培养液中所含菌量(CFU/ml)
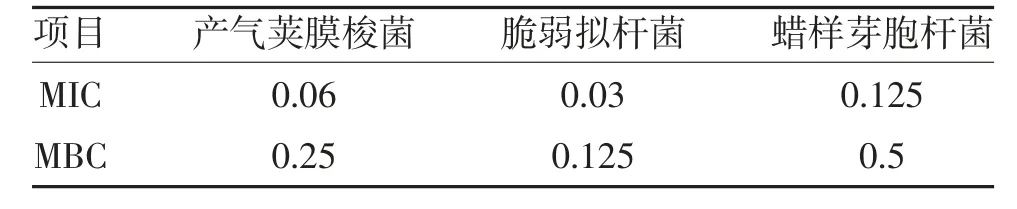
表2 蒲公英药液对3 种细菌的MIC 及MBC(g/ml)
2.2 蒲公英干预对3 种细菌蛋白种类的影响
2.2.1 干预后3 种细菌质谱图谱中的峰数量明显减少 使用肌红蛋白作为参照蛋白,其m/z 处于3513~3515 位置,用于规避实验操作及检测失误。随着蒲公英药液浓度的升高,干预后3 种细菌质谱图谱中的峰数量明显减少。产气荚膜梭菌:蒲公英药物浓度为0 g/ml 时显著峰有6 个,离子m/z 为3884、4791、5277、6722、6992、7677;药物浓度为0.03 g/ml时显著峰有5 个,离子m/z 为3884、4792、5279、6296、6724;药物浓度为0.06 g/ml 时显著峰有3 个,离子m/z 为3882、6376、7198;药物浓度为0.125 g/ml时显著峰仅有1 个,离子m/z 为:3884。脆弱拟杆菌:蒲公英药物浓度为0 g/ml 时显著峰有5 个,离子m/z为3885、4684、6520、7397、9363;药物浓度为0.03 g/ml时显著峰有2 个,离子m/z 为3885、5252;药物浓度为0.06 g/ml 时显著峰仅有1 个,离子m/z 为3885。蜡样芽胞杆菌:蒲公英药物浓度为0 g/ml 时显著峰有8 个,离子m/z 为3679、4602、5166、5611、6255、7359、7761、9202;药物浓度为0.03 g/ml 时显著峰有8 个,离 子m/z 为3679、4329、5165、5879、6418、7357、7759、9199;药物浓度为0.06 g/ml 时显著峰有5 个,离子m/z 为3882、4601、5166、6255、7306;药物浓度为0.125 g/ml 时显著峰仅有1 个,离子m/z 为3883;药物浓度为0.25 g/ml 时显著峰仅有1 个,离子m/z 为3883,见图1~3。

图1 不同浓度蒲公英药液干预后产气荚膜梭菌质谱图谱
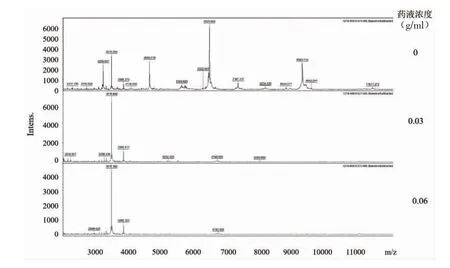
图2 不同浓度蒲公英药液干预后脆弱拟杆菌质谱图谱

图3 不同浓度蒲公英药液干预后蜡样芽孢杆菌质谱图谱
2.2.2 干预后3 种细菌的离子m/z 数量明显减少 产气荚膜梭菌:蒲公英药物浓度为0、0.03、0.06、0.125 g/ml 时,离子m/z 种类分别有35、8、6、6 种;脆弱拟杆菌:蒲公英药物浓度为0、g/ml、0.06 g/ml时离子m/z 数量种类分别有76、47、44 种;蜡样芽胞杆菌:蒲公英药物浓度为0、0.03、0.06、0.125、0.25 g/ml 时离子m/z 种类分别有40、42、32、7、5 种。质谱参数显示离子m/z 种类明显减少,见表3,表明中药蒲公英的水提物可显著减少产气荚膜梭菌、脆弱拟杆菌、蜡样芽胞杆菌的蛋白种类。
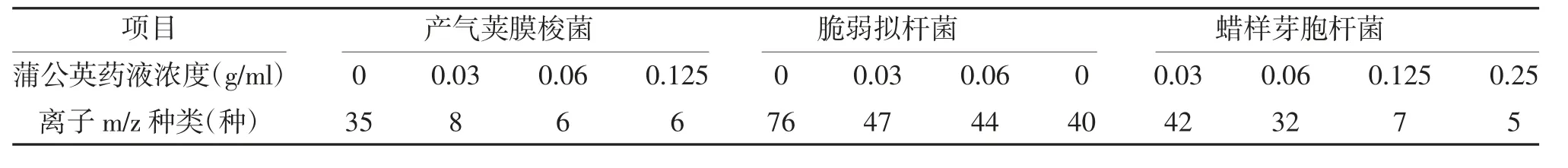
表3 不同浓度蒲公英药液干预后3 种细菌离子m/z 数量的变化
2.3 蒲公英干预后3 种细菌的主要蛋白含量显著降低 通过质谱参数选择峰强度较高的前10 种离子m/z,参照蛋白m/z 为3513~3515,记录不同离子m/z 对应的峰强度,计算其相对峰值,计算公式为:相对峰值=细菌峰强度/参照蛋白峰强度。选择产气荚膜梭菌峰强度较高的离子m/z 为:6992.75、6961.14、6722.71、5294.07、5277.99、4791.11、3884.37、3551.63、3535.95、3496.39。脆弱拟杆菌峰强度较高的离子m/z 为:9363.11、7397.23、6584.93、6566.31、6540.30、6520.04、6492.50、4684.01、3885.27、3259.65。蜡样芽孢杆菌峰强度较高的离子m/z 为:7359.65、6255.05、5210.66、5183.15、5166.96、5150.56、4602.03、3679.26、2581.32、6420.36。结果显示,产气荚膜梭菌、脆弱拟杆菌、蜡样芽胞杆菌分别在蒲公英浓度为0.03、0.06、0.125 g/ml 时离子相对峰值明显降低且成剂量依赖性,意味着中药蒲公英的水提物可减少产气荚膜梭菌、脆弱拟杆菌、蜡样芽胞杆菌的蛋白含量,见图4~图6。

图4 不同浓度蒲公英药液干预后产气荚膜梭菌相对峰值
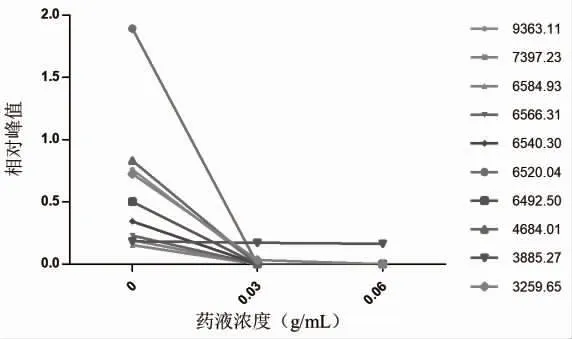
图5 不同浓度蒲公英药液干预后脆弱拟杆菌相对峰值

图6 不同浓度蒲公英药液干预后蜡样芽胞杆菌相对峰值
3 讨论
对抗菌药物抑菌效果的检测,传统的方法多基于生长实验等方法,这些传统方法往往耗时长且灵敏度低[10]。本实验为了进一步深入探究蒲公英对细菌的影响,使用传统方法联合MALDI-TOF 质谱仪检测细菌中蛋白的表达情况。近年来发展起来的基于质谱的检测方法具有快速和灵敏度高等优点[11],MALDI-TOF 质谱仪质谱检测细菌主要基于分析细菌解离后离子质核比,可间接反映细菌蛋白种类及含量。本实验中为了能够比较蛋白的含量的变化,引入了肌红蛋白作为参照蛋白[12]。质谱图谱中可以看到,未经处理的细菌质谱图谱有较为丰富的峰,而经高浓度蒲公英药液干预后图谱中仅包含参照蛋白的峰,参照蛋白一方面可以较好的反映质谱检测效果,另一方面可于计算相对峰值,反映真实峰强度变化,体现细菌中蛋白的相对含量。
产气荚膜梭菌、脆弱拟杆菌、蜡样芽胞杆菌为肠道中具有代表性的有害菌,本研究中采用不同浓度蒲公英药液对3 种细菌进行药物敏感性实验,从细菌的生长、细菌蛋白种类、细菌蛋白含量3 方面验证了蒲公英对肠道有害菌的作用。研究结果显示,蒲公英药液对其有很强的抑菌及杀菌作用,并确定了蒲公英药液对不同细菌的抑菌和杀菌浓度,其对产气荚膜梭菌的MIC 为0.06 g/ml,MBC 为0.25 g/ml;对脆弱拟杆菌的MIC 为0.03 g/ml,MBC 为0.125 g/ml;对蜡样芽胞杆菌的MIC 为0.125 g/ml,MBC 为0.5 g/ml。随着蒲公英药液浓度的增加,3 种细菌的蛋白种类明显减少,当蒲公英药液浓度由0 g/ml 增加至0.125 g/ml 时,产气荚膜梭菌的蛋白种类由6 种减少到1 种,当蒲公英药液浓度由0 g/ml 增加到0.06 g/ml 时,脆弱拟杆菌的蛋白种类由5 种减少到1 种,当蒲公英药液浓度由0 g/ml 增加到0.25 g/ml时,蜡样芽胞杆菌的蛋白种类由8 种减少到1 种,同时3 种细菌的蛋白含量明显降低且成剂量依赖性,从多个方面证实了蒲公英对于肠道有害菌的抑制和杀伤作用,为临床使用蒲公英预防和治疗菌群失调提供了参考依据。质谱较好的反映了细菌整体蛋白种类及表达量情况,但图谱中细菌具体为是哪种蛋白发生了改变尚不清楚,后期将在此实验基础上进一步探讨蒲公英所影响的这些蛋白属于结构蛋白还是功能蛋白,阐明其具体的抑菌机制。
本实验结果显示,蒲公英对肠道有害菌具有抑制作用,也有文献提出蒲公英多糖可以调节正常菌群和益生菌数量,从而改善肠道菌群失调[13]。肠道菌群为疾病和健康的重要调控因素,正常肠道菌群具有消化、吸收、代谢等生理功能,并参与免疫反应,可保证人体的正常生理功能,此外,肠道菌群在一些肿瘤治疗过程中也有关键作用[14,15]。但近年来随着抗菌药物的使用,临床患者出现菌群失调的比例大大增加。研究表明,肠道菌群失调后,尤其是肠道中有害菌的数量及占比增高,会产生有害物质、促发炎症、影响免疫功能和激素水平等,从而引起肥胖、糖尿病、肿瘤等疾病[16-19]。
蒲公英作为临床常用中药,对各种炎症、湿热性便秘、产妇缺乳、肝火旺盛、高脂血症、甲状腺功能亢进等多种疾病均有显著的临床疗效[20-22]。此外,蒲公英对乳痈具有独特的治疗作用,有文献统计了近30 年来,41 位名老中医治疗乳腺癌的用药特色,发现蒲公英单药常用于乳腺癌治疗[23]。那么蒲公英如此多的临床功效是否与其调节肠道菌群有关,这将为现代中药的药物机制研究提供更多新的研究思路。
综上所述,草药蒲公英的水提物对临床常见的肠道有害菌的生长及蛋白合成具有很好的抑制作用。

