钛表面ALD构建氧化锌纳米薄膜及其性能研究
孙汪心悦,舒 菲,张志豪,陈 虹,敦芷悦,吕玮瑾,张青红,刘 梅
近几十年来,口腔医学领域对钛材料的需求呈显著上升趋势。钛和钛合金凭借其强度高、质量轻、生物相容性好等优点[1-3],被广泛应用在种植、活动修复等多个方面。然而,人体口腔是一个开放、复杂的环境,细菌密度高、数量多[4-5],患者长期使用钛材料过程中容易发生细菌感染,如种植体周围炎、义齿性口炎等[6-7]。目前,临床上对口腔细菌感染性疾病的防治多采用机械清洁、抗生素等方法,治疗效果不稳定,易造成抗生素滥用和口腔微生态失衡,使细菌产生耐药性[8]。
为了研究钛材料表面的抗菌改性,人们已做出多种尝试[9-10]。现阶段,口腔钛材料表面改性的抗菌剂可分为有机和无机两大类,有机抗菌剂(抗生素、抗菌肽等)存在易产生耐药菌株、易失活、易剥脱等问题[11];无机抗菌剂多以金属/金属氧化物为主,如银、铜、氧化锌等,具有广谱抗菌性[12-14]。氧化锌作为无机抗菌剂的重要代表,被证实可以通过破坏细菌细胞膜、产生活性氧自由基(reactive oxygen species,ROS)等可能的机制发挥抗菌作用[15-16]。纳米氧化锌由于具有高比表面积,对细菌的亲和力更强,抗菌效率也更高[17]。
常见的钛表面制备氧化锌的方法包括水热法、电泳沉积法、磁控溅射法等[18],但这些方法存在一些局限性,例如水热法制备过程耗时、涂层成分相对单一,电泳沉积和磁控溅射法在精确调控涂层厚度的参数上还需进一步优化改进等。20世纪70年代,芬兰的Suntola博士首次提出原子层沉积(atomic layer deposition,ALD)的概念,这是一种气相薄膜沉积技术,凭借其独特的自限制化学吸附过程,可以通过控制反应循环次数精确调控薄膜沉积厚度,最终在三维衬底上形成均匀、致密、高质量的纳米级目标薄膜[19-21]。
本实验拟利用ALD技术,在光滑纯钛表面制备不同沉积周期的氧化锌纳米薄膜,评估其理化性能和生物安全性,研究不同沉积周期的氧化锌对金黄色葡萄球菌的体外抗菌效果,为口腔新型抑菌钛材料的设计提供参考。
1 材料与方法
1.1 试剂与仪器
纯钛试件(TA3,盛达兴金属材料有限公司,中国),SiC砂纸(鹰牌,中国),抛光膏(美耐特,中国),丙酮、无水乙醇(分析纯,国药,中国),小鼠胚胎成骨细胞前体细胞(MC3T3-E1,ATCC,美国),α-MEM培养基(Gibco,美国),胎牛血清(Gibco,美国),青霉素-链霉素双抗溶液(Gibco,美国),磷酸盐缓冲液(PBS)(Gibco,美国),CCK-8试剂盒(Beyotime,中国),金黄色葡萄球菌(S.aureus, ATCC25923)(ATCC,美国),胰酪大豆胨培养基粉(TSB)(海博,中国),琼脂粉(Biofroxx,德国),4%多聚甲醛(Biosharp,中国),超声波清洗机(XO25-12DT,南京先欧仪器,中国),ALD反应仓(MNT-S200-L3S1,MNT Micro and Nano Co., Ltd,中国),场发射扫描电子显微镜(MAIA3-TESCAN,捷克),能谱仪(ULTIM MAX 170-OXFORD,英国),X射线衍射仪(Rigaku SmartLab SE,日本),水接触角检测仪(Dataphysics OCA20,德国),多功能酶标仪(SpectraMaxM2e,MD,德国),倒置显微镜(DMIL LED,Leica,德国),细菌浊度计(WGZ-2XJ,上海昕瑞仪器,中国)。
1.2 制备与表征
1.2.1 纯钛试件的制备 制备厚1 mm、直径分别为6、15 mm两种规格的圆片形纯钛试件。区分正反面,正面为实验面,反面刻有划痕作为区别。样品正面经400、600、800、1 000目的砂纸逐级打磨,并用1 500、2 000、3 000、4 000目直至10 000目的抛光膏逐级抛光,使表面光滑并呈现出金属光泽。分别用丙酮、75%乙醇和去离子水超声清洗样品各30 min,重复2次,烘箱烘干,真空包装待用。将试件随机分为4份,根据ALD技术参数的不同进行实验分组,A为光滑钛组,B为300循环组,C为600循环组,D为1 200循环组。
1.2.2 纯钛表面氧化锌纳米薄膜的ALD制备 使用ALD反应仓在钛片表面制备氧化锌薄膜,选择二乙基锌(DEZn)为锌源前驱体,水(H2O)为氧源前驱体,反应温度200 ℃,反应气压19 Pa,载气量20 mL/min。将钛片正面朝上摆放于反应仓的有效反应区内,水脉冲30 ms,氮气吹扫20 s,共50循环,之后开始反应过程:先通入二乙基锌脉冲30 ms,等待5 s,氮气吹扫25 s;再通入水脉冲30 ms,等待5 s,氮气吹扫30 s,以此为一个生长周期(循环)。此次实验制备300、600、1 200循环的共3组样品。反应方程式为:
Ti-OH + C2H5-Zn-C2H5→Ti-O-Zn-C2H5+ C2H6↑,
Ti-O-Zn-C2H5+ H2O→Ti-O-Zn-OH + C2H6↑。
1.2.3 场发射扫描电子显微镜(SEM)和能谱仪(EDS) 选择直径15 mm的A、B、C、D组试件,正面喷金后用SEM在200 000倍下观察表面形貌,同时在每个试件正面随机选取3个点,用EDS检测薄膜元素组成。
1.2.4 X射线衍射仪(XRD) 选择直径15 mm的A、B、C、D组试件,用XRD(靶材Cu,管电压40 kV,电流30 mA)检测薄膜的晶型。
1.2.5 水接触角 选择直径15 mm的A、B、C、D组试件,在正面随机选取3个点,用水接触角检测仪检测薄膜的亲水性。
1.2.6 椭偏仪 选择直径15 mm的B、C、D组试件,在正面随机选取3个点,用椭偏仪检测镀膜的厚度。
1.3 纯钛表面氧化锌纳米薄膜的细胞毒性
1.3.1 细胞培养 将冻存的MC3T3-E1细胞系体外复苏后,加入α-MEM培养基(含有10%胎牛血清、1%青霉素-链霉素双抗溶液),在37 ℃、95%相对湿度、5% CO2细胞培养箱中静置培养,每2~3 d换液。显微镜下观察细胞生长情况,待细胞密度达80%后进行传代。
1.3.2 CCK-8实验 选择直径15 mm规格的试件,清洗消毒后,按照ISO-10993-5标准制备A、B、C、D组样品浸提液,采用完全培养基浸泡钛片并放置于细胞培养箱中24 h。制备30 000个/mL的MC3T3-E1细胞悬液,按每孔100 μL的量接种于96孔板中,放入细胞培养箱中培养。24 h后,弃旧培养基,PBS润洗,每孔加入100 μL材料浸提液,培养1、3、5、7 d。在各时间节点取出孔板,加入CCK-8试剂,避光孵育2 h,用酶标仪检测各孔溶液在450 nm处的光密度,读取OD值并进行分析。
1.3.3 倒置显微镜观察细胞形态 同上述实验步骤,在材料浸提液培养细胞的第1、7天,用倒置显微镜观察各组细胞的形态,并进行对比分析。
1.4 纯钛表面氧化锌纳米薄膜的抗菌性评价
1.4.1 细菌培养 选择金黄色葡萄球菌作为抗菌性评价的实验菌株,配制灭菌的胰酪大豆胨液体培养基(TSB)和胰酪大豆胨琼脂培养基(TSA)待用。将冻存的金黄色葡萄球菌体外复苏,接种于TSA平板上,放入37 ℃、5% CO2细菌培养箱培养直至长出单菌落。用TSB培养基配制细菌悬液,细菌浊度计确定菌液浓度,稀释调整为1×106CFU/mL的密度待用。
1.4.2 光密度法 选择直径15 mm的A、B、C、D组试件放置于24孔板中,将金黄色葡萄球菌菌悬液以1×106CFU/mL的浓度接种在材料表面,每孔菌液1 mL,放入细菌培养箱培养,24 h后用酶标仪检测菌液的光密度值,读取OD值并进行数据分析。抗菌率计算公式为:抗菌率=(OD值光滑钛组-OD值实验组)/OD值光滑钛组×100%。
1.4.3 SEM观察细菌形态 选择直径6 mm的A、B、C、D组试件放置于96孔板中,将金黄色葡萄球菌菌悬液以1×106CFU/mL的密度接种在材料表面,每孔菌液100 μL,放入细菌培养箱培养,24 h后加入1 mL 4%多聚甲醛4 ℃冰箱过夜固定。之后样品用30%、50%、70%、80%、90%和100%的乙醇溶液梯度脱水10 min,室温下干燥。干燥后的样品表面喷金,用SEM观察各组样品表面的细菌形态。
1.5 统计学分析
实验结果采用SPSS22.0软件进行处理,定量数据的表示形式为平均值±标准差,通过单因素方差分析检验组间差异,采用LSD检验进行组间两两比较,P<0.05为差异有统计学意义。
2 结 果
2.1 理化性能结果
2.1.1 SEM结果 图1示,光滑钛片经过逐级打磨抛光,表面平滑,但仍可见细小的划痕和凹坑。B、C、D组镀有氧化锌薄膜的样品表面覆盖了致密、均匀的结晶层,具有明显的晶粒形状,未见裂纹、气孔等缺陷。随着沉积周期数的增加,B、C、D组镀膜的晶粒尺寸逐渐变大。

A:光滑钛组;B:300循环组;C:600循环组;D:1 200循环组
2.1.2 EDS结果 图2显示了各组样品内主要元素(Ti、Zn、O、C)含量的变化。A组不含有Zn元素,B、C、D组含有Zn元素,且Zn、O元素含量随着ALD沉积周期数的增加而增加。

A:光滑钛组;B:300循环组;C:600循环组;D:1 200循环组
2.1.3 XRD结果 如图3所示,对比标准物质数据库可知,35°~36°的衍射峰来自钛基底,30°~38°的另外3个衍射峰属于氧化锌晶体,分别为(100)、(002)、(101)3个晶面。A组未检测到明显的氧化锌晶体衍射峰,B、C、D组样品中,随着ALD沉积周期的增加,氧化锌晶体的3个衍射峰整体强度增强,半高宽(FWHM)变窄,未表现出对钛基底表面生长氧化锌晶体某一晶向的抑制。

A:光滑钛组;B:300循环组;C:600循环组;D:1 200循环组
2.1.4 水接触角 如图4所示,A组的水接触角为81.42°±1.89°,表现为亲水。B、C、D组样品的接触角较A组增加,表现为疏水,依次为100.15°±0.88°、97.32°±2.46°、103.70°±1.61°,与A组之间有显著的统计学差异(P<0.000 1)。B组与C、D组之间未表现出统计学差异,而C、D组之间存在统计学差异(P<0.05)。
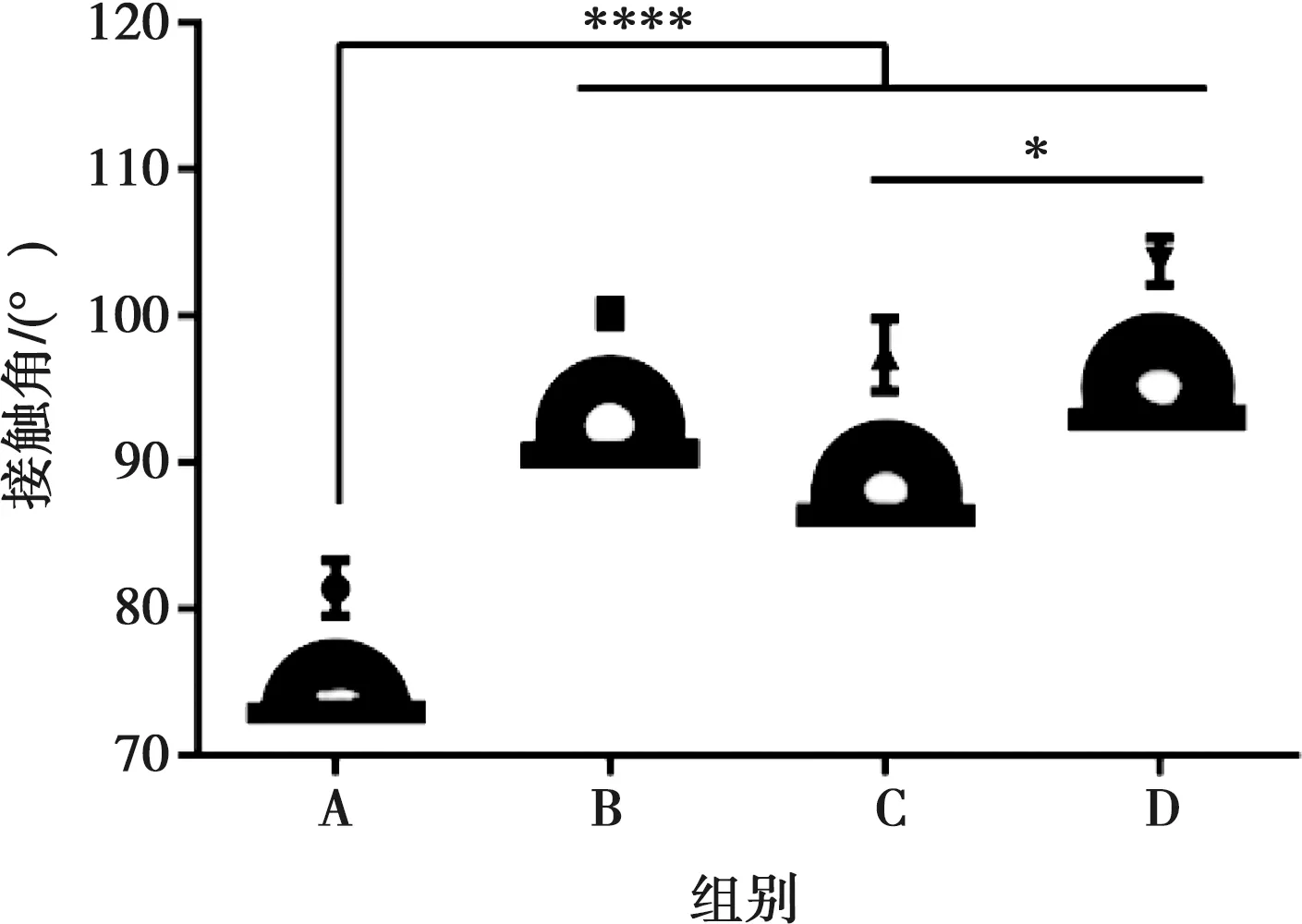
A:光滑钛组;B:300循环组;C:600循环组;D:1 200循环组;*:P<0.05,****:P<0.000 1
2.1.5 椭偏仪 B、C、D组试件表面氧化锌薄膜的厚度依次为(59.54±2.01)、(106.19±0.08)、(214.95±2.57)nm。对实验组试件的镀膜厚度进行线性拟合,分析得出氧化锌薄膜厚度与ALD沉积周期数之间存在线性关系(图5),氧化锌薄膜的生长速率(生长速率=镀膜厚度(Å)/循环数,10 Å = 1 nm)约为1.74Å/循环。

图5 椭偏仪结果的线性拟合Fig.5 Linear fitting of ellipsometer results
2.2 细胞毒性结果
2.2.1 CCK-8实验 如图6所示,经过1、3、5、7 d,A、B、C、D组浸提液共培养的MC3T3-E1细胞密度随时间增加而增大,且均未表现出明显的细胞毒性,组间无统计学差异。
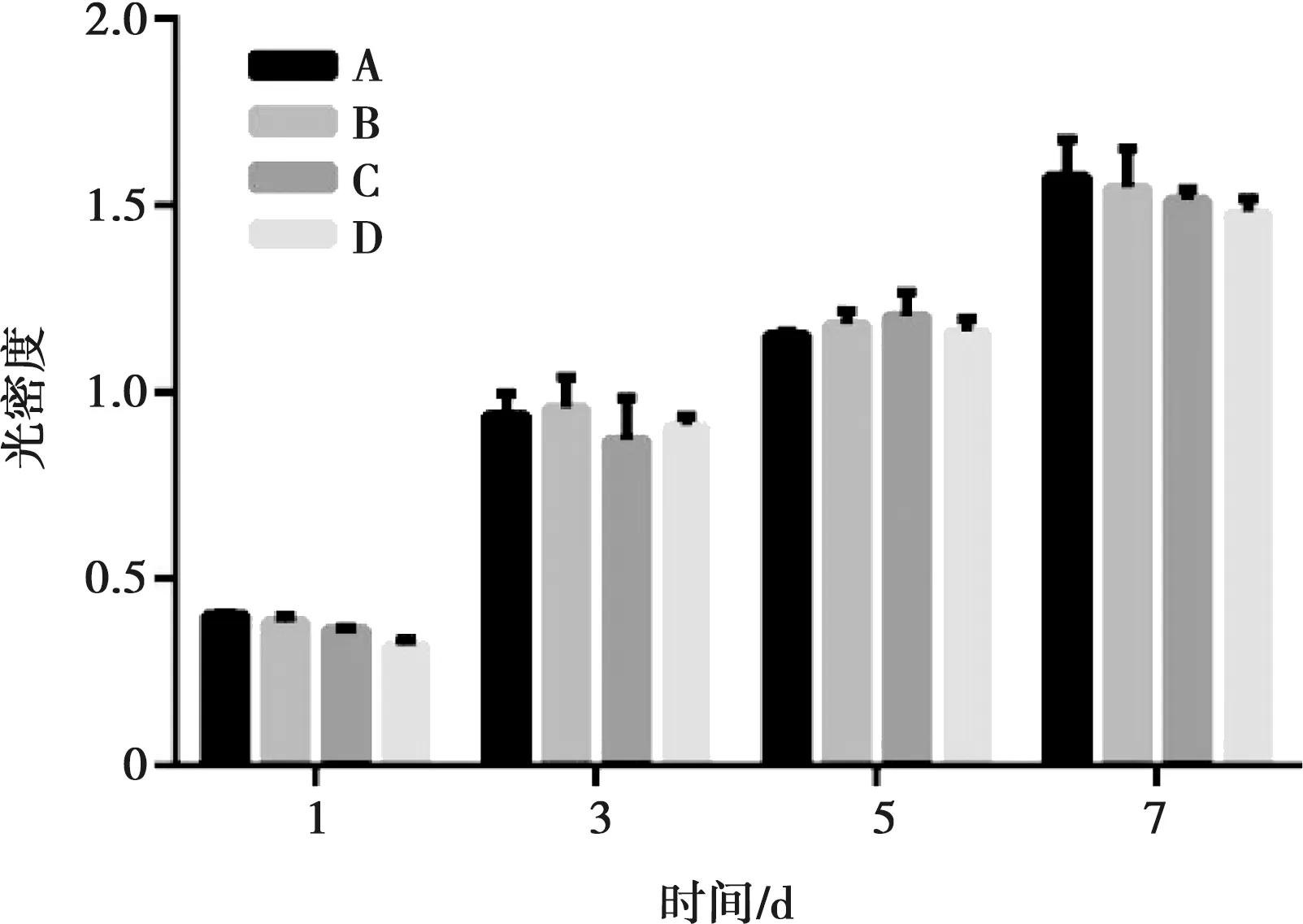
A:光滑钛组;B:300循环组;C:600循环组;D:1 200循环组
2.2.2 倒置显微镜观察细胞形态 如图7所示,第1、7天,A、B、C、D组浸提液共培养的MC3T3-E1细胞形态无明显差异,细胞贴壁生长,平铺伸展,呈现长梭形,细胞核、细胞膜边界清晰。

A:光滑钛组;B:300循环组;C:600循环组;D:1 200循环组
2.3 抗菌性评价结果
2.3.1 光密度法 如图8所示,与金黄色葡萄球菌共培养24 h后,B、C、D组与A组之间有较显著的统计学差异(P<0.001),B、C、D组组间的OD值均存在统计学差异(P<0.05);共培养48 h后,B、C、D组与A组之间存在较显著的统计学差异(P<0.001),B组与D组之间统计学差异显著(P<0.01),C、D组之间表现出统计学差异(P<0.05)。计算得培养24 h B、C、D组平均抗菌率依次为33.6%、51.4%和65.9%;培养48 h B、C、D组平均抗菌率依次为36.1%、40.5%和52.3%,均表现出明显的抗菌效果,其中D组抗菌效果最好。
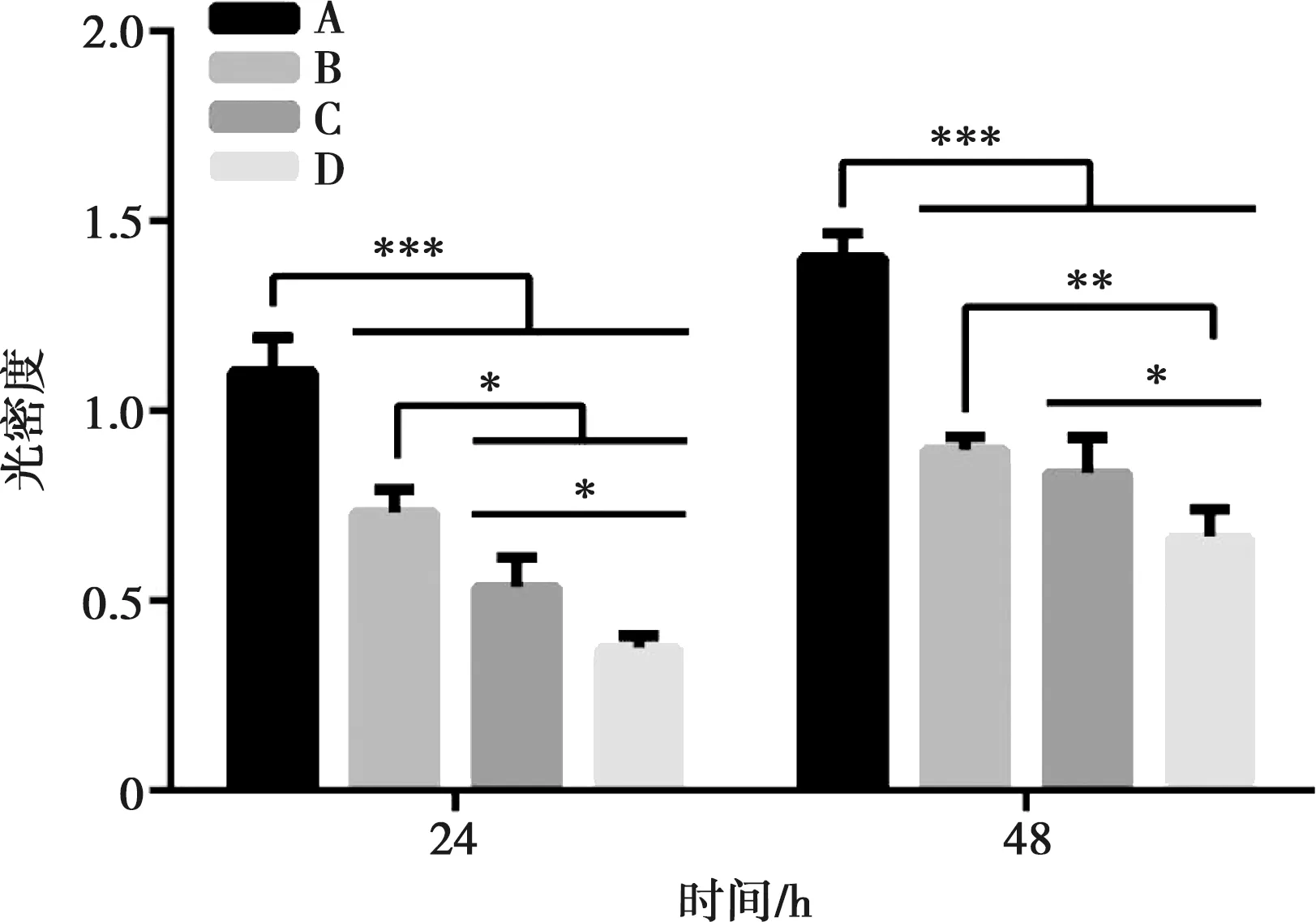
A:光滑钛组;B:300循环组;C:600循环组;D:1 200循环组;*:P<0.05,**:P<0.01,***:P<0.001
2.3.2 SEM观察细菌形态 如图9所示,A组表面的金黄色葡萄球菌呈现圆球形,表面光滑、完整,形态规则,成对或呈葡萄串珠状排列;B、C、D组表面的金黄色葡萄球菌形态出现了不同程度的变化,呈不规则皱缩,有些出现了细菌胞膜破裂。

A:光滑钛组;B:300循环组;C:600循环组;D:1 200循环组
3 讨 论
本研究利用ALD技术,在光滑纯钛表面分别制备了300、600、1 200循环的3组氧化锌纳米薄膜。通过SEM可以发现, 200 000倍电镜放大下的光滑钛表面平滑,可见一些细小的打磨划痕。沉积了氧化锌后,B、C、D组镀膜观察到均匀、致密的晶体层,晶粒尺寸随着沉积周期数的增加而增大。EDS结果表明,B、C、D组薄膜的主要元素组成为Zn、O,沉积周期数越大,Zn、O元素含量越高。结合XRD检测,证实B、C、D组薄膜成分为氧化锌晶体,出现了(100)、(002)、(101)3个晶面的特征性衍射峰,随着沉积周期数的增加,3个衍射峰整体强度增强,半高宽(FWHM)变窄。根据Scherrer公式,衍射峰的半高宽可以判断晶体晶粒尺寸的大小,半高宽越窄,意味着晶粒尺寸越大,晶体的结晶度越高[22],这个结果与本实验中SEM观察到的形貌一致。
椭偏仪结果显示,ALD制备的氧化锌薄膜厚度为纳米级,沉积周期与薄膜厚度之间符合线性关系,其生长速率约为1.74Å/循环,与文献提供的参考值1.6~1.9Å/循环相符[23]。综合上述实验结果,本实验制备的氧化锌纳米薄膜致密、均匀,生长速率稳定,有着通过改变沉积周期参数精准调控薄膜厚度的典型特点和优势。
细胞毒性CCK-8实验结果显示,4组样品浸提液培养的MEC3T3-E1细胞数量在1~7 d呈逐渐增长趋势,与光滑钛组相比,各实验组均未表现出明显的细胞毒性。倒置显微镜观察可见各实验组培养的细胞在1、7 d的形态与光滑钛组均无明显差别,细胞贴壁生长、形态良好。结合以上结果,B、C、D组氧化锌纳米薄膜具有良好的生物安全性。
本实验体外抗菌结果显示,B、C、D组氧化锌纳米薄膜24 h抗菌效果明显,抗菌率分别为33.6%、51.4%和65.9%;48 h后,菌液OD值有所上升,但各实验组的抗菌率依然维持在36.1%、40.5%和52.3%,D组在24 h和48 h的抗菌率是3个实验组中最高的,与B、C组之间存在统计学差异。Song等[24]的研究表明,材料的疏水性可以抑制细菌生物膜的黏附,口腔龈上环境的波动剪切作用也使得疏水表面的生物膜更易脱落。经检测,A组光滑钛的水接触角为81.42°±1.89°,表现为亲水,B、C、D组氧化锌薄膜的水接触角分别为100.15°±0.88°、97.32°±2.46°、103.70°±1.61°,较A组增大,表现为疏水。这种改变可能来自原子层沉积的反应过程,前驱体二乙基锌需要与基底材料表面的羟基进行结合,从而使材料带有锌元素,这个反应会消耗掉材料表面的羟基,使材料与空气界面表现为水接触角的增大。也有学者认为,ALD沉积金属氧化物的疏水性并非金属氧化物本身固有的特性,而是来自材料表面对碳氢化合物的吸附[25]。研究表明,亲水性的骨植入材料表面倾向于在植入初期促进细胞黏附与增殖分化[26-27]。然而,亲水性并非影响材料植入初期稳定性的唯一因素,材料的化学组成、表面形貌、粗糙度等也与之相关[28]。此外,临床推广的不同品牌、型号种植体的水接触角也存在巨大差异,有研究总结了部分商业种植体表面亲水性的现有发表数据,数值分布在0°~150°[28-29]。
目前,氧化锌的抗菌机制依然不明确,但结合文献可以大致归纳为3个方面:①释放游离锌离子破坏细胞膜的极性状态,或与胞内蛋白酶分子结合使之结构改变;②直接与细胞膜表面接触发生作用,使胞膜变性导致损伤;③受可见光激活产生大量氧自由基(ROS),破坏胞膜进入菌体内杀菌[15-16,30-31]。结合体外抗菌实验、椭偏仪实验结果及ALD反应过程可得,ALD沉积周期数越高则氧化锌薄膜的厚度越厚,氧化锌含量越高,可使更多的细菌胞膜变性、破坏直至细菌损伤,故D组表现出最好的抗菌效果。同时SEM观察可知,B、C、D组材料表面的金黄色葡萄球菌存在不同程度的皱缩和破裂,与A组正常状态下饱满、完整、串珠状外观形成鲜明对比,由此推测,氧化锌破坏了细菌的胞膜完整性。然而,该过程是否与产生ROS有关,有待进一步研究。此外,ALD技术参数调节对氧化锌纳米薄膜抗菌效应的具体影响、氧化锌锌离子释放与抗菌作用的关系等问题,也需更多的探索。
综上所述,本研究利用ALD技术在光滑纯钛表面制备了不同沉积周期的氧化锌纳米薄膜,薄膜均匀、致密,厚度随沉积周期数增加而增加,具有良好的生物安全性和明显的体外抗金黄色葡萄球菌效果,其中D组(1 200循环)在各实验组中抗菌效果最好。

