T2WI 联合DWI 用于直肠癌的诊断、术前分期效能及rADC、ADC 值与患者临床特征的相关性
郭 婧,高 洁,郭世欣,勾少波,贺燕林
直肠癌属于常见的消化系统恶性肿瘤,近年人均寿命延长、饮食结构改变等因素影响下直肠癌发病率呈逐年上升趋势[1]。 目前该病有效的治疗手段为手术治疗,但由于直肠癌早期症状不明显,部分患者就诊时病情已至中晚期,增加了治疗难度,不利于预后[2]。及早诊断、治疗是提高直肠癌患者5 年生存率的重要途径。 MRI 近年在各类肿瘤疾病诊断普遍应用,其良好的软组织分辨率为恶性病变的早期检出提供了有利条件[3]。 直肠癌的手术方式选取依赖于术前分期,MRI 检查中T2加权成像(T2-weighted imaging,T2WI)可良好显示受检者直肠系膜及腹膜反折情况,扩散加权成像(diffusion-weighted imaging,DWI)可显示肿瘤形态改变之前的功能性变化, 在部分研究中已报道T2WI 联合DWI 具有良好的术前分期效能[4]。 表观扩散系数(apparent diffusion coefficient,ADC)作为DWI检查肿瘤疾病的定量分析依据,在多种肿瘤疾病良恶性鉴别中具有重要参考价值[5]。 不过,关于ADC 在不同分化程度、不同病理分期的直肠癌患者间的差异情况仍需补充临床数据。笔者选择212 例患者为研究对象,就T2WI 联合DWI 用于直肠癌诊断、术前分期的效能及相对表观扩散系数 (relative apparent diffusion coefficient,rADC)、ADC 与患者临床特征的关系进行研究,望为临床诊断提供依据。
1 资料与方法
1.1 临床资料
选择2017 年6 月至2021 年6 月在内蒙古自治区人民医院收治的疑似直肠癌患者212 例,其中男性118 例,女性94 例;年龄42 ~83 岁,平均年龄60.93岁(标准差7.06 岁);病程3 个月~10 年,平均病程5.64 年(标准差1.25 年)。 该研究获得医院伦理委员会批准。
选择标准:①经X 射线片诊断为直肠病变患者;②患者有腹痛、排便困难等症状;③均接受MRI 及病理检查;④知情研究,已签署同意书;⑤此前未进行任何手术治疗、放射治疗、化学治疗。
排除标准:①体内植入磁性金属,无法进行MRI检查;②严重幽闭恐惧症;③认知功能障碍。
1.2 方法
1.2.1 MRI 检查
212 例患者进行MRI T2WI 序列联合DWI 检查。采用设备为德国西门子公司Verio 3.0 T MRI 扫描仪。体部相控阵表面线圈为8 通道,检查前一晚叮嘱患者禁食、禁饮。 检查时指导患者取仰卧位接受扫描。 矢状位T2WI 扫描,参数:重复时间(repetition time,TR)3 000 ms,矩阵256 × 256,视野(field of view,FOV)36 cm×36 cm,层厚0.4 cm,层间距0.3 mm,回波时间(echotime,TE)87ms;轴位T2WI 扫描,参数:TR451ms,FOV 32 cm×32 cm, 层厚4 mm, 层间距0.3 mm,TE 85 ms,矩阵269 × 384;冠状位T2WI 扫描,参数:TR 1 400 ms,层厚0.4 cm,层间距0.3 mm,TE 87 ms,FOV 40cm×40cm;矩阵256×256。DWI 轴位参数:TR6500,层厚0.4 cm,FOV 38 cm×38 cm, 层间距0.3 mm,TE 74 ms;矩阵326×384。 由2 名资历10 年以上影像科医师进行诊断,并利用软件进行DWI 分析,测量直肠癌ADC(b=800 s/mm2),并测量闭孔内肌ADC,rADC=直肠癌ADC/闭孔内肌ADC。
1.2.2 分期标准
参照2017 版欧洲肿瘤学会(European Society for Medical Oncology,ESMO) 提出的直肠癌原发灶(tumor,T)、淋巴结(node,N)、远处转移(metastasis,M)分期标准[6]。 T 分期标准:T1 期,肿瘤已侵及黏膜及黏膜下层;T2 期,已侵及固有肌层;T3 期,已穿透肌层深至周围脂肪;T4 期,周围脏器受肿瘤侵犯。 N 分期标准:N0 期,盆腔内淋巴结未见转移;N1 期,盆腔内淋巴结转移数量≤3 个;N2 期, 盆腔内淋巴结转移数量>3 个。
1.2.3 病理检查
手术治疗后采集患者肿瘤组织,进行甲醛溶液固定后给予石蜡包埋,4 ℃条件下保存。 切片后烘烘片,脱蜡处理后进行乙醇水化、抗原修复等操作,给予苏木精-伊红(hematoxylin-eosin,HE)染色,再进行脱水、透明、封片处理,于显微镜下观察,结合组织结构及细胞形态进行诊断。
1.2.4 观察指标
以病理诊断结果为金标准,计算T2WI 联合DWI诊断直肠癌及其T 分期、N 分期的准确度、灵敏度、特异度,并与病理诊断结果进行一致性检验;以不同分化程度、病理类型、良恶性等临床特征进行分组,观察rADC、ADC 值差异情况。
1.3 统计学方法
使用SPSS 21.0 软件处理数据。 计量资料采用均数± 标准差表示, 两组比较采用t 检验,3 组及3 组以上比较进行方差分析;两组比较t 检验,利用Kappa 值进行一致性检验。 绘制受试者工作特性(receiver operating characteristic,ROC)曲线,探究ADC、rADC 值对直肠癌的诊断效能。 P <0.05 为差异有统计学意义。
2 结果
2.1 病理组织诊断结果
术后病理诊断恶性172 例,良性40 例。T1 期、T2期、T3 期、T4 期 分 别 为8 例、35 例、31 例、6 例,N0期、N1 期、N2 期分别为37 例、22 例、21 例。
2.2 T2WI 联合DWI 诊断与病理诊断结果比较
2.2.1 T2WI 联合DWI 诊断病变性质与病理诊断结果比较
T2WI 联合DWI 诊断为直肠癌164 例,良性病变48 例。 T2WI 联合DWI 诊断准确度为92.45 %(196/212),灵敏度为93.02%(160/172),特异度为90.00%(36/40)。 见表1。
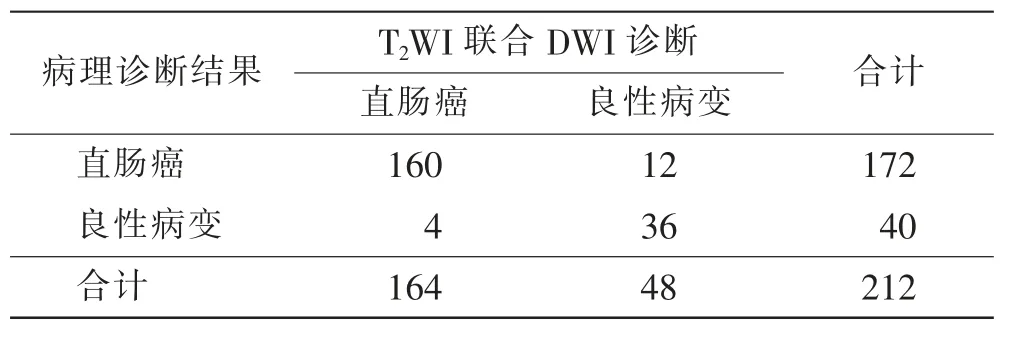
表1 T2WI 联合DWI 诊断与病理诊断结果比较 例Tab.1 Comparison diagnosis results between of T2WI + DWI examination and pathological diagnosis cases
2.2.2 T2WI 联合DWI 术前T 分期结果与病理诊断结果比较
T2WI 联合DWI 诊断为直肠癌且符合病理诊断结果的160 例患者,T2WI 联合DWI 诊断为T1 期、T2期、T3 期、T4 期分别为16 例、70 例、60 例、14 例。 表2 可知,T2WI 联合DWI 术前诊断T 分期总符合率为90.00%(144/160),其中T1 期、T2 期、T3 期、T4 期诊断准确度分别为95.00%、93.75%、96.26%、95.00%,灵敏度分别为75.00 %、94.12 %、93.55 %、71.43 %,特异度分别为97.22 %、95.65 %、95.92 %、97.26 %。一致性检验可知,T2WI 联合DWI 术前诊断直肠癌T分期与病理诊断结果一致性较好(Kappa=0.863,P=0.000,95%CI 0.797 ~0.930)。

表2 T2WI 联合DWI 术前诊断T 分期结果与病理诊断结果对比Tab.2 Comparison diagnosis results between T2WI+DWI preoperative T staging and pathological diagnosis
2.2.3 T2WI 联合DWI 术前诊断N 分期结果与病理诊断结果比较
T2WI 联合DWI 诊断为N0 期、N1 期、N2 期分别为76 例、40 例、44 例。表3 可知,T2WI 联合DWI 术前诊断N 分期总符合率为90.00%(144/160),其中N0 期、N1期、N2 期诊断准确度分别为93.75%、90.00%、96.25%,灵敏度分别为94.59%、77.27%、95.24%, 特异度分别为93.02%、94.83%、96.61%。T2WI 联合DWI 术前诊断直肠癌N 分期与病理诊断结果一致性较好(Kappa=0.844,P=0.000,95%CI 0.771 ~0.916)。
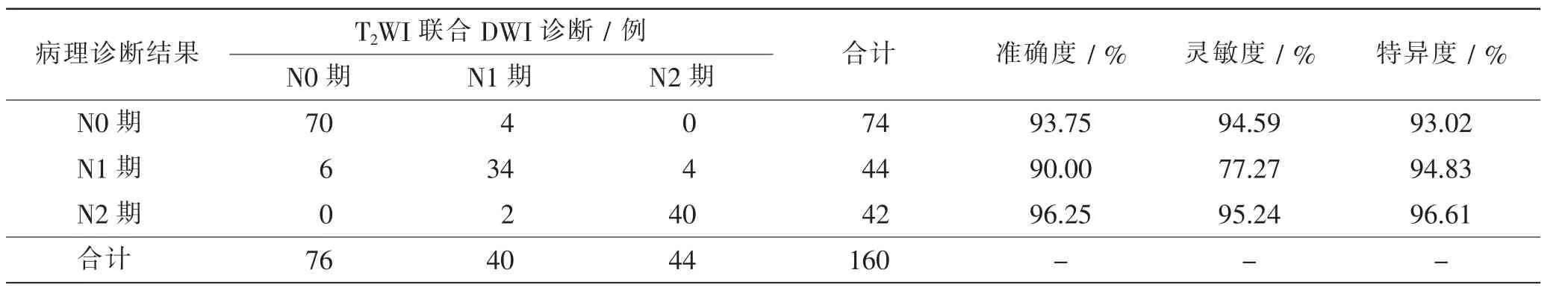
表3 T2WI 联合DWI 术前诊断N 分期结果同病理诊断结果比较Tab.3 Comparison diagnosis results between T2WI+DWI preoperative N staging and pathological diagnosis
2.3 ADC、rADC 在不同病变特征间的差异比较
良性病变及腺癌ADC、rADC 显著高于恶性病变及黏液腺癌(P <0.05), 不同分化等级病变间ADC、rADC 从高至低依次为高分化、中分化、低分化(P <0.05),高分化显著高于中分化、低分化(P <0.05),中分化显著高于低分化(P <0.05)。 见表4。

表4 不同病变特征的ADC、rADC 比较Tab.4 Comparison of ADC and rADC in different lesion characteristics
2.4 rADC、ADC 诊断直肠癌的效能
绘制ROC 曲线可知,ADC 诊断直肠癌曲线下面积(area under curve,AUC)为0.987,95%CI 0.976 ~0.999,P <0.001,灵敏度为92.44%,特异度为97.50%,最佳截 断 值 为1.225 × 10-3s/mm2。 rADC 诊 断 结 直 肠 癌AUC 为0.941,95%CI 0.862 ~0.985,P <0.001,灵敏度为92.44 %, 特异度为87.50 %, 最佳截断值为1.028×10-3s/mm2。 见图1。
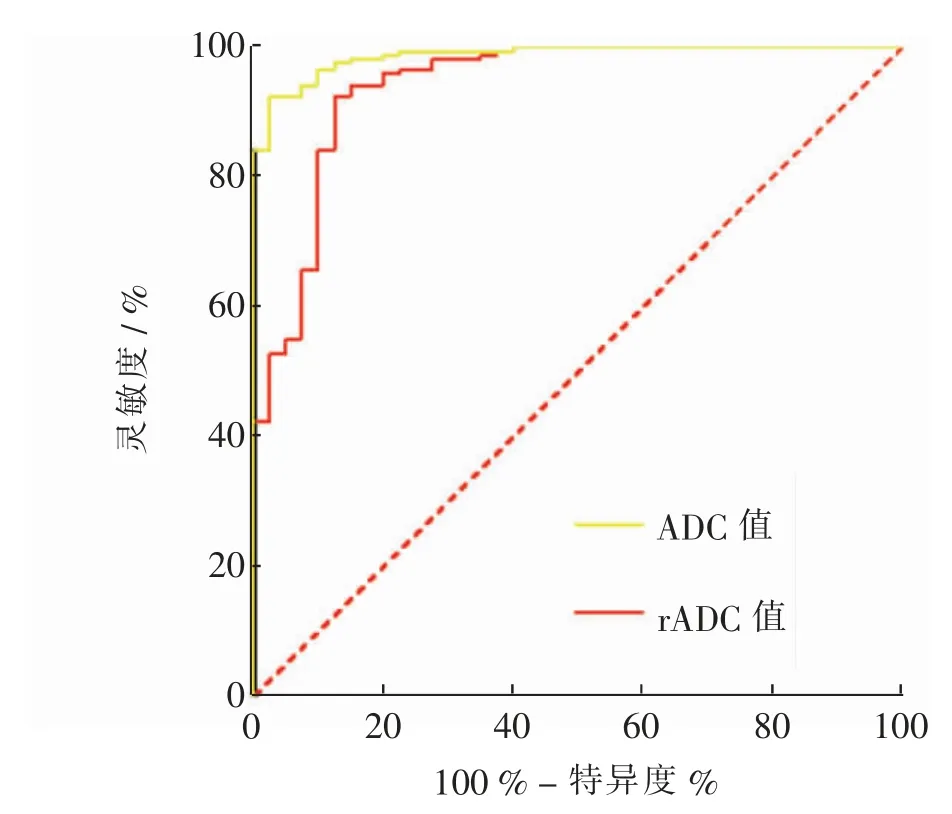
图1 rADC、ADC 诊断直肠癌的ROC 曲线图Fig.1 ROC curve of rADC and ADC in diagnosis of rectal cancer
3 讨论
在中国直肠癌占大肠癌比例约60%~70%;近年发病年龄有年轻化趋势,是威胁人们生命健康的常见疾病之一[7]。 及早确诊并进行相应干预对于改善患者预后具有重要意义。既往常用超声内镜进行肠道病变诊断, 但超声无法准确对肿瘤侵犯的直肠系膜、筋膜等进行显示,逐渐不能满足临床诊断需要[8]。 MRI作为软组织分辨率较高的影像学技术,T2WI 序列可多方位显示肿瘤、直肠系膜筋膜、病灶周围脏器,且检查无侵袭性,是直肠癌诊断及术前分期的有效手段[9]。但是, 由于人体多种组织及肠内容物均可能在MRI 检查时表现为高信号, 仅仅进行T2WI 检查也易出现误诊、漏诊[10]。
DWI 与其量化指标ADC 可连续评估受评估组织内水分子运动受限程度,有效反映组织细胞的生物学特点及病理状态[11]。 由于恶性肿瘤增殖速度快,促使水分子运动空间收缩,扩散运动受限,在DWI 检查中恶性肿瘤呈高信号,ADC 图呈低信号,而其他直肠炎性病变或良性肿瘤伴随的炎性细胞及良性肿瘤细胞增多, 对水分子扩散的影响程度较少, 在DWI 及ADC 图像中均呈高信号,因而通过DWI 及ADC 测量可进行肿瘤性质鉴别[12]。 笔者观察中利用T2WI 联合DWI 进行直肠癌诊断,结果显示诊断准确度为92.45%,灵敏度为93.02%,特异度为90.00%。 证实T2WI 联合DWI 诊断直肠癌具有良好诊断效能。
术前精准分期是制定手术方案、改善患者预后的重要因素。 在不同T、N 分期患者的治疗中,T1 及T2期肿瘤仅局限在肠壁,可利用手术直接切除,而T3 及T4 期患者术前往往需进行新辅助化学治疗, 待瘤体缩小后再行手术[13]。 通过T2WI 联合DWI 观察患者盆腹腔有无转移、淋巴结是否肿大、病灶周围组织受侵犯程度等情况,可对直肠癌患者进行术前分期诊断[14]。笔者观察中T2WI 联合DWI 诊断T 分期及N 分期的总符合率均达90%, 且与病理诊断结果一致性较好(Kappa=0.846、0.844,均P <0.001)。 证实T2WI 联合DWI 具有良好的术前分期效能。
ADC 作为DWI 测量水分子运动的量化指标,既往研究已证实其与肿瘤患者良恶性、肿瘤病理性质等具有密切关联[15]。 笔者观察中发现良性病变、腺癌患者ADC 及rADC 显著高于恶性肿瘤及黏液腺癌患者(P <0.05)。 究其原因,恶性肿瘤增殖速度更快,对水分子运动影响更大。 既往研究普遍报道黏液腺癌ADC 值较腺癌ADC 值更高,而笔者研究中多数黏液腺癌患者为黏液腺癌与非黏液腺癌的混合型,这导致对ADC、rADC 的观察与既往研究存在一定差异[16]。在肿瘤分化程度观察中, 不同分化程度的肿瘤ADC 及rADC 从高至低依次为高分化、中分化、低分化(P <0.05), 表明通过ADC 及rADC 可对直肠癌患者肿瘤分化程度进行有效鉴别。 究其原因,肿瘤不同分化程度直接影响细胞排列的紧密程度,随肿瘤细胞分化程度降低,水分子扩散受限程度上升。 ROC 曲线分析中ADC 及rADC 诊断直肠癌的AUC 均高于0.9,也证实该两项参数对直肠癌有良好诊断效能。 不过,由于笔者收集样本有限,T2WI 联合DWI 的直肠癌术前分期诊断结果和ADC 及rADC 测量结果可能与既往研究存在一定出入,需在后续研究补充样本予以完善。
综上所述,T2WI 联合DWI 具有良好的直肠癌诊断效能,且其术前T、N 分期符合率高,与病理诊断结果一致性较好,且ADC 及rADC 与患者肿瘤良恶性、病理类型、肿瘤分化程度有关。

