SD 大鼠乳鼠心房肌细胞间歇性低氧模型制备
谢竹馨月,王浩南,郭 涛,郭秋哲
心房颤动(atrial fibrillation,AF)是常见而严重的房性心律失常,AF 导致卒中、心力衰竭、认知障碍等将威胁患者生命和降低患者生存质量, 已成为严重的社会经济负担[1]。既往认为AF 主要发生于器质性心脏病患者,伴随AF 研究的深入和人类疾病谱变化,其他系统疾病如慢性阻塞性肺疾病、 阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA)、 慢性肾病、 肥胖人群亦可发生AF[2,3]。 OSA 特指上气道完全或部分阻塞导致睡眠状态下反复发作呼吸暂停和/或低通气,伴夜间打鼾、白天嗜睡等临床症状的一种综合征。 研究显示,21%~74%的AF 患者合并OSA,非瓣膜性AF 患者OSA 患病率甚至高达90%[4];AF 发生率与OSA 的严重程度正相关,夜间血氧饱和度降低的程度是OSA 患者发生AF 的强预测因子[5,6],OSA 已成为非瓣膜性AF 的主要病因之一。
目前认为,睡眠期间反复发生上气道塌陷引起的慢性间歇性低氧(intermittent hypoxia,IH)、微觉醒和胸腔负压变化等病理生理因素相互协同, 共同导致AF 易感。 然而现行的持续正压通气治疗OSA 并不能完全降低AF 发生率[7,8],原因可能是缺乏对OSA 致AF机制的清晰认识。现主要通过调节环境O2浓度对动物实施周期性低氧/复氧刺激,构建模拟OSA 的慢性IH动物模型[9,10]。但在体实验受神经-体液诸多因素干扰,难以准确反映单一因素的生物学效应。体外培养心肌细胞既能保持其原有结构及功能,又能排除神经-体液干扰,可有效反映心肌细胞电生理特性、信号传导通路及基因表达[11],在补充和完善在体实验结果、丰富研究内容、提高研究准确度方面有重要作用。 目前已有使用肺腺癌细胞等细胞株模拟OSA 构建IH 细胞模型的报道[12],但利用原代心房肌细胞模拟OSA构建IH 模型尚无报道。 成功构建心房肌细胞IH 模型对阐明OSA 致AF 的分子生物学机制具有重要意义。
笔者分离、纯化、鉴定和培养SD 大鼠乳鼠原代心房肌细胞,利用IH 干预模拟OSA 构建心房肌细胞体外IH模型。检测不同刺激条件下心房肌细胞活力变化、缺氧诱导因子-1α (hypoxia-inducible factor-1α,HIF-1α)、剪切的含半胱氨酸的天冬氨酸蛋白水解酶-3(cleaved cysteinyl aspartate specific proteinase-3,cleaved caspase-3)和缝隙连接蛋白43(connexin 43,Cx43)表达的变化,评价建模效果,探索IH 致AF 的分子机制,为研究OSA 与AF 的关系提供体外实验方法和依据。
1 材料与方法
1.1 实验材料与试剂
1.1.1 实验动物
选择SPF 级1 ~3 d 龄SD 大鼠乳鼠30 只,雌雄不限。 由昆明医科大学实验动物中心提供,动物使用许可证号SCXK(滇)K2020-0004。
1.1.2 实验试剂与仪器
达氏修正伊氏培养液 (Dulbecco’s modified Eagle’s medium,DMEM)(批号2033115)、磷酸缓冲盐溶液(phosphate buffered saline,PBS)(批号0033519)、新生牛血清(批号1927731)、青霉素-链霉素溶液(批号1950172)(BioInd,以色列);马血清(批号1832764。Giboco/Invitrogen,美国);山羊血清(批号904W051)、Brdu 5-溴-2'-脱氧尿苷(批号4086231)、 胶原酶Ⅱ(批号701J021)、曲拉通X-100(批号829I0212)(索莱宝,中国);胰蛋白酶1 ∶250(批号A0801A。 美伦生物, 中国);MTS CellTiter 96®AQueous One Solution Reagent 试剂盒(批号406301。 Promega,美国);Anti ɑ-tubulin 抗体(批号66031-1-Ig)、辣根过氧化物酶(horseradish peroxidase,HRP)-Goat Anti-Mouse IgG(批号20000191)(Proteintech,美国);Anti-HIF-1 alpha 抗体(批号GR3228170-12)、Anti-caspase-3 抗体(批号GR219726-22)、Anti-Connexin 43 antibody (批号GR3287932-4)、 山羊抗兔IgG H&L (HRP)(批号GR3307521-1)、 山羊抗小鼠IgG (Alexa Fluor@488)(批号GR3256397-1)、α 横纹肌辅肌动蛋白 (antisarcomeric alpha actinin) 抗体 (α-SCA 抗体)(批号GR3296454-1)、 封固剂4',6-二脒基-2-苯基吲哚(4',6 -diamidino -2 - phenylindol,DAPI) ( 批 号GR3353352-3)(Abcam, 美国);4%多聚甲醛通用型组织固定液(批号69100900。 Biosharp,中国)。
正常细胞培养箱、三气细胞培养箱(Heal force,中国);倒置相差显微镜(Olympus,日本);倒置荧光显微镜(Nikon,日本);Amersham Imager 600 凝胶成像系统(美国通用电气公司)。
1.2 方法
1.2.1 心房肌细胞原代培养
用75%乙醇溶液清洗乳鼠表面皮肤, 剪开胸骨取出心脏,并置于预冷的含1%双抗的PBS 中;更换另外一套无菌器械,修剪去除心室组织,保留薄壁松软的心房组织,反复漂洗去除血液;将组织块剪成1 mm×1 mm×1 mm 大小的碎块, 再转移至离心管中。 加入0.05%胶原酶Ⅱ和0.05%胰蛋白酶混合液,于37 ℃水浴消化5 ~10 min(边消化边晃动离心管),使用等体积含10%新生牛血清的DMEM 高糖培养液终止消化,自然沉淀后收集上清液,重复以上操作7 ~10 次(弃去第一次消化获得的上清液,最后一次消化后经100 μm 无菌细胞筛过滤后移入离心管)。在1 000 r/min 室温离心5 min 后弃上清液, 使用含10 %马血清的DMEM 高糖培养液重悬细胞, 放入37 ℃、体积分数5%CO2细胞培养箱中差速贴壁培养80 min 后,可将成纤维细胞及上皮细胞等大部分贴壁较快的细胞去除。 随后平稳取出细胞培养瓶,吸出细胞悬液。 按5×105/mL 将细胞接种于6 孔板中,并加入Brdu 抑制成纤维细胞生长,最后放入37 ℃、体积分数5 % CO2常氧培养箱中。 培养24 h 后换不含Brdu 的培养液, 于倒置显微镜下观察细胞形态、大小、贴壁情况、搏动情况等并拍照记录。
1.2.2 心房肌细胞鉴定
当心房肌细胞培养48 h 后,吸去培养液,用PBS洗涤3 次。 加入4%多聚甲醛溶液固定细胞30 min,再用PBS 浸洗3 次, 每次5 min。 加入0.1% 曲拉通X-100 室温通透20 min,PBS 浸洗3 次后加入10%山羊血清,每孔室温封闭1 h。吸去封闭液,将α-SCA 抗体用1%牛血清白蛋白(bovine serum albumin,BSA)按1 ∶200 稀释,于4 ℃条件下过夜孵育。次日,使用PBS 浸洗3 次(每次5min)后,加入山羊抗小鼠IgG(Alexa Fluor@488)并用1%BSA 稀释使其质量浓度为2 μg/mL,室温下避光孵育1 h 后,用PBS 清洗3 次(每次5 min),滴加3 ~4 滴封固剂DAPI, 对细胞核进行染色和封片,室温下孵育5 min。吸走DAPI,用PBS 清洗。在荧光显微镜下观察并摄片。于200 倍放大显微镜下任选10 个视野,计数阴性细胞数和细胞总数,阳性细胞率(%)=(细胞总数-阴性细胞数)/细胞总数×100%。
1.2.3 构建心房肌细胞间歇性低氧模型
将培养的心房肌细胞随机分常氧组、IH 6 h 组(6 h IH 组)、IH 12 h 组(12 h IH 组)、IH 24 h 组(24 h IH 组)和IH 48 h 组(48 h IH 组)5 组。 常氧组培养24 h 后,使用不含血清的DMEM 高糖培养液对细胞进行同步化处理4 h。随后将培养液更换为含10%马血清的DMEM 高糖培养液。 将常氧组放入正常细胞培养箱,将6 h IH 组、12 h IH 组、24 h IH 组和48 h IH组放入三气培养箱,以体积分数5%O230 min+21%O230 min 为1 个循环,分别培养6、12、24、48 h。
1.2.4 四唑氮化合物法检测心房肌细胞活力
用IH 干预完成后,将不同组心房肌细胞消化后接种于96 孔板中(按104/孔加入细胞悬液,每孔100μL),设置只含培养液无细胞的空白对照。 每100 μL 培养液加四唑氮化合物[3-(4,5-dimethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2Htetrazolium,inner salt,MTS]试剂20 μL,置于37 ℃、体积分数5%CO2环境孵育2 h。 选择490 nm 波长,酶标仪测定光密度(optical density,OD)值,每个样品设置4 个复孔取平均值。
1.2.5 Western blot 检测各组caspase-3、HIF-1α 和Cx43 表达
提取各组细胞总蛋白,用二辛可酸(bicinchoninic acid,BCA)法测定各组细胞的总蛋白浓度,分别配制压缩胶和分离胶,上样后蛋白电泳(80 V 恒压30 min,120 V 恒压1 h)、湿法转膜(290 mA 恒流转膜120 min)。转膜完成后洗膜3 次(每次5 min),然后用5%脱脂奶粉室温封闭90 min,洗膜3 次后加入一抗(HIF-1α稀释倍数为1 ∶2 000,caspase-3 稀释为1 ∶5 000,Cx43稀释为1 ∶2 000,内参ɑ-Tubulin 稀释为1 ∶5 000),4 ℃条件下过夜孵育。 次日,将膜取出,洗膜3 次(每次5 min);随后加入对应的二抗(稀释为1 ∶5 000)室温孵育90 min,洗膜3 次,每次10 min。 滴加显影液后置于Amersham Imager 600 凝胶成像系统拍照,以ɑ-Tubulin 作为内参, 各目的蛋白与内参条带灰度比值作为其相对表达量,分析各组蛋白表达量。
1.3 统计学方法
使用SPSS 20.0 进行统计分析。 数据均采用均数± 标准差表示, 多组间比较采用单因素方差分析,采用LSD 法两两比较。 P<0.05 为差异有统计学意义。
2 结果
2.1 SD 大鼠乳鼠心房肌细胞的分离、培养及鉴定结果
体外培养24 h 后,心房肌细胞全部贴壁,呈长梭形或三角形,核仁清晰可见,个别细胞可见自律性搏动(图1 左);培养48 h 后,细胞伸展,折光性好,可见菊型细胞团形成,有规律性搏动(图1 中);培养72 h后,心房肌细胞体积变大,相互交联,形成片状,搏动节律一致(图1 右)。 采用α-SCA 抗体免疫荧光法鉴定心房肌细胞,α-SCA 阳性表达为绿色荧光,蓝色为DAPI 复染的细胞核(图2)。 随机计数10 个视野,心房肌细胞培养48 h 时,α-SCA 阳性细胞率达85%~90%。

图1 光学显微镜下心房肌细胞原代培养24 ~72 h(200×)Fig.1 Images of cultured neonatal rat atrial myocytes at 24-72 hours(200×)

图2 免疫荧光染色鉴定心肌细胞(左200×,右400×)Fig.2 Images of cardiomyocytes identification by immunofluorescence staining(left 200 ×,right 400×)
2.2 间歇性低氧对心房肌细胞活力的影响
不同组心房肌细胞经IH 干预后,在光学显微镜下均可见部分死亡细胞悬浮于培养液中。 MTS 法检测心房肌细胞活力,常氧组、6 h IH 组、12 h IH 组、24 h IH 组、48 h IH 组OD 值 分 别 为1.66 ± 0.12、1.38 ±0.14、1.69±0.08、1.70±0.18、2.19±0.17(F=16.391,P<0.001)。 6 h IH 组OD 值较常氧组明显下降,但随IH 干预时间延长,OD 值逐渐上升;48 h IH 组OD 值甚至高于常氧组,差异有统计学意义(P<0.05)。 5 组两两比较,差异有统计学意义(P<0.05)。
2.3 间歇性低氧对心房肌细胞各类蛋白的影响
常氧下HIF-1α 不能稳定表达,但心房肌细胞经IH 6 h、12 h、24 h 和48 h 干预后, 随IH 时间延长,HIF-1α 蛋白表达水平逐渐增高,48 h IH 组增高最明显(P<0.05)。6 h IH 组cleaved caspase-3 的表达量较常氧组略升高, 随后开始下降并保持较稳定的水平;12 h IH、24 h IH、48 h IH 组的表达量较6 h IH 组明显下降(P<0.05);与常氧组比较,12 h IH 组和24 h IH组cleaved caspase-3 表达量降低(P<0.05)。 Cx43 蛋白表达随IH 干预时间延长呈先下降后趋于平稳的趋势;6 h IH 组、12 h IH 组、24 h IH 组、48 h IH 组Cx43表达均较常氧组明显降低(P<0.05),但各IH 干预组间差异无统计学意义。 见表1、图2。
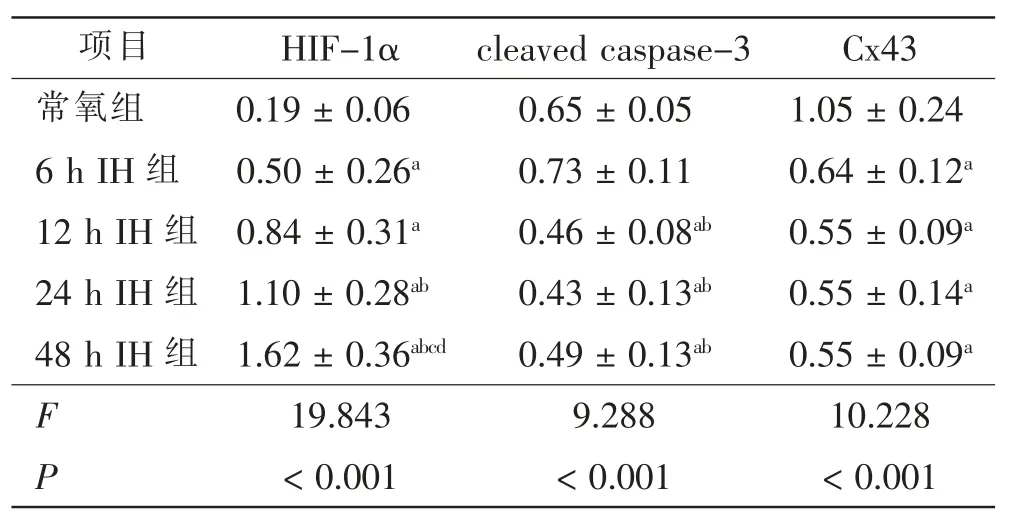
表1 不同组别HIF-1α、cleaved caspase-3、Cx43 蛋白水平比较Tab.1 Comparison of HIF-1α, cleaved caspase-3 and Cx43 protein levels in each group
3 讨论
OSA 是高血压、冠心病、心力衰竭、AF 等心脑血管疾病的独立危险因素,其主要病理生理机制是IH。目前主要通过低氧舱、手术或干预动物呼吸规律来构建OSA 致AF 的动物模型,这些动物模型均观察到心房电-解剖重构和AF 易感性增加[13,14]。 然而在体研究受神经-体液诸多因素干扰,难表征单一刺激因素对信号转导通路和基因表达的影响。体外细胞实验具有选择性高、周期短、依从性高、易重复等优点,可弥补在体实验的不足。 H9c2 心室肌细胞表现出与原代心肌细胞相似的氧化损伤特性, 被广泛应用于构建缺血/再灌注模型。 Li G 等[15]利用三气培养箱以体积分数5%O230 min+ 体积分数21%O230 min 为1 个循环,成功构建IH 致H9c2 心室肌细胞肥厚的模型。但H9c2 细胞缺乏自律性和收缩性,不具备心肌细胞特有的电生理特性,不能客观、真实观察到心肌细胞电传导、收缩功能和相关信号通路的变化。 笔者复习文献, 利用SD 大鼠乳鼠心房肌细胞构建IH 模型并优化实验条件, 模拟OSA 状态下心房肌细胞反复低氧/复氧、不缺血的状态,探讨不同IH 刺激时长对细胞活力及相关蛋白表达的影响,探寻OSA 致AF 的可能机制。 结果显示,IH 引发的HIF-1ɑ 蛋白表达上调呈时间依赖性;OD 值随IH 刺激时间延长先降低后升高;cleaved caspase-3 表达呈先升后降并逐渐趋于稳定;Cx43 表达因IH 刺激而下调但无时间依赖性。
图3 不同组HIF-1α、cleaved caspase-3、Cx43 蛋白表达水平电泳图Fig.3 Electrophoretogram of HIF-1α, cleaved caspase-3 and Cx43 protein expression levels in different groups
HIF-1 是低氧诱导因子家族的成员,由组成性表达HIF-1β 亚基和氧浓度调节亚基HIF-1ɑ 组成。HIF-1ɑ 在常氧条件下不能稳定表达。 细胞缺氧时,HIF-1ɑ 降解减少并与HIF-1β 形成异源性二聚体,在转录激活因子作用下与靶基因结合,有利于细胞在低氧环境中存活[16]。 研究显示,HIF-1α 在IH 刺激下持续高表达[17,18],可用作IH 干预成功的标志。 笔者研究发现,HIF-1α 蛋白表达量随IH 干预时间延长逐渐增加,说明该IH 模型可有效模拟OSA 过程。
caspase-3 是细胞内最重要的凋亡蛋白之一,cleaved caspase-3 是caspase-3 被剪切后激活形成、具有催化功能并诱导细胞凋亡的关键因子[19],其表达量直接反映细胞凋亡的程度。缺氧可导致心肌细胞凋亡、 介导心脏结构重构、 诱导AF 发生和维持[20,21]。MTS 是一种新型四唑化合物, 可被代谢活跃细胞内脱氢酶产生的还原型辅酶II 或还原型辅酶I 还原为有色的甲臜产物,直接溶解于培养液。 490 nm 处OD值代表甲臜产量,OD 值越高则细胞活力越强。 药物处理、培养条件改变、理化刺激可影响细胞活力。一般而言,反复IH 导致细胞能量代谢异常、细胞活力变化、加速细胞过氧化损伤甚至细胞凋亡[22~24]。 而笔者研究实施的IH 刺激未导致大量心肌细胞死亡和活力下降,间接证明此建模方法安全、可行。IH 刺激时长、循环次数、缺氧程度对细胞有不同效应。 杨胜昌等[25]发现,高频IH(体积分数1%O27 min+体积分数21%O23 min 为1 个循环) 刺激下细胞活力低于中频组(体积分数1%O220 min+ 体积分数21%O210 min为1 个循环);Chang JC 等[26]观察到,体积分数5%O230 min + 体积分数21 % O230 min 为1 个循环持续96 h 的IH 刺激可降低心室肌细胞过氧化损伤,提高细胞活力,减少细胞凋亡,有利于细胞存活。 笔者推测,IH 引发的细胞活力和cleaved caspase-3 表达水平变化未完全呈现时间依赖性,与IH 刺激调控了某些基因的表达、改善了心房肌细胞对IH 刺激的适应性可能有关。
Cx43 是心肌细胞间缝隙连接的重要蛋白分子,在调节心肌细胞动作电位传导速度和方式及心脏同步收缩中起重要作用。Cx43 表达量、分布和磷酸化异常可影响心肌细胞间兴奋传导的速度和方向,引发折返激动[27]。Cx43 表达异常普遍存在于AF 的病理生理过程, 不同病因AF 患者的心房组织中均可观察到Cx43 表达异常。 研究显示,OSA 合并AF 患者的血清Cx43 基因表达水平较无AF 患者明显下降[28];OSA 致AF 的动物模型也观察到心房组织中Cx43 表达下降、分布异常、传导速度减慢和AF 易感性增加[14,29]。 动物实验难于确保Cx43 的改变只与IH 有关而非神经-体液因素干扰所致。 笔者研究则证实IH 刺激可直接降低心房肌细胞Cx43 表达的水平, 提示Cx43 重构先于AF 发生,可能在AF 发生和维持中扮演重要角色。
4 结论
以体积分数5 % O230 min + 体积分数21 % O230 min 为1 个循环对SD 大鼠乳鼠离体心房肌细胞施加IH 刺激,HIF-1ɑ 表达呈时间依赖性增加, 较长时间IH 刺激下,SD 大鼠乳鼠心房肌细胞仍可存活,该方法成功构建的IH 心房肌细胞模型的制备。IH 刺激下调心房肌细胞Cx43 的表达可能是IH 诱发AF的分子机制之一,而IH 刺激是否可以改变心房肌细胞膜电位水平从而诱发AF,仍待进一步探索。笔者研究为探究OSA 导致AF 的机制提供了方法学基础。

