低分割同期推量调强放疗联合贝伐珠单抗治疗脑胶质瘤的临床效果
范娟,杨东方,王森,王丽森,唐森
(驻马店市中心医院 a.放疗科;b.肿瘤内科;c.神经内科,河南 驻马店 463000)
脑胶质瘤是多因素引发的在中枢神经系统发生的原发性颅内恶性肿瘤,在颅内肿瘤中占比40%~50%,且恶性程度较高[1-2]。手术切除是治疗该病首选方式,但因其生长浸润性特征导致病灶无法彻底切除,术后辅助放疗是预防其复发的主要方式[3],随着放疗技术不断发展进步,低分割同期推量调强放疗可最大程度保护周围正常组织,并提高治疗剂量,具有明显生存优势[4-5]。但研究表明,术后胶质瘤放疗敏感性较差,预防复发价值有限[6]。近年来研究显示,过表达血管内皮生长因子(vascular endothelial growth factor,VEGF)是致使肿瘤浸润性生长重要原因,而贝伐珠单抗作为一种靶向VEGF药物,对VEGF生物学特征可发挥特异性拮抗功能[7]。但临床有关低分割同期推量调强放疗与贝伐珠单抗联合治疗脑胶质瘤的研究较少,因而本次开展此项研究,结果如下。
1 资料和方法
1.1 一般资料选取2018年4月至2021年4月在驻马店市中心医院治疗的脑胶质瘤患者66例为研究对象进行前瞻性研究。(1)纳入标准:①经术后病理检查诊断明确为脑胶质瘤;②临床分级Ⅲ、Ⅳ级;③手术方案为部分切除或全部切除肿瘤。(2)排除标准:①合并其他肿瘤;②精神疾病;③近期采用中药治疗或抗生素治疗;④免疫系统疾病;⑤重要器官严重功能不全;⑥严重内分泌疾病、血液疾病或骨髓储备功能异常;⑦复发脑胶质瘤;⑧放疗禁忌证。按随机数字表法分为研究组33例、对照组33例,两组一般资料经统计学分析具有可比性(P>0.05),见表1。本研究取得医院医学伦理委员会审批,且患者均知情同意。
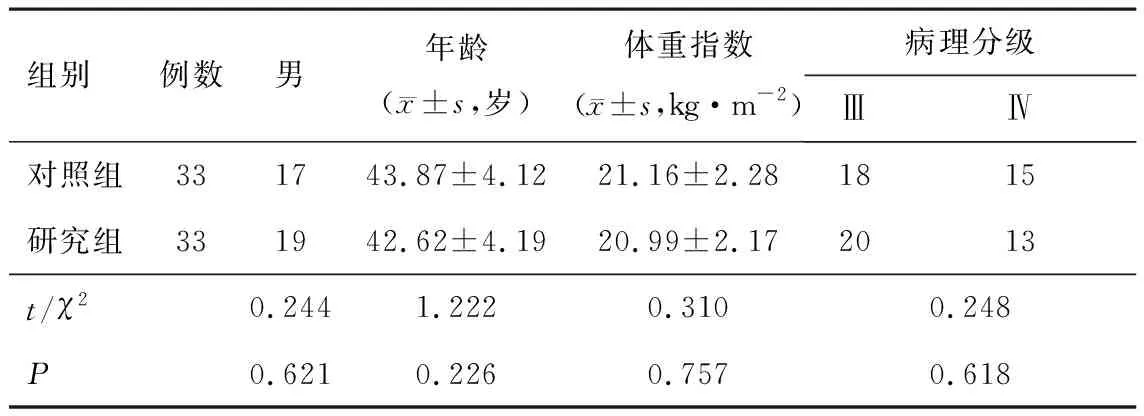
表1 一般资料比较
1.2 治疗方法
1.2.1对照组 治疗方式为低分割同期推量调强放疗。(1)患者于术后3~6周间行CT模拟定位,平卧双手与身体平行放置,热塑面膜于60~70 ℃水箱进行软化处理,沥干水分后固定头部,完全冷却后制成个体化面罩。戴面罩CT扫描,层厚3 mm,平扫与增强连续扫描,所得图像经内部网络传导至治疗计划系统工作站,进行图像构建。(2)根据患者CT、MRI图像在平扫CT图像上进行靶区逐层勾画,靶区定位。肿瘤靶区(GTV):MRI强化区域与T2Flair高信号区域。临床靶区(CTV)1:GTV外扩1 cm,并根据正常组织结构适当调整,全部包括原瘤床区域。CTV2:GTV外扩2.5~3 cm,并适当调整,最大程度避开重要器官。计划靶区(PTV):包含计划肿瘤靶区(PGTV)、计划临床靶区(PCTV)1、PCTV2,由以上3个靶区外扩3 cm获取,并适当调整,避开重要器官。(3)制定动态调强放射治疗计划:PGTV剂量给定64 Gy、PCTV1剂量给定60 Gy、PCTV2剂量给定54 Gy,分27次完成,单次剂量选择分别为2.37 Gy、2.22 Gy、2.00 Gy,每日1次,每周5次,在6周内完成全部治疗。海马剂量:健侧海马Dmax常规低于12 Gy,可放宽至20~24 Gy;患侧海马Dmax低于24 Gy,Dmean低于12 Gy。由6MV-X线直线加速器执行计划,首次治疗前验证锥形束CT(CBCT),校正位置误差可接受或无误差后开展治疗,后续每隔1周进行1次CBCT验证,确保精确治疗位置。
1.2.2研究组 接受低分割同期推量调强放疗联合贝伐珠单抗治疗:500 mL生理盐水中加入5~10 mg·kg-1贝伐珠单抗,行静脉滴注,2~3周重复1次,共治疗3个月。
1.3 观察指标
1.3.1疗效 按实体瘤疗效判断标准[8]评估疗效,共包括4个等级:进展(progressive disease,PD)、稳定(stable disease,SD)、部分缓解(partial remission,PR)、完全缓解(complete remission,CR)。疾病控制率(disease control rate,DCR)为SD、PR、CR所占比率之和,治疗有效率(response rate,RR)为PR、CR所占比率之和。
1.3.2肿瘤标志物与免疫因子 采集晨空腹静脉血2 mL,离心取上清液,采用酶联免疫吸附试验法检测表皮生长因子(endothelial growth factor,EGF)、白细胞介素-2(interleukin 2,IL-2)、VEGF、白细胞介素-6(IL-6)、可溶性白细胞介素-2受体(soluble interleukin-2 receptor,SIL-2R)、多效生长因子(pleiotrophin,PTN)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、免疫球蛋白E(immunoglobulin E,IgE)水平。
1.3.3不良反应 比较两组治疗期间不良反应发生情况,包括恶心、呕吐、白细胞减少等。
1.3.4生存情况 自手术起截止末次随访时间(2022年2月),观察记录患者总生存时间(分组至死亡发生时间)。
2 结果
2.1 疗效研究组疗效与对照组相比更好,且DCR、RR率优于对照组,差异有统计学意义(P<0.05)。见表2。
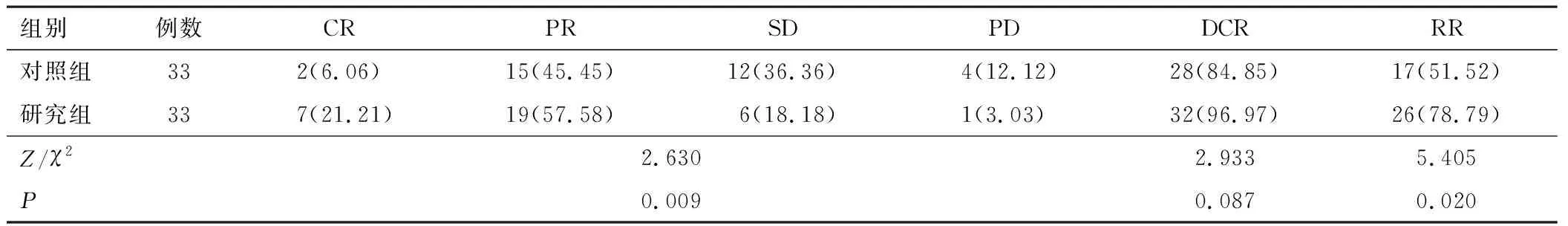
表2 两组疗效比较[n(%)]
2.2 肿瘤标志物、免疫因子治疗后,两组IL-2、IL-6、TNF-α、VEGF、EGF、IgE水平均降低,SIL-2R、PTN水平均升高(P<0.05);且研究组IL-2、IL-6、TNF-α、VEGF、EGF、IgE、SIL-2R、PTN水平均较对照组更低(P<0.05)。见表3。
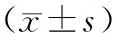
表3 两组肿瘤标志物水平、免疫因子水平比较
2.3 不良反应两组治疗期间均未发生明显不良反应,研究组患者存在1例恶心、呕吐,2例白细胞减少,对照组存在1例恶心、呕吐,经治疗后均好转,两组不良反应发生情况比较差异无统计学意义(χ2=1.065,P>0.05)。
2.4 生存情况截至末次随访时间(2022年2月),随访2~46个月,研究组中死亡14例(42.42%),生存19例(57.58%),中位生存时间27.901个月;对照组死亡20例(60.61%),生存13例(39.39%),中位生存时间17.235个月。Kaplan-Meier生存分析显示,研究组总生存情况优于对照组(P<0.05)。见图1。
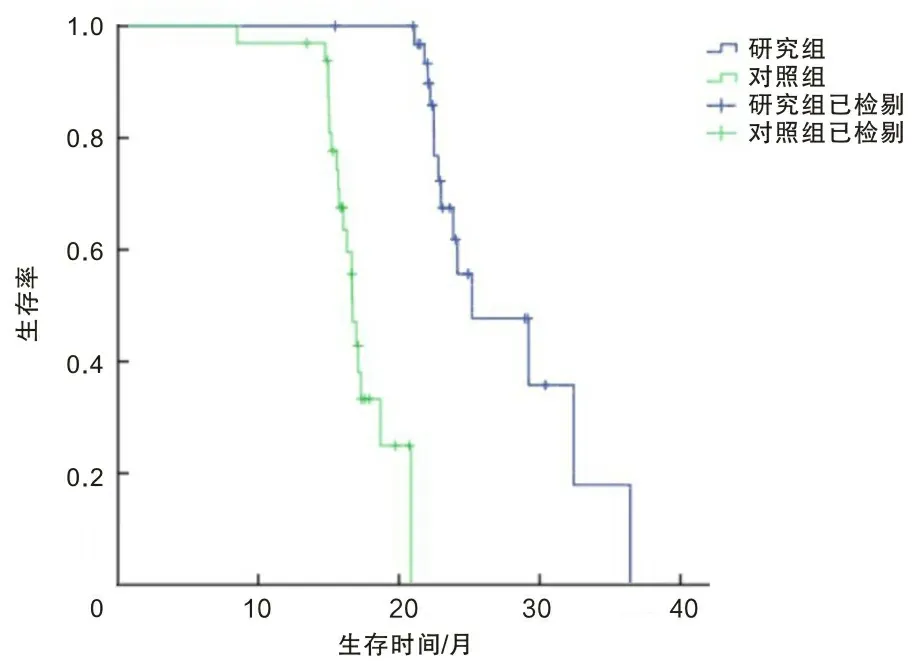
图1 两组患者总生存情况Kaplan-Meier图分析
3 讨论
脑胶质瘤是临床常见难治性中枢神经肿瘤,该病最突出的生物学特点为浸润性生长[9]。瘤体向周围组织浸润生长会使病灶边界不明,给手术切除增加难度。外科手术切除病灶是首选治疗方式,但难以完全切除,为术后复发奠定生物学基础[10]。化疗是指在DNA链间与链内交链中采用化学药物发挥作用,从而形成DDP-DNA复合物,对DNA复制进行干扰,并进入细胞核结合核内DNA,使DNA产生不可逆损伤,致使细胞无法正常新陈代谢,促进有丝分裂肿瘤死亡,抑制细胞增殖转移,但化疗易出现肿瘤耐药性,成为现阶段临床治疗障碍。放疗可通过放射线对癌细胞进行灭杀,术后放疗可进一步杀死残留病灶,提高局部控制效果。但在放射治疗过程难以避免对正常中脑组织产生放射性损伤。低分割同期推量调强放疗通过不同靶区给予不同剂量与不同分次剂量在肿瘤靶区与周围组织形成剂量梯度,可使治疗增益比提高[11]。但研究提出,脑胶质瘤放疗敏感性差,仅调强放疗清除残余病灶效果未达预期,具有较高远期复发率[12]。
随着分子机制深入研究发现:脑胶质瘤病灶内VEGF高表达,结合受体可对病灶内血管生成进行介导,进而促进细胞浸润性生长[13]。贝伐珠单抗可结合VEGF对促血管生成进行拮抗,积极作用于复发性胶质瘤治疗[14]。本研究创新性提出低分割同期推量调强放疗与贝伐珠单抗联合治疗脑胶质瘤,结果显示研究组疗效与对照组相比更好,且DCR、RR率优于对照组。这提示两者治疗脑胶质瘤均具有疗效,且联合治疗效果显著,分析为在低分割同期推量调强放疗杀死局部肿瘤活性后,贝伐珠单抗特异性抑制VEGF,致使肿瘤细胞血供与氧供减少,促进肿瘤细胞凋亡。
癌细胞浸润生长过程中会继发释放促凝物质,并大量释放纤维蛋白原激活物,进而对纤溶物质释放产生促进作用,形成促凝物质与纤溶物质间恶性循环,促进癌细胞浸润扩散[15-16]。IL-2、IL-6、TNF-α为促炎因子,VEGF可作用于内皮细胞,三者均可促进细胞增殖迁移与血管内皮生长;SIL-2R具有抑制免疫功能,EGF可对肿瘤细胞发挥直接促增殖、生长作用;PTN具有多种生物学功能,可致使肿瘤细胞增殖迁移;IgE是免疫蛋白分子,具有亲细胞性。本研究中,治疗后,两组IL-2、IL-6、TNF-α、VEGF、EGF、IgE水平均降低,SIL-2R、PTN水平均升高;且研究组IL-2、IL-6、TNF-α、VEGF、EGF、IgE、SIL-2R、PTN水平均低于对照组。这提示低分割同期推量调强放疗联合贝伐珠单抗治疗能有效杀伤胶质瘤细胞,降低血清中具有增殖活力的相关因子水平。且本研究中两组治疗期间均较少发生不良反应,且差异无统计学意义。这提示联合贝伐珠单抗治疗不增加不良反应,具有安全性。两组治疗后均较少发生不良反应,分析为低分割同期推量调强放疗勾画脑干、晶体器官,并按规定限量,最大程度减少放疗毒性,降低不良反应。同时本研究Kaplan-Meier生存分析显示,研究组总生存时间均高于对照组。这提示低分割同期推量调强放疗与贝伐珠单抗联合治疗脑胶质瘤具有良好远期治疗效果。
综上所述,低分割同期推量调强放疗与贝伐珠单抗联合治疗脑胶质瘤疗效较好,可有效提高生存率。

