食管癌手术与非手术切除患者肠道菌群组成及差异
王文浩,万里新,尚付梅,陶海云
(1.河南大学临床医学院,河南 开封 475000;2.南阳市中心医院,河南 南阳 473000;3.广西科技大学第一附属医院,广西 柳州 545000)
食管癌是原发于食管黏膜上皮的恶性肿瘤,主要为鳞癌和腺癌,鳞癌多发于亚洲东部,腺癌多发于欧美国家[1],食管癌是世界范围内常见的恶性肿瘤,《2020年全球癌症中心报告》显示,2020年全球食管癌发病人数60.4万例,发病率居全球恶性肿瘤第8位,死亡人数54.4万,死亡率居全球恶性肿瘤第6位[2];食管癌的发生发展是多因素作用的结果,随着宏基因组和二代测序技术的发展,人们发现肠道微生物与消化道肿瘤的发生发展息息相关[3-4]。肠道微生物在人体内保持着一个动态平衡,当此动态平衡遭到破坏时,就会导致肠道内有益菌的减少和有害菌的增加,从而导致各种疾病的发生;肠道菌群紊乱与炎症性肠病、肠易激综合征、糖尿病等疾病的发生发展有着一定的关系[5-6]。研究表明,食管癌的发生发展与食管黏膜微生物的变化密切相关,Gao等[7]发现牙龈卟啉单胞菌在食管癌中有致病作用,但食管癌的发生与肠道微生物的改变是否有关,目前尚不明确;通过手术方式切除食管肿瘤后,对肠道菌群的变化产生何种影响,目前仍未可知,需要进一步去探索。
1 对象与方法
1.1 研究对象选取2021年11月至2022年3月南阳市中心医院收治的食管癌患者,其中手术切除患者21例,非手术切除患者20例。纳入标准:经组织学或细胞学确诊为食管癌。排除标准:(1)2周内应用过抗生素或益生菌;(2)目前患有腹泻或肠梗阻等其他消化道疾病;(3)合并其他部位恶性肿瘤病史;(4)手术患者接受过除手术外的其他抗肿瘤治疗(放疗、化疗、免疫及靶向治疗等);(5)非手术患者既往接受过抗肿瘤治疗。从医疗记录中收集其临床数据,包括姓名、性别、年龄、吸烟饮酒史、家族史、肿瘤生长部位、病理类型、分化程度、临床分期等。所有研究对象在参加本研究之前均签署了书面知情同意书,且该研究已通过南阳市中心医院临床试验伦理委员会批准。
1.2 标本收集及检测分析方法
1.2.1粪便标本收集 收集患者治疗前的粪便标本,嘱其排便前先排空小便,将大便排入准备好的器皿内,并嘱其尽量勿将尿液排入器皿,避免粪便标本受到污染,用一次性无菌牙签或粪便取样器挑取约2 g中段内部大便放入到写有编号冻存管中,置入液氮中保存。
1.2.2粪便细菌DNA提取及测序 运用Mag-Bind Soil DNA Kit试剂盒提取粪便标本中细菌DNA,利用Illumina测序方法对细菌16S rRNA基因V3~V4可变区进行PCR扩增,运用TruSeq Nano DNA LT Library Prep Kit试剂盒构建高通量测序文库。
1.2.3序列去噪及功能基因矫正 运用QIIME2(2019.4)软件调用切除序列的引物片段,弃去未匹配引物的序列,通过DADA2[8]进行质控、去噪、拼接、去嵌合体后得到ASVs。完成对所有文库的去噪后,合并ASVs特征序列和ASV表格,并去除singletons ASVs。使用R语言对全部样本中所包含的高质量序列的长度分布进行统计,并对核酸序列中的插入和缺失错误进行纠正。
1.2.4物种分类学注释及ASV表抽平 通过QIIME2中的classify-sklearn[9]算法对每个ASVs的特征序列进行物种分类学注释,再使用qiime feature-table rarefy功能在每个样本中分别随机抽取一定数量的序列以到达统一的深度,并预测各样本在该测序深度下,所能观测到的ASVs及其相对丰度[10],抽平深度设为最低样本序列量的95%。
1.2.5微生物多样性及分类分析 微生物Alpha多样性分析是使用未抽平的ASV表,通过运用QIIME2、R语言计算Alpha多样性指数,包括Chao1指数、Observed species指数、Shannon指数、Faith’s PD指数、Pielou指数、Good’s coverage指数,来评估组内微生物的均匀度和丰富度;Beta多样性是通过R脚本对bray-curtis距离矩阵进行NMDS分析,以三维排序图展示微生物群落的组间差异。
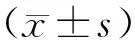
2 结果
2.1 手术组与非手术组食管癌患者的临床特征本研究共纳入41例食管癌患者,男32例,女9例;年龄为53~85岁,平均(66.59±8.31)岁;病理类型中鳞癌患者有36例,腺癌患者有5例;手术患者21例,非手术患者20例,手术组与非手术组患者间的年龄、性别、吸烟史、饮酒史、病理类型及临床分期差异无统计学意义(P>0.05)。见表1。

表1 手术与非手术患者基本临床特征
2.2 食管癌患者粪便标本测序结果本研究中,共41份粪便标本进行16S rRNA高通量测序,共得到4 630 070条有效序列,去噪后得到4 047 187条序列,聚类去嵌合体及功能基因矫正后共得到2 687 172条高质量序列,每条序列平均长度为416.5 bp,平均每个样品有886个ASV,分类注释后共得到29门、70纲、126目、228科、497属、698种。
2.3 手术组与非手术组食管癌患者菌群Alpha多样性分析本研究采用QIIME2(2019.4)软件对数据加以分析,使用R脚本对数据处理并绘制成箱线图,以此来直观地展示不同样分组间的Alpha多样性及差异,研究结果显示,两组间Chao1指数、Observed species指数、Shannon指数、Simpson指数、Faith’s PD指数、Pielou指数、Good’s coverage指数差异无统计学意义(P>0.05),见图1。手术组与非手术组食管癌患者之间的Alpha多样性差异无统计学意义。
S_TX为手术患者;NS_TX为非手术患者。图1 Alpha多样性指数
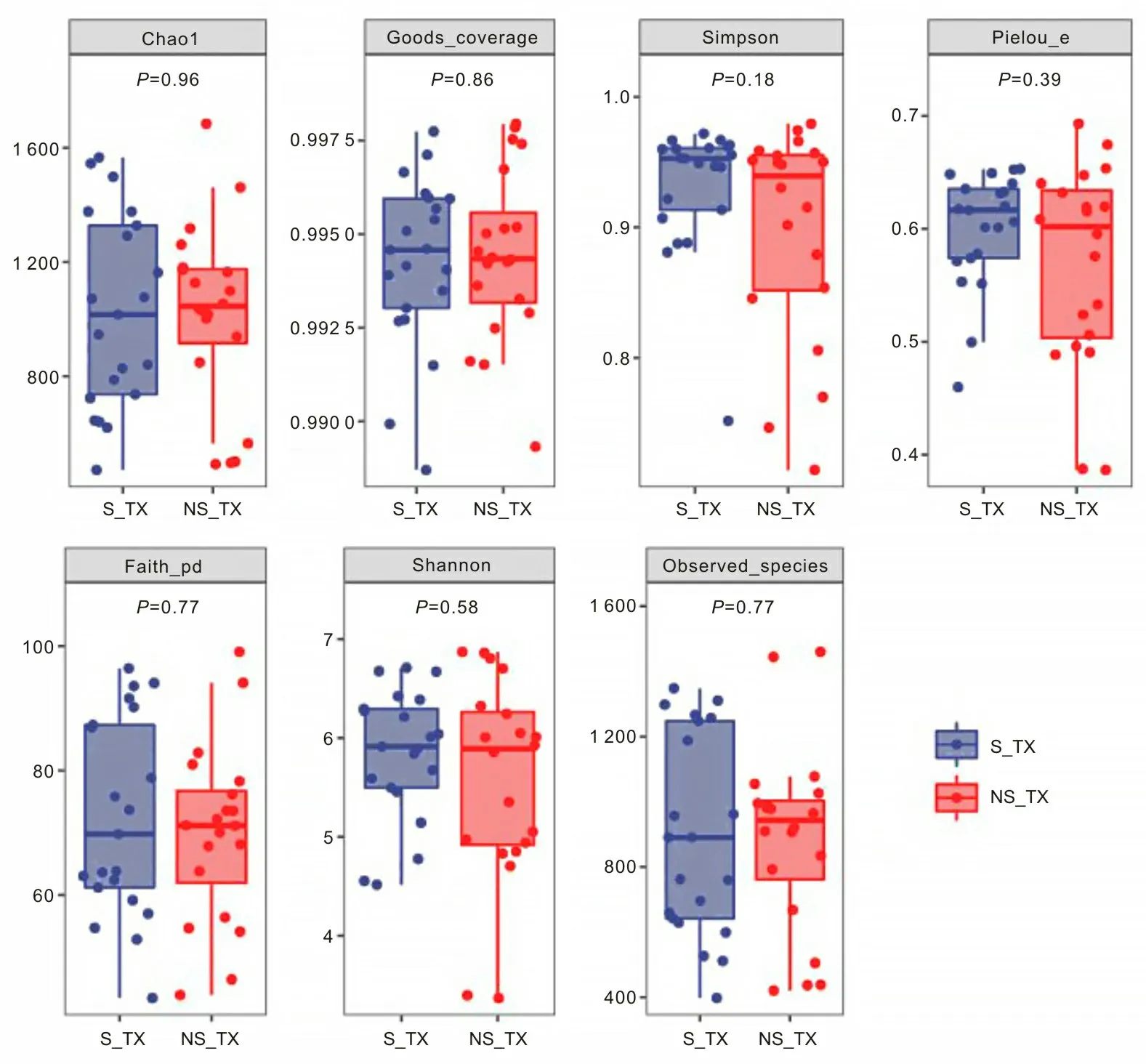
2.4 手术组与非手术组食管癌患者菌群组成结构本研究通过采用ASV在所有样本中的丰度数据,将每个分组作为一个集合,按样品的分组情况统计每个集合中的ASV,并计算各个集合之间的关系,得到两组所共有和独有的ASV数量,即Venn图(图2),其中有2 697个ASV是两组间共有的,有10 088个ASV是手术组患者所独有的,有9 226个ASV是非手术组患者独有的;通过QIIME2软件对去除singleton后的特征表进行统计分析,两组患者肠道微生物在门水平的主要优势细菌分别是厚壁菌门、拟杆菌门、变形菌门、放线菌门、疣微菌门、互养菌门、梭杆菌门、软壁菌门(图3);在属水平上,手术组中的链球菌属(11.36%比4.58%)、双歧杆菌属(10.06%比4.59%)、粪杆菌属(5.11%比4.57%)、布劳特氏菌属(4.33%比3.59%)的菌群丰度比非手术组高,非手术组中的志贺菌属(12.07%比6.03%)、拟杆菌属(8.79%比6.51%)、乳杆菌属(6.14%比5.36%)、罗氏菌属(2.86%比2.33%)的菌群丰度要比手术组高(图4)。
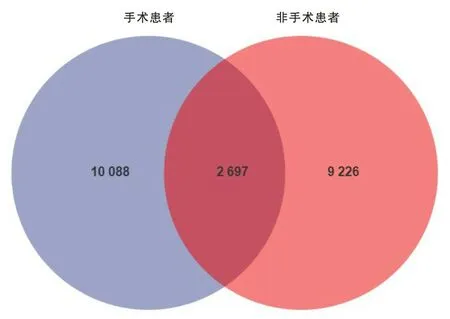
图2 韦恩图

图3 门水平菌群相对丰度
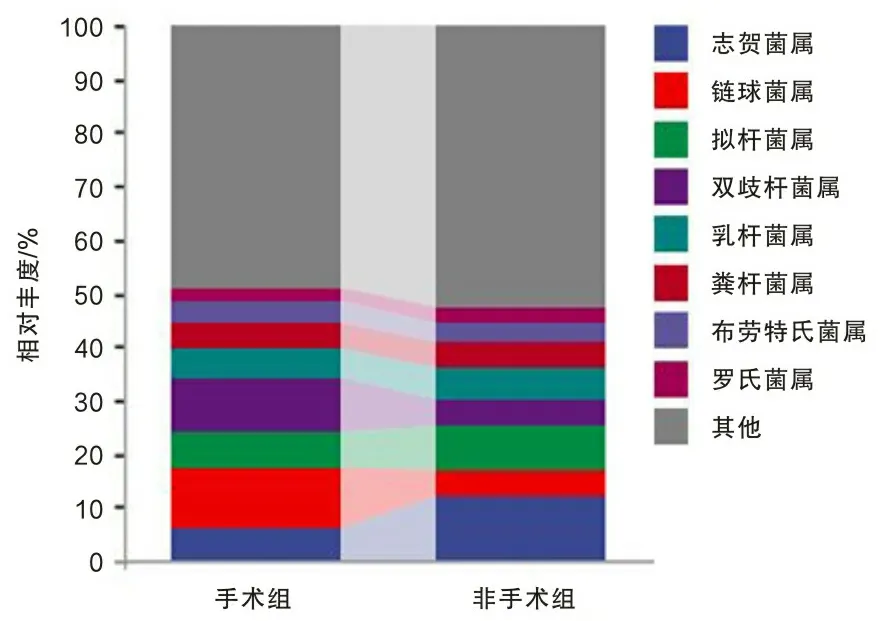
图4 属水平菌群相对丰度
2.5 手术组与非手术组食管癌患者菌Beta多样性分析本研究通过对bray-curtis距离矩阵进行NMDS分析,采用Anosim非参数检验分析方法比较,比较两组之间的菌群差异,结果显示手术组与非手术组间肠道微生物群落差异有统计学意义(R=0.067,P=0.040)。见图5。
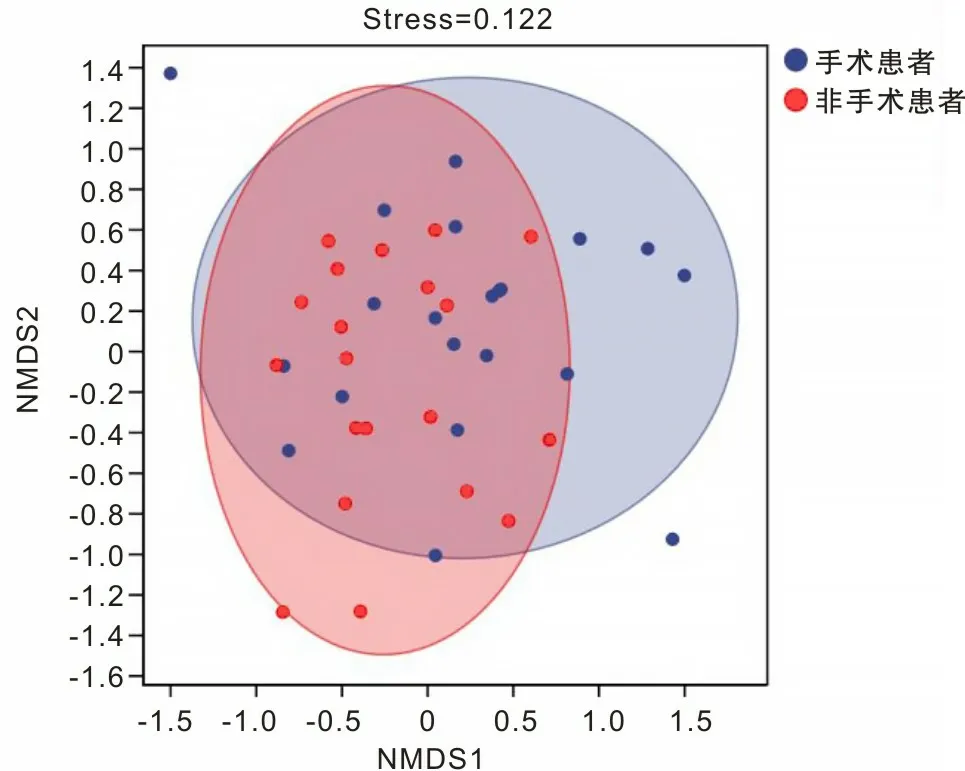
图5 NMDS分析(P=0.04)
2.6 手术组与非手术组食管癌患者菌LEfSe分析LEfSe分析是一种差异分析方法,本研究通过描述显著差异物种LDA值分布柱状图,来展示每个组内显著富集的物种。LEfSe分析结果显示,手术组与非手术之间微生物群落存在差异,手术组微生物富集区包括:乳杆菌目(LDA得分4.65,P=0.047)、链球菌科(LDA得分4.58,P=0.042)、放线菌科(LDA得分4.43,P=0.044)、双歧杆菌科(LDA得分4.42,P=0.019)、韦荣球菌(LDA得分4.11,P=0.017)、梭杆菌属(LDA得分2.99,P=0.011)、月形单胞菌属(LDA得分2.72,P=0.014)(图6);非手术组中有6种微生物显著富集,主要包括小杆菌属(LDA得分4.01,P=0.036)、马赛菌属(LDA得分3.33,P=0.019)、螺杆菌属(LDA得分3.29,P=0.033)、消化球菌属(LDA得分2.62,P=0.045)、巨单胞菌属(LDA得分2.57,P=0.012)、微单胞菌属(LDA得分2.49,P=0.041)。
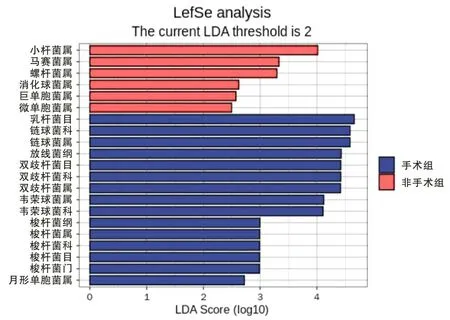
图6 LEfSe分析
3 讨论
人体肠道中存在着至少100万亿种微生物,共同影响着人体的免疫系统及健康状况,包括癌症的发生[11-13]。饮食习惯、生活方式及药物等都可以影响肠道菌群的组成,肠道微生物通过维持肠道黏膜屏障的完整性、营养代谢、免疫调节等功能来维持人体内环境稳态[14-16]。人体肠道微生物处于动态平衡,当此平衡遭到破坏时,菌群结构和丰度会发生一定的变化,进而导致病理学的改变及一些疾病的发生[17],因此肠道菌群在维持人体正常生理功能中起着至关重要的作用,又被称为人体“被遗忘器官”[18]。
研究发现,食管病变与食管内菌群特征紧密相关,YANG等[19]通过16S rRNA测序技术描述了正常食管、反流性食管炎及巴雷特食管患者远端食管菌群的多样性,Pei等[20]对健康人群食管研究发现,在门水平上食管菌群中厚壁菌门、拟杆菌门、放线菌门丰度较高,占比95.1%。本研究发现,在门水平上,食管癌患者肠道菌群主要优势菌门分别为厚壁菌门、拟杆菌门、放线菌门,占比95%左右,提示在门水平食管微生态与胃肠道微生态微生物群落差异无统计学意义。另有研究表明,与健康成年人相比,食管癌患者口腔内厚壁菌门丰度显著增加[21-22];而本研究发现,手术组厚壁菌门丰度要低于非手术组,推测可能原因为通过手术切除肿瘤,减轻肿瘤负荷作用,进而影响肠道微环境。Gall等[23]发现,链球菌和普雷沃菌在巴雷特食管患者的食管微生物群中占主导地位,链球菌和普雷沃菌的比值与食管腺癌的一些风险因素有密切关系;本研究并未在食管癌患者肠道菌群中检测到上述2种菌群的差异,表明食管微生态与胃肠道微生态在属水平上存在差异,可能原因为细菌从上消化道至下消化道的转运过程中受到胃液、胰液以及某些代谢作用的影响,进而促使肠道菌群发生改变。
对于早期食管癌患者,手术切除仍为主要治疗手段[24],但术口感染、吻合口瘘等术后并发症发生率依然很高。研究表明,肠道微生物会对术后患者的预后产生影响。Bachmann等[25]发现肠道微生物对结直肠癌术后吻合口的愈合有较大的影响,宣煜龙等[26]发现口腔及胃内微生物群组成不同可致吻合口瘘发生率增加。为了探索手术切除食管肿瘤引起的肠道菌群差异,本研究对食管癌患者手术与非手术组肠道菌群的Alpha及Beta多样性加以分析,发现两组间的Chao1指数、Observed species指数、 Shannon指数、Simpson指数、Faith’s PD指数、Pielou指数、Good’s coveragecha指数差异无统计学意义,表明两组间菌群丰富度、多样性、均匀度、覆盖度相似;但NMDS分析表明,两组间微生物组成有所不同,提示手术切除肿瘤,对肠道微环境的变化产生影响,进而影响菌群组成。平贯芳等[27]发现消化道肿瘤会导致肠道内乳杆菌及双歧杆菌丰度显著减少,本研究通过LEfSe分析,评估两组间肠道微生物的组成差异,发现与非手术组相比,乳杆菌目与双歧杆菌等有益菌在手术组中较富集,推测由于通过手术切除肿瘤,减轻肿瘤负荷,进而改变肿瘤微环境,更适合有益菌群的增长。而夏冰清等[28]发现结直肠癌患者术后肠道内乳杆菌和双歧杆菌等益生菌的丰度较术前减少,这与本研究结果存在差异,考虑可能原因为结直肠癌根治术在切除肿瘤的同时,也直接破坏了肠道微环境,食管癌患者的发病部位位于上消化道,手术切除食管肿瘤,仅消除肿瘤对肠道微环境的影响,并未对肠道微环境造成直接破坏;而非手术组中有益菌减少,有害菌增加,这是否与肿瘤改变胃肠道生理,进而导致肠道菌群结构发生变化,需要进一步探索。
本研究为小样本量关于食管癌患者手术与非手术组肠道菌群组成及差异的研究,排除了抗生素、益生菌及其他胃肠道疾病对试验结果的影响,并严格遵循粪便收集标准,及时保存送检。本研究局限在于样本量小,部分差异无统计学意义,下一步将扩大样本量,继续往下探索肠道微生物对食管癌患者手术切除与非手术切除预后的影响。
综上,本研究发现食管癌患者手术切除与非手术切除肠道菌群组成存在差异,手术组较非手术有益菌群组富集,考虑通过手术切除食管肿瘤,减轻肿瘤负荷,由此改变了肿瘤对胃肠道生理环境的影响。

