小黑杨转录因子PsnbZIP1应答盐胁迫功能分析
廖诗贤 王宇婷 董立本 顾咏梅 贾丰璘 姜廷波 周博如
(林木遗传育种国家重点实验室,东北林业大学,哈尔滨 150040)
杨树(Populus)具有分布广,生长快,适应性强,材质优良等优点,在我国广泛用于绿化、造林、造纸等各个方面[1]。由于气候异常、工业污染、灌溉施肥方式不当等因素的影响,土壤盐碱化程度及次生盐碱化情况越来越严重[2],杨树常常因为过度严重的高盐环境而发育不良、病变、干枯甚至死亡。盐胁迫主要从渗透胁迫、氧化胁迫、高pH 胁迫以及离子毒害等多个方面对植物造成损伤,它能改变植物的细胞膜透性和营养状况,减少植物对营养元素的吸收并造成植物生理代谢的紊乱,影响植物的生长、发育和再生[3]。为了能适应盐碱环境,植物自身进化出了一系列防御机制来抵抗盐胁迫,如促进合成渗透调节物质、调节植物体内离子平衡、维持活性氧稳态等[3]。一些信号转导途径(如脱落酸信号通路)、转录因子与功能基因也在植物应答盐碱胁迫的过程中发挥重要作用[3]。
转录因子是植物通过信号转导途径应答环境胁迫的主要调节因子,当外界环境对植物的正常生长产生限制作用时,转录因子会激活下游胁迫相关基因的表达,从而快速提高抵抗外界不良环境的能力。目前已有的研究表明,bZIP、bHLH、MYB、ERF、NAC、WRKY等转录因子家族成员均具有增强植物响应环境胁迫能力的功能。bZIP转录因子具有一个由60~80 个氨基酸构成的高度保守结构域,该结构域包括2 个功能区域,分别为位于C 端碱性区域(Basic region,BR)和位于N 端亮氨酸拉链(Leucine zipper region,LZ),碱性氨基酸区域主要通过一个固定的N-x7-R/K结构与特异DNA序列相结合[1];亮氨酸拉链区域主要负责bZIP蛋白DNA 结合之前的异源或同源二聚化[4]。在拟南芥(Arabidopsis thaliana)中,bZIP转录因子家族根据其结构和功能的特点常被分为A、B、C、D、E、F、G、H、I、S等不同的亚族[5],该转录因子家族成员在植物种子成熟萌发、植物组织器官生长发育、激素和信号传导、生物及非生物胁迫应答过程中都发挥着重要的作用,其相关的调控途径与机理受到各位学者的探究重点。近年来已有研究表明bZIP转录因子能通过二聚化、磷酸化修饰、与其他蛋白之间的相互作用或参与激素信号传导途径的方式来发挥功能,并影响其他基因的激活[6]。在植物耐低渗胁迫中,AtbZIP10与AtbZIP53形成异源二聚体,从而与脯氨酸脱氢酶的启动子特异性结合来激活脯氨酸脱氢酶的表达[6];在植物的ABA 途径及耐逆胁迫应答中,磷酸化作用可调控AtbZIP家族的A 组(bZIP的保守序列中具有磷酸化位点)成员的活性和稳定性;在植物的应激反应和激素信号转导途径中,bZIP转录因子通过与ABRE 作用元件(ABA responsive element)结合来调控目的靶基因的表达[7]。
关于杨树bZIP基因家族目前还缺乏系统的研究[8]。根据保守结构域将杨树bZIP家族的214 个成员参照拟南芥bZIP转录因子家族分类方法分为11个亚家族[9]。将其中86个基因与拟南芥基因组进行同源性分析并预测可能具有的功能。如AT1G75390.1是Potri.007G019900.1的 同 源 基 因,参与拟南芥的种子发芽过程[10];AT2G40950.1与Potri.006G034500.1和Potri.016G032400.1是 同 源基因,通过渗透压来调节细胞对盐胁迫的反应[11];AT1G45249.1与Potri.009G101200.1、Potri.014G028-200.1和Potri.002G125400.1是同源基因,在干旱胁迫耐受性相关的ABRE 依赖性ABA 信号通路发挥功能[12]。再通过比较杨树在盐胁迫前后的表达数据,共鉴定出45个相关的基因[8],这些表明bZIP基因家族在杨树生长发育和抗逆过程极有可能发挥着重要作用。
小黑杨由小叶杨(Populus simonii)和黑杨(Populus nigra)杂交而来,在生长速度、抗寒、抗旱、抗病虫害等优良特性上均强于小叶杨和小青杨(Populus pseudo-simonii)[13],在干旱、寒冷地区长势良好,因此可作为我国北方沙荒、干旱地区优良速生绿化树种之一。我国土壤盐渍化的不断扩增,极大限制了小黑杨的生长发育和空间分布,随着基因工程技术的不断发展,利用转基因技术提高杨树的耐盐碱性是一条快速有效的途径。本研究初步解析小黑杨耐盐相关基因PsnbZIP1的生物信息、理化性质以及蛋白质结构,克隆该基因上游的启动子序列并预测了其顺式作用元件的种类信息,为后续杨树抗逆性相关研究提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 植物材料
培养1个月的小黑杨组培苗,小黑杨来源于林木遗传育种国家重点实验室,本氏烟草(Nicotiana benthamiana)土培苗,由本实验室保存。
1.1.2 菌株和载体
植物过表达载体pBI121-35S-GFP,酵母表达载体pGBKT7,酵母阳性对照质粒pGBKT7-53,酵母菌株Y2HGold(Saccharomyces),农杆GV3101 菌株(Agrobacterium)均为本实验室保存。pMD19-T载体与大肠杆菌(Escherichia coli)TOP10 感受态细胞均购自TaKaRa公司。
1.2 试验方法
1.2.1 PsnbZIP1基因的克隆
根据实验室小黑杨转录组数据,选择PsnbZIP1基因作为目的基因,运用Phytozome 数据库获取PsnbZIP1基因在毛果杨中的同源基因Potri.010G142900.1转录本序列,在基因的5′和3′UTR 设计扩增引物,引物序列为PsnbZIP1-F 与PsnbZIP1-R(见表1)。选取培养40 d 左右且生长状态良好的小黑杨组培苗为试验材料,用150 mmol·L-1NaCl 对小黑杨组培苗进行盐胁迫处理24 h,从叶片中提取总RNA 与基因组DNA。用总RNA 反转录得到cDNA 文库作为模板用于PsnbZIP1基因的扩增。PCR 反应结束后,取10 μL 样品利用质量分数为1%的琼脂糖凝胶电泳检测。将大小正确的DNA片段进行胶回收并与pMD19-T载体连接,构建pMD19-T-PsnbZIP1 载体,之后转入大肠杆菌中进行蓝白斑筛选。

表1 PsnbZIP1基因引物Table 1 Primers for PsnbZIP1gene
从每一个培养皿上挑取10个正常的白色大肠杆菌单菌落,加入到含400 μL 液体LB 培养基(含Amp)的1.5 mL离心管中,在摇床中37 ℃震荡培养4 h 后进行菌液PCR 检测,选择条带大小正确的菌液进行测序,将测序结果正确的阳性菌液加入等量的体积分数为50%的甘油,于冰箱中-80 ℃保存并提取质粒。
1.2.2 PsnbZIP1基因的时空表达测定
选择培养1 个月且长势良好且相近的小黑杨组培苗,用流水将根部培养基洗干净后用霍氏营养液水培1 个月,环境条件为16 h 光照/8 h 黑暗、相对湿度60%~70%、平均温度(25±1)℃。培养结束后将长势相近的小黑杨用150 mmol·L-1NaCl 进行处理,在处理后的0、3、6、12、24、48 h 时,分别对小黑杨幼苗的叶片、茎、根组织进行取样并将样品于液氮中速冻,放于冰箱中-80 ℃保存备用。每个处理和时间点均包含3个生物重复。
将所有样品提取总RNA,反转录成cDNA 并调节浓度为(100.0±0.1)ng·μL-1,用于实时荧光定量PCR(Quantitative Real-time PCR,qRT-PCR)分析。然后在PsnbZIP1基因编码区的非保守结构域序列设计定量引物qRT-PsnbZIP1-F 与qRT-PsnbZIP1-R。根据前人研究设计内参基因Actin(基因登录号:JM986590)引物为对照,引物为Actin-F 和Actin-R。根据荧光定量试剂盒SYBR Premix ExTaqⅡ的说明确定反应体系,在q-PCR 仪ABI7500中进行PCR反应,用2-ΔΔCt法处理数据,计算PsnbZIP1基因的相对表达量。
1.2.3 PsnbZIP1基因生物信息学分析
用软件Bioxm 查找PsnbZIP1基因的开放阅读框(ORF);从 网 站Phytozome(https://phytozomenext.jgi.doe.gov/cart)中下载毛果杨bZIP家族转录因子的相关数据,去除其中属于可变剪切的基因序列后与小黑杨PsnbZIP1基因一起通过软件MEGAX 进行多序列比对,通过Maximum Likelihood、1 000 次重复的bootstrap 测试来构建系统进化树。通过在线网站MEME(https://meme-suite.org/meme/tools/meme)分析bZIP蛋白序列的保守基序,设置查找保守基序最大数目为10;用BLASTP(https://blast.ncbi.nlm.nih.gov/Blast.cgi)从不同物种中检索与PsnbZIP1蛋白氨基酸序列相似性较高的蛋白质构建进化树。
使用SignalP-4.1(http://www.cbs.dtu.dk/services/SignalP-4.1)在线软件对氨基酸进行信号肽预测;利用ExPASyn(http://web.expasy.org/cgibin/protparam/)中Protparam 程序分析氨基酸的理化性质;利用TMHMM Serverv.2.0(http://www.cbs.dtu.dk/services/TMHMM)进行跨膜结构预测;使用在线软件PSIPRED(http://bioinf.cs.ucl.ac.uk/psipred)进行蛋白二级结构分析;用SWISS-MODEL(https://swissmodel.expasy.org/)在线软件进行蛋白三级结构建模;利用在线软件PSORT Prediction(http://psort1.hgc.jp/form.html)预测蛋白亚细胞定位。
1.2.4 PsnbZIP1蛋白的亚细胞定位
构建用于亚细胞定位的融合蛋白表达载体pBI121-PsnbZIP1-GFP,在PsnbZIP1基因编码区序列设计引物,引入SalⅠ和SpeⅠ酶切位点,引物设计为pBI121-PsnbZIP1-GFP-F 与pBI121-PsnbZIP1-GFP-R。使用T4DNA 连接酶对双酶切产物进行过夜连接。将连接产物转入大肠杆菌中,挑取阳性克隆单菌落使用pBI121 载体通用引物pBi121-GFPF1与pBi121-GFP-R1进行PCR检测并送测序。
用液氮冻融法分别将pBI121-GFP 空载质粒与pBI121-PsnbZIP1-GFP 重组质粒转入GV3101 农杆菌中,分别挑取2 种阳性克隆菌落加入5 mL 液体LB(含Kan+Rif),摇床里28 ℃过夜培养,2 种菌液各取1 mL 再加入100 mL 液体LB,培养至OD600为1.0 后离心收集菌体,加入等体积的新鲜LB 重悬菌体。用不带针头的1 mL 注射器将2 种侵染菌液从烟草叶片的下表皮缓缓注入,做好标记。把注射好的烟草进行暗培养48 h。使用LSM800 激光共聚焦显微镜观察并保存试验结果。
1.2.5 PsnbZIP1蛋白转录激活活性分析
根据PsnbZIP1基因的ORF 区设计引物,引入NdeⅠ和EcoRⅠ酶切位点,引物设计为PsnbZIP1-BD-F 和PsnbZIP1-BD-R。将连接产物转入大肠杆菌中,使用pGBKT7载体通用引物BD-F和BD-R进行检测并送测序,获得PsnbZIP1-ORF-pGBKT7 重组质粒。
将PsnbZIP1基因的ORF 区分为N 端与C 端,分别设计引物为PsnbZIP1-BD-N-F、PsnbZIP1-BDN-R 与PsnbZIP1-BD-C-F、PsnbZIP1-BD-C-R,成功获得PsnbZIP1-N-pGBKT7 与PsnbZIP1-C-pGBKT7重组质粒。
将以上3 种重组质粒、pGBKT7 空载质粒、pGBKT7-53 分别转入Y2HGold 酵母细胞中,通过PCR进行检测后分别蘸取5种酵母菌液在SD-Trp、SD/-Trp/-His/-Leu/X-α-Gal 缺陷培养基上点点,30 ℃倒置培养3~5 d,观察菌落生长状态与能否变蓝来检验PsnbZIP1蛋白是否具有转录激活活性。其中含有pGBKT7空载质粒的酵母菌株与含有pGBKT7-53的酵母菌株分别为阴性对照和阳性对照。
1.2.6 PsnbZIP1基因启动子的克隆和分析
用小黑杨基因组DNA 作为模板,根据PsnbZIP1的毛果杨(Populus trichocarpa)同源基因Potri.010G142900.1编码区上游大约2 000 bp 的序列设计引物Pro-PsnbZIP1-F 与Pro-PsnbZIP1-R 并进行PCR 扩增,电泳检测后将大小正确的目的条带与pMD19-T 载体连接,转入大肠杆菌后送生物公司进行测序。
将PsnbZIP1基因启动子序列导入PlantCARE数据库中并分析顺式作用元件。
2 结果与分析
2.1 PsnbZIP1基因序列的分析
以小黑杨cDNA 文库为模板进行PCR 扩增,得到长度约为587 bp 的DNA 片段(含5′和3′UTR序列)。将胶回收产物与pMD19-T 载体连接后转入大肠杆菌,进行测序。将测序结果与毛果杨同源基因序列进行比对,小黑杨PsnbZIP1基因的编码区序列长度为432 bp,2 条基因的核算序列相似度为98.61%,确认获得PsnbZIP1基因序列。
2.2 PsnbZIP1基因的时空表达分析
为了探索PsnbZIP1在不同组织中的表达模式,使用qRT-PCR 分别检测其在根、茎、叶的表达水平。结果表明在150 mmol·L-1NaCl处理下,PsnbZIP1在根、茎、叶中的表达水平都有显著变化。由表2 所示,PsnbZIP1在小黑杨响应盐胁迫的初期阶段表现出快速上升的趋势,之后渐渐恢复或者波动,PsnbZIP1基因在茎部的表达量最高,可达217.3 倍,其次是根和叶片。这表明PsnbZIP1基因能快速参与到小黑杨抗盐胁迫的生理过程中。
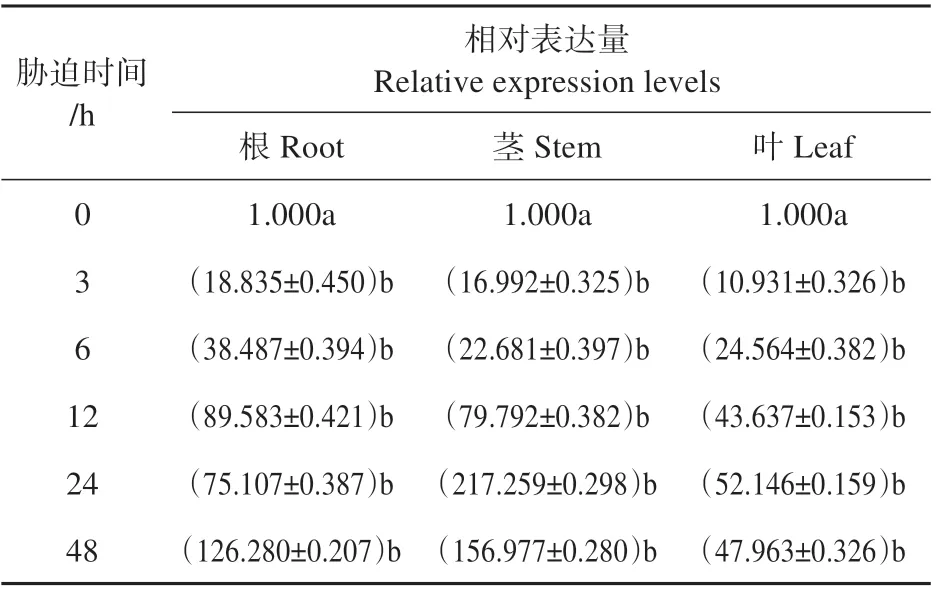
表2 盐胁迫下小黑杨PsnbZIP1相对表达量Table 2 Relative expression of PsnbZIP1under salt stress
2.3 PsnbZIP1蛋白质的生物信息学分析
2.3.1 PsnbZIP1蛋白的理化性质
利用ExPASyn 中Protparam 程序分析氨基酸的理化性质。结果显示,PsnbZIP1蛋白编码143个氨基酸,分子质量为16 571.91 Da,理论等电点(pI)为9.30,分子式为C725H1171N211O221S6,总原子数为2 334,不稳定系数Ⅱ为60.28,脂肪系数(AI)为76.36。该蛋白的总平均亲水性GRAVY 为-0.757,表明其为亲水性蛋白质。氨基酸组成的分析显示,该蛋白由20种氨基酸组成,其中丝氨酸(Ser),赖氨酸(Lys)和谷氨酸(Glu)的含量较高,分别占到10.5%、9.8%和9.1%。亚细胞定位的预测结果显示PsnbZIP1为核定位蛋白。
通过BLASTP 对PsnbZIP1蛋白序列进行比对,挑选了7 个来自不同物种中相似性最高的蛋白,分 别 是 美 洲 黑 杨(Populus deltoides)KAF9841271.1(98.60%)、毛果杨XP_002314935.1(97.90%)、毛白杨(Populus tomentosa)KAG6757882.1(95.10%)、银白杨(Populus alba)XP_034911111.1(92.31%)、长 梗 柳(Salix dunnii)KAF9674261.1(90.91%)、簸箕柳(Salix suchowensis)KAG5237088.1(90.97%)、小垫柳(Salix brachista)KAB5538362.1(89.58%)。将这7 个物种的氨基酸序列PsnbZIP1氨基酸序列一起输入MEGA 7 软件进行了多序列比对(见图1)并构建系统发育树(见图2),结果显示小黑杨PsnbZIP1蛋白美洲黑杨和毛果杨的亲缘关系较近,而与簸箕柳和小垫柳的亲缘关系较远。

图1 PsnbZIP1与7个不同物种的蛋白氨基酸序列的多序列比对Fig.1 Multiple sequence alignment of protein amino acid sequences of PsnbZIP1and seven different species
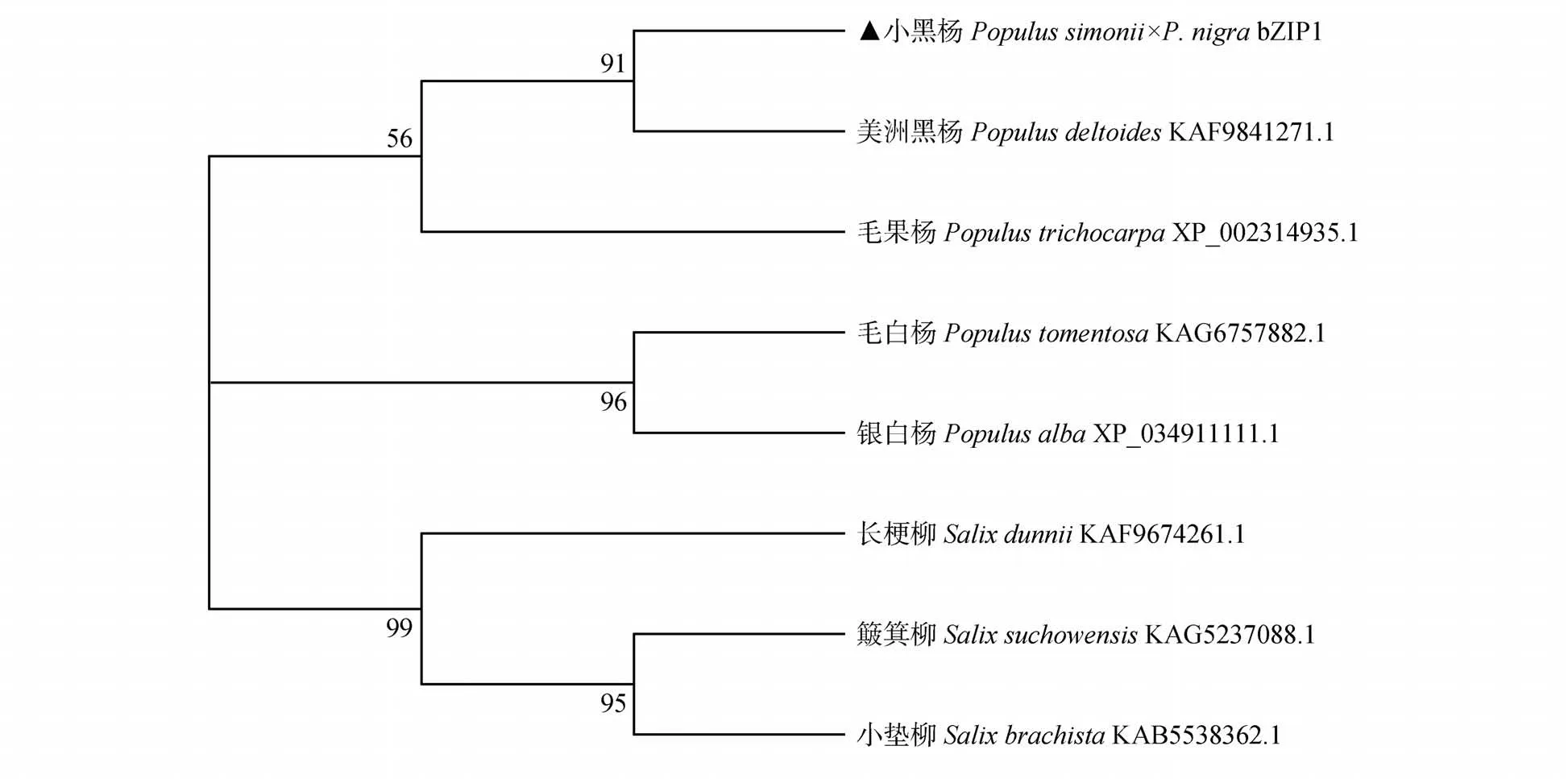
图2 PsnbZIP1与7个不同物种的系统发育分析Fig.2 Phylogenetic analysis between PsnbZIP1 and seven different species
2.3.2 PsnbZIP1蛋白的空间结构
利用TMHMM Serverv.2.0 进行跨膜结构预测,结果显示PsnbZIP1 蛋白无跨膜结构(见图3A)。使用在线软件PSIPRED 对PsnbZIP1 蛋白的二级结构PsnbZIP1分析,结果显示PsnbZIP1 的二级结构由39.16%的无规则卷曲与60.84%的α-螺旋组成,没有其他特别结构(见图3C);用SWISS-MODEL在线软件进行蛋白三级结构建模(见图3B)。
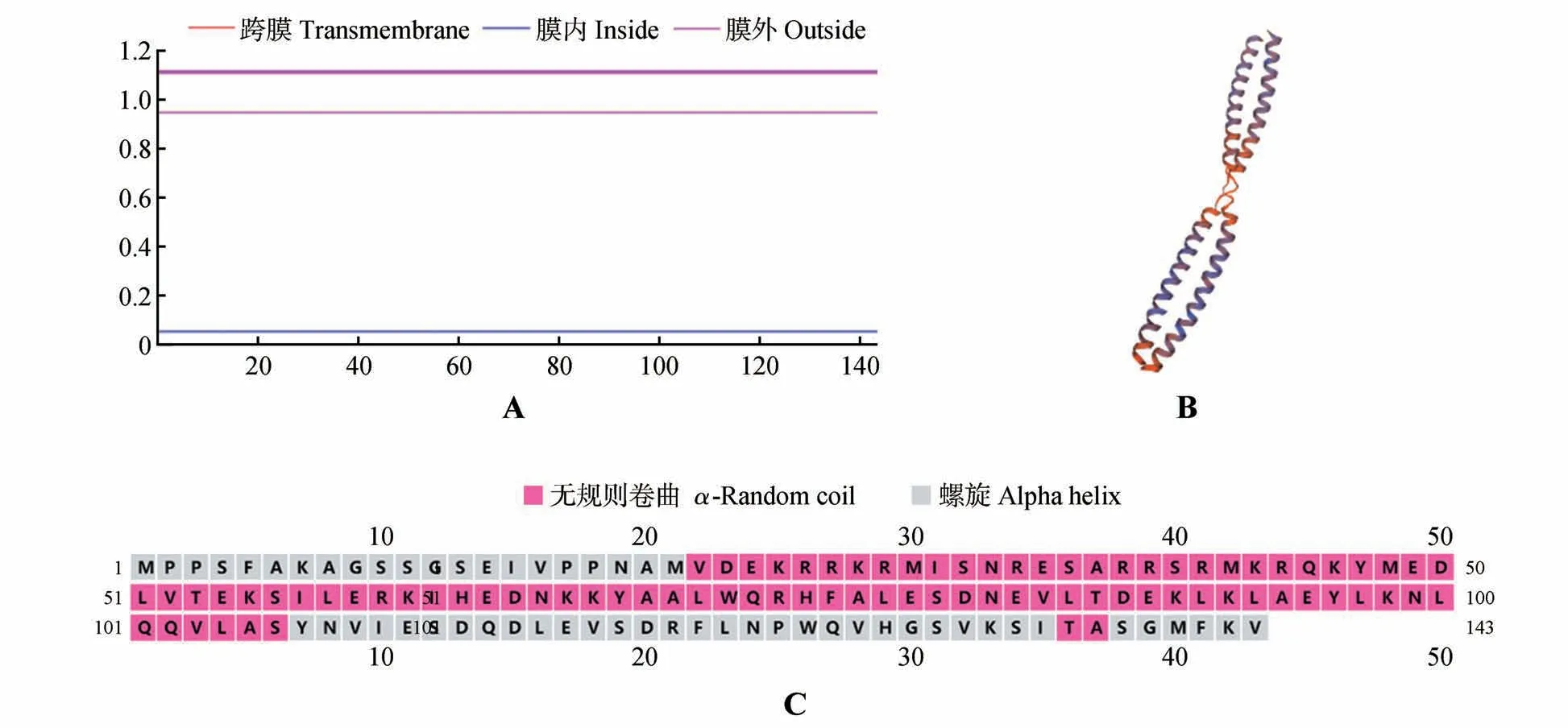
图3 PsnbZIP1蛋白分析A.PsnbZIP1蛋白的跨膜结构预测;B.PsnbZIP1蛋白三级结构分析;C.PsnbZIP1蛋白二级结构分布;粉色.α-螺旋;灰色.无规则卷曲Fig.3 PsnbZIP1protein analysis A.Prediction of trans-membrane structure of PsnbZIP1protein;B.Analysis of the tertiary structure of PsnbZIP1 protein;C.Secondary structure distribution of PsnbZIP1 protein;Pink.Alpha helix;Grey.Random coil
2.3.3 PsnbZIP1信号肽预测
使用SignalP4.1 server在线软件进行信号肽预测,预测结果中会包含C值(剪切位点值)、S值(表示是否为信号肽)、D值(表示是否为分泌蛋白)及Y值(综合考虑C值及S值的参数),如S均值高于0.5,认为存在信号肽;如D均值高于0.5,则可能为分泌蛋白。结果显示第20 位丙氨酸残基Max.C值为0.323、Max.Y值为0.481,第13 位丝氨酸信号肽Max.S值 为0.804。因S均 值 为0.724,D值 为0.612,则推测存在分泌途径信号肽,信号肽区在1~19氨基酸残基之间(见表3)。

表3 PsnbZIP1蛋白的信号肽预测结果Table 3 Predicted results of PsnbZIP1protein signal peptide
2.3.4 PsnbZIP1系统进化树分析
为了明确小黑杨PsnbZIP1的功能作用,从基因进化关系的角度对该基因的具体功能进行预测并提供一些参考。该研究参考了前人关于毛果杨bZIP转录因子参照拟南芥bZIP转录因子的分类方法所得出的亚家族分类结果,将小黑杨PsnbZIP1蛋白序列与毛果杨bZIP家族94个蛋白序列一起构建了系统发育树[9]。结果如图4 所示,在杨树bZIP 转录因子A、B、C、D、E、F、G、H、I、S 及其他等11 个亚族中[9],小黑杨PsnbZIP1与其同源性最高的PtbZIP172都归为其他亚族。由于毛果杨与拟南芥物种差异较大,部分基因并没有划分在拟南芥已确定的亚家族内,而是在其他的组中,这种现象可能是与杨树存在某些特定的生物学功能相关,需要进一步研究。

图4 PsnbZIP1基因和杨树bZIP家族进化树不同颜色代表不同亚族;含背景框的序列为小黑杨PsnbZIP1基因Fig.4 Phylogenetic tree of the PsnbZIP1gene and poplar bZIP family Different colors represented different sub-ethnic classifications;The sequence wiWWth the background frame was the PsnbZIP1 gene of Populus simonii × P.nigra
2.3.5 bZIP蛋白序列保守motif分析
用网站MEME 分析毛果杨bZIP 家族中94 个蛋白序列与小黑杨PsnbZIP1蛋白序列的保守基序motif,得到的10 个保守基序中motif 1 和motif 6 的保守性最强,序列如图5 所示。其中94 个bZIP 家族成员中均含有motif 1,80个成员中均含有motif 6(见图6),这表明毛果杨bZIP 转录因子拥有高度保守的bZIP结构域。PsnbZIP1同时含有保守基序motif 1 与motif 6,有明显的bZIP 转录因子特征。此外,一些基序具有明显的特异性,motif 2、motif 3、motif 4和motif 7只出现在D亚族群中,motif 5只在E 亚族和I亚族存在,说明不同亚族群的motif结构会存在较大的差异,这可能与不同亚族具有某些特定功能相关。motif 9、motif 10 存在于A 亚族和其他亚族之中,可能其他亚族中存在基因在结构与功能上与A 亚族的基因具有相关性,因此杨树bZIP家族亚族具体的分类方式还有待深究。

图5 保守基序结构图A.motif 1的保守基序;B.motif 6的保守基序Fig.5 Conserved motif structure diagram A.The conserved motif sequence of motif 1;B.The conserved motif sequence of motif 6

图6 PsnbZIP1和杨树bZIP家族蛋白基序分析Fig.6 Motif analysis of PsnbZIP1 and poplar bZIP family protein
2.4 PsnbZIP1蛋白的亚细胞定位
将含有pBI121-PsnbZIP1-GFP 和pBI121-GFP质粒的农杆菌侵染液用注射器注入烟草叶片,暗培养2~3 d后用在LSM800激光共聚焦显微镜下进行荧光观察。如图7 所示,对照质粒35S:GFP 蛋白的荧光信号在整个细胞中均能观察到,即在细胞中为全表达。而融合蛋白pBI121-PsnbZIP1-GFP的绿色荧光信号只能在细胞核中观察到。证明PsnbZIP1为核定位蛋白,符合大部分转录因子特性。

图7 PsnbZIP1蛋白亚细胞定位A,D.暗场观察;B,E.明场观察;C,F.暗场和明场的叠加场Fig.7 Subcellular localization of PsnbZIP1protein A,D.Observed in dark filed for green fluorescence;B,E.Observed in bright field;C,F.The combination of dark filed and bright field
2.5 PsnbZIP1蛋白转录激活活性分析
通过酵母单杂交试验来验证小黑杨PsnbZIP1蛋白是否具有转录激活活性,结果由图8 所示,所有酵母细胞均可在SD/-Trp 缺陷固体培养基上生长,但在SD/-Trp/-His/-Leu/X-α-Gal 三缺固体培养基上生长且变蓝的是含有阳性对照质粒的酵母菌,含有pGBKT7 空载质粒和3 种重组质粒的酵母均不生长。结果表明PsnbZIP1蛋白全长在酵母中没有转录激活活性。

图8 PsnbZIP1转录激活活性检测Fig.8 Detection of transcriptional activation activity of PsnbZIP1
2.6 PsnbZIP1基因启动子分析
通过PCR 反应从PsnbZIP1基因上游克隆出长度为2 009 bp 的DNA 目的片段。利用Plant-CARE 对PsnbZIP1基因的启动子序列中的顺式作用元件进行分析。结果表明该启动子除了核心启动子元件外还含有许多激素应答元件(见表4),包括脱落酸应答元件(ABRE)、生长素应答元件(TGA-element)。此外,还发现了许多光应答元件(GTGGC-motif、chs-CMA2a、TCT-motif)和一些参与种子特异性调控、参与干旱诱导反应的元件,表明PsnbZIP1基因有可能在小黑杨种子的生长发育和小黑杨响应环境胁迫的生理过程发挥重要作用。
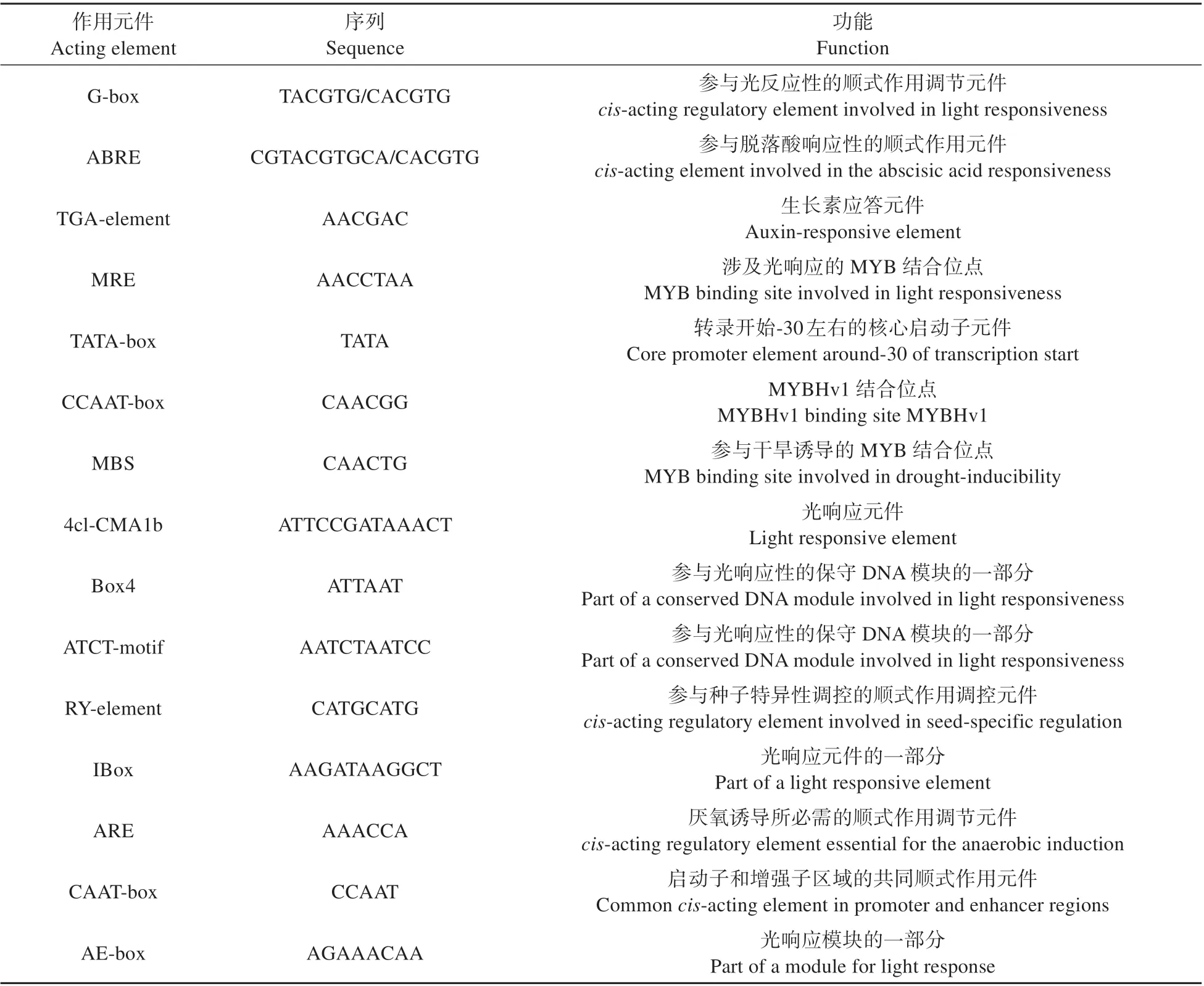
表4 PsnbZIP1基因启动子上的顺式作用元件分析Table 4 Analysis of the cis-acting element on the promoter of PsnbZIP1
3 讨论
以毛果杨同源基因Potri.010G142900.1的转录本序列作为参考,从小黑杨中克隆出PsnbZIP1基因,其ORF 区序列长度为432 bp,编码143 个氨基酸。基于生物信息学理论,分析了PsnbZIP1 蛋白的理化性质以及预测该蛋白的二级结构和三级结构。之后用农杆菌介导的烟草瞬时表达明确PsnbZIP1 蛋白的亚细胞定位情况,结果表明该蛋白为核定位蛋白。然后,在酵母中对该蛋白的转录激活活性进行分析,结果显示PsnbZIP1 蛋白在酵母中没有转录激活活性。通过与毛果杨bZIP家族转录因子构建的进化树得知,PsnbZIP1转录因子与PtbZIP172基因同源性最高,PtbZIP172基因在毛果杨bZIP转录因子抗盐胁迫的表达量分析中无明显变化[9],而通过q-PCR对PsnbZIP1基因进行时空表达测定,发现该基因在小黑杨耐盐胁迫的生理过程中表达量快速提高。推测在小黑杨体内PsnbZIP1基因是具有抗盐胁迫功能的转录因子。
有研究表明,转录因子AtbZIP60没有转录激活活性,但是仍然可以正调控植物的耐盐能力和通过与NtMYB7相互作用的方式调控种子萌发[14]。同样,PsnbZIP1也没有转录激活活性,可能会与其他转录因子相互作用从而调控抗盐能力,可利用PsnbZIP1的基因进行酵母双杂交实验获取互作蛋白从而深入研究PsnbZIP1的抗盐作用机理。此外,水稻(Oryza sativa)转录因子OsbZIP46负调控水稻的抗旱能力,并且OsbZIP46全长区域没有转录激活活性,但当位于羧基端的D结构域缺失时,剩余OsbZIP46区域便具有组成型激活活性,并且正调控植物的抗旱能力[15]。PsnbZIP1已验证全长区域没有转录激活活性,之后可进行人为改造突变再验证突变体是否具有组成型激活活性,并需要验证突变体与PsnbZIP1是否也表现出不同的生物学功能。
顺式作用元件是一段具有转录调节功能的特异DNA 序列,启动子则是能够调控基因表达的顺式作用元件。从PsnbZIP1基因上游克隆出长度为2 009 bp的启动子序列并进行分析,结果显示该启动子上存在2 个生长素应答元件和6 个ABA 应答元件。植物激素是由植物自身代谢产生的一类有机物质,对植物生长发育有重要的调节控制作用,也对植物响应环境胁迫有关键作用。ABA 参与了高等植物的生长发育与环境胁迫等诸多生理过程。干旱和高盐会导致植物ABA 含量大幅增加[16],并通过ABA信号传导路径来发挥相应功能。ABA 能通过SnRK2s 蛋白激酶对多种下游靶标基因进行激活及转录调控的方式来提高植物抗逆能力。此外有相关研究表明被SnRK2s 激酶激活的基因可进一步识别其他基因启动子区的ABRE 元件从而调控其表达[12],启动子区含有ABRE 元件的水稻锌指蛋白OsbZIP23的高表达增加了转基因植株对ABA 的敏感性及耐盐性[17]。小麦(Triticum aestivum)锌指蛋白家族基因TaCHP启动子区也含有ABRE 元件,盐敏感型小麦品种JN17 由于基因TaCHP的转入与过表达抗盐能力有明显提高[18]。因此,PsnbZIP1基因启动子含有ABA 应答元件可能是小黑杨响应非生物胁迫的证据之一。
在植物组织的生长发育过程中,ABA 也充当着一个关键角色。在胚胎形成早期,ABA 能促进胚的生长发育[19]。在胚胎发育晚期,ABA 通过拮抗GA 的效应来阻止种子胚继续生长,从而导致穗萌[20]。在种子成熟阶段,ABA 的含量显著增加,大量的ZEP 基因在烟草中表达[21]。除此之外,光是种子萌发的环境因子,光被光敏色素蛋白感知并转换为内部信号,从而调节种子的生理进程[22]。除了ABA 元件外,PsnbZIP1基因的启动子还存在参与种子特异性调控的顺式作用调控元件(RYelement),以及大量的光响应元件。该基因极有可能存在调控种子萌发生长的功能,可以向这个方向研究探索。
在PsnbZIP1基因启动子上还存在参与干旱诱导的MYB结合位点MBS、MYBHv1 结合位点CCAAT-box、参与光响应的MYB结合位点MRE。MYB转录因子在植物中广泛存在,能与其他家族的转录因子相互作用,以转录复合体的方式实现了对靶基因的精密调控[23-24]。已有大量研究证实MYB转录因子家族多数成员中在植物响应非生物胁迫的调控过程具有关键作用。在烟草中MYB家族基因TaODORANT1过表达增强了烟草的耐旱和耐盐性[23]。拟南芥中GmMYB12B2的过表达提高了对盐和紫外线辐射胁迫的耐受性[24]。由于一个完整的生物学过程是单基因无法完成,往往需要多个基因协同参与。上游调控基因可以通过其编码的蛋白质结合到下游靶基因的启动子上激活或抑制其表达,从而完成调控过程[25]。PsnbZIP1转录因子本身不具有转录激活活性,启动子上所存在相关的MYB结合位点,表明PsnbZIP1极有可能会与MYB家族的一些相关基因相互作用共同发挥调节功能。之后的研究可以通过酵母单杂交试验寻找PsnbZIP1基因上游调控基因,分析其相关的结构特点与功能作用,在此基础上更深层次地探寻多基因协同作用的复杂机制以及基因调控网络构建的核心逻辑,解析其对于植物生命活动的重要意义。

