CO2气调处理对鲜莲贮藏品质的影响
舒小芳,郜海燕,韩延超,房祥军,陈杭君
(浙江省农业科学院食品科学研究所 农业农村部果品产后处理重点实验室 浙江省果蔬保鲜与加工技术研究重点实验室 中国轻工业果蔬保鲜与加工重点实验室 杭州 310021)
莲子(Lotus-seed),又名莲实、莲米、水芝丹,属睡莲科莲属(NympheaceaeNelumbo Adans),在我国主要种植在福建、浙江、湖北、江苏等地[1-2],是中国和东南亚地区常见的药食两用植物[3]。由于鲜莲采收为夏季高温季节,采后呼吸作用旺盛,导致莲蓬在短时间内失水,营养物质流失,表皮褐变和叶绿素降解,因此严重制约了鲜莲产业的发展[4-5]。解决鲜莲贮藏过程中的褐变和品质衰老等问题,开发出一种安全、有效的保鲜技术至关重要。
目前有报道表明,气体熏蒸(如臭氧、1-甲基环丙烯、一氧化碳)、可食性涂膜、化学药剂浸泡(如氯吡苯脲、6-苄基腺嘌呤、壳聚糖)、箱式气调及低温贮藏等保鲜技术可有效控制鲜莲褐变,减少营养物质流失和细胞壁多糖降解[6-12]。人工气调贮藏是一种恒定保持贮藏环境中气体浓度及温、湿度的保鲜方式。通常采用降低O2、升高CO2浓度来控制贮藏环境中的气体成分,降低植物的呼吸作用和生理生化代谢,从而延长其贮藏时间。由于气体熏蒸和化学保鲜在果蔬表面会有部分残留,具有潜在危害,而气调保鲜技术具有操作条件可控、安全健康等特点,因此已普遍应用到石榴[13]、黄瓜[14]、苹果[15]、火龙果[16]等果蔬中,并取得较好的保鲜效果。研究表明适宜的CO2浓度可有效抑制微生物的生长[17]。气调处理可减缓樱桃[18]和草莓[19]贮藏过程中病害的发生,降低腐烂率;气调贮藏可有效维持果蔬的生理平衡,降低对果蔬的胁迫伤害,低O2、高CO2气调处理可降低杏鲍菇的活性氧和谷氨酸代谢,减少营养物质的损失[20-21]。
本文以5% O2及CO2气调处理新鲜莲子,通过分析贮藏过程中莲肉还原糖含量、可溶性糖含量、淀粉含量等营养品质的变化,以及对莲皮酶促褐变和叶绿素降解的影响,探究鲜莲气调保鲜的最佳CO2含量。
1 材料与方法
1.1 材料与试剂
1.1.1 试验材料与采后处理 莲子品种为 “十里荷一号”,采自杭州湾里塘莲藕专业合作社,采后1 h 内运回实验室进行预冷,选择乳熟期且颗粒饱满、无病虫害、无机械损伤的莲蓬作为试验用果。将莲蓬置于4 ℃冷库预冷2 h 后剥出莲子。
将无机械损伤、成熟度和大小均一的莲子随机分装在4 个保鲜盒中,每盒50 颗,分别放入不同气调箱内贮藏。本研究基于前期预试验结果,O2固定为5%,按要求分别改变CO2(4%,8%和12%),其余氮气补充;在气调箱内注入空气为对照组。贮藏温度为(4±1)℃,湿度为85%~90%。各处理每4 d 取一次样,取至20 d。每次随机取样并进行3 个生物学重复,完成相应基础指标测定后,将果肉和果皮分离,分别用液氮速冻后,-80 ℃冷冻保存,用于后续指标测定。
1.1.2 试剂氢氧化钠、磷酸二氢钠、磷酸氢二钠、苯酚、浓硫酸、3,5-二硝基水杨酸、酒石酸钾钠、亚硫酸钠、无水乙醚、无水乙醇等均为分析纯级,购于上海凌锋化学试剂有限公司;碘、碘化钾、福林酚等均为分析纯级,购于上海源叶生物科技有限公司。
1.2 仪器与设备
TA.XT.plus 型物性测定质构仪,英国Stable Micro Systems 公司;CR-400 型手持色差仪,日本柯尼卡美能达公司;LB20T 型手持糖度计,广州市速为电子科技有限公司;5430 型台式高速离心机,美国Eppendorf 生命科学公司;UV-2802 型紫外分光光度计,尤尼柯仪器公司;MRC-250B 型智能人工气候箱,上海百典仪器设备有限公司;YSXCAB 型气调保鲜实验设备,杭州屹石科技有限公司。
1.3 试验方法
1.3.1 失重率测定 采用称量法测定失重率,计算公式见式(1)。
1.3.2 色泽测定 采用CR-400 手持色差仪测定L*、a*和b*值,其中L*表示明度,a*和b*表示色度。每个处理随机取6 粒莲子,将鲜莲表皮侧面分为3 等份,每等份测定1 次。
1.3.3 硬度和脆度测定 参考严锐等[5]的方法进行修改,每个处理随机取莲子20 粒,采用TAXT2i 型质构仪P6 探头进行质地多面分析(TPA),测前速度5 mm/s,测试速度2 mm/s,测后上行速度2 mm/s,莲子受压变形为5 mm,触发力为0.049 N。表皮硬度表示莲子表皮破裂时探头所用的最大力度,表皮脆度表示莲子表皮发生破裂的深度;内部硬度表示莲子果肉的平均硬度,内部脆性表示莲子果肉发生破裂时探头所用的最大力度。
1.3.4 褐变度测定 参考Sun[22]等的方法略有改动。称取0.5 g 莲肉样品于2.0 mL 离心管中,加入1.5 mL 0.1 mol/L 磷酸缓冲液(pH 6.8)混匀,离心(4 ℃,10 000 r/min,20 min)。取上清液在波长410 nm 处测定吸光度值(A410nm),计算褐变度。
式中,V——样品提取液总体积,mL;m——样品质量,g。
1.3.5 还原糖含量测定 参照曹建康等[23]的方法略有改动。采用3,5-二硝基水杨酸法测定。还原糖的提取:称取0.5 g 莲肉样品,加入蒸馏水定容至25 mL,于80 ℃恒温水浴锅中浸提30 min。收集滤液,蒸馏水反复冲洗滤渣,合并滤液,定容至100 mL,即为还原糖提取液。还原糖的测定:取2 mL 提取液,加入1.5 mL 3,5-二硝基水杨酸溶液,混匀后沸水浴5 min,冷却后定容至25 mL,在波长540 nm 处测定吸光度值。根据显色液吸光度值,葡萄糖标准溶液绘制标准曲线,并用公式计算还原糖含量,单位用质量分数(%)表示。
1.3.6 可溶性糖含量测定 参照曹建康等[23]的方法略有改动。采用苯酚-硫酸试剂法测定。可溶性糖的提取:称取0.5 g 莲肉样品,加入5 mL 蒸馏水,沸水浴浸提30 min,冷却后过滤,将滤液转移至100 mL 容量瓶中,再将滤渣重新转入试管中,加5 mL 蒸馏水,继续沸水浴浸提10 min,过滤至容量瓶中,用水反复冲洗试管及残渣,合并滤液并定容至100 mL,即为可溶性糖提取液。可溶性糖的测定:吸取0.5 mL 样品提取液到25 mL 刻度试管中,加入1.5 mL 蒸馏水和1 mL 90 g/L 苯酚溶液,摇匀,再加入5 mL 浓硫酸,充分混匀,在室温下静置30 min。以蒸馏水代替提取液作为空白对照并调零,在波长485 nm 处测定吸光值。蔗糖标准溶液绘制标准曲线,并用公式计算可溶性糖含量,单位用质量分数(%)表示。
1.3.7 可溶性固形物(TSS)含量测定参照隋棠等[11]的方法略有改动。取1.0 g 莲肉样品,研磨后加2 mL 磷酸缓冲液离心(4 000 r/min,10 min),取上清液,用阿贝折光仪测定。
1.3.8 淀粉含量测定 按照GB 5009.9-2016《食品安全国家标准 食品中淀粉的测定》中的方法进行淀粉含量的测定。
1.3.9 总酚含量测定 莲子的总酚含量用福林酚法测定。取1.0 g 莲皮样品研磨后,加入10 mL 60%乙醇,于暗处常温提取2 h,离心(4 ℃,12 000 r/min,20 min),上清液备用。取0.2 mL 上清液加入1.2 mL 福林酚试剂,混匀后静置5 min,加入2.4 mL 7.5%的碳酸钠溶液,充分混匀后,室温避光静置2 h 后,在波长760 nm 处测定吸光度值,没食子酸标准溶液绘制标准曲线,并用公式计算总酚含量。
1.3.10 多酚氧化酶(PPO)和过氧化物酶(POD)活力测定 PPO 和POD 活力测定均参考曹建康等[23]的方法。粗酶液提取:称取0.2 g 莲皮样品,液氮研磨,加入1.5 mL 0.1 mol/L 磷酸钠缓冲液(pH 6.8),于12 000 r/min、4 ℃条件下离心25 min,所得上清液即为粗酶提取液。
PPO 酶活力反应体系包括:0.2 mL 粗酶液+2.8 mL 10 mmol/L 邻苯二酚溶液,测定3 min 内波长420 nm 处吸光度值的变化,以每分钟鲜样吸光度值变化0.01 为1 个酶活单位(U/g)。POD 酶活力测定反应体系包括:0.3 mL 粗酶液、0.3 mL 6 mmol/L 愈创木酚溶液和2.4 mL 5 mmol/L H2O2溶液,混匀,测定3 min 内波长470 nm 处吸光度值的变化,以鲜样每分钟吸光度值变化0.01 为1 个酶活单位(U/g)。
1.3.11 叶绿素含量测定 采用Mampholo 等[24]的方法。取0.2 g 莲皮样品,加入20 mL 95%甲醇,于暗处常温提取2 h,于4 ℃下9 558×g离心10 min。取上清液测定OD646nm和OD662nm。
式中,V——样品提取液总体积,mL;m——样品质量,g。
1.4 数据处理
所有指标测定进行3 次重复实验,采用Excel 2010 统计试验数据,SPSS 18.0 进行方差分析和单因素ANOVA 分析,P<0.05 表示存在显著差异。采用GraphPad Prism8 进行绘图。
2 结果与分析
2.1 气调处理对采后莲子色泽与褐变度的影响
莲皮的表观色泽直接影响莲子的商品价值,褐变度、L*值(亮度)、a*值(+:偏红,-:偏绿)和b*值(+:偏黄,-:偏蓝)是表征色泽变化的重要指标[25]。由图1a 可知,在贮藏过程中,随着莲子的表观色泽由嫩绿色转变为黄绿色,最后逐渐褐变,对照组和气调处理组莲子的褐变度呈上升趋势。在贮藏12~20 d 期间,8% CO2处理褐变度明显低于对照组和其它处理组(P<0.05)。由图1b 和1c 得出,对照组和气调处理组莲子亮度会下降,并且随着叶绿素的降解,黄化现象加重。在贮藏12~20 d期间,8% CO2处理莲子的L*值和a*值与对照组和其它处理组具有显著差异(P<0.05);由图1d 可知,在贮藏0~8 d 期间,对照组与气调处理组b*值变化不显著(P>0.05),在贮藏8 d 以后,各处理莲子b*值上、下波动,其中对照组的b*值保持较大值;而12% CO2处理在贮藏期间b*值变化不明显。结果表明适宜的二氧化碳可有效抑制鲜莲贮藏过程中莲皮色泽变化,过高的二氧化碳容易造成表皮损伤,而过低的二氧化碳对莲子保鲜效果不明显。

图1 气调处理对采后果皮褐变度(a)、L*值(b)、a*值(c)和b*值(d)的影响Fig.1 Effect of air conditioning treatment on the browning degree(a), L value(b), a* value(c)and b* value(d)of pericarp after harvest
2.2 气调处理对采后莲子失重率与质构的影响
莲子在贮藏过程中失重程度严重会导致失鲜,影响表皮和果肉的硬度与脆性[26]。由图2 可知,气调处理能有效延缓莲子失重率。从整体上看,对照组的失重程度较为严重,与气调处理组呈显著差异(P<0.05),在贮藏20 d 时,失重率为19.96%;12% CO2处理莲子虽比4% CO2处理莲子的失重程度更为严重,但两处理间无显著差异(P>0.05);8% CO2处理莲子的失重程度最轻,在贮藏12 d 后,与对照组和其它气调处理组呈显著差异(P<0.05),在贮藏20 d 时,此处理失重率为8.54%。
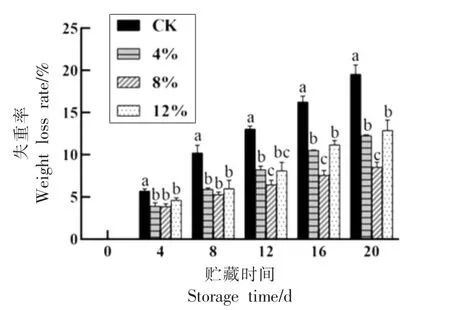
图2 气调处理对采后莲子失重率的影响Fig.2 Effect of air conditioning treatment on weight loss rate of lotus seed after harvest
如表1所示,随着贮藏时间的延长,对照组和气调处理组的表皮硬度、表皮脆度、内部平均硬度以及内部脆性都有显著变化(P<0.05)。表皮硬度呈先上升后下降的趋势,对照组和8% CO2处理组的表皮硬度始终保持显著差异(P<0.05)。在贮藏期间,表皮脆度呈持续下降趋势,这与莲子的失重程度密切相关;内部平均硬度是指果肉的平均硬度,对照组和气调处理组的内部平均硬度呈显著上升趋势,但各处理之间显著差异不大;对照组和气调处理组的内部脆性变化较为显著(P<0.05),在贮藏4~8 d 时,各处理组间有显著差异(P<0.05)。莲子在后熟过程中伴随着糖类物质转化为淀粉,淀粉的积累会导致口感变得更加紧实,导致莲肉的硬度明显上升。8% CO2处理在表皮硬度、表皮脆度以及内部脆性方面表现出较好的效果。
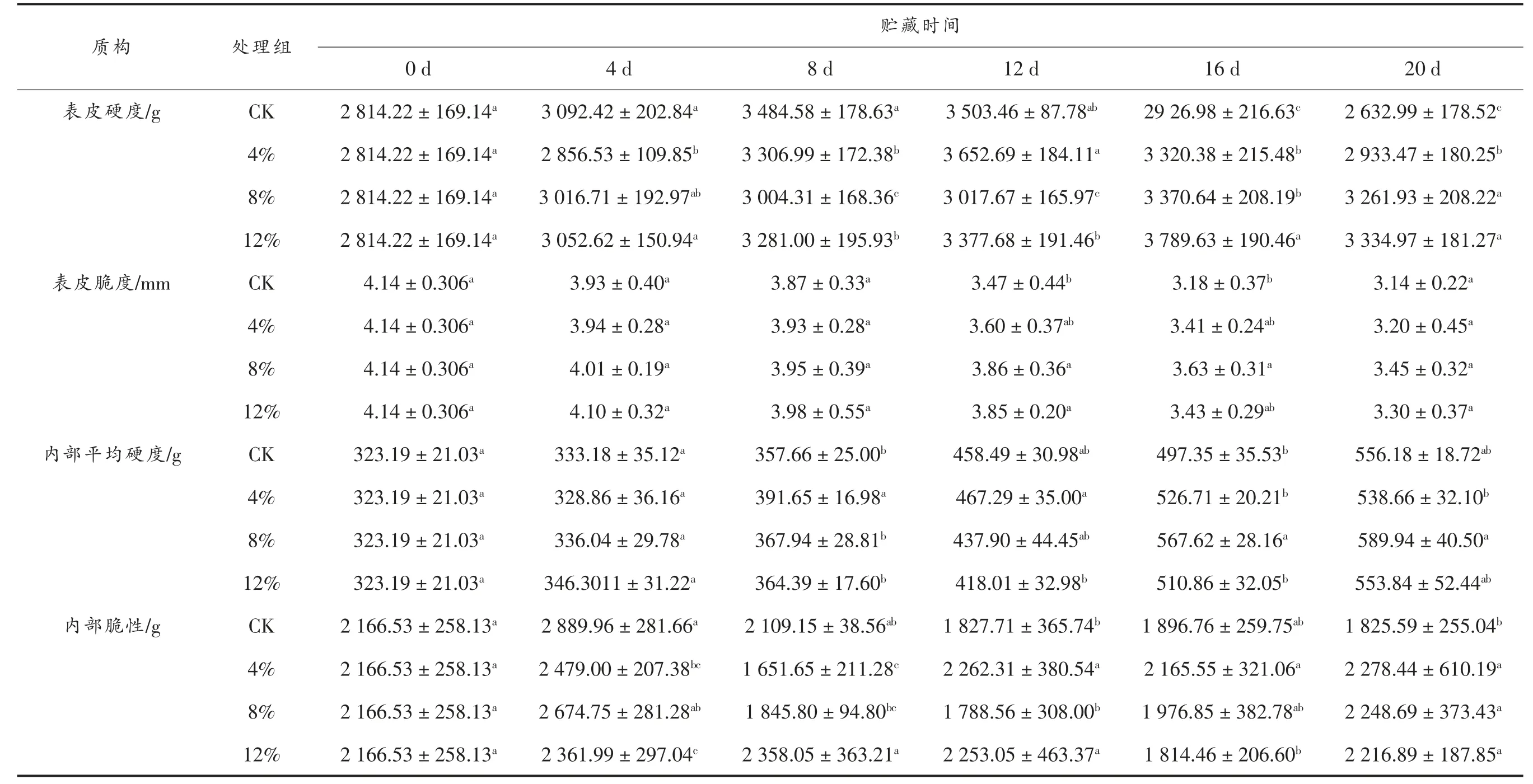
表1 气调处理对采后莲子质构指标的影响Table 1 Effect of air conditioning treatment on quality and structure index of lotus seed after harvest
2.3 气调处理对采后莲肉糖类物质含量的影响
莲子果肉中的还原糖主要是提供莲子新陈代谢的主要能量物质。如图3a所示,随着贮藏时间的延长,对照组和气调处理组莲子的还原糖含量整体呈先上升再下降趋势。对照组和12% CO2处理的还原糖含量在贮藏12 d 后出现下降趋势,而8% CO2处理的还原糖含量在贮藏8 d 后急剧下降;在贮藏结束时,各处理组的还原糖含量差异显著(P<0.05),对照组和4%,8%,12% CO2处理的还原糖含量分别是0.90%,0.85%,0.70%,0.77%。
由图3b所示,在贮藏期间,对照组和气调处理组的可溶性糖含量总体呈下降趋势,并且对照组始终低于气调处理组,在贮藏8 d 后,对照组和气调处理组之间的可溶性糖含量差异显著(P<0.05);从贮藏12 d 后,8% CO2处理的可溶性糖含量始终高于对照组和其它气调处理组,在贮藏20 d 后可溶性糖含量相比对照组高0.16%,这说明8% CO2处理可有效延缓莲子贮藏过程中可溶性糖的消耗。
在植物体内,淀粉是主要的能量物质之一。由图3c所示,随着贮藏时间的延长,对照组和气调处理组的莲子淀粉含量呈现先上升再下降的趋势;对照组在贮藏0~8 d 期间呈现上升趋势,第8 天时达到峰值为153.11 mg/g,随后开始下降。12% CO2处理在第12 天时达到峰值,其淀粉含量为149.22 mg/g,显著高于对照组(P<0.05)。4%和8%CO2处理淀粉含量变化趋势较为相同,而8% CO2处理的淀粉含量在贮藏16 d 后变化趋于平缓,这说明8% CO2处理能延缓鲜莲糖代谢和抑制莲子淀粉的分解速率。
可溶性固形物是表征果蔬品质的重要指标。由图3d所示,在贮藏过程中,对照组和12% CO2处理的TSS 含量呈现先下降后上升的趋势,而4%和8% CO2处理的莲子TSS 含量呈现先下降再趋于平缓。在贮藏0~16 d 期间,对照组与气调处理组无显著差异(P>0.05),在第20 天时,4%,8%和12% CO2处理的TSS 含量分别比对照组低0.47%,0.53%和0.20%,4%和8% CO2处理与对照组之间存在显著差异(P<0.05),说明气调处理能延缓莲子贮藏期间淀粉等营养物质的消耗,从而减少TSS 的累积。

图3 气调处理对采后还原糖(a)、可溶性糖(b)、淀粉(c)、可溶性固形物(d)含量的影响Fig.3 Effect of air conditioning treatment on reducing sugar(a),soluble sugar(b),starch(c),TSS(d)content of lotus seed after harvest
2.4 气调处理对采后莲皮总酚和相关酶的影响
酚类物质是植物体中重要的次生代谢物质,也是酶促褐变的底物,褐变主要是由过氧化物酶催化酚类物质形成醌类物质,呈现出褐色[25]。由图4a 可知,在贮藏过程中,8% CO2处理莲皮的总酚含量始终高于对照组和其它处理组,4% CO2处理组呈持续下降趋势。在贮藏结束时,8% CO2处理组总酚含量最高(218.77 mg/g),依次是12%(210.00 mg/g)、4%(195.58 mg/g)和对照组(186.52 mg/g)。由图4b 可知,在贮藏0~12 d 期间,对照组和气调处理组莲子表皮的PPO 活性呈上升趋势,第12 天以后出现下降趋势。8% CO2处理组的PPO 活性始终低于对照组和其它处理组,在贮藏8 d 后,8% CO2处理组与其它处理之间存在显著差异(P<0.05)。在贮藏结束时,8% CO2处理组的PPO 活性比对照组低0.14 倍。由图4c 可见,不同处理莲皮POD 活性呈现先上升后下降的趋势。对照组、4%和8% CO2处理组在贮藏第8 天时达到最大值,而12% CO2处理组在第12 天时达到最大值,随后均呈现下降趋势。在贮藏期间,8% CO2处理组的POD 活性始终小于对照组和其它气调处理组,在贮藏16~20 d 期间,与对照组和其它气调处理组存在显著差异(P<0.05)。

图4 气调处理对采后总酚(a)、PPO(b)、POD(c)的影响Fig.4 Effect of air conditioning treatment on total phenol(a),PPO(b),POD(c)of lotus seed after harvest
2.5 气调处理对采后莲皮叶绿素含量的影响
由图5 可知,对照组和气调处理组莲皮的叶绿素含量呈下降趋势;在贮藏0~12 d 期间,对照组的叶绿素含量下降较快,4%和8% CO2处理组叶绿素含量下降速率较慢。在整个贮藏期间,8%CO2处理的叶绿素含量下降速率最慢,其次是4%和12%,可看出8% CO2处理组可明显延缓莲皮叶绿素的降解。

图5 气调处理对采后莲皮叶绿素含量的影响Fig.5 Effect of air conditioning treatment on chlorophyll of lotus seed after harvest
3 讨论
莲子在高温潮湿季节采收,采后依然维持着较高的呼吸作用,极易导致莲肉品质劣变,本试验发现莲皮失绿、褐变和莲肉糖类物质消耗是影响莲子食用品质和商品价值的关键因素。研究结果表明,当5% O2+8% CO2气调处理时,可有效降低莲子的失重率、褐变度、表皮硬度,维持莲肉的脆性和表皮的叶绿素含量,莲子变色进程明显迟于对照组,说明该处理可有效延缓莲子在贮藏过程中莲皮色泽和莲肉质地变化。当CO2过高时,莲子主要进行无氧呼吸作用,生理代谢紊乱,莲皮组织更易褐变,莲肉的营养物质消耗也较快。在柑橘研究中发现,15% CO2处理使柑橘出现CO2损伤,加快果皮褪绿及乙醛和乙醇的产生[26]。不同果蔬对CO2耐受力存在差异,苹果、杏和桃等水果的CO2耐受力在5%左右,而蓝莓、黑莓等小浆果的CO2耐受力在25%[27]。本研究得出莲子的CO2耐受力在10%左右,在CO2为8%的贮藏环境下能保持新鲜莲子的最佳品质。
莲子采后呼吸作用使葡萄糖、果糖和蔗糖等糖类物质被消耗,导致可溶性糖含量降低,是莲子甜味降低的主要原因[28],吴松霞等[29]研究也发现芋艿贮藏过程中可溶性糖和还原糖含量呈下降趋势。在本试验发现,对照组和气调处理组的淀粉含量呈先上升后下降趋势。在贮藏前期,对照组和气调处理组的淀粉含量变化不显著,此时淀粉的合成与分解速率达到相对平衡;在贮藏后期,淀粉含量迅速下降,而可溶性固形物和可溶性糖含量变化趋于平缓,这是由于此时淀粉分解速率大于合成速率,淀粉分解后产生可溶性糖,弥补了呼吸作用消耗的糖类物质。适宜的气调处理能减弱呼吸作用,从而减少莲子在贮藏期间营养物质消耗。8% CO2处理的淀粉含量和可溶性糖含量显著高于对照组(P<0.05),而还原糖含量和可溶性固形物低于对照组。气调贮藏在处理“砀山酥”梨、香菇等果蔬中均有延缓其糖类物质降解的作用[30-31]。
POD 和PPO 虽然作为抗氧化酶参与清除自由基,但两者在有氧条件下能催化酚类、类黄酮物质的氧化和聚合,导致组织褐变。适宜的CO2处理有助于维持果蔬细胞的氧化还原平衡,同时高CO2造成的环境胁迫,导致果实自由基产生与清除系统失衡,从而需要增强POD、PPO 活性及更多的总酚用于减少氧化损伤[32]。颜征等[33]证实莲皮中的多酚物质有较强的还原能力和清除DPPH、ABTS+、O2-等自由基的能力。王超[34]发现6% CO2处理促进苹果细胞膜透性和丙二醛含量上升,加快了膜脂过氧化程度,导致PPO 活性被激发,加速果肉褐变。本研究发现8% CO2处理的POD 和PPO 活性低于对照组,而总酚含量高于对照组,这说明8% CO2气调可通过抑制莲皮POD 和PPO活性,从而减缓了莲皮酚类物质氧化,降低褐变度。
4 结论
本文针对鲜莲在贮藏过程中易出现褐变和营养物质流失等问题,采用固定5% O2,改变CO2的气调技术对鲜莲贮藏保鲜20 d,通过测定分析相关品质指标,得出以下结论:
1)鲜莲在贮藏期间外观品质和营养品质的下降是不可避免的,气调保鲜技术通过调控鲜莲的生理代谢从而影响其品质变化,该技术促进或延缓鲜莲品质劣变取决于合理的O2及CO2气调。
2)随着贮藏时间的延长,对照和气调处理组鲜莲的褐变度、a*值、失重率、莲肉硬度等均呈上升趋势,而L*值、表皮脆度、可溶性糖、淀粉、还原糖、总酚、叶绿素等含量均呈下降趋势,这些指标与莲肉口感和莲皮色泽密切相关,通过延缓品质指标的变化可以达到保鲜的目的。
3)4% CO2处理虽可以降低莲子的失重率和褐变度,但营养物质消耗较为严重;8% CO2处理降低了莲皮褐变度、失重率、还原糖含量及POD和PPO 活性,维持了莲肉的脆性及淀粉、可溶性糖和表皮叶绿素含量;12% CO2处理使莲子受到高CO2伤害,褐变现象比对照组更加明显。
综上所述,气调处理对新鲜莲子贮藏过程中外观及贮藏品质有显著影响。在4 ℃、5% O2贮藏条件下,8% CO2处理对维持鲜莲品质效果相对最佳,可作为一种安全可靠的技术开展应用。

