外源脱落酸处理对蓝莓采后低温胁迫下生理响应的影响
房祥军,吴伟杰,穆宏磊,陈杭君,郑小林,郜海燕*
(1 浙江工商大学食品与生物工程学院 杭州 310018 2 浙江省农业科学院食品科学研究所 农业农村部果品采后处理重点实验室 浙江省果蔬保鲜与加工技术研究重点实验室 中国轻工业果蔬保鲜与加工重点实验室 杭州 310021)
蓝莓(Vaccinium corymbosumL.)为杜鹃花科越橘属植物,富含花色苷、VC 等抗氧化活性物质,具有保护视力、抗肿瘤、预防心血管疾病等多种药用价值[1-3]。蓝莓采收季节高温多雨,果实含水量高,采收过程的机械损伤和微生物侵染易造成蓝莓果实腐烂软化,缩短其贮藏期[4-5]。温度是影响果蔬贮藏期和品质的最重要的因素,控制环境温度可有效延长果蔬的贮藏期。低温贮藏是蓝莓鲜果生产中普遍应用的贮藏方法[6-7]。在不影响果蔬正常生理代谢的情况下,贮藏温度越低,贮藏期越长。然而,长时间的低温贮藏易导致果蔬组织产生冷害,反而降低其贮藏期和品质。
脱落酸(Abscisic acid,ABA)是一种半倍萜羧酸类植物激素,在高等植物体内广泛分布,对植物生长发育的多个环节起到调节作用。ABA 的生理作用主要体现在抑制生长和抵抗逆境等方面。例如:抑制种子萌发,调控植物气孔关闭,促进叶片衰老及抵抗干旱胁迫、盐胁迫和高低温胁迫等[8-10]。目前对ABA 抗逆性的研究主要集中在植株生长发育过程中重金属胁迫、盐胁迫、干旱胁迫等方面[11-12],在果蔬采后抗逆性方面的研究较少,低温贮藏下蓝莓果实对外源ABA 的生理响应机制尚不清楚。
本研究以浙江地区主栽“园蓝”蓝莓为试验材料,用不同浓度的ABA 溶液对采后蓝莓进行处理,在(2±1)℃贮藏35 d,探讨细胞膜透性、丙二醛(MDA)含量、抗氧化物质含量、抗氧化酶等生理指标的变化与果实抗逆性的关系,以期为蓝莓低温贮藏提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料供试蓝莓品种为园蓝,2019年7月29日采自浙江新昌兆丰生态园,采摘采收后3 h 内用保鲜车运回实验室,2 ℃预冷备用。
1.1.2 试剂 三氯乙酸、胆汁酸、磺基水杨酸、冰醋酸、茚三酮、甲苯、考马斯亮蓝G-250、丙酮、浓氨水、KNO2、抗坏血酸、邻菲罗琳,国药集团化学试剂有限公司;矢车菊-3-葡萄糖苷标准品,上海阿拉丁试剂有限公司;脱落酸,Sigma-Aldrich 公司;SOD 试剂盒,南京建成生物工程研究所。
1.2 仪器与设备
TA-XT plus 质构仪,英国SMS 公司;CHROMA METER CR-400 手持色差仪,日本SEMSING公司;Metrohm 877 Titrino plus 自动滴定仪,瑞士万通公司;LB 20T 数显糖度计,广州市速为电子科技有限公司;GBC Cintra 20 紫外-可见光光度计,澳大利亚GBC 公司,Thermo MR 23i 高速低温冷冻离心机,法国JOUAN 公司。
1.3 方法
试验设1 个对照组C1(清水对照)和3 个处理组:C2(400 μmol/L)、C3(600 μmol/L)和C4(800 μmol/L),每处理组设3 个重复。蓝莓样品分别经不同浓度的脱落酸溶液喷淋,2 ℃下自然风干,之后转入2 ℃低温贮藏,环境湿度90%~95%。分别在贮藏第0,7,14,21,28 天和35 天取样测定。样品用液氮速冻后置于-80 ℃超低温冰箱中保存。
1.3.1 硬度测定 参考Chu 等[13]的方法,采用TA.XT Plus 质构仪测定蓝莓的硬度。每个处理随机抽取15 个蓝莓果实。用P/6 不锈钢探头(直径6 mm,压力距离5 mm,测量速度1 mm/s),硬度值以最大断裂力(N)表示。
1.3.2 可溶性固形物(TSS)含量 每个处理随机选择8 个蓝莓果实,挤压取果汁,蒸馏水调零,数显手持糖度计测定TSS。
1.3.3 相对电导率(REC)蓝莓果实切成厚度为1 mm 的薄片,于25 mL 试管中定容,110 r/min 振荡30 min,此时溶液测定的电导率为P1(s/m);煮沸10 min,迅速冷却,定容至原刻度,测定溶液电导率为P2(s/m),去离子水测得的电导率为P0(s/m)。相对电导率按以下公式计算:
1.3.4 丙二醛(MDA)含量 MDA 含量的测定参考Chen 等[14]的方法,稍作修改。1 g 冷冻研磨的蓝莓与5 mL 100g/L TCA 混匀后离心。0.5 mL 上清液与3 mL 0.67% TBA 混合后沸水浴20 min,冷却至室温后分别测定OD450nm、OD532nm、OD600nm。丙二醛含量以μmol/g 表示。
1.3.5 脯氨酸(Pro)含量 0.5 g 蓝莓样品在5 mL 3%磺基水杨酸中研磨,沸水浴提取10 min,吸取2 mL 冷却后的滤液加入2 mL 冰醋酸和2 mL 酸性茚三酮,沸水浴加热30 min 后加入4 mL 甲苯显色,在波长520 nm 处测定吸光度值,通过标准曲线计算脯氨酸含量[15],脯氨酸的含量以每kg 蓝莓鲜重(FW)中含有的脯氨酸的μg 数表示。
1.3.6 可溶性蛋白(SP)的含量 可溶性蛋白采用考马斯亮蓝G-250 比色法测定。0.2 g 蓝莓果肉匀浆,定容至10 mL,匀浆液5 000 r/min 离心10 min,吸取上清0.1 mL,加入0.9 mL 蒸馏水和5 mL 考马斯亮蓝G-250,斡旋混匀,2 min 后测定波长595 nm 处的吸光度值,并根据标准曲线计算SP 含量。
1.3.7 过氧化氢(H2O2)含量 H2O2含量测定参考Ferguson 等[16]的方法,稍作修改。冷冻研磨的蓝莓样品1 g,加入5 mL 预冷丙酮充分混匀提取,离心后吸0.5 mL 上清液,加入0.5 mL 预冷丙酮,0.1 mL 10% TiCl4-HCl,0.2 mL 浓氨水后混匀反应5 min 后离心,向沉淀中加入3 mL 2 mol/L H2SO4,完全溶解后测定OD412nm。绘制标准曲线,计算样品H2O2含量,结果以μmol/g 表示。
1.3.8 超氧阴离子(O2·-)生成速率 O2·-生成速率的测定参照孙莎等[17]的方法,以KNO2作为标准参照,以μmol/min·g 为单位计算样品中O2·-的生成速率。
1.3.9 超氧化岐化物酶(SOD)的活性 采用南京建成SOD 试剂盒进行测定。计算公式如下:
1.3.10 过氧化氢酶(CAT)参考胡琼英等[18]的方法并略作改动,测定蓝莓中CAT 活性。反应酶液制备:冷冻研磨的蓝莓1.0 g,加入pH 7.8 的5 mL缓冲溶液,冰浴提取30 min,上述提取液在4 ℃、10 000 r/min 条件下离心30 min,取上清液备用。
酶活性测定方法如下:反应液体系包含3 mL 0.1 mol/L Tris-HCl 缓冲液(pH 7.8)、0.2 mL 上清酶液、0.4 mL 0.75% H2O2。加入反应液后混匀,立即测定波长240 nm 处3 min 内光吸收度值的变化。以波长240 nm 处吸收度值每分钟变化0.01表示一个酶活单位(U)。
1.3.11 抗坏血酸过氧化物酶(APX)APX 酶活测定参照曹建康等[19]方法,略有改动。1 g 冷冻研磨的蓝莓果肉,加入5 mL 0.1 mol/L(pH 7.5)磷酸钾缓冲液(含0.1 mol/L EDTA、1 mmol/L AsA 和2% PVPP),4 ℃12 000×g高速离心15 min;反应体系中依次加入2.6 mL 50 mmol/L pH 7.5 硼酸钾缓冲液(含0.1 mol/L EDTA 和0.5 mmol/L AsA)和0.1 mL 酶提取液,最后加入0.3 mL 2 mmol/L H2O2溶液启动反应,涡旋混匀,迅速测定反应液在波长290 nm 处的吸光值。
1.3.12 花色苷含量 花色苷含量测定参考Correa-Betanzo 等[20]的方法,采用pH 值示差法稍作修改。称取冷冻研磨蓝莓样品1.0 g,加入pH 3.0 的60%乙醇溶液,按料液比1∶20 混合均匀,40 ℃水浴浸提2 h。吸取抽滤后滤液0.1 mL,分别用0.2 mol/L KCl 缓冲液(pH 1.0)和1 mol/L NaAc 缓冲液(pH 4.5)定容至10 mL,以蒸馏水为对照,分别测定溶液在波长510 nm 和700 nm 处的吸光度,结果以克冻样所含矢车菊-3-葡萄糖苷的毫克数(mg/g)表示。
式中,A——pH 1.0 与pH 4.5 处(A510nm-A700nm)的差值;MW——矢车菊素-3-葡萄糖苷分子质量(取449.2);DF——稀释倍数;ε——矢车菊素-3-葡糖苷的摩尔消光系数(取26 900);V——提取液的总体积,mL;m——称取的蓝莓样品的质量;1——比色皿光程(1 cm)。
1.3.13 抗坏血酸(AsA)含量 AsA 含量的测定参考吴媛媛等[21]的方法,1 g 样品加入5 mL 5%三氯乙酸(TCA)溶液,混匀离心取上清液0.1 mL,加入1.9 mL TCA,1 mL 无水乙醇,0.5 mL 0.5%磷酸-乙醇,1 mL 0.5%邻菲罗琳-乙醇,0.5 mL 0.03%FeCl3-乙醇,于30 ℃水浴60 min,测定OD534nm,每个样品重复3 次,AsA 含量以mg/100 g 表示。
1.4 数据处理方法
采用GraphPad Prism 9.0 做图,SPSS 16.0 对数据分析,用Duncan 新复极差法(P<0.05)进行差异显著性比较,Origin pro 2021 进行主成分分析、相关性分析和聚类分析。各项指标测定均重复3次,试验结果以平均值±标准偏差表示。
2 结果与分析
2.1 ABA 处理对低温贮藏下蓝莓硬度和TSS 含量的影响
硬度是指示果实品质的重要指标,随着果实的成熟,水溶性果胶、半纤维素和纤维素水平降低[22]。TSS 含量的高低与果实的成熟度有关,同时也会影响果蔬的风味。由图1所示,在贮藏过程中,各组处理蓝莓果实的硬度和TSS 含量均呈现不同幅度下降的趋势,这与果实的后熟及衰老进程有关。其中对照组维持相对较高的硬度和较低的TSS 含量。经不同浓度的ABA 处理后,加速了蓝莓果实的硬度降低和TSS 含量的升高,其中以600 μmol/L 和800 μmol/L ABA 处理效果较为明显,与对照组相比差异显著(P<0.05)。在贮藏至35 d,600 μmol/L 和800 μmol/L ABA 处理的果实硬度分别为对照组的87.8%和86.1%;TSS 含量分别为对照组的103.2%和101.6%。
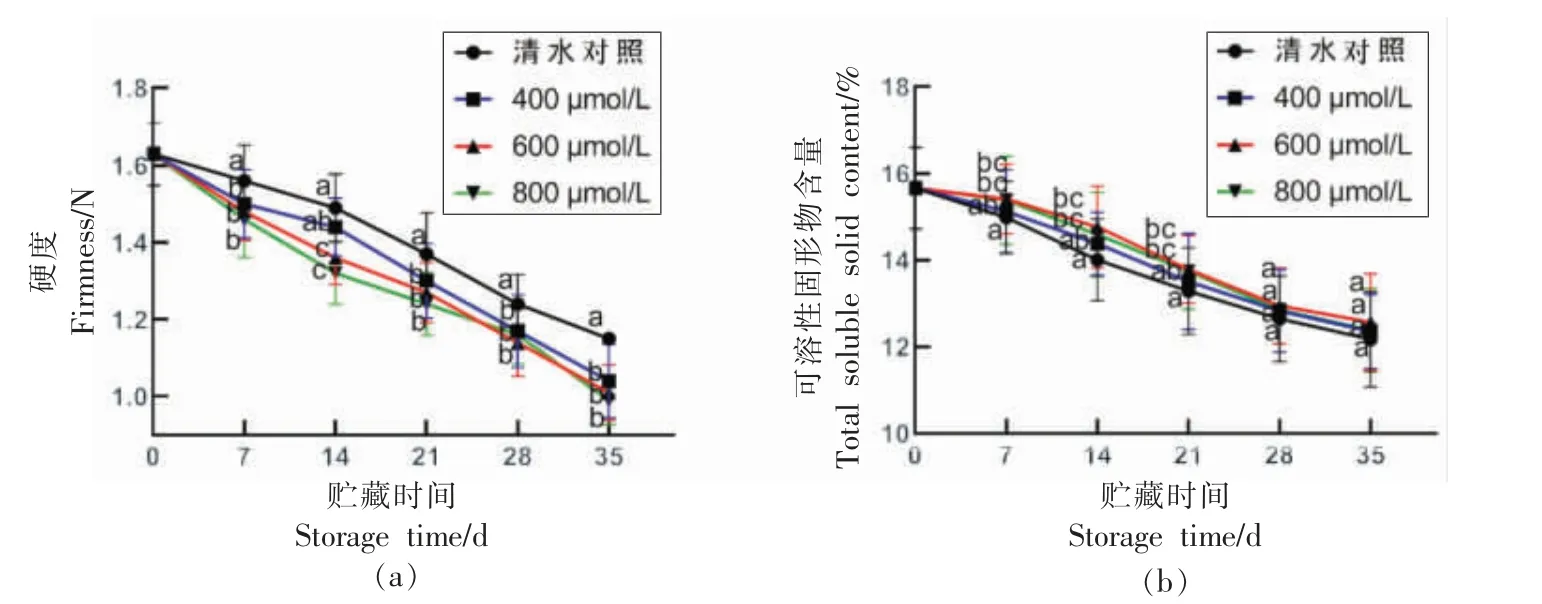
图1 ABA 处理对采后蓝莓低温贮藏硬度和可溶性固形物含量的影响Fig.1 Effect of ABA treatment on firmness and total soluble solids content of postharvest blueberry during low temperature storage
本研究发现ABA 处理降低了蓝莓果实硬度,提高了TSS 含量。该研究结果与张帆[23]报道的蓝莓的硬度与ABA 的含量呈显著负相关的结果相似,表明ABA 处理促进了蓝莓的成熟。
2.2 ABA 处理对低温贮藏下蓝莓相对电导率(REC)和MDA 含量的影响
相对电导率的变化指示细胞膜透性的改变,通常用细胞膜透性的变化来反映细胞膜结构完整性和损伤程度[24]。贮藏前期变化缓慢,7 d 后相对电导率上升趋势明显,可能由于低温胁迫及果实衰老导致细胞膜损伤程度增加造成。对照组果肉细胞膜透性的变化较大,在贮藏35 d 时相对电导率达到71.46%;600 μmol/L 处理上升趋势较其它处理组缓慢,贮藏35 d 相对电导率为66.41%,与对照相比差异显著(P<0.05)。结果表明,600 μmol/L ABA 处理降低了细胞膜破坏程度。
MDA 是生物细胞膜脂质发生过氧化的产物,其含量是衡量植物细胞衰老和膜脂质受损伤程度的重要指标。随着贮藏时间的延长,MDA 含量不断增加。ABA 处理不同程度的抑制了MDA 含量升高,其中以600 μmol/L ABA 处理的效果最为显著。贮藏至35 d,MDA 含量为CK 的90.7%,差异显著(P<0.05),说明ABA 处理维持了细胞膜的完整性、减轻了蓝莓膜脂过氧化程度。减轻MDA 对细胞膜的伤害,提高了其抵御低温胁迫的能力。
植物在受到外界不良环境侵袭时,细胞膜会首先起到防御功能。低温改变了细胞膜的通透性,导致细胞内物质流出;同时导致细胞内大量活性氧的累积,活性氧会导致细胞膜脂氧化,产生大量MDA。MDA 与蛋白质、核酸结合,阻碍相关蛋白质的合成,对细胞膜造成损伤。甘薯低温冷藏研究发现,降低膜渗透性、MDA 水平和活性氧自由基(ROS)的产生,保持较高的抗氧化酶活性、抗坏血酸和总酚含量,增强抗氧化保护系统,可抑制甘薯块根冷害的发生[25]。低温可诱导甜瓜内源ABA 的合成,保持甜瓜细胞膜结构的完整性,从而提高甜瓜的氧化应激耐受性,提高甜瓜的抗寒性和光合作用[26]。本研究的结果也表明,ABA 处理降低了细胞膜的透性,抑制了MDA 含量的增加,从而维持细胞的正常生理功能,提高其低温耐受性。

图2 ABA 处理对采后蓝莓低温贮藏相对电导率和MDA 含量的影响Fig.2 Effect of ABA treatment on relative conductivity and MDA content of postharvest blueberries during low-temperature storage
2.3 ABA 处理对低温贮藏下蓝莓Pro 和SP 含量的影响
Pro和SP 是植物体内的重要渗透调节物质,Pro 和SP 起到调节植物细胞的渗透压、降低冰点的作用。从图3 可知,在整个贮藏过程中,Pro 和SP 的含量不断升高。外源ABA 处理提高了蓝莓果实中Pro 和SP 的含量,其中以600 μmol/L ABA 处理效果最为明显。贮藏至35 d,600 μmol/L ABA 处理Pro 含量和SP 含量分别是对照组的1.16 倍和1.4 倍,差异显著(P<0.05)。

图3 脱落酸处理对采后蓝莓低温贮藏脯氨酸和可溶性蛋白含量的影响Fig.3 Effects of abscisic acid treatment on the content of proline and soluble protein in postharvest blueberries during cold storage
Pro 和SP 作为植物抗逆调节物质在多种植物都有报道。低温应激可促进甜瓜中Pro 的积累,ABA 作为信号分子通过调控Pro 代谢关键基因的表达来调节Pro 的积累[27]。盐、脱水、PEG 和H2O2处理通过Pro 合成和分解代谢协同调节Pro 积累以响应非生物胁迫[28]。研究表明,外源褪黑素处理提高了冷藏处理的芒果中Pro 的含量,降低了芒果的冷害指数,保持了果实品质[29]。
2.4 ABA 处理对低温贮藏下蓝莓H2O2 和O2·-生成速率影响
正常生理情况下,植物体内的自由基处于动态平衡状态。在遭受低温、干旱等逆境胁迫时,体内的自由基平衡被破坏打破,导致大量ROS 积累,从而引起膜脂氧化和细胞损伤[30]。过度累积H2O2和O2·-等会引起核酸结构改变,氧化蛋白质和脂质氧化,导致细胞损伤和凋亡。由图4 可知,蓝莓在低温贮藏过程中,H2O2和O2·-不断累积。脱落酸处理对H2O2和O2·-的生成具有抑制作用,特别是在贮藏中期更为显著。贮藏至第21 天,600 μmol/L ABA 处理组的H2O2含量是对照组的90.1%;O2·-生成速率是对照组的79.45%,差异显著(P<0.05)。

图4 ABA 处理对采后蓝莓低温贮藏H2O2 含量和O2·-生成速率的影响Fig.4 Effect of ABA treatment on hydrogen peroxide content and superoxide anion formation rate of postharvest blueberry during low temperature storage
低温破坏了植物体内ROS 平衡,过量的ROS会攻击细胞大分子,造成蛋白质损伤、脂质过氧化、DNA 突变和酶失活等,进而损伤植株。青椒在低温下长时间贮藏会产生冷害,冷激+草酸联合处理可以抑制O2·-产生、H2O2含量、MDA 水平和相对膜透性的增加,并提高了抗氧化酶活性和Pro 积累来减轻青椒果实的冷害[31]。
2.5 ABA 处理对低温贮藏蓝莓抗氧化酶(SOD、CAT、APX)活性的影响
植物的抗氧化酶系统由SOD、CAT、APX 等组成,抗氧化酶可以减少ROS 积累,降低活性氧带来的损伤[32]。抗氧化酶活性提高可以提升ROS 清除能力,减轻MDA 造成的细胞膜伤害,保护细胞膜结构的完整性,维持其正常的生理功能,从而提高蓝莓的低温抗冷性。图5 显示对照组与处理组果实SOD、CAT 和APX 酶活性先上升后降低,在第7 天左右上升至高峰,而后缓慢下降。和对照相比,ABA 处理能维持较高的SOD 和APX 酶的活性,CAT 酶活性在贮藏前期低于对照组,21 天后,ABA 处理能维持较高的CAT 酶活性,其中600 μmol/L ABA 处理效果最好。贮藏至35 d,SOD、CAT 和APX 活性分别是对照组的1.51,1.26 倍和1.18 倍,与对照组相比差异显著(P<0.05)。
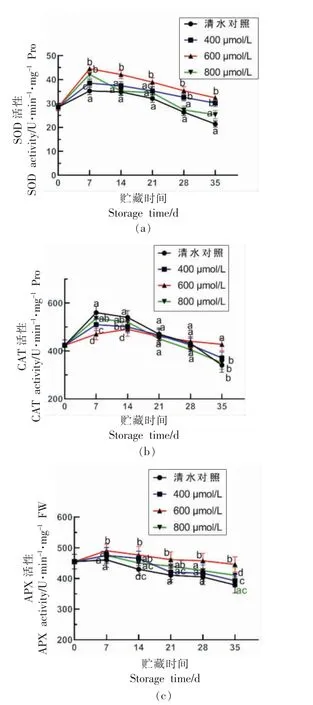
图5 ABA 处理对采后蓝莓低温贮藏抗氧化酶(SOD、CAT、APX)活性影响Fig.5 Effect of ABA treatment on the activities of antioxidant enzymes(SOD,CAT,APX)of blueberry during low temperature storage
植物中的抗氧化酶系统可以在细胞受到胁迫时消除活性氧,减少细胞损伤。ABA 处理显著提高了干旱胁迫下番茄幼苗抗逆性,上调SlSOD、SlCAT和SlAPX的基因表达量,进而增加了干旱胁迫下SOD、CAT 和APX 酶的活性,有效缓解了干旱胁迫对番茄幼苗造成的氧化性伤害,稳定细胞膜结构,增强番茄幼苗的抗旱性[33]。栝楼在铝胁迫下抗氧化酶活性受到抑制,ABA 处理后显著增强了抗氧化酶SOD、POD、CAT 等的活性,使栝楼具有更强的抗氧化活性去适应铝胁迫[34],这与本研究中ABA 处理提高了抗氧化酶活性,增强其抗低温胁迫的研究结果相一致。
2.6 ABA 处理对低温贮藏蓝莓花色苷和AsA 含量的影响
花色苷和AsA 是蓝莓中主要的抗氧化功能成分,共同组成蓝莓的非酶抗氧化系统,花色苷和AsA 的含量变化与果实品质密切相关。在贮藏过程中,花色苷含量呈先上升后下降的趋势,在贮藏至7 d 到达峰值,之后随贮藏时间逐渐下降。ABA处理显著促进了蓝莓花色苷的合成,其中以600 μmol/L ABA 处理效果最好。贮藏至35 d,600 μmol/L ABA 处理的蓝莓花色苷的含量是对照组的1.72 倍,差异显著(P<0.05)。AsA 含量在贮藏过程中逐渐下降。ABA 处理可抑制AsA 含量的下降速度,维持较高的AsA 水平。600 μmol/L ABA 处理组的作用效果最为明显,贮藏至35 d,600 μmol/L ABA 处理组的AsA 含量是对照组的1.34倍。
研究发现,ABA 处理可显著提高果实中花色苷和AsA 含量,特别是花色苷,具有促进花色苷合成,提高果实品质的功效[35]。同时花色苷和AsA作为抗氧化物质,对提高其自身的抗氧化能力也能起到一定作用。
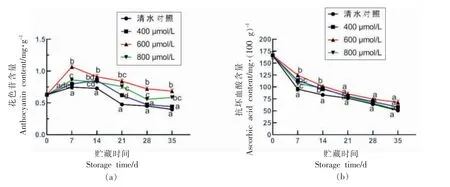
图6 ABA 处理对采后蓝莓低温贮藏花色苷和抗坏血酸含量的影响Fig.6 Effect of ABA treatment on anthocyanin and AsA content of postharvest blueberry during low temperature storage
2.7 相关性分析
对蓝莓果实中的13 种生理生化指标进行主成分分析,通过主成分分析共提取出3 个主成分(图7a)。PCA 模型显示出数据集的总方差为96.4%(其中PC1 方差贡献率为70.2%,PC2 方差贡献率为18.7%,PC3 方差贡献率为7.5%)几乎包含了蓝莓样品的所有信息。PCA 结果表明可以很好的解释不同脱落酸浓度处理下蓝莓抗冷性相关指标之间的变异信息。其中PC1 和PC2 的特征值大于1,说明提取因素可以反映PCA 得分总体特征。由前2 个综合指标的特征值向量可以看出,主成分1 中REC、MDA、Pro、O2·-的特征向量值较大;主成分2 中SOD 和花色苷的特征向量值较大。综合相关性分析结果,蓝莓果实中的REC、MDA、Pro和O2·-可以作为评价其抗冷性的指标。从主成分分析的原理可知,样品在得分图上的距离的远近反映出样品间组分和含量的接近程度。从主成分分析图上可以看出,600 μmol/L ABA 处理组和对照组的蓝莓明显分开,说明ABA 处理对蓝莓低温抗冷性具有显著影响。从相关性分析图7b 可以看出,REC、MDA、Pro、SP、H2O2、O2·-之间呈显著正相关(P<0.01);硬度、TSS 和REC、MDA、Pro、SP、H2O2、O2·-之间呈显著负相关(P<0.01),这与聚类热图7c 的分析结果一致。在聚类热图上,硬度和TSS 被聚为一类,REC、MDA、Pro、SP、H2O2和O2·-被聚为一类。从聚类热图7c 还可以看出,贮藏时间是影响蓝莓采后品质变化的主要因素。0 d 到14 d 的样品大致被聚为一类,21 d 到35 d 的样品被聚为一类,不同贮藏时间的蓝莓被聚在一起。同时还可以看出ABA 处理对蓝莓品质指标的影响。其中600 μmol/L ABA 处理组的样品与对照组的间隔最远,说明600 μmol/L ABA 处理组蓝莓的抗冷性指标变化和对照组差异较大,具有较好的处理效果。

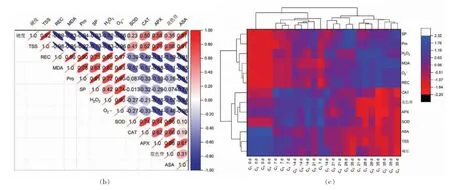
图7 ABA 处理蓝莓果实的生理生化指标的PCA 图、相关性分析图和聚类热图Fig.7 PCA diagram,correlation analysis diagram and cluster heat map of physiological and biochemical indexes of blueberry fruit treated with ABA
3 结论
ABA 对采后蓝莓抵御低温胁迫起重要的作用,通过外源ABA 处理可显著提高蓝莓的抗低温胁迫能力。ABA 处理可通过提高蓝莓的抗氧化酶SOD、CAT、APX 等的活性,降低过ROS,维持细胞膜的完整性;提高蓝莓果肉组织中Pro 和SP 等渗透调节物质的含量,保持较高的花色苷和AsA 等抗氧化物质含量,提高其抗低温逆境能力。其中REC、MDA、Pro、O2·-可以作为蓝莓抗冷性的指标。ABA 具有安全、用量低、使用方便等优点,在蓝莓等浆果的低温长时间贮藏品质保持中具有潜在的应用价值。

