超声波辅助冻结对蓝莓渗透传质特性的影响
张晓敏,张尚悦,白 鸽,庄朝月,郑健蓉,曹雪慧*,励建荣
(1 渤海大学食品科学与工程学院 辽宁锦州 121013 2 海军大连舰艇学院航海系 辽宁大连 116018)
蓝莓(Vacciniumspp.)又称越橘、蓝浆果,属杜鹃花科(Ericaceae)越橘属(Vaccinium)植物,果实色泽诱人,肉质细腻,口感酸甜[1]。富含维生素、矿物质、多酚、花青素等功能性成分[2],被称为“浆果之王”[3]。蓝莓中含有丰富的花色苷,具有抗氧化,延缓衰老,抗癌,缓解心血管疾病等优点[4-5]。新鲜的蓝莓水分含量高[6],保质期相对较短。冷冻是一种有效保留食品颜色、风味和营养品质的方法,通过降低化学反应速率,抑制微生物和酶的活性,从而延长食品的储存时间。
浸渍式冷冻(Immersion chilling and freezing,ICF)是通过低温载冷剂直接与食品接触,加速传热,从而使食品快速冷冻,具有冻结速率快,所得产品品质高的优点,得到广泛认可和应用[7]。冰结晶是影响冷冻食品品质的主要因素,冰晶的大小可通过冷冻速率来控制,因此,发展快速冷冻,提高冻结速率有重要意义。
食品的浸渍冷冻过程中不仅有热量的传递,也伴随着溶液溶质与食品内部水分的相互迁移。Xu 等[17]研究表明,在浸渍冷冻过程中,钙从冷却剂向原料组织中迁移,而超声辅助冷冻又提高了解冻后样品的钙含量;超声波辅助冷冻西兰花[18]时,冷冻样品中钙含量也较高。Zhu 等[19]研究发现,超声频率越高,土豆中总钙的损失越少。Tian 等[20]也发现超声能较好地保留土豆中的钙。Mehmet 等[21]研究表明,在真空浸渍过程施加超声,可以增强乳酸钙和黑胡萝卜酚在苹果组织中的渗透。
海藻糖属于一种非还原性双糖,由2 分子葡萄糖经半缩醛羟基缩合形成,常用作冷冻保护剂,可维持生物膜、蛋白质等各种组织在高温、低温、干旱胁迫等极端环境下的稳定性[22-23]。Elena 等[24]研究表明,含海藻糖的低温保护液与脉冲电场相结合冷冻处理草莓后,草莓细胞活力更高,并且解冻后果肉颜色保持得更好。Ante 等[25]发现,在冻干酸樱桃泥时,添加麦芽糖和海藻糖对花青素的保存有积极的作用。Velickova 等[26]将海藻糖与冷驯化冬小麦草提取物(AWWE)的组合作为冷冻保护剂,通过真空浸渍将溶液注入草莓和菠菜中,结果表明,海藻糖和AWWE 浸渍样品的细胞活力和质地性能最好,与新鲜样品基本一致。
本研究采用空气冷冻、钙溶液协同海藻糖浸渍冷冻、超声辅助浸渍冷冻对蓝莓进行冻结处理,研究冷冻对蓝莓渗透传质和品质的影响,为进一步探究浸渍冷冻过程中载冷剂的渗透传质机理以及提高蓝莓冻结品质的新方法提供参考。
1 材料及方法
1.1 原料及试剂
蓝莓,品种为伯克利(Berkeley),采摘于辽宁省锦州市龙硕蓝莓园。挑选无病虫害和械损伤、大小均一的新鲜蓝莓,为保持其初始温度一致,放于4 ℃冰箱中冷藏。
无水氯化钙、无水乙醇,均为分析纯级,国药集团化学试剂有限公司;海藻糖,食品级,河南万邦实业有限公司。
1.2 仪器及设备
XO-120 L-II 超声辅助速冻冰柜,南京先欧仪器制造有限公司;TA.XT Plus 物性测试仪,英国Stable Micro Systems 公司;RX9608D-HO-BA 温度记录仪,杭州美控自动化技术有限公司;Evolution 201 紫外-可见分光光度计,美国赛默飞Thermo 公司;NMI 20 型低场核磁共振分析仪,上海纽迈电子科技有限公司;HH-4 型数显恒温水浴锅,上海力辰邦西仪器科技有限公司;RX-TDS 210 电导率仪,杭州美控自动化技术有限公司;贝克曼库尔特Allegra 64R 高速冷冻离心机,贝克曼库尔特商贸(中国)有限公司;HD-6 型智能水分活度测量仪,无锡市华科仪器仪表有限公司。
1.3 试验方法
1.3.1 分组及处理 随机从4 ℃冰箱中拿取蓝莓并均分为4 组,进行处理。其中,新鲜组(CK 组)为新鲜蓝莓样品,在4 ℃冰箱保存备用;空气冻结组(AF 组)在-20 ℃冰箱中进行空气冻结,当蓝莓中心温度达到-18 ℃时,冻结完成;浸渍冻结组(IF组)在(-20±1)℃载冷溶液(25%氯化钙及10%海藻糖)中进行浸渍冷冻,当蓝莓中心温度达到-18℃时,冻结完成;超声浸渍冻结组(UIF)组在(-20±1)℃载冷溶液(25%氯化钙及10%海藻糖)中进行超声辅助浸渍冷冻,蓝莓中心温度在0 ℃至-8 ℃时,开启超声,工作60 s,间歇60 s,超声功率96 W,超声频率25 kHz,当蓝莓中心温度达到-18 ℃时,冻结完成。
青海贵南县中学教师云丹的父亲患肺癌晚期住在曼巴扎仓,活佛说他的父亲可能来日不多。于是他特地赶过来最后照顾一下父亲。
将冻结的蓝莓放入密封袋,并做好标记,置于-20 ℃冰箱中贮藏72 h,之后将各处理组蓝莓从-20 ℃冰箱转移至4 ℃恒温培养箱中解冻12 h,再对其各项指标进行测定。
1.3.2 冻结曲线的测定 使用RX9608D-HO-BA温度记录仪测定蓝莓中心位置在冻结过程中的温度变化。
1.3.3 汁液损失测定 参考Diao 等[27]和Cao 等[28]的方法略有修改。取出冻藏的蓝莓,立即称量,称量后将其放在吸水纸上,置于4 ℃恒温培养箱中解冻12 h。解冻完成后将蓝莓表皮的汁液用滤纸吸干,然后称重记录。计算冻融前、后的质量差占冻藏样品质量的百分比,即为汁液损失。
1.3.4 水分分布情况的测定 参考Wang 等[29]的方法略有修改。采用低场核磁共振成像进行测定。试验条件为:重复时间:1 000 ms、回波时间:1.52 ms、累加次数:8,图像大小256×256。
1.3.5 氯化钙含量的测定 采用络合滴定法进行测定[30]。
1.3.6 硬度的测定 参考Xu 等[31]的方法略有修改。利用TA-XT-plus 质构分析仪对蓝莓的硬度进行了测量。试验条件如下:P/50 探头,测前、测试及测后速度均为1.00 mm/s,触发力5 g,压缩量30%。
1.3.7 花色苷含量的测定 采用pH 示差法测定蓝莓花色苷含量[32]。
1.3.8 细胞膜透性的测定 参考Wang 等[33]方法并略有改动。将蓝莓切割为均匀大小的块状,加入20 mL 蒸馏水震荡20 min 后,测定溶液电导率,即为P0;将测后的溶液置于沸水浴中15 min,冷却至室温后测定电导率P1。计算相对电导率,表示细胞膜透性大小,即(P0/P1)×100%。
1.3.9 丙二醛含量的测定 参考曹建康等[34]的方法测定。
1.4 数据处理
采用SPSS 软件对数据进行分析(P<0.05 为显著性差异),使用Origin 2018 软件制图。数据取3 次重复试验的平均值,以平均值±标准差表示。
2 结果与分析
2.1 蓝莓冻结曲线
冻结速率是影响冷冻产品品质的重要原因,快速冷冻产生细小的冰晶,而缓慢冷冻产生较大的冰晶,冰晶越小,食品品质越好[35]。因此,冷冻时间短有助于更好地保持冷冻产品的最终品质。图1 是不同冷冻条件下蓝莓的冻结曲线,可以看出,冻结曲线大致分为3 个阶段:1)初步预冷阶段:4~0 ℃,2)相变阶段:0~-8 ℃,3)低温冷冻阶段:-8~-18 ℃。从图中可看出,3 种冷冻方式的冻结速度有较大差别,与空气冷冻处理组相比,浸渍冷冻处理的蓝莓冻结时间更短,而超声波辅助浸渍处理组在这3 个处理组中,冷冻时间最短,可能是由于超声波产生的空化和微流效应,有效增强冷冻介质与食品之间的传热传质速率,促进多个成核位点的产生,提高成核速率,从而提高冷冻速率[10]。

图1 蓝莓的冻结曲线Fig.1 The freezing curve of a blueberry
2.2 冷冻对蓝莓汁液流失率的影响
汁液流失是评价冷冻样品质量的重要指标之一。如图2所示,3 种不同冷冻处理对蓝莓汁液流失率的影响存在显著差异(P<0.05),其中AF 处理组蓝莓的汁液流失率最高,为15.46%,IF 处理组次之,为11.88%,UIF 处理组的损失最低,为8.26%。这可能是由于超声波的加入促进蓝莓冻结时产生更细小、分布均匀的冰晶,对果肉细胞组织损伤较小,从而降低了蓝莓解冻后的汁液流失。在冷冻过程中,蓝莓与含有钙离子及海藻糖的浸渍液直接接触,会使部分钙离子与海藻糖渗入果实内部。渗入果实中的钙离子能够与蓝莓细胞壁中的果胶相互作用形成果胶酸钙,加强果实细胞壁的稳定性,减少汁液损失[36];同时,海藻糖作为冷冻保护剂,具有维持细胞膜的稳定性作用。因此,超声辅助浸渍冷冻可有效降低蓝莓解冻后汁液损失。

图2 冷冻对蓝莓汁液流失的影响Fig.2 Effects of freezing on drip loss of blueberries
2.3 冷冻对蓝莓水分分布的影响
利用低场核磁成像及伪彩技术测得蓝莓水分分布如图3所示,水分含量越高,显示信号越强,颜色越偏向红色,反之亦然。从图3 中可以看出,CK 组的核磁成像图颜色分布最为均匀,表明新鲜蓝莓内部水分分布均匀,不同冻结处理组的图像,蓝莓中心区域出现了不同程度的绿色,这是由于冷冻过程中冰晶的形成及生长,促使水分向外迁移;浸渍冷冻处理的图像中出现了绿色区域,可能是由于浸渍液压差导致了水分从样品内部向外迁移,相似的结果在西兰花[14]、草莓[37]和萝卜[38]等研究中均有出现。冻结处理组图像都呈现出部分红色聚集分布区域,这说明经冻融后的蓝莓局部水分分布不均匀,可能是由于冷冻产生的冰晶对果实组织造成了损伤,随着液泡中水转变成冰,液泡内溶液浓度增加,导致细胞内水分通过细胞膜迁移出来,致使水分分布不均,水分流向的区域水分含量高,呈现红色。从图中可以看出,AF 图像中红色区域面积较大,且中心位置出现较大绿色区域,可能是由于空气冻结过程中随着温度的降低,蓝莓外层水分先形成冰晶,水分从蓝莓内部向外迁移,导致蓝莓中心区域水分流失,产生较大的绿色区域,解冻后,冰晶融化,大量的水无法被组织重新吸收,从而出现图像中红色区域。UIF 图像中红色区域面积最小,这表明,超声在冷冻过程中促进小冰晶的形成,缓解冷冻对果实细胞的损伤,在解冻后,水分迁移小,水分分布均匀,接近新鲜蓝莓样品。

图3 冷冻对蓝莓水分分布的影响Fig.3 Effect of freezing on water distribution in blueberries
2.4 冷冻对钙迁移量的影响
钙是细胞壁成分之一,在果胶之间形成交叉桥,形成果胶酸钙复合物,这些结构赋予细胞壁抗性并防止其降解[39]。钙浸渍溶液不仅可以维持产品质量,还可提高食品中钙含量,因此钙盐广泛应用于果蔬加工。图4所示是冷冻对蓝莓钙含量的影响,IF 及UIF 处理组与CK 相比,蓝莓整果与果肉中钙含量都存在显著差异(P<0.05);而AF 与CK 处理组间蓝莓中钙含量无显著性差异(P>0.05),UIF 处理组整果和果肉中钙含量最高,分别为0.244%,0.228%,IF 处理组钙含量次之,分别为0.211%,0.187%。这是由于冷冻过程中蓝莓与含氯化钙的浸渍液直接接触,在冷冻过程中有部分浸渍液渗入蓝莓果实内部,导致蓝莓中钙含量升高。超声辅助冷冻,虽然超声波作用提高了冻结速率,缩短了蓝莓与浸渍液的接触时间,但由于超声波能促进溶液中溶质与果实中水分之间的渗透作用,因此,UIF 处理组及IF 处理组与CK 及AF处理组相比,钙含量有显著升高,而UIF 处理组钙含量更高。
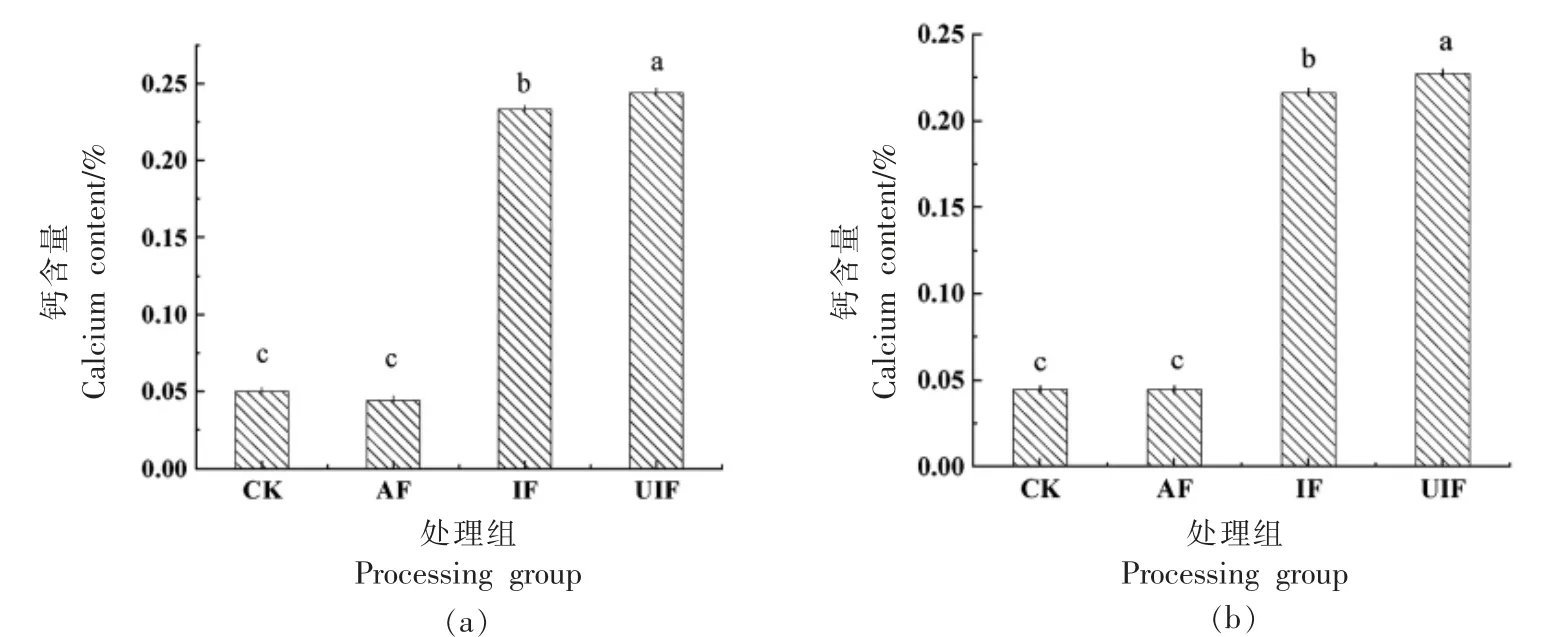
图4 冷冻对蓝莓整果(a)及果肉(b)钙含量的影响Fig.4 Effect of freezing on calcium content in whole fruit(a)and pulp(b)of blueberry
2.5 冷冻对蓝莓硬度的影响
冻品的质地与冷冻过程中形成的冰晶大小有关,与大冰晶相比,小尺寸冰晶的形成对细胞微观结构的破坏更小,质地保存的更好[40]。图5 主要从蓝莓冻融后硬度值来反映其质地变化。如图所示,与CK 组相比,冻融后蓝莓的硬度显著降低(P<0.05),各处理组间存在显著差异(P<0.05)。冻融后蓝莓的硬度值大小为UIF 处理组>IF 处理组>AF处理组,表明在冷冻过程中,浸渍冷冻能够有效保留冷冻食品的硬度值,而超声波的加入促进更小尺寸冰晶的产生,对蓝莓组织产生的损伤更小,解冻后,硬度值更高。同时,IF 及UIF 处理组中,样品直接与浸渍液接触,浸渍液中氯化钙及海藻糖会附着及渗透进样品。钙离子可与果胶交联,对维持质地有显著的作用[39];海藻糖通过保护脂膜的完整性,降低体系中水分的流动,抑制大冰晶的形成[41],在一定程度上对食品质地起到了冷冻保护的作用。
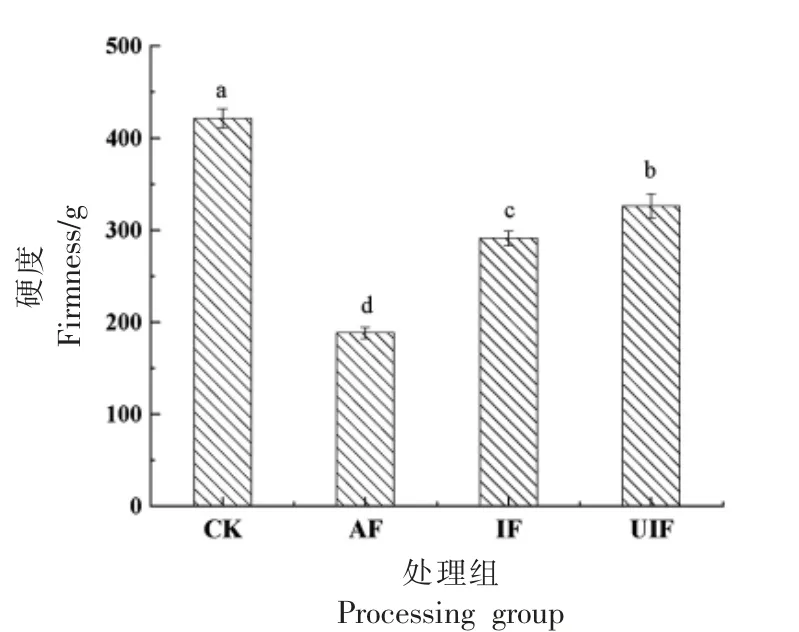
图5 冷冻对蓝莓硬度的影响Fig.5 Effect of freezing on firmness of blueberries
2.6 冷冻对蓝莓花色苷含量的影响
蓝莓果实中含有丰富的花色苷,如图6所示,各处理组间花色苷含量具有显著性差异(P<0.05)。冷冻处理后,与CK 组相比蓝莓花色苷含量显著降低(P<0.05),表明冷冻处理导致蓝莓花色苷有不同程度的损失。3 种冷冻方式中,IF 处理组花色苷含量最高,这表明冷冻过程中海藻糖的加入有利于花色苷的保留,可能是由于海藻糖在蓝莓表面形成了一层薄膜,可有效阻止花色苷氧化;而在冻结过程中辅以超声波却导致花色苷含量损失较大,这可能是超声波空化作用产生的自由基攻击花色苷,发生反应[17],导致花色苷含量损失。冷冻后花色苷损失还有一个原因是可能是由于在冻结过程中,冰晶产生对蓝莓组织造成损伤,在解冻后蓝莓产生汁液损失,导致花色苷流失。从实际结果来看,超声波对花色苷的影响较大,因此,需进一步优化超声强度等参数。
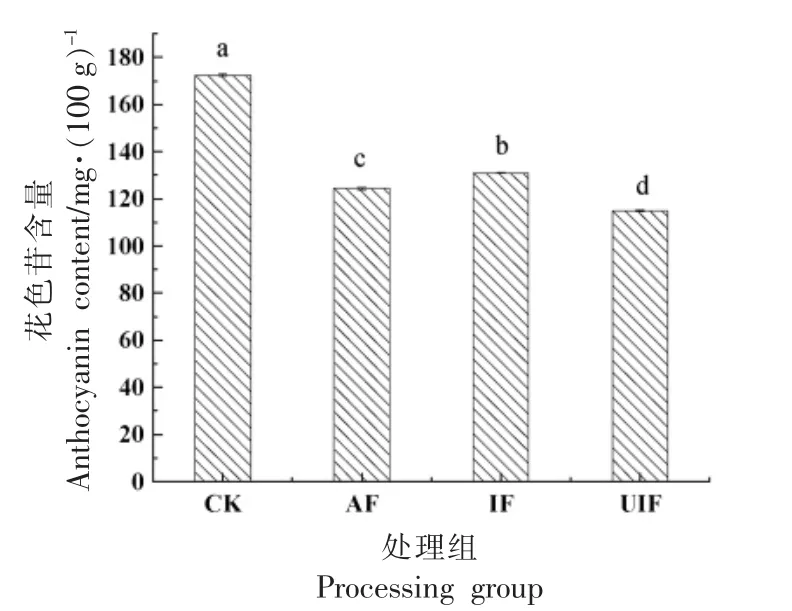
图6 冷冻对蓝莓花色苷含量的影响Fig.6 Effect of freezing on anthocyanin content in blueberry
2.7 对蓝莓细胞膜透性的影响
相对电导率是衡量细胞膜透性的重要方式。如图7所示,经冷冻处理后蓝莓的细胞膜渗透率都大幅升高,与CK 处理组相比具有显著性差异(P<0.05)。冻结处理后,AF 处理组、IF 处理组和UIF 处理组细胞膜透性分别为63.23%,61.14%和54.65%,UIF 处理组最低,较CK 处理组相比增长35.04%。其中,空气冷冻与浸渍冷冻处理组之间无显著性差异(P>0.05),而超声辅助冷冻与其它两组存在显著差异(P<0.05)。这表明与空气冻结相比,浸渍冷冻虽然提高了冻结速率,但可能由于蓝莓样品直接与低温载冷溶液接触,在浓度差的作用下,增加了渗透压,导致载冷溶液中溶质与蓝莓组织中水分相互渗透迁移,增加细胞膜的透过率,对蓝莓细胞膜造成了损伤,解冻后使电解质不断渗出,导致细胞膜渗透率与空气冻结没有显著性差异(P>0.05)。在浸渍冷冻过程中加入超声,加速了冻结速率,缩短与载冷溶液的接触时间;同时,在超声波作用下能产生更加细小,分布均匀的冰晶,对蓝莓组织及细胞膜的破坏程度更小,从而在解冻后细胞内电解质外渗少,相对电导率较低。并且,海藻糖作为冷冻保护剂,可保护细胞脂膜的完整性,故UIF 处理组细胞膜渗透率较低。
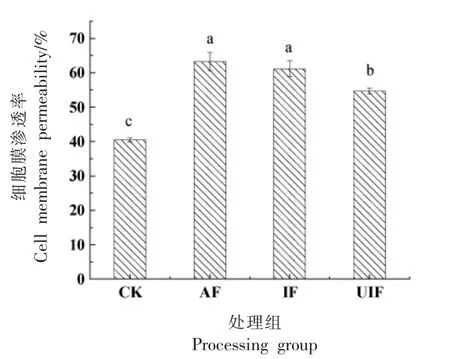
图7 冷冻对蓝莓细胞膜渗透率的影响Fig.7 Effect of freezing on cell membrane permeability of blueberry
2.8 冷冻对蓝莓丙二醛含量的影响
丙二醛是膜脂过氧化的主要产物之一,含量可作为衡量冷害胁迫程度的指标,丙二醛的积累对果实细胞膜及细胞壁造成一定的损伤[42]。如图8所示,经冷冻处理后蓝莓果实中丙二醛含量显著升高,各处理组之间丙二醛含量具有显著差异(P<0.05)。UIF 处理组蓝莓果实中丙二醛含量最低,为9.15 nmol/g FW,与CK 处理组相比,升高11.82%;AF 处理组,丙二醛含量最高,为9.78 nmol/g FW,与CK 处理组相比,升高19.46%;IF 处理组较CK处理组丙二醛含量升高14.90%,这表明海藻糖作为冷冻保护剂能够有效保护细胞结构,维持植物细胞膜的完整性[41]。同时,浸渍冷冻加快冻结速率,能有效降低对细胞脂膜的损伤,降低脂膜过氧化,减缓丙二醛的累积。在冷冻过程中加入超声波,使冷冻速率更快,同时产生更加细小均匀的冰晶,降低对蓝莓组织损伤,有效缓减蓝莓膜脂过氧化程度,维持果实细胞膜的完整性[42],降低丙二醛含量。
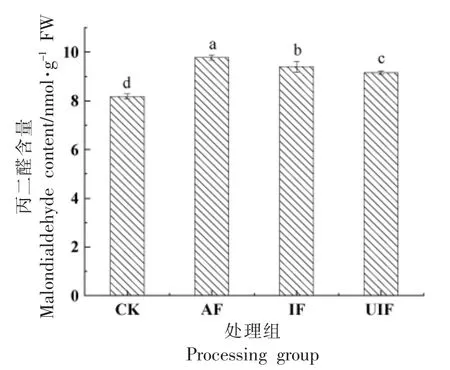
图8 冷冻对蓝莓丙二醛含量的影响Fig.8 Effect of freezing on malondialdehyde content in blueberry
3 结论
本试验研究超声辅助冷冻对蓝莓渗透传质的影响,结果表明:在25 kHz,96 W 超声条件下,与空气冷冻和浸渍冷冻相比,超声辅助冷冻缩短了蓝莓的冻结时间,解冻后蓝莓的汁液流失率较低,水分分布更均匀,更接近于新鲜蓝莓内部水分分布;与新鲜蓝莓相比,浸渍冷冻及超声辅助冷冻处理组蓝莓中钙含量显著升高;超声作用下蓝莓硬度得到了更好的保存;但花色苷含量较浸渍冷冻有较高的损失;同时,超声在一定程度上抑制了细胞膜透性及丙二醛含量的升高。
综上所述,超声辅助冷冻不仅可以提高冷冻速率,降低脂膜过氧化,维持细胞膜的完整性,还可以促进溶液溶质与食品内水分互相渗透传质,但还需进一步优化超声功率,从而在达到快速冷冻,保持良好冷冻蓝莓品质的基础上,降低蓝莓花色苷的损失。

