太子参化学成分、药理作用和应用的研究进展
倪建成,范永飞, 2,叶祖云*
太子参化学成分、药理作用和应用的研究进展
倪建成1,范永飞1, 2,叶祖云1*
1. 福建省特色药用植物工程技术研究中心,宁德师范学院,福建 宁德 352100 2. 福建农林大学食品科学学院,福建 福州 350002
太子参是中国传统补益中药材之一,兼具药用和食疗功效,主要含有挥发油、多糖、环肽、生物碱、皂苷、酚类等成分,具有降血糖、抗炎、抗癌、保护细胞、抑制酪氨酸酶、免疫调节等药理作用。对太子参的化学成分及其药理作用,以及太子参在临床、食疗、保健食品、化妆品、兽药制剂和功能性饲料添加剂等方面应用进行总结,为太子参进一步开发利用提供依据。
太子参;多糖;环肽;生物碱;降血糖;酪氨酸酶抑制;免疫调节;太子参环肽B;二氢阿魏酸
太子参为石竹科(Caryophyllaceae)多年生草本植物孩儿参(Miq.) Pax ex Pax et Hoffm.的干燥块根,别名孩儿参、童参、四叶参、米参,始载于《本草从新》[1-2],主要分布于福建、贵州、安徽、江苏、山东等地。太子参味甘、微苦,药性平和,归脾、肺经,具有益气健脾、生津润肺的功效,临床上主要用于治疗脾虚体倦、食欲不振、病后虚弱、气阴不足、自汗口渴、肺燥干咳等症状[2]。太子参的药性符合新型冠状病毒感染中药预防方用药规律[3],多省制定的2022版新冠病毒感染中医药干预推荐方案中,一些预防汤剂含有太子参,如连香太子饮(安徽)、益气解毒方和益气生津方(福建)[4]。与人参相比,太子参药性平缓;与党参相比,补气作用稍弱,但生津养阴之力比党参强,更适合儿童、老人、病后虚弱和体弱多病者使用[5]。
目前,以太子参为君药的消导健脾类的中成药如健胃消食片[6-8]、复方太子参颗粒[9]、儿宝颗粒[10-13]等均有应用于临床。在食疗保健方面,太子参可用于炖鸡、煲鸭、熬粥、浸酒和制茶饮等,能健脾胃、益气血,堪称“老少皆宜”的清补佳品[5,14-17]。前期大量研究表明太子参含有糖类、苷类、氨基酸类、环肽类、甾醇类、挥发油类、脂肪酸类、油脂类、磷脂类和微量元素等化学成分,具有降血糖、调血脂、心肌保护、免疫调节、抗氧化、抗应激、抗疲劳、抗肿瘤等药理作用[18-24]。但已有文献缺乏对太子参挥发油类、生物碱类和酚类等成分的归纳,且多糖类和环肽类成分尚需归纳补充,此外鲜有太子参单体成分的药理活性总结报道。因此,本文通过检索归纳1992年1月—2022年7月报道的国内外太子参相关文献,对太子参的主要化学成分及其药理活性,以及太子参的应用情况进行综述,以期为太子参在药品、保健食品、化妆品等领域的开发利用提供参考依据。
1 化学成分
已有研究表明太子参中含有挥发油类[25-31]、多糖类[32-37]、环肽类[38-46]、生物碱类[40,45,47-50]、皂苷及其苷元[47,51-52]、酚类[45,51-52]以及氨基酸类、脂肪酸类、油脂类、磷脂类和微量元素[18,23]等成分。
1.1 挥发油类
挥发油是普遍存在于植物中的一类挥发性成分,是中药材特殊气味的特色表现形式[53]。其化学成分组成复杂,主要包含萜烯类、烷烃类、酯类、醛类、醇类、酮类、酸类、醚类等,通常以药效分子群发挥作用,具有抗菌、抗炎、抗氧化、抗病毒、驱虫等生物活性[53-54]。太子参含有丰富的挥发油类成分,目前已从太子参挥发油中检测到165种成分(表1),包含36个芳香族类(1~36)、28个醇类(37~64)、28个酯类(65~92)、22个醛类(93~114)、17个酮类(115~131)、17个烷烃类(132~148)、11个酸类(149~159)、4个烯类(160~163)、2个酰胺类(164、165)。其中,2-呋喃甲醇(糠醇,44)、4-丁基-3-甲氧基-2,4-环己二烯-1-酮(127)、十六烷酸(棕榈酸,152)和9-十八碳烯酸(油酸,156)是太子参挥发油中相对含量较高的成分[25-29]。

表1 太子参挥发油类成分

续表1
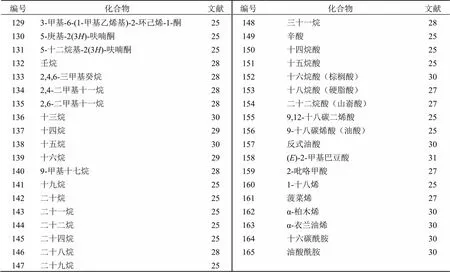
续表1
太子参药材散发的挥发油带有独特的“土腥味”,该气味易被误解为农药味或霉变气味。钱伟等[31]运用顶空进样气相色谱-质谱联用技术表明太子参特异气味主要来源于挥发性成分中的低、中沸程成分,如甲硫醇(46)、二甲基硫(47)、小分子呋喃类(糠醇、糠醛)等。黄特辉[29]采用电子鼻联合顶空固相微萃取连用气相色谱-质谱技术比较不同产地、不同产地加工和不同储藏期的太子参气味、挥发性成分种类和成分差异,从47批太子参样品中检测到44个共有峰,其中25个共有峰具有香气,初步推断1-辛烯-3-醇(42)、土臭素(43)和反-2-壬烯醛(104)为太子参特异气味的贡献成分。这些研究为科学看待太子参的特异气味提供依据,通过科普宣传可避免因特异气味引起患者在购买和饮用过程的困扰。
1.2 多糖
多糖又称多聚糖,通常由10个以上单糖通过糖苷键连接形成的聚合物,是药用植物重要的活性物质之一[55-57]。根据单糖组成情况,由同种单糖组成的多糖称为均多糖,而以不同单糖组成的多糖称为杂多糖。多糖是太子参中除提取物外药理作用研究最多,药效最为显著的一类成分[33-37]。已报道的太子参多糖中,单糖组成和相对分子质量均确定的多糖有10个(166~175),见表2。Hu等[33]利用85%乙醇对太子参粉进行浸提脱脂,采用水提醇沉结合Sevage法获取了太子参粗多糖,该粗多糖依次用40%、60%和90%乙醇沉淀后得到3种多糖PF40、PF60、PF90(166~168),这3种多糖均由不同比例的半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖组成,相对分子质量为3.0×103~2.1×105。Chen等[34]采用离子交换纤维素DEAE-52和丙烯葡聚糖凝胶S-300柱色谱对PF40进行分离纯化得到一种新颖的均多糖H-1-2(172),该多糖是一种葡聚糖,相对分子质量为1.4×104。杨斌等[58]采用上述相同的柱色谱从PF40中分离纯化到另一种葡聚糖HPh-1-1(173),相对分子质量为1.8×104。Chen等[35]从太子参中分离纯化到一种由鼠李糖、半乳糖醛酸、半乳糖、阿拉伯糖4种单糖组成的杂多糖0.5MSC-F(174),其相对分子质量为4.8×104,质量分数高于97.1%。从表2可知,构成太子参多糖的单糖主要为半乳糖醛酸、葡萄糖醛酸、葡萄糖、半乳糖、阿拉伯糖、甘露糖、鼠李糖和岩藻糖,且均一多糖主要是葡聚糖类。
1.3 环肽
植物环肽是指植物中由常见氨基酸和一些不常见氨基酸以肽键结合形成的一类环状化合物,石竹科植物普遍含有环肽[59-60]。环肽是太子参中常见的化学成分,其研究发现主要集中在20世纪90年代,截至目前从太子参中分离得到且有详细图谱数据的环肽有14种(176~189),见图1。Tan等[38]采用95%乙醇对江苏产太子参进行煮沸提取,并使用醋酸乙酯对太子参醇提物进行萃取,该萃取物经硅胶柱反复色谱得到太子参环肽A(heterophyllin A,HA,176)和HB(177)。这2个环肽分别由7或8个氨基酸残基组成,该研究揭开了太子参环肽研究的序幕;此外从太子参中分离得到一个环七肽HC(178)[39]。Yang等[40]从太子参中分离鉴定出一个新结构的环五肽HJ(179)。Morita等[41-44]采用甲醇对太子参进行提取,并使用正丁醇对太子参醇提物进行萃取,该萃取物经大孔吸附树脂HP-20、硅胶及反相高效液相柱色谱得到8个结构新颖的环肽类化合物(pseudostellarins A~H,PA~PH,180~187)。近年来,太子参须根作为太子参加工过程的废弃物,其开发利用得到研究人员的重视。Zhao等[45]对福建柘荣产的太子参须根的化学成分进行开展研究,分离得到一种环六肽PK(188),是太子参中首次报道的由6个氨基酸残基组成的新颖环肽,陈前锋等[46]进一步分离得到一种新结构的环七肽PL(189)。

表2 太子参多糖类成分

图1 太子参环肽类化合物的化学结构
1.4 生物碱
植物源生物碱具有结构多样和生物活性广泛的特点,在现代和传统药物中均具有独特优势[61]。目前已从太子参中分离鉴定出来24个生物碱(190~213),见图2和表3。石竹科植物中富含β-咔啉生物碱[62-64],而太子参中的β-咔啉生物碱只在最新研究中报道了4个(190~193)[45,48],结构差别主要是C-1或C-3位支链有差异,该类生物碱有待进一步挖掘。Yang等[40]从太子参中分离鉴定出3个酰胺类生物碱(197~199),为焦谷氨酸及其衍生物。此外,太子参还含有多种核苷类成分,马阳等[49]测定了不同采收期太子参中13种核苷类成分(200~212)的含量,以鸟苷、肌苷、胞苷、胸苷、尿苷(201~205)含量较高。

图2 太子参生物碱类化合物的化学结构
1.5 皂苷及其苷元
皂苷主要由苷元配基与糖构成。苷元配基的结构可分为萜类衍生物和甾体衍生物2类。组成皂苷的糖主要有葡萄糖、鼠李糖、半乳糖、木糖、阿拉伯糖、葡萄糖醛酸和半乳糖醛酸等。截至目前,从太子参中分离到4个皂苷元(214~217)和6个皂苷(218~223),见图3和表4。王喆星等[52]采用75%乙醇提取太子参,并用石油醚、氯仿、醋酸乙酯、正丁醇等溶剂依次萃取,各萃取相及水相经硅胶柱色谱得到太子参皂苷A(218)、尖叶丝石竹皂苷D(219)、β-谷甾醇-3--β--葡萄糖苷(220)、β-谷甾醇-3--β--葡萄糖苷-6′--棕榈酸酯(221)、Δ7-豆甾烯醇-3--β--葡萄吡喃糖苷(222)。秦民坚等[65]采用95%乙醇对太子参粗粉进行回流提取,并使用石油醚、醋酸乙酯依次萃取,水层经D101大孔树脂和硅胶柱色谱得到α-菠菜甾醇-3--β--吡喃葡萄糖苷(223)。上述6个太子参皂苷中,太子参皂苷A和尖叶丝石竹皂苷D属于五环三萜皂苷,其苷元均为丝石竹皂苷元(gypsogenin),其余4个为甾体皂苷类。

表3 太子参生物碱类成分

图3 太子参皂苷及皂苷元类化合物的化学结构

表4 太子参皂苷及皂苷元类成分
1.6 酚类
酚类物质是植物中普遍存在的芳香类次级代谢产物,具有抗炎、抗菌、抗氧化等活性[66]。从太子参中分离得到13个酚类成分(224~236),见图4和表5,包含3个苯甲酸类化合物(224、225、231)、5个肉桂酸类化合物(226~230)、4个黄酮类化合物(232~235)和1个二苯乙烯类化合物(236)。
1.7 其他类
除上述化合物外,太子参中还分离到6个其他类型化合物,如3-呋喃甲酸(237)[45]、3-呋喃甲醇-α--吡喃半乳糖苷(238)[50]、肌-肌醇-3-甲醚(239)[59]、乙基-α--吡喃半乳糖苷(240)[47]、活性肽RP-5(241)[67]和YG-9(242)[68],见图4。此外,太子参还含有氨基酸、脂肪酸、油脂、磷脂和微量元素等成分[18,23]。

图4 太子参酚类及其他类化合物的化学结构

表5 太子参酚酸类及其他类成分
2 药理作用
既往研究表明太子参单体成分具有降血糖、抗炎、抗癌、保护细胞、抑制酪氨酸酶、免疫调节等药理活性。
2.1 降血糖作用
高血糖是导致糖尿病并发症的主要原因,2型糖尿病(diabetes mellitus type 2,T2DM)常通过服用降糖药物和注射胰岛素来控制血糖水平,而太子参常作为治疗糖尿病的临床用药。Hu等[33]研究发现太子参精制多糖PF40、PF60和PF90(166~168)均能降低T2DM大鼠的血糖水平,其中PF40降糖效果最佳,PF40(3 g/kg)与阳性药物二甲双胍降糖效果相当。此外,PF40能够促进白细胞介素-10(interleukin-10,IL-10)表达,抑制肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)生成,减轻T2DM慢性低度炎症。Chen等[34]研究发现太子参均一葡聚糖H-1-2(172)能显著提高人肝癌HepG2细胞、小鼠脂肪前体3T3-L1细胞和大鼠骨骼肌成肌L6细胞对葡萄糖的摄取和利用,具有潜在的降糖应用价值。Chen等[35]分离鉴定的太子参杂多糖0.5MSC-F(174)能明显促进高糖培养的大鼠胰岛细胞分泌胰岛素,且呈剂量相关性。Fang等[69]研究发现H-1-2(172)可通过调节T2DM患者缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)和组蛋白去乙酰化酶沉默信息调节因子1(silent information regulator 1,SIRT1)表达,增强胰岛素分泌,改善血糖和血脂水平,同时提高葡萄糖和胰岛素耐受性。张伟云等[70]研究发现PE(184)可明显促进3T3-L1细胞分化,通过葡萄糖示踪剂吸收试验,进一步推测PE可能是增加成熟脂肪细胞的胰岛素敏感性,提高脂肪细胞对葡萄糖的吸收,发挥降血糖作用。
2.2 抗炎作用
Yang等[71]研究发现HB(177)在脂多糖诱导的小鼠单核巨噬细胞白血病RAW264.7细胞炎症模型中,通过调控磷脂酰肌醇3-激酶/蛋白激酶B(phosphatidylinositol-3-kinase/protein kinase B,PI3K/ Akt)信号通路,下调促炎因子IL-1β、IL-6表达,使得一氧化氮和活性氧产生减少,从而抑制脂多糖诱导产生的炎症反应和细胞凋亡。You等[37]分离到一种多糖PHP90(175),该多糖能够与脂多糖竞争性的结合RAW264.7细胞表面的Toll样受体4(Toll-like receptor 4,TLR4)。在葡聚糖硫酸钠诱导的小鼠急性结肠炎模型中,该多糖通过激活TLR4信号通路,下调IL-1β和TNF-α表达,同时能够改善肠道菌群来抑制炎症。综上,太子参环肽和太子参多糖能够通过激活不同的信号通路发挥抗炎作用。
2.3 抗癌作用
Tantai等[72]研究发现HB(177)通过介导PI3K/Akt/β-钙黏蛋白(β-catenin)信号通路,促进-钙黏蛋白的表达,而波形蛋白(vimentin)、转录调控因子(snail)、基质金属蛋白酶2、基质金属蛋白酶9等蛋白在人食管癌ECA-109细胞中的表达水平显著降低,有效抑制ECA-109细胞的黏附和侵袭,且呈剂量相关性。另有研究表明太子参多糖H-1-2(172)在体外能够抑制胰腺癌细胞的侵袭和迁移,而在小鼠体内能够抑制异种移植胰腺肿瘤的生长,并能显著延长处理组小鼠的总体存活时间[73]。在肿瘤细胞毒性方面,陈前锋等[46]测试了HB(177)、PB(181)、PC(182)和PL(189)这4种环肽对人乳腺癌MCF-7、人肺癌A549、人结肠癌HCT-116、人胃癌SGC-7901细胞的毒性,半数抑制浓度(half maximal inhibitory concentration,IC50)均大于100 μmol/L。另有研究表明,环肽PC(182)、PD(183)和PG(186)对小鼠黑色素瘤B16细胞的IC50分别为171、49、102 μmol/L[41-43]。
2.4 细胞保护作用
Shi等[74]研究发现HB(177)5~20 mg/kg对博来霉素诱导的肺纤维化表现出保护作用,显著减弱肺纤维化小鼠的肺泡塌陷。谢美林等[36]研究发现太子参多糖PHP(169)对RAW264.7细胞的保护作用,在安全浓度80~640 μg/mL时,该多糖能够促进RAW264.7细胞增殖,同时也能提高脂多糖诱导的RAW264.7细胞存活率,改善细胞形态;当该多糖浓度达到960 μg/mL后,对细胞表现出毒害作用。太子参碱A~C(190~192)是最新从太子参中分离到的β-carboline型生物碱,能够有效保护大鼠心肌H9c2细胞免受连二亚硫酸钠诱导的缺氧/复氧损伤[48]。Wang等[75]研究证实太子参皂苷和太子参多糖通过降低胞内丙二醛和活性氧水平,增加超氧化物歧化酶活性,减轻氯化钴所致H9c2细胞的缺氧损伤。
2.5 酪氨酸酶抑制作用
酪氨酸酶是生物体合成黑色素以及果蔬褐变的关键酶,广泛存在于动植物、微生物及人体中,而酪氨酸酶抑制剂应用涉及美容保健、色素型皮肤病治疗、病虫害防治以及食品保鲜等多个领域[76]。已有研究表明太子参提取物及其环肽类成分具有酪氨酸酶抑制活性。Morita等[41-44]对分离得到的8个环肽PA~PH(180~187)进行酪氨酸酶抑制活性测试,结果表明PA~PD(180~186)的IC50为50~187 μmol/L,PF(185)的抑制活性最强,IC50为50 μmol/L,而PH(187)的抑制活性较弱,在800 μmol/L浓度时的抑制率仅为15%。李军等[77]评价了太子参甲醇提取物、水提物及HB(177)的酪氨酸酶抑制活性,结果表明太子参甲醇提取物生药量在2.53~12.67 mg/mL时,对酪氨酸酶抑制率达42%;太子参水提液生药量在1.39 mg/mL时,抑制率达47%;HB质量浓度在4.98 μg/mL时抑制率达43%。
2.6 免疫调节作用
太子参提取物具有免疫调节作用[78],其蛋白水解物是增强免疫系统的潜在营养补充剂[79]。Yang等[67]从太子参蛋白水解物中分离到1个相对分子质量为522.29的特异性肽RP-5(241),在100 μg/mL培育48 h对脾淋巴细胞增殖指数为1.27。此外,该活性肽通过激活RAW264.7细胞TLR2/核因子-κB(nuclear factor-κB,NF-κB)信号通路,促进RAW264.7细胞分泌一氧化氮、活性氧和TNF-α,从而发挥免疫调节作用。此外,YG-9(242)在100 μg/mL培育72 h时对脾淋巴细胞增殖指数为1.40。该活性肽能够激活TLRs/NF-κB/TNF-α信号通路,促进RAW264.7细胞分泌一氧化氮、活性氧和TNF-α,而对IL-10无明显影响[68]。值得注意的是,活性肽RP-5(241)和YG-9(242)是通过模拟胃肠消化获得的,因此在胃肠道中具有优异的稳定性,可作为免疫促进功能食品成分。
3 太子参的应用
3.1 临床应用
太子参味甘、微苦,药性平和,归脾、肺经,具有益气但不升提、生津而不助湿、扶正却不恋邪、补虚又不峻猛的特点[80],临床上多以含太子参复方制剂和复方中成药给药,用于治疗小儿消化不良[6-8,10]、小儿食欲不振[9]、小儿腹泻[81]、支气管哮喘[82]、T2DM乏力干渴[83]等症。
3.1.1 太子参复方制剂 太子参常配山药、扁豆、谷芽,用于脾胃气虚引起的食欲不振、倦意乏力;配沙参、麦冬,用于肺虚阴虚、气虚所致燥咳;配石斛、天花粉,用于津液不足、咽干口渴等症[84];配丹参、五味子、麦冬,用于治疗T2DM乏力、口干、心悸、气短等症[85]。汤剂中太子参临床用量为6~45 g,常用剂量为10~30 g,丸剂用量为0.9 g[86]。
3.1.2 太子参复方中成药 目前市售太子参复方中成药以消导健脾类为主,如健胃消食片、复方太子参颗粒、儿宝颗粒等,还有止咳平喘的复方中成药,如复方太子参止咳益气散。健胃消食片、复方太子参颗粒、儿宝颗粒对功能性消化不良的临床疗效确切,且无不良反应,安全性高[6-8,10]。复方太子参止咳益气散在治疗支气管哮喘方面疗效明显,且对少儿的作用强于成人[82]。
3.2 食疗应用
太子参作为药膳食疗用品常用于炖鸡、煲鸭、熬粥、浸酒和制茶饮等,能健脾胃、益气血,堪称“老少皆宜”的清补佳品[5,14-17]。太子参、黄芪、黄精、党参、甘草、红枣等与鸡共炖,能够补中益气养血,适合体弱、食欲不振之人食用;太子参、枸杞子、山药与鹌鹑煲汤,能补五脏,益气力,有助于小孩发育;太子参、山药与猪蹄共炖,可益气养血通乳,适用于产后缺乳;太子参、沙参与老鸭共炖,太子参健脾益气、沙参养阴润肺、老鸭滋阴化痰,可改善肺阴不足之咳喘、老年人糖尿病、胃炎、肠燥引起的便秘等病;太子参、白术、茯苓、山药、陈皮、红枣各30 g,捣成粗粉,用绢布包扎与2000 mL黄酒共浸10 d,制成参术酒,饮服可改善食欲不振、脘腹易胀、形寒腹冷等症[5]。太子参、乌梅各15 g,加适量白糖,水煎代茶饮,可生津解渴,是解暑佳饮[81]。
3.3 保健食品中的应用
太子参在2002年已被卫生部列入“可用于保健食品的物品”名单[87],我国以太子参为主要原料的国产保健食品有41种,包含[卫食健字] 12种和[国食健字] 29种,涉及增强免疫力、改善胃肠道、促进消化、缓解体力疲劳、辅助降血糖、减肥等主要保健功能,如太子参黄精酒、太乙参茶、欧力康牌玄驹口服液、黄芪太子参口服液[16]。此外,有研究将太子参干品制成真空膨化太子参,口感脆香,辅以其他佐料,还可制成枣汁即食太子参、什锦太子参酥脆、姜汁太子参酥脆等营养保健食品[88]。
3.4 化妆品中的应用
太子参富含葡聚糖和果胶类多糖[34-35],是天然、温和、无刺激性的聚合物,且水溶性好,可增加美容产品乳化体系的稳定性,保持配方中的水分,并可减少皮肤水分的透皮损失,达到良好的润肤保湿效果。此外,太子参富含氨基酸、微量元素等营养功能成分,其提取液可作为护肤品和护发品的理想的营养添加剂[89]。目前市售添加太子参提取物的已备案的化妆品有多款,如宫品太子参定型啫喱液、葆倍乖乖太子参婴儿营养洗发露、Do-win太子参蜗牛紧致面膜、拉丽莎太子参蚕丝面膜、拉丽莎太子参胶原蛋白洁面乳和精华霜等[16]。
3.5 兽药制剂或功能性饲料添加剂中的应用
近年来,在健康养殖行业的“无抗”“减抗”趋势下,太子参提取物应用于兽药制剂或功能性饲料添加剂方面研究渐多,在开发新型动物保健类药品或功能性饲料添加剂具有较大潜力[90-91]。在兽药制剂研发方面,福建贝迪药业有限公司立足福建柘荣太子参的产业资源优势,相继研发出太子参艾曲久、太子参颗粒、太子参口服液、太子参须散、蓝贝克等兽药制剂,具有抗炎、抗氧化、增强机体免疫、提高抵抗力等效果。吴建华等[92]考察了太子参须散对环磷酰胺所致的免疫抑制仔猪免疫功能的影响,研究表明太子参须散能够提高仔猪血液中白细胞数,且能提高抗体水平,延长抗体持续时间,增强仔猪的免疫效果。在功能性饲料添加剂研究方面,应用太子参多糖伴料投喂福瑞鲤,对福瑞鲤的非特异性免疫功能有增强作用,能提高其抗病力,在基础饲料中添加0.3%的太子参多糖为最佳[93]。应用添加0.5%、1.0%、1.5%和2.0%太子参提取液(质量浓度为40 g/L)的饲料饲喂大黄鱼120 d,结果表明,太子参提取液能提高大黄鱼的存活率、食物的消化吸收率,添加量在0.5%~1.0%为宜,且投喂时间越长,效果越佳[94];太子参提取液作为饲料添加剂还可以改善大黄鱼的肌肉品质,添加量0.5%为宜,该实验组中的粗蛋白、粗脂肪、甘氨酸、赖氨酸以及氨基酸总量显著高于对照组,且能提高大黄鱼肌肉多不饱和脂肪酸-3族含量和降低-6族含量[95]。
4 太子参单体成分、提取物及复方的作用分析
太子参是一味补益中药,药效缓和,以清补见长,能益气健脾、生津润肺,临床上常作为君药,配伍其他中药来治疗小儿消化不良、小儿食欲不振、小儿腹泻、哮喘、咳嗽、T2DM等症。如图5所示,太子参提取物及其一些单体成分均具有免疫调节、降血糖、抗炎、细胞保护、抑制酪氨酸酶等药理作用,其中太子参提取物中的总多糖和总皂苷活性较突出,单体成分主要是多糖类、环肽类、生物碱类和线型小肽类在发挥作用。太子参多糖无论是精制多糖,还是总多糖都表现出广泛的药理活性,可推测其为太子参的主要药效物质,在复方太子参中发挥降血糖、免疫调节等作用。环肽是太子参中常见的一类活性成分,HB(177)曾作为《中国药典》2010年版中太子参的指标性成分,具有抗炎[71]、抗癌[72]、细胞保护[74]、抑制酪氨酸酶[77]等活性。值得注意的是,鲜有太子参单体皂苷类成分活性报道,根据现有研究,太子参皂苷尚不宜作为主要药效物质。此外,太子参单体成分和提取物的细胞毒性小,既往研究表明其提取物或复方制剂对动物或人未见有不良反应,可见太子参给药的安全性有保障[6,46,86,90]。

图5 太子参单体成分、提取物及复方的作用
5 结语与展望
5.1 太子参单体成分需进一步挖掘利用
本文对太子参的化学成分和单体成分的药理作用进行整理,从太子参中共分离报道242个化合物,包括165个挥发油类、10个多糖类、14个环肽类、24个生物碱类、13个酚类、10个皂苷及其苷元类、及6个其他类型化学成分,具有降血糖、抗炎、抗癌、保护细胞、抑制酪氨酸酶、免疫调节等活性。太子参挥发油化学成分组成复杂,不同提取方法获取的挥发油成分差异较大,其中1-辛烯-3-醇(42)、土臭素(43)和反-2-壬烯醛(104)为太子参特异气味的贡献成分[29]。太子参多糖是太子参发挥功效及保健养身功能的重要的物质基础成分,具有降血糖、抗炎、细胞保护、免疫调节等多种生物活性[33-37,69]。近年来基于太子参多糖为主要成分的太子参提取物应用于兽药制剂或功能性饲料添加剂方面研究渐多,在新型动物保健类药品或功能性饲料添加剂方面具有开发应用前景[91,93-95]。太子参环肽类成分细胞毒性低[46],普遍具有酪氨酸酶抑制活性[41-43,77],可将其开发应用于化妆品的美白护肤领域,如拉丽莎太子参蚕丝面膜中添加了太子参提取物。鉴于线型活性肽RP-5(241)[67]和YG-9(242)[68]是通过模拟胃肠消化获得,且具有免疫调节活性,太子参环肽是否能直接发挥免疫调节作用或经消化系统降解为线型肽间接发挥免疫调节作用值得进一步研究。最新研究表明,太子参含有β-carboline型生物碱太子参碱A~C(190~192)[48],该类生物碱C-3位上的羧基能够与谷氨酸分子的氨基结合,而谷氨酸2侧的羧基具有与其他片段分子缩合的潜力,因此该类生物碱的结构多样性和生物活性可进一步探究。太子参功能成分及其生物活性研究虽已取得长足进展,还需加快推进太子参功效成分挖掘,深入探究药理作用机制,对太子参产业的健康发展具有重要意义。
5.2 太子参的应用前景展望
随着现代人们生活节奏加快,饮食不规律、食欲不佳现象频发,世界各地区消化不良的平均发病率达25%,此外还有高血糖、高血脂、免疫力低下、易疲劳、哮喘咳嗽,病后虚弱等群体,太子参复方制剂、中成药、保健食品、民间药膳食疗的市场需求量增加,太子参年需求量为4000~4500 t[16]。中药配方颗粒是由单味中药饮片经水提、浓缩、干燥、制粒而成,经中医临床配方后,供患者即冲即服的颗粒,具有不需煎煮、有效利用高的优点[96-100]。截至2022年10月,已颁布中药配方颗粒国家标准有200个,30个省级行政区先后发布实施合计6219个中药配方颗粒省级标准[101]。共有15个省份相继制订了太子参配方颗粒省级标准,其中14个省份标准内容相对统一,含量测定项下规定,每克配方颗粒含HB(177)应为0.28~0.74 mg,部分省份规定为0.30~0.80 mg,每克配方颗粒相当于饮片3.1 g。另有上海市中药配方颗粒质量标准(第一批),其含量测定项下规定,每克配方颗粒含二氢阿魏酸(228)应为0.04~0.40 mg,每克配方颗粒相当于饮片3 g。鉴于太子参配方颗粒使用方便、有效利用率高,且质量可控,其市场需求持续提升,积极开展多方式的临床应用研究,逐步构建科学有效的临床应用数据库[101],有利于太子参配方颗粒推广应用,提升太子参的市场需求。此外,太子参在加工过程会产生15%左右的尾根、须根等废弃物,这些废弃物拥有与太子参相近的功能成分,充分利用该资源,将其提取物应用于润肤、护发类化妆品,新型兽药制剂或功能性饲料添加剂开发等,能进一步拓宽太子参产业链。
利益冲突 所有作者均声明不存在利益冲突
[1] 江维克, 周涛. 太子参产业发展现状及其建议 [J]. 中国中药杂志, 2016, 41(13): 2377-2380.
[2] 中国药典 [S]. 一部. 2020: 69.
[3] 史鸣飞, 王传池, 胡镜清. 新型冠状病毒肺炎中药预防方用药规律分析 [J]. 世界科学技术—中医药现代化, 2020, 22(2): 306-309.
[4] 李芹, 陈志斌. 福建省中医药防治新型冠状病毒肺炎专家共识(试行第五版) [J]. 福建中医药, 2022, 53(3): 1-3.
[5] 赵德贵. 老少皆宜太子参 [J]. 药膳食疗, 2005(8): 44-46.
[6] 周静, 尧梅香. 健胃消食片治疗功能性消化不良的临床研究 [J]. 实用中西医结合临床, 2016, 16(8): 39-40.
[7] 孙红霞. 健胃消食片用于小儿消化不良治疗中的临床效果 [J]. 中西医结合心血管病电子杂志, 2018, 6(14): 171.
[8] 马生存, 刘忠琴. 健胃消食片联合西药治疗功能性消化不良的疗效分析 [J]. 世界最新医学信息文摘, 2018, 18(3): 132.
[9] 樊华. 复方太子参颗粒治疗小儿厌食症47例临床观察 [J]. 内蒙古中医药, 2010, 29(13): 65.
[10] 赵聪伶. 探讨儿宝颗粒治疗小儿消化不良75例的临床效果 [J]. 中外医疗, 2013, 32(15): 117.
[11] 方绍艳. 儿宝颗粒治疗肠套叠复位后腹泻疗效观察 [J]. 中国民康医学, 2014, 26(15): 94-95.
[12] 曹刚良. 儿宝颗粒联合硫酸锌口服液治疗100例小儿消化不良的疗效分析 [J]. 临床医学研究与实践, 2017, 2(25): 101-102.
[13] 王丹, 李桂凌, 郑诗华, 等. 儿宝颗粒对脾虚泻小儿免疫功能影响的观察 [J]. 中国实验方剂学杂志, 2019, 25(10): 81-86.
[14] 陈家从. 太子参食用开发的初步论证研究 [J]. 中国医药指南, 2011, 9(9): 7-8.
[15] 张婕, 于华生, 游勇基. 柘荣太子参的食用和药用价值 [J]. 海峡药学, 2011, 23(5): 48-50.
[16] 刘斌, 陈军义, 孙兴. 贵州省太子参产业发展前景展望 [J]. 农村经济与科技, 2017, 28(15): 160-162.
[17] 王延群. 清补扶正,膳用太子参 [J]. 现代养生, 2020, 20(7): 11-12.
[18] 余永邦, 秦民坚, 余国奠. 太子参化学成分、药理作用及质量评价研究进展 [J]. 中国野生植物资源, 2003, 22(4): 1-3.
[19] 吴朝峰, 林彦铨. 药用植物太子参的研究进展 [J]. 福建农林大学学报: 自然科学版, 2004, 33(4): 426-430.
[20] 林泗定, 戴启文, 张鸿程, 等. 太子参化学成分和生物活性研究进展 [J]. 中国民族民间医药, 2010, 19(19): 33-34.
[21] 宋叶, 林东, 梅全喜, 等. 太子参化学成分及药理作用研究进展 [J]. 中国药师, 2019, 22(8): 1506-1510.
[22] 孔钰婷, 何丹, 安风平, 等. 太子参活性成分及利用研究进展 [J]. 粮食科技与经济, 2019, 44(10): 110-113.
[23] 杨倩, 蔡茜茜, 林佳铭, 等. 太子参的生物活性及其在食品工业中的应用 [J]. 食品工业科技, 2021, 42(11): 335-341.
[24] 滕力庆, 周涛, 王晓, 等. 太子参化学成分及其药理作用研究进展 [J]. 食品与药品, 2021, 23(1): 73-79.
[25] 刘训红, 王媚, 蔡宝昌, 等. 不同产地太子参挥发性成分的气相色谱-质谱联用分析 [J]. 时珍国医国药, 2007, 18(1): 43-45.
[26] 沈祥春, 陶玲. 贵州产太子参挥发油化学成分的气相色谱-质谱分析 [J]. 中成药, 2007, 29(11): 1659-1661.
[27] 张卓旻, 贺静静, 张兰. 太子参挥发性成分的GC-MS分析 [J]. 福州大学学报: 自然科学版, 2008, 36(3): 460-464.
[28] 侯娅, 马阳, 邹立思, 等. 基于气相色谱-质谱的闽产太子参挥发性成分动态变化研究 [J]. 天然产物研究与开发, 2016, 28(3): 371-376.
[29] 黄特辉. 基于电子鼻技术的太子参气味识别及其物质基础研究 [D]. 北京: 北京中医药大学, 2020.
[30] Shen Y, Han C, Liu J D,. Analysis of volatile components of(Miq.) Pax by microwave-assisted solvent extraction and GC-MS [J]., 2008, 68(7): 679-682.
[31] 钱伟, 韩乐, 刘训红, 等. 太子参药材特异气味成分的HSGC-MS分析研究 [J]. 现代中药研究与实践, 2010, 24(5): 25-27.
[32] 刘训红, 阚毓铭, 王玉玺. 太子参多糖的研究 [J]. 中草药, 1993, 24(3): 119-121.
[33] Hu J, Pang W S, Chen J L,. Hypoglycemic effect of polysaccharides with different molecular weight of[J]., 2013, 13: 267.
[34] Chen J L, Pang W S, Shi W T,. Structural elucidation of a novel polysaccharide fromand stimulating glucose uptake in cells and distributing in rats by oral [J]., 2016, 21(9): 1233.
[35] Chen J L, Pang W S, Kan Y J,. Structure of a pectic polysaccharide fromand stimulating insulin secretion of INS-1 cell and distributing in rats by oral [J]., 2018, 106: 456-463.
[36] 谢美林, 徐海清, 李景明, 等. 太子参多糖的纯化、组成及对LPS损伤Raw264.7巨噬细胞的保护作用 [J]. 食品工业科技, 2022, 43(14): 392-400.
[37] You S Y, Liu X W, Xu G T,. Identification of bioactive polysaccharide fromwith its anti-inflammatory effects [J]., 2021, 78: 104353.
[38] Tan N H, Zhou J, Chen C X,. Cyclopeptides from the roots of[J]., 1993, 32(5): 1327-1330.
[39] 谭宁华, 周俊. 太子参中新环肽: 太子参环肽C [J]. 云南植物研究, 1995, 17(1): 60.
[40] Yang Y B, Tan N H, Zhang F,. Cyclopeptides and amides from(Caryophyllaceae) [J]., 2003, 86(10): 3376-3379.
[41] Morita H, Kayashita T, Kobata H,. Pseudostellarins A—C, new tyrosinase inhibitory cyclic peptides from[J]., 1994, 50(23): 6797-6804.
[42] Morita H, Kayashita T, Kobata H,. Pseudostellarins D—F, new tyrosinase inhibitory cyclic peptides from[J]., 1994, 50(33): 9975-9982.
[43] Morita H, Kayashita T, Kobata H. Pseudostellarin G, a new tyrosinase inhibitory cyclic octapeptide from[J]., 1994, 35(21): 3563-3564.
[44] Morita H, Kayashita T, Takeya K,. Cyclic peptides from higher plants, Part 15. Pseudostellarin H, a new cyclic octapeptide from[J]., 1995, 58(6): 943-947.
[45] Zhao X F, Zhang Q, Zhao H T,. A new cyclic peptide from the fibrous root of[J]., 2021, 36(13): 3368-3374.
[46] 陈前锋, 赵筱斐, 赵邯涛, 等. 太子参须根中环肽类化学成分研究 [J]. 中国中药杂志, 2022, 47(1): 122-126.
[47] 李滢, 杨秀伟. 太子参 (柘参1号) 的化学成分 [J]. 中国中药杂志, 2008, 33(20): 2353-2355.
[48] Xu G B, Zhu Q F, Wang Z,. Pseudosterins A—C, three 1-ethyl-3-formyl-β-carbolines fromand their cardioprotective effects [J]., 2021, 26(16): 5045.
[49] 马阳, 侯娅, 邹立思, 等. 不同采收期太子参中13种核苷类成分的含量测定研究 [J]. 中国药学杂志, 2015, 50(1): 75-79.
[50] 张春丽, 徐国波, 刘俊, 等. 太子参化学成分研究 [J]. 天然产物研究与开发, 2017, 29(7): 1132-1135.
[51] 张健, 李友宾, 王大为, 等. 太子参化学成分研究 [J]. 中国中药杂志, 2007, 32(11): 1051-1053.
[52] 王喆星, 徐绥绪, 张国刚, 等. 太子参化学成分的研究(IV)[J]. 中国药物化学杂志, 1992, 2(3): 65-67.
[53] 王雅琪, 杨园珍, 伍振峰, 等. 中药挥发油传统功效与现代研究进展 [J]. 中草药, 2018, 49(2): 455-461.
[54] 冯是燕, 杜江超, 杨嘉莹, 等. 5种唇形科植物挥发油的化学成分及抗流感病毒活性研究 [J]. 中国药学杂志, 2022, 57(11): 896-909.
[55] 谢明勇, 殷军艺, 聂少平. 天然产物来源多糖结构解析研究进展 [J]. 中国食品学报, 2017, 17(3): 1-19.
[56] 赵宏权, 王知斌, 孙延平, 等. 贝母属多糖分离、鉴定、生物活性研究进展 [J]. 中成药, 2022, 44(2): 504-510.
[57] 谢溢坤, 张静, 余茜, 等. 灵芝多糖类成分及其生物活性研究进展 [J]. 中草药, 2021, 52(17): 5414-5429.
[58] 杨斌, 庞文生, 胡娟. 太子参均一多糖的分离与表征 [J]. 中国民族民间医药, 2017, 26(4): 11-12.
[59] Zhou J, Tan N H. Application of a new TLC chemical method for detection of cyclopeptides in plants [J]., 2000, 45(20): 1825-1831.
[60] Tan N H, Zhou J. Plant cyclopeptides [J]., 2006, 106(3): 840-895.
[61] Lichman B R. The scaffold-forming steps of plant alkaloid biosynthesis [J]., 2021, 38(1): 103-129.
[62] Chen Y F, Kuo P C, Chan H H,. β-carboline alkaloids fromvar.and their anti-inflammatory activity [J]., 2010, 73(12): 1993-1998.
[63] Cao L H, Zhang W, Luo J G,. Five new β-carboline-type alkaloids fromvar.[J]., 2012, 95(6): 1018-1025.
[64] Luo J G, Cao L H, Kong L Y. Two new β-carboline-type alkaloids fromvar.[J]., 2012, 23(12): 1385-1388.
[65] 秦民坚, 余永邦, 黄文哲. 江苏栽培太子参的化学成分研究 [J]. 现代中药研究与实践, 2005, 19(1): 38-40.
[66] Rahman M M, Rahaman M S, Islam M R,. Role of phenolic compounds in human disease: Current knowledge and future prospects [J]., 2021, 27(1): 233.
[67] Yang Q, Cai X X, Huang M C,. A specific peptide with immunomodulatory activity fromand the action mechanism [J]., 2020, 68: 103887.
[68] Yang Q, Cai X X, Huang M C,. Isolation, identification, and immunomodulatory effect of a peptide fromprotein hydrolysate [J]., 2020, 68(44): 12259-12270.
[69] Fang Z H, Duan X C, Zhao J D,. Novel polysaccharide H-1-2 fromalleviates type 2 diabetes mellitus [J]., 2018, 49(3): 996-1006.
[70] 张伟云, 姚芳华, 王青, 等. 太子参环肽类化合物Pseudostellarin E对3T3-L1前脂肪细胞分化和葡萄糖吸收的作用 [J]. 时珍国医国药, 2018, 29(5): 1028-1030.
[71] Yang C J, You L T, Yin X B,. Heterophyllin B ameliorates lipopolysaccharide-induced inflammation and oxidative stress in RAW264.7 macrophages by suppressing the PI3K/Akt pathways [J]., 2018, 23(4): 717.
[72] Tantai J C, Zhang Y, Zhao H. Heterophyllin B inhibits the adhesion and invasion of ECA-109 human esophageal carcinoma cells by targeting PI3K/Akt/β-catenin signaling [J]., 2016, 13(2): 1097-1104.
[73] Sun H W, Shi K Q, Qi K,.extract polysaccharide H-1-2 suppresses pancreatic cancer by inhibiting hypoxia-induced AG2 [J]., 2020, 17: 61-69.
[74] Shi W, Hao J T, Wu Y L,. Protective effects of heterophyllin B against bleomycin-induced pulmonary fibrosis in mice via AMPK activation [J]., 2022, 921: 174825.
[75] Wang Z, Liao S G, He Y,. Protective effects of fractions fromagainst cobalt chloride-induced hypoxic injury in H9c2 cell [J]., 2013, 147(2): 540-545.
[76] 胡泳华, 贾玉龙, 陈清西. 酪氨酸酶抑制剂的应用研究进展 [J]. 厦门大学学报: 自然科学版, 2016, 55(5): 760-768.
[77] 李军, 周涛, 郑伟, 等. 太子参不同提取物及环肽HB对酪氨酸酶抑制活性的分析 [J]. 时珍国医国药, 2019, 30(5): 1100-1102.
[78] Choi Y Y, Kim M H, Ahn K S,. Immunomodulatory effects of(Miquel) Pax on regulation of Th1/Th2 levels in mice with atopic dermatitis [J]., 2017, 15(2): 649-656.
[79] Yang Q, Cai X X, Huang M C,. Immunomodulatory effects ofpeptide on spleen lymphocytes via a Ca2+/CaN/NFATc1/IFN-γ pathway [J]., 2019, 10(6): 3466-3476.
[80] 黄伏顺. 太子参的功效特点 [J]. 江苏中医, 1993, 25(4): 29-30.
[81] 王建雄. 太子参苓汤治疗小儿腹泻78例 [J]. 湘南学院学报: 自然科学版, 2004, 6(4): 31.
[82] 周志荣. 复方太子参止咳益气散治疗支气管哮喘2180例疗效观察 [J]. 中国民族医药杂志, 2005, 11(5): 12.
[83] 孔宪兰, 王式云. 太子参降糖方治疗II型糖尿病33例 [J]. 光明中医, 2000, 15(4): 27-28.
[84] 杨徐杭. 太子参的功效特点 [J]. 陕西中医函授, 1994, 14(5): 16.
[85] 王靓. 基于结构化中医住院病历的围绝经期2型糖尿病中医诊疗特点探讨 [D]. 北京: 中国中医科学院, 2018.
[86] 朱思宇, 于同月, 朴春丽. 太子参的临床应用及其用量探究 [J]. 吉林中医药, 2021, 41(9): 1230-1233.
[87] 陈家从. 太子参食用开发研究与展望 [J]. 中国食物与营养, 2011, 17(3): 72-74.
[88] 王维亮. 真空膨化太子参系列产品制法 [J]. 适用技术市场, 1996, 9(8): 21-22.
[89] 许榕生. 太子参提取液在化妆品中的应用 [J]. 中国化妆品, 1995(5): 28.
[90] 张炎达, 潘慧青, 马玉芳, 等. 太子参提取物对提高动物免疫力的系统评价与Meta分析 [J]. 中国兽医杂志, 2020, 56(2): 102-108.
[91] 张炎达, 潘慧青, 赵军, 等. 太子参的生物学功能及其在畜牧生产中的应用 [J]. 养殖与饲料, 2018(12): 42-47.
[92] 吴建华, 杨荣平, 张炎达, 等. 太子参须对仔猪免疫系统调理作用的研究 [J]. 福建畜牧兽医, 2018, 40(5): 1-3.
[93] 吴斌. 太子参多糖对福瑞鲤部分非特异性免疫功能和抗病力的影响 [J]. 福建农业学报, 2017, 32(5): 481-485.
[94] 阮少江, 黄伟卿, 倪建成, 等. 饲料中添加太子参提取液对大黄鱼成活和生长的影响 [J]. 水产学杂志, 2020, 33(2): 40-44.
[95] 黄伟卿, 阮少江, 周逢芳, 等. 饲料中添加太子参提取物对大黄鱼肌肉营养的影响 [J]. 饲料研究, 2020, 43(9): 50-55.
[96] 何军, 朱旭江, 杨平荣, 等. 中药配方颗粒的现状与发展新思路 [J]. 中草药, 2018, 49(20): 4717-4725.
[97] 于姗姗, 刘洪超, 郭东晓, 等. 从质量标准复核和审评视角浅析中药配方颗粒标准制定工作(I)[J]. 中草药, 2022, 53(14): 4243-4248.
[98] 刘洪超, 于姗姗, 齐红, 等. 从质量标准复核和审评视角浅析中药配方颗粒标准制定工作(II)[J]. 中草药, 2022, 53(14): 4249-4255.
[99] 于姗姗, 郭东晓, 张秋红, 等. 从质量标准复核和审评视角浅析中药配方颗粒标准制定工作(III)[J]. 中草药, 2022, 53(14): 4256-4264.
[100] 张伟, 孙叶芬, 金传山, 等. 中药配方颗粒研究现状与展望 [J]. 中草药, 2022, 53(22): 7221-7233.
[101] 王赵, 金红宇, 马双成. 从市场抽验角度探讨中药配方颗粒质量标准相关问题 [J].中草药, 2023, 54(3): 677-687.
Research progress on chemical constituents, pharmacological effects and application of
NI Jian-cheng1, FAN Yong-fei1, 2, YE Zu-yun1
1. Engineering Technology Research Center of Characteristic Medicinal Plants of Fujian, Ningde Normal University, Ningde 352100, China 2. College of Food Science, Fujian Agriculture and Forestry University, Fuzhou 350002, China
Taizishen () is one of traditional Chinese tonic medicinal herbs with medicinal and therapeutic effects. The major components ofinclude volatile oils, polysaccharides, cyclopeptides, alkaloids, saponins, and phenolic compounds, etc., and these chemical compounds are related to diverse pharmacological effects such as hpyerglycemic, anti-inflammatory, anti-cancer, protecting cells, tyrosinase inhibition, and immunomodulatory effects. Chemical constituents and pharmacological effects of, along with application ofin clinic, dietotherapy, health food, cosmetics, veterinary drug preparations and functional feed additives were summarized in this paper, in order to provide a basis for further development and utilization of.
; polysaccharides; cyclopeptides; alkaloids; hyperglycemic activity; tyrosinase inhibition; immunomodulation; heterophyllin B; dihydroferulic acid
R284;R285
A
0253 - 2670(2023)06 - 1963 - 15
10.7501/j.issn.0253-2670.2023.06.029
2022-08-31
国家重点研发计划中药现代化专项(2019YFC1710500);中央引导地方科技发展专项资金项目(2021L3030);福建省自然科学基金项目(2020J05226);宁德市科技计划项目(20190012);宁德师范学院科研项目(2018Y14,2022ZX01)
倪建成(1987—),讲师,硕士生导师,主要从事天然产物研究。E-mail: njc2130215001@163.com
叶祖云(1968—),教授,硕士生导师,主要从事药用植物研究。E-mail: zyye0593@163.com
[责任编辑 赵慧亮]

