黄连须多糖降血糖活性及结构表征
田谷正男,周鑫超,颉若童,王 誉,毛美林,邓子言,蔡长君,涂 康,朱希强,姜 宁, 2,刘晓鹏, 2*
黄连须多糖降血糖活性及结构表征
田谷正男1,周鑫超1,颉若童1,王 誉1,毛美林1,邓子言1,蔡长君1,涂 康1,朱希强1,姜 宁1, 2,刘晓鹏1, 2*
1. 湖北民族大学生物与食品工程学院,湖北 恩施 445000 2. 生物资源保护与利用湖北省重点实验室,湖北 恩施 445000
探究黄连副产品黄连须多糖(fibrous polysaccharides,CRFP)的降血糖活性和物质基础。研究CRFP对糖尿病模型小鼠的作用,并对其进行分离纯化,检测纯化产物的纯度和相对分子质量,分析其结构和单糖组成。给药8周后,CRFP能显著降低糖尿病模型小鼠的血糖(<0.01),加速小鼠的血糖和血脂代谢,提高空腹胰岛素水平(<0.01),改善血脂紊乱(<0.05、0.01),提高肝脏己糖激酶(hexokinase,HK)和丙酮酸激酶(pyruvate kinase,PK)活性(<0.01),改善氧化应激(<0.05、0.01)。CRFP经纯化后得到成分均一的多糖CRFP-1和CRFP-2,相对分子质量分别为24 307±311和18 405±168,CRFP-1为α-型多糖,由8种单糖组成;CRFP-2为β-型多糖,由10种单糖组成。CRFP具有良好的降血糖活性,为黄连这一传统中药的深度开发和提高利用价值奠定了基础。
黄连须;多糖;糖尿病;分离纯化;结构解析
糖尿病作为代谢紊乱的慢性疾病,主要由体内胰岛素分泌障碍或胰岛素耐受引起,糖尿病会引起体内脏器受损,引发一系列并发症,甚至导致死亡[1-2]。2021年全世界20~79岁糖尿病患者约占10.5%(5.37亿),预计2045年将达到12.2%(7.83亿)[3],我国是成人糖尿病患者最多的国家,2021年达1.4亿[4],其中90%以上为2型糖尿病(type 2 diabetes mellitus,T2DM)。目前,已有多种降糖药物被用于临床治疗T2DM,如二甲双胍、磺脲类、格列奈类、α-糖苷酶抑制剂、噻唑烷二酮类、二肽基肽酶IV(dipeptidyl peptidaseIV,DPP-4)、钠-葡萄糖共转运蛋白2(sodium-glucose cotransporter 2,SGLT2)、胰高糖素样肽-1受体激动剂、胰岛素,但这些降糖药物会引起胃肠道反应、低血糖、骨质疏松、心力衰竭、泌尿生殖系统感染等不良反应[5]。研究表明多种植物多糖具有较强的降血糖活性,且来源广泛、安全性好,是筛选新型降血糖药物的宝库[6-7]。
黄连为毛茛科植物黄连Franch.的干燥根茎[8],多项研究表明,黄连多糖具有降血糖、抗氧化、调血脂等活性[9-11]。但药用黄连生长周期为3~4年,而收获时大量的黄连须被废弃,课题组前期研究表明,黄连须富含多糖,且具有较强的体外抗氧化活性[12]。本研究以黄连须多糖(fibrous polysaccharides,CRFP)为对象,研究CRFP对糖尿病模型小鼠的作用,明确其降血糖活性,从中分离纯化出2种成分均一的多糖,并解析其结构,为提高黄连的利用率,将黄连须变废为宝提供了实验依据。
1 材料与方法
1.1 动物
SPF级雄性ICR小鼠,体质量18~22 g,6周龄,购自辽宁长生生物技术股份有限公司,实验动物许可证号SCXK(辽)2020-0001。动物于温度(24±2)℃、12 h光昼交替的环境中适应性饲养1周,自由进食饮水。动物实验经湖北民族大学实验动物伦理审查委员会批准,批准号为(2021)131。
1.2 药品与试剂
CRFP为本实验室提取并制备[12];右旋糖酐分子量标准品(批号10237229)购自中国食品药品检定研究院;标准品鼠李糖(批号O12A10K95105,质量分数>98%)、阿拉伯糖(批号K28J12B135956,质量分数>98%)、甘露糖(批号TS08J12G137083,质量分数>98%)、岩藻糖(批号X16N8Y48166,质量分数>98%)、半乳糖(批号MFCD00151230,质量分数>99%)、半乳糖醛酸(批号3962101,质量分数>97%)、葡萄糖醛酸(批号R09J11H115178,质量分数>98%)、核糖(批号B21897,质量分数>98%)购自上海源叶生物科技有限公司;标准品木糖(批号D17N9S74410,质量分数>99%)购自TMstandard;1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone,PMP,批号C11370802,质量分数>99%)购自上海阿拉丁生化科技股份有限公司;三氟乙酸(批号H2123035)、乙腈(批号0114220806)、盐酸二甲双胍(批号D16GS171362)、氯化钠(批号20190919)、无水乙醇(批号20211014)、硫酸(批号20210517)、蒽酮(批号20210220)、氯仿(批号20210514)、磷酸二氢钾(批号20180223)购自国药集团化学试剂有限公司;链脲佐菌素(streptozotocin,STZ,批号20210316)购自北京索莱宝科技有限公司;柠檬酸钠(批号20201006)购自天津博迪化工股份有限公司;甲醇(批号20180605)购自武汉市中天化工有限责任公司;盐酸(批号2022110902)购自成都市科隆化学品有限公司;葡萄糖检测试剂盒(批号20201029)、总胆固醇(total cholesterol,TC)检测试剂盒(批号20210708)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)检测试剂盒(批号20210703)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)检测试剂盒(批号20210703)、三酰甘油(triacylglycerol,TG)检测试剂盒(批号20210430)、游离脂肪酸(free fatty acid,FFA)检测试剂盒(批号20210728)、己糖激酶(hexokinase,HK)检测试剂盒(批号20210726)、丙酮酸激酶(pyruvate kinase,PK)检测试剂盒(批号20220822)、超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒(批号20220827)、过氧化氢酶(catalase,CAT)检测试剂盒(批号20211105)、总抗氧化能力(total antioxidant capacity,T-AOC)检测试剂盒(批号20180508)、丙二醛(malondialdehyde,MDA)检测试剂盒(批号20180302)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)检测试剂盒(批号20190731)、胰岛素检测试剂盒(批号20210728)购自南京建成生物工程研究所;其余试剂均为分析纯。
1.3 仪器
P680A型液相色谱(戴安中国有限公司);RI-101型示差折光检测器(日本Showa Denko K.K.公司);Nicolet iS5型傅里叶红外光谱仪、Multiskan FC全波长酶标仪(美国Thermo Fisher Scientic公司);HH-8型数显恒温水浴锅(常州智博仪器制造有限公司);752型紫外可见分光光度计(上海菁华科技有限公司);SPX-250B-Z型生化培养箱(上海博讯实业有限公司医疗设备厂)。
2 方法
2.1 CRFP对糖尿病模型小鼠的影响
2.1.1 动物分组、造模和给药 ICR小鼠随机分为对照组(10只)、模型组、二甲双胍(200 mg/kg)组和CRFP低、中、高剂量(100、200、400 mg/kg)组各13只。模型组和各给药组连续4 d ip STZ(50 mg/kg),对照组ip等体积的柠檬酸缓冲液,除对照组外其余各组给予高脂饲料喂养。检测小鼠空腹血糖,选取空腹血糖≥11.1 mmol/L[13]的10只小鼠进行后续实验。造模成功后,各给药组ig相应药物,对照组和模型组ig等体积的蒸馏水,1次/d,连续8周。
2.1.2 生理生化指标检测 治疗期间,各组小鼠每周眼眶静脉丛取血,检测空腹血糖。取血前小鼠禁食8 h,自由饮水,取血后3500 r/min离心15 min,取血清,按照试剂盒说明书操作,检测血糖含量。
治疗结束后,小鼠禁食8 h,进行口服葡萄糖耐量试验(oral glucose tolerance test,OGTT)。各组小鼠ig葡萄糖(2 g/kg),分别于0、0.5、1、1.5、2 h眼眶静脉丛取血,测定血糖,绘出血糖变化曲线,计算曲线下面积(area under curve,AUC)[14]。
OGTT结束24 h后,小鼠禁食8 h,进行口服脂肪耐量试验(oral fat tolerance test,OFTT)。各组小鼠ig橄榄油(10 mL/kg)。分别于0、1、2、3、4 h眼眶静脉丛取血,按照试剂盒说明书操作,检测血清TG水平,绘出血脂变化曲线,计算AUC[15]。
最后,摘眼球取血,血液3500 r/min离心15 min取血清,按照说明书操作,检测血糖、空腹胰岛素(fasting insulin,FINS)、TC、TG、LDL-C、HDL-C、FFA水平。
取小鼠肝脏,生理盐水清洗,称定质量,剪碎,加入9倍体积的生理盐水,制成10%匀浆,2500 r/min离心10 min,取上清,按试剂盒说明书检测匀浆液中HK和PK活性;按照说明书操作,测定小鼠血清和肝脏中SOD、CAT、T-AOC、GSH-Px活性及MDA含量。
2.2 CRFP的结构表征
2.2.1 CRFP的分离纯化 将CRFP粉末溶于20 mmol/L的醋酸-醋酸钠缓冲液(pH 4.5)中,进行DEAE纤维素DE-52色谱分离,醋酸-醋酸钠缓冲液洗脱3个柱体积,分管收集,硫酸-蒽酮法[16]检测每管的多糖含量,合并洗脱峰,为CRFP-a;然后用含1mol/L NaCl的醋酸-醋酸钠缓冲液洗脱3个柱体积,分管收集,检测每管的多糖含量,合并洗脱峰,为CRFP-b。分别将CRFP-a和CRFP-b醇沉,60 ℃烘干。分别将CRFP-a和CRFP-b配制成10 mg/mL的水溶液,采用Sephacry1 S-200凝胶过滤色谱纯化,蒸馏水洗脱,体积流量为1 mL/min,分管收集洗脱液,检测每管的多糖含量,合并洗脱峰,分别命名为CRFP-1和CRFP-2,冷冻干燥。
2.2.2 多糖纯度和相对分子质量的检测 采用高效分子排阻色谱(high performance molecular exclusion chromatography,HPSEC)法[17]检测多糖纯度和相对分子质量。Shodex SUGAR KS-805色谱柱(300 mm×8 mm);检测器为示差折光检测器;流动相为H2O;体积流量1 mL/min;柱温65 ℃;进样量20 µL。
将不同相对分子质量(分别为180、2700、5250、9750、13 050、36 800)的右旋糖酐标准品分别配制成2 mg/mL的水溶液,上样,以相对分子质量的对数为横坐标,保留时间为纵坐标,绘制标准曲线。分别将CRFP-1和CRFP-2水溶液按上述条件进行HPSEC,根据色谱图分析样品纯度,根据保留时间计算样品的相对分子质量。
2.2.3 红外光谱扫描 分别称取2 mg CRFP-1和CRFP-2,加入一定量溴化钾充分研磨,制成溴化钾压片进行傅里叶红外光谱扫描[18],扫描范围为500~4000 cm−1。
2.2.4 CRFP单糖组成分析 CRFP-1和CRFP-2采用1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone,PMP)柱前衍生法[19]测定其单糖组成。称取多糖样品10 mg于水解管中,加入4 mol/L三氟乙酸1 mL,于120 ℃烘箱中水解2 h。然后氮气吹干,加蒸馏水定容至20 mL。分别称取鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖、岩藻糖、半乳糖、半乳糖醛酸、葡萄糖醛酸、核糖标准品10 mg,配制成1.0 mg/mL的混合溶液,稀释成质量浓度分别为2.5、5.0、12.0、18.0、25.0 μg/mL的溶液。取样品和标准品溶液0.5 mL,加1 mL 0.5 mol/L PMP-甲醇溶液以及0.5 mL 0.3 mol/L NaOH溶液,70 ℃水浴60 min,冷却后依次加入0.5 mL 0.3 mol/L HCl溶液和0.5 mL氯仿,振荡摇匀后静置20 min,弃去下层,萃取3次,取水层过0.45 μm滤膜进行HPLC分析。色谱条件:SHISEIDO C18色谱柱(250 mm×4.6 mm,5 μm),流动相为0.1 mol/L KH2PO4(pH 6.8)-乙腈(82∶18);体积流量1.0 mL/min;柱温25 ℃;进样量10 μL,波长245 nm。以单糖标准品质量浓度为自变量,峰面积为因变量,计算标准曲线。根据样品各单糖的峰面积计算单糖含量,计算物质的量比。
2.3 统计学分析
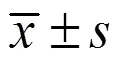
3 结果
3.1 CRFP对糖尿病模型小鼠的影响
3.1.1 CRFP对糖尿病小鼠血糖、OGTT、OFTT和FINS水平的影响 如图1-A所示,造模后,模型组血糖水平呈上升趋势;经CRFP治疗2周后血糖逐步下降。如图1-B所示,治疗结束后ig葡萄糖,各给药组血糖随时间的变化趋势一致,均在ig葡萄糖0.5 h时达到最大值,然后逐步下降,2 h后恢复。根据各组的血糖变化曲线,计算各组的AUC,与对照组比较,各给药组的AUC均与模型组有显著差异(<0.01),说明CRFP能显著加快糖尿病模型小鼠的葡萄糖代谢速度,从而降低血糖。
如图1-C所示,治疗结束后,各组小鼠的TG水平各异,这是因为糖尿病小鼠的血脂代谢紊乱,模型组的TG维持在较高水平,各给药组TG水平有所降低,但下降程度有所不同。ig橄榄油后,各组小鼠的TG变化趋势相同,均在2 h时达最高值,随后开始下降。计算各组TG的AUC,与模型组比较,CRFP中、高剂量组的AUC均显著降低(<0.05、0.01),CRFP低剂量组虽然与模型组无显著差异,但已表现出下降趋势。因此,CRFP能加速糖尿病小鼠的脂肪代谢,具有潜在的改善糖尿病脂肪代谢紊乱功能。如图1-D所示,与对照组比较,模型组FINS水平显著降低(<0.01);与模型组比较,各给药组FINS水平均显著升高(<0.01),且呈剂量相关性。
与对照组比较:##P<0.01;与模型组比较:*P<0.05 **P<0.01
3.1.2 CRFP对糖尿病小鼠肝脏HK和PK活性的影响 如表1所示,与对照组比较,模型组小鼠肝脏HK和PK活性均显著降低(<0.01);与模型组比较,各给药组肝脏HK活性均显著升高(<0.01),二甲双胍组和CRFP中、高剂量组PK活性均显著升高(<0.01),且呈剂量相关性。表明CRFP能有效提高肝脏HK和PK活性,从而达到降低血糖的作用。

表1 CRFP对糖尿病小鼠肝脏HK和PK活性的影响(, n = 10)
与对照组比较:##<0.01;与模型组比较:*<0.05**<0.01,下表同
##< 0.01control group;*< 0.05**< 0.01model group, same as below tables
3.1.3 CRFP对糖尿病小鼠血脂的影响 如表2所示,与对照组比较,模型组小鼠TC、LDL-C、TG、FFA水平均显著升高(<0.01),HDL-C水平显著降低(<0.01);与模型组比较,各给药组LDL-C、TG、FFA水平均显著降低(<0.05、0.01),HDL-C水平显著升高(<0.05、0.01);二甲双胍组和CRFP中、高剂量组TC水平均显著降低(<0.05、0.01)。
3.1.4 CRFP对糖尿病小鼠体内抗氧化活性的影响 如表3、4所示,与对照组比较,模型组小鼠血清和肝脏中SOD、CAT、T-AOC和GSH-Px活性均显著降低(<0.01),MDA水平显著升高(<0.01);与模型组比较,各给药组血清和肝脏中SOD、CAT、T-AOC和GSH-Px活性均显著升高(<0.05、0.01),MDA水平显著降低(<0.01)。
3.2 CRFP的结构表征
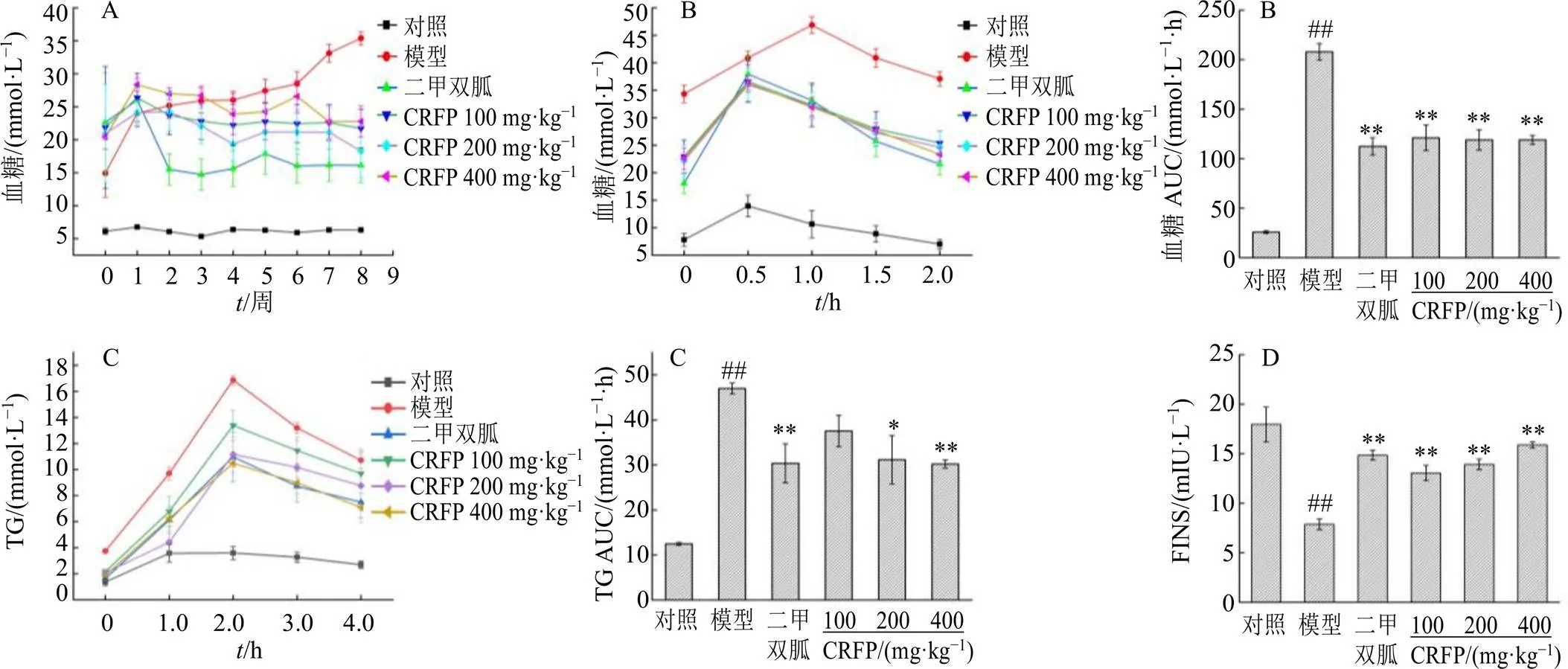
3.2.1 DE-52离子交换色谱 图2为CRFP经DE-52离子交换色谱不同洗脱液的洗脱图谱,CRFP经20 mmol/L醋酸-醋酸钠缓冲液(pH 4.5)和1 mol/L NaCl缓冲液洗脱后各自得到单一峰,分别收集对应主峰的洗脱液,醇沉,60 ℃烘干。得到CRFP-a和CRFP-b,离子交换色谱的得率分别为28.25%和53.17%。

表2 CRFP对糖尿病小鼠血脂的影响(, n = 10)

表3 CRFP对糖尿病小鼠血清抗氧化活性的影响(, n = 10)

表4 CRFP对糖尿病小鼠肝脏抗氧化活性的影响(, n = 10)
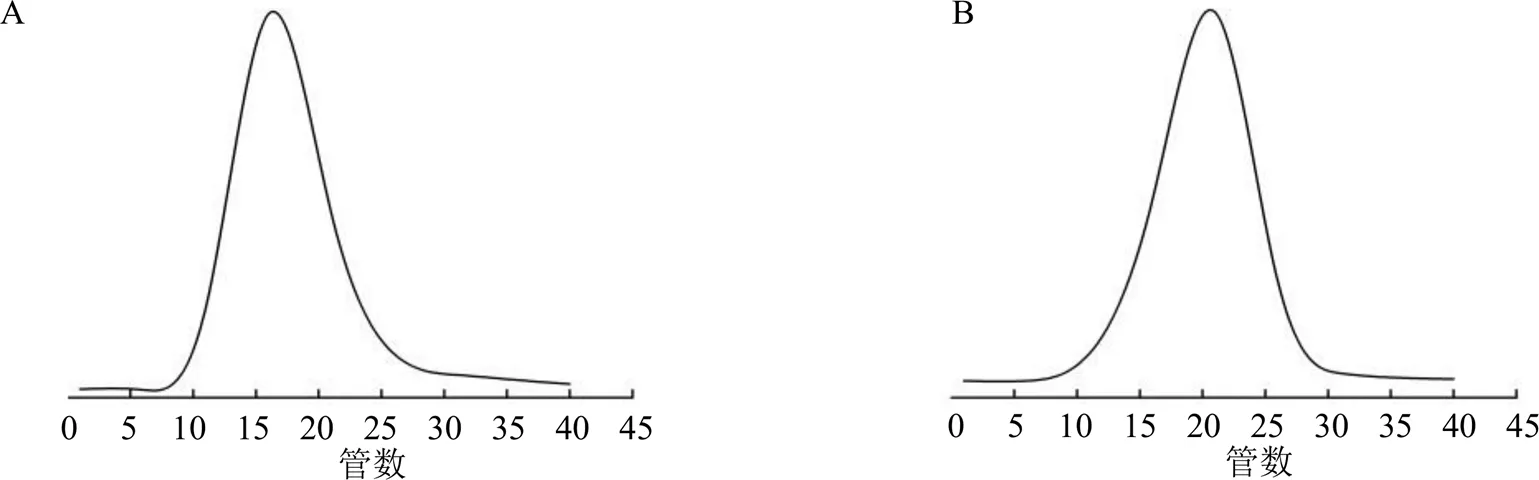
图2 CRFP DE-52 HAc-NaAc缓冲液洗脱曲线(A) 和盐洗脱曲线(B)
3.2.2 Sephacry1 S-200凝胶过滤色谱 CRFP-a和CRFP-b分别经Sephacry1 S-200分子筛进一步纯化后均得到单一洗脱峰(图3),分别收集对应的洗脱液,冷冻干燥,分别命名为CRFP-1和CRFP-2,凝胶过滤色谱的得率分别为82.39%和78.65%。
3.2.3 CRFP-1和CRFP-2纯度和相对分子质量的检测 CRFP-1和CRFP-2经高效液相示差检测均为单一对称峰,质量分数分别为99.86%和99.58%,均为均一组分多糖(图4)。右旋糖酐标准品相对分子质量对数值(lgP)与保留时间(R)具有线性关系,2=0.996,线性方程为=−0.587 9+12.531。高效液相检测CRFP-1的R为(9.953±0.006)min、CRFP-2的R为(10.024±0.002)min,根据线性方程求得所对应的相对分子质量为24 307±311和18 405±168。

图3 CRFP-a (A) 和CRFP-b(B) S-200洗脱曲线
图4 CRFP-1 (A) 和CRFP-2 (B) 高效液相色谱图
3.2.4 红外光谱扫描 CRFP-1红外光谱扫描结果见图5-A,在3383 cm−1附近处的特征吸收峰为O-H伸缩振动吸收峰;在2932 cm−1附近处为C-H伸缩振动吸收峰;在1649 cm−1附近为-CHO上的C=O缩振动吸收峰,是酰胺碳基的特征吸收峰;在1376 cm−1附近为=CH2变形吸收峰;在1252 cm−1附近为C-H弯曲振动吸收峰;在1041 cm−1附近为醇羟基-OH变角振动吸收峰,在865 cm−1附近为α-型糖苷键的特性吸收峰,说明CRFP-1为α-型多糖。
CRFP-2红外光谱扫描结果见图5-B,在3417 cm−1附近处的特征吸收峰为O-H伸缩振动吸收峰;在2927 cm−1附近处为C-H伸缩振动吸收峰;在1614 cm−1为-OH弯曲振动吸收峰;1414 cm−1为=CH2变形吸收峰;在1251 cm−1附近为C-H弯曲振动吸收峰;在1074 cm−1附近为醇羟基-OH变角振动吸收峰,在916 cm−1附近为β-型糖苷键的特性吸收峰,说明CRFP-2为β-型多糖。
3.2.5 CRFP-1和CRFP-2单糖组成 如图6所示,与单糖标准品图谱比较,CRFP-1由8种单糖组成,分别为甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖、岩藻糖,物质的量比为0.245∶0.071∶0.003∶0.001∶0.122∶0.425∶0.123 5∶0.01,其中半乳糖占比最高。CRFP-2由10种单糖组成,分别为甘露糖、核糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、木糖、阿拉伯糖、岩藻糖,物质的量比为0.061∶0.01∶0.083∶0.128∶0.127∶0.038∶0.301∶0.048∶0.112∶0.093,其中半乳糖占比最高。

图5 CRFP-1 (A) 和CRFP-2 (B) 红外扫描图谱

1-甘露糖 2-核糖 3-鼠李糖 4-葡萄糖醛酸 5-半乳糖醛酸 6-葡萄糖 7-半乳糖 8-木糖 9-阿拉伯糖 10-岩藻糖
4 讨论
课题组前期研究表明,CRFP得率高于黄连多糖,且具有较强的体外抗氧化活性[12]。黄连多糖的降血糖作用已得到证实[20-21],但CRFP是否具有降血糖作用,还需研究确认。由于黄连须成本远低于黄连,所以从黄连须中得到降血糖的多糖具有重大意义。本研究表明CRFP能显著降低糖尿病小鼠的空腹血糖水平,降低OGTT的AUC,说明加速外周组织(肝、肌肉、脂肪)对葡萄糖的利用、改善胰岛素抵抗是CRFP降血糖的机制之一;提高FINS,表明CRFP能改善受损胰岛的功能,促进胰岛素分泌;HK和PK作为体内糖酵解过程中的关键性的限速酶,在体内糖代谢过程发挥重要作用,CRFP提高了糖尿病小鼠肝脏的HK和PK活性,说明CRFP能通过提高糖代谢中的关键酶活性起到降血糖作用。糖代谢异常会导致血脂代谢紊乱,引发高脂血症、动脉粥样硬化和心血管疾病等。本研究结果显示,给予CRFP后糖尿病小鼠OFTT的AUC、TG、TC、LDL-C和FFA含量显著降低,HDL-C水平提高,说明CRFP能改善糖尿病引起的血脂代谢紊乱,降低由血脂异常引发的糖尿病并发症风险。血糖升高会引起体内氧化应激水平增高,反之,氧化应激水平增高又会加剧血糖升高,所以抗氧化是治疗糖尿病的重要辅助手段。CRFP能显著提高糖尿病小鼠血清和肝脏中的抗氧化活性,显示抗氧化活性亦是CRFP降血糖的机制之一。
在证实CRFP降血糖活性后,本研究通过色谱技术对其进行了分离纯化,得到2种成分均一的精多糖CRFP-1和CRFP-2,并解析了结构。李云[20]采用了4种不同梯度的NaCl溶液作为洗脱液,得到了4种电荷量不同的黄连多糖;范刚等[22]通过柱前衍生法分析了3种不同品种黄连单糖组分,均有7种单糖组分,而本研究的CRFP-1和CRFP-2分别由8种和10种单糖组成,与张亚丽等[23]的研究基本一致。研究材料、提取方法和分离纯化技术的不同会导致单糖组成存在差异。至于CRFP-1和CRFP-2在降血糖中的作用还有待进一步研究。
综上,本研究从黄连采收过程中废弃的黄连须中提取了CRFP,研究该多糖对糖尿病小鼠的作用,发现CRFP通过促进外周组织对葡萄糖的利用、提高胰岛分泌胰岛素能力、加速葡萄糖代谢、改善血脂代谢紊乱和提高氧化应激水平降低血糖,具有开发成降血糖药物的潜力。为进一步深入研究CRFP的结构和组成,本研究对CRFP进行了分离纯化,得到了成分均一的α-型CRFP-1和β-型CRFP-2,相对分子质量分别为24 307±311和18 405±168,均为半乳糖含量最高,但其他组成各异。CRFP-1和CRFP-2在降血糖中所起的作用还有待进一步研究。
利益冲突 所有作者均声明不存在利益冲突
[1] 曾立, 向荣, 张运良, 等. 黄精多糖对糖尿病小鼠的降血糖作用及机制 [J]. 中成药, 2022, 44(9): 2989-2994.
[2] Zhou Z, Sun B, Yu D S,. Gut microbiota: An important player in type 2 diabetes mellitus [J]., 2022, 12: 834485.
[3] Sun H, Saeedi P, Karuranga S,. IDF Diabetes Atlas: Global, regional and country-level diabetes prevalence estimates for 2021 and projections for 2045 [J]., 2022, 183: 109119.
[4] 郭立新. 2021年糖尿病领域年度重大进展回顾 [J]. 中华糖尿病杂志, 2022, 14(1): 1-8.
[5] 中国老年型糖尿病防治临床指南编写组, 中国老年医学学会老年内分泌代谢分会, 中国老年保健医学研究会老年内分泌与代谢分会, 等. 中国老年2型糖尿病防治临床指南 (2022年版) [J]. 中华内科杂志, 2022, 61(1): 12-50.
[6] 吴梦琪, 夏玮, 徐志珍, 等. 植物多糖的分离纯化、结构解析及生物活性研究进展 [J]. 化学世界, 2019, 60(11): 737-747.
[7] 张蕊馨, 张彦华, 周迎春, 等. 中药多糖化学结构及药理作用研究进展 [J]. 黑龙江中医药, 2018, 47(1): 88-89.
[8] 中国药典[S]. 一部. 2020: 1088.
[9] Cui L J, Liu M, Chang X Y,. The inhibiting effect of thepolysaccharide on the type II diabetic mice [J]., 2016, 81: 111-119.
[10] Jiang S, Wang Y H, Ren D Y,. Antidiabetic mechanism ofpolysaccharide through its antioxidant property involving the JNK pathway [J]., 2015, 53(7): 1022-1029.
[11] 盖晓红, 刘素香, 任涛, 等. 黄连的化学成分及药理作用研究进展[J]. 中草药, 2018, 49(20): 4919-4927.
[12] 田谷正男, 胡莹, 蒋凤珍, 等. 黄连须多糖水浴提取工艺优化及体外抗氧化活性研究 [J]. 湖北民族大学学报: 自然科学版, 2022, 40(2): 142-149.
[13] Yuan Y, Zhou J H, Zheng Y F,. Beneficial effects of polysaccharide-rich extracts fromleaves on hypoglycemic and gut microbiota in type 2 diabetic mice [J]., 2020, 127: 110182.
[14] Mbagwu I S, Akah P A, Ajaghaku D L.improved glucose and fat homeostasis in a TYPE-2 diabesity mice model [J]., 2020, 251: 112555.
[15] Lattibeaudiere K G, Alexander-Lindo R L. Oleic acid and succinic acid synergistically mitigate symptoms of type 2 diabetes in streptozotocin-induced diabetic rats [J]., 2022, 2022: 8744964.
[16] 温文娟, 刘珊, 黄远丽. 苯酚硫酸法与蒽酮硫酸法测定香菇多糖含量比较 [J]. 现代食品, 2020(21): 177-179.
[17] 顾健, 吴伟, 沈志冲, 等. 高效分子排阻色谱法测定滇黄精多糖的分子量 [J]. 中国药业, 2021, 30(13): 72-74.
[18] 黄俊彬, 丁婕, 朱海媚, 等. 三个不同种源的铁皮石斛多糖比较及其初步的药理活性评价 [J]. 食品工业科技, 2022, 43(5): 71-78.
[19] 李婷婷, 王雪吟, 胡丹荔, 等. 柱前衍生法测定桂花多糖中的6种单糖的含量 [J]. 食品工业, 2019, 40(4): 323-327.
[20] 李云. 黄连多糖分离纯化及其对高级糖基化终产物形成的影响 [D]. 合肥: 安徽中医药大学, 2015.
[21] 齐刚, 王继锋, 齐凤军, 等. 黄连多糖联合甘精胰岛素治疗2型糖尿病胰岛素抵抗 [J]. 中医学报, 2018, 33(10): 1899-1903.
[22] 范刚, 唐策, 李艳, 等. 柱前衍生HPLC分析黄连多糖的单糖组成 [J]. 中国实验方剂学杂志, 2014, 20(11): 74-78.
[23] 张亚丽, 高简, 苗祥贞, 等. 黄连多糖中单糖组成的HPLC-MSn法快速识别 [J]. 世界中医药, 2017, 12(11): 2775-2778.
Hypoglycemic activity and structure characterization offibrous polysaccharides
TIAN Gu-zheng-nan1, ZHOU Xin-chao1, XIE Ruo-tong1, WANG Yu1, MAO Mei-ling1, DENG Zi-yan1, CAI Chang-jun1, TU Kang1, ZHU Xi-qiang1, JIANG Ning1, 2, LIU Xiao-Peng1, 2
1. College of Biological and Food Engineering, Hubei Minzu University, Enshi445000, China 2. Hubei Key Laboratory of Biological Resources Protection and Utilization, Enshi 445000, China
To explore the hypoglycemic activity and material basis of Huanglian () fibrous polysaccharides (CRFP), a by-product of.The effect of CRFP on diabetes model mice was studied and CRFP was purified. The purity and relative molecular weight of purified product were detected, and its structure and monosaccharide composition were analyzed.After eight weeks of administration, CRFP could significantly reduce blood glucose (< 0.01), accelerate blood glucose and lipid metabolism, increase fasting insulin level (< 0.01), improve blood lipid disorder (< 0.05, 0.01), increase liver hexokinase (HK) and pyruvate kinase (PK) activities (< 0.01), and improve oxidative stress (< 0.05, 0.01) in diabetes model mice. After purification, CRFP-1 and CRFP-2 with uniform components were obtained. The relative molecular weight of CRFP-1 and CRFP-2 respectively were (24 307 ± 311) and (18 405 ± 168), CRFP-1 was α-type polysaccharide, composed of eight monosaccharides; CRFP-2 was β-type polysaccharide, composed of 10 monosaccharides.CRFP has good hypoglycemic activity, which lays a foundation for the deep development and improvement of utilization value of.
fibrous; polysaccharides; diabetes mellitus; separation and purification; structural analysis
R285.5
A
0253 - 2670(2023)06 - 1825 - 08
10.7501/j.issn.0253-2670.2023.06.014
2022-11-03
国家自然科学基金资助项目(82160713);湖北省技术创新专项(2017AKB077,2016AKB058);湖北产业教授人才项目(2019029,2021067);湖北民族大学大学生创新创业训练计划项目(X202210517208)
田谷正男(1994—),男,研究生,研究方向为天然产物研究。E-mail: 976050052@qq.com
刘晓鹏(1971—),男,教授,博士,硕士生导师,研究方向为天然产物研究。Tel: 15671896031 E-mail: liuxp999@163.com
[责任编辑 李亚楠]

