基于网络药理学和分子对接探讨鸦胆子治疗结直肠癌的作用机制
赵韦欣,王 晴,王梦齐,季安璇,郑晶莹,赵淑华
基于网络药理学和分子对接探讨鸦胆子治疗结直肠癌的作用机制
赵韦欣,王 晴,王梦齐,季安璇,郑晶莹*,赵淑华*
吉林大学第二医院 妇产科,吉林 长春 130022
采用网络药理学结合分子对接及体内验证,探究鸦胆子治疗结直肠癌的活性成分、关键作用靶点及潜在的分子机制。从公共数据库中检索并收集鸦胆子的活性成分和对应的靶点以及结直肠癌相关的靶点,通过网络药理学分析出鸦胆子治疗结直肠癌的活性成分、成分-疾病的交集靶点以及可能的信号通路。通过分子对接预测活性成分与靶点蛋白的结合能力。通过体内实验进一步验证鸦胆子活性成分治疗结直肠癌的作用和作用机制。在满足筛选条件的15个成分中共筛出鸦胆子苦醇、木犀草素、鸦胆子苷B、β-谷甾醇4个鸦胆子生物活性成分及32个鸦胆子治疗结直肠癌的作用靶点,表皮因子生长受体(epidermal growth factor receptor,EGFR)、半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,Caspase-3)及细胞周期蛋白D1(cyclin D1)是鸦胆子治疗结直肠癌的关键靶点,EGFR/磷脂酰肌醇3-激酶(phosphatidylinositol-3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)信号通路可能在鸦胆子治疗结直肠癌中发挥重要作用。分子对接结果表示4个生物活性成分均可较好结合,其中鸦胆子苦醇与3个关键靶点的平均结合能负值最大,结合最稳定,可能是鸦胆子抗结直肠癌最有效的活性成分。动物实验结果表明,与对照组比较,鸦胆子苦醇明显抑制裸鼠体内移植瘤的体积和质量(<0.01),下调肿瘤组织中EGFR、PI3K和Akt的蛋白表达水平(<0.01),下调与G1/G0期细胞阻滞相关的cyclin D1和细胞周期蛋白依赖性激酶4(cyclin-dependent kinase 4,CDK4)的表达(<0.01),上调与肿瘤细胞凋亡相关的cleaved Caspase-3表达及B淋巴细胞瘤-2相关X蛋白(B-cell lymphoma-2 associated X protein,Bax)/B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)值(<0.01),下调与迁移和侵袭相关的蛋白基质金属蛋白酶9(matrix metalloproteinase 9,MMP9)、MMP7表达(<0.01);鸦胆子苦醇组裸鼠肝功能、肾功能及血液指标均未见显著性差异。鸦胆子能够通过多靶点、多通路治疗结直肠癌,其主要活性成分为鸦胆子苦醇,其机制可能与抑制EGFR/PI3K/Akt信号通路从而引起G1/G0期阻滞,抑制增殖、侵袭和迁移,促进细胞凋亡有关。
鸦胆子;鸦胆子苦醇;结直肠癌;网络药理学;分子对接;木犀草素;鸦胆子苷B;β-谷甾醇;表皮因子生长受体;半胱氨酸天冬氨酸蛋白酶-3;细胞周期蛋白D1
结直肠癌(colorectal cancer,CRC)是消化系统常见的恶性肿瘤之一,是全球癌症死亡率的第2大原因[1]。大多数CRC是散发的,遗传及环境因素是其重要的致病因素[2]。化疗是CRC的关键治疗方案之一[3]。传统中药制剂作为癌症化疗的辅助治疗已经在全世界范围内被广泛接受[4]。大量研究及临床实践向肿瘤的综合治疗不断拓展,已经证明传统中药作为辅助疗法,与化疗或者放疗相结合,可以提高疗效、减少不良反应[5-7]。
鸦胆子(L.) Merr.是原生于我国东南部及其他热带、亚热带地区的苦木科灌木。以鸦胆子果实为原料生产的中药抗肿瘤注射液,已广泛在临床被用于肺癌、肺癌脑转移和胃肠道肿瘤的辅助治疗。临床研究证明鸦胆子可以增强临床上晚期非小细胞肺癌的疗效并降低化疗的不良反应[8-9]。鸦胆子苦醇是鸦胆子的重要活性成分[10]。研究发现,鸦胆子苦醇对乳腺癌、鼻咽癌、肺癌和其他恶性肿瘤均有抑制作用[11-14]。鸦胆子果实的乙醇提取物可能通过上调p53和抑制核因子-κB(nuclear factor-κB,NF-κB)抗人结肠癌HCT116细胞生长[15]。然而,其潜在机制尚不清楚。
网络药理学是一种结合计算机科学与医学来阐述药物对疾病作用机制的新兴方法,能系统地研究、鉴定中药配方的生物活性化合物并可视化其多靶点、多途径的作用机制,已被广泛应用于预测、分析中药的药理作用及潜在机制[4,16-17]。因此,本研究从网络药理学角度筛选鸦胆子的活性成分及针对CRC的靶点和信号通路。分子对接是研究小分子药物与靶点蛋白受体之间的相互作用及亲和力的模拟计算方法。分子对接可以作为网络药理学的进一步验证,二者互补地用于中药研究[18]。本研究通过分子对接模拟鸦胆子已鉴定组分与其可能靶标蛋白的分子相互作用并计算结合力。鸦胆子苦醇作为被验证的鸦胆子抗肿瘤活性成分[10],本研究进一步在裸鼠荷瘤模型中验证其抗CRC的潜力及网络药理学预测的效应机制。
1 材料
1.1 动物
12只SPF级雌性BALB/c-Nu小鼠,6周龄,体质量16~20 g,购自北京华阜康生物科技股份有限公司,质量合格证编号No.110322220103372262,质量许可证号SCXK(京)2019-0008,动物使用许可证号SYXK(吉)2018-0001。动物于相对湿度45%~55%、温度(22±1)℃、12 h光暗循环的环境下,适应性饲养1周,自由进食饮水。动物实验经吉林大学基础学院伦理委员会批准(批准号202073)。
1.2 细胞
HCT116细胞购自武汉普诺赛生命科技有限公司。
1.3 药品与试剂
鸦胆子苦醇(批号B26016,质量分数≥98%)、β-环糊精(批号T66291)购自上海源叶生物科技有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO,批号D8418)购自美国Sigma公司;RIPA裂解液、BCA蛋白浓度测定试剂盒(批号P0006C)购自上海碧云天生物技术有限公司;4%~15%连续梯度聚丙烯酰胺预制胶(批号DG101-01)购自北京全式金生物技术股份有限公司;表皮因子生长受体(epidermal growth factor receptor,EGFR)抗体(批号AF6043)、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)抗体(批号AF6241)、蛋白激酶B(protein kinase B,Akt)抗体(批号AF6261)、细胞周期蛋白依赖性激酶4(cyclin-dependent kinase 4,CDK4)抗体(批号DF6102)、细胞周期蛋白B1(cyclin B1)抗体(批号AF6168)、cyclin D1抗体(批号AF0931)、剪切型半胱氨酸天冬氨酸蛋白酶-3(cleaved cystein-asparate protease-3,cleaved Caspase-3)抗体(批号AF7022)、B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)抗体(批号AF6139)、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)抗体(批号AF0120)、蛋白基质金属蛋白酶7(matrix metalloproteinase 7,MMP7)抗体(批号AF0218)、MMP2抗体(批号AF5330)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(批号AF7021)、电化学发光试剂盒(批号KF001)均购自江苏亲科生物研究中心有限公司;HRP标记的羊抗兔二抗(批号SA00001-2)购自武汉三鹰生物技术有限公司。
1.4 仪器
ChemiScope 6000 Touch型凝胶成像仪(上海勤翔科学仪器有限公司);SC-412型4 ℃立式冷藏柜(青岛市海尔股份有限公司);PowerPac3000型电泳仪(美国Bio-Rad公司);MOV-112F型细胞培养箱(日本三洋公司);V18R型高速冷冻离心机(瑞士Dynamica公司);BETS-100型摇床振荡器(海门市其林贝尔公司);Hemo 3600V型Shinova血液学分析仪(上海麦本医疗科技有限公司)。
2 方法
2.1 鸦胆子的网络药理学分析及分子对接
2.1.1 鸦胆子的活性成分及靶点 利用中医系统药理学数据库(TCMSP,https://old.tcmsp-e.com/tcmsp. php)、中医药资料库(http://tcm.cmu.edu.tw/)以及文献检索的方法收集鸦胆子的主要活性成分,将能在PubChem中检索对应的CAS号和SMILES号的成分进行收集。同时,对收集的成分进行药动学信息检索,以口服生物利用度(oral bioavailability,OB)≥30%、类药性(drug-likeness,DL)≥0.18为筛选条件。
2.1.2 CRC的靶点及交集靶点的获取 在GeneCards(https://www.genecards.org)中,以“CRC”为检索词,物种限定为“Homo sapiens”,对其进行注释和预测。收集相关性值大于1的靶点作为疾病靶点。在Venn 2.1.0制图平台(https://bioinfogp.cnb. csic.es/tools/venny/index.html)绘制CRC与鸦胆子的交集靶点。
2.1.3 “活性成分-CRC”网络的构建 通过Cytoscape 3.7.2(https://cytoscape.org)可视化“活性成分-CRC”网络,连接的节点越密集,受该成分调控的靶点越多,表明该成分是鸦胆子抗CRC的重要活性成分。
2.1.4 蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络的构建及关键靶点筛选 将CRC靶点导入STRING 11.0数据库(https://cn.string-db.org)进行分析,模式设置为“多种蛋白”,物种限定为“Homo sapiens”。预读数据后,其余蛋白的置信度≥0.99,与其余蛋白无联系的蛋白被隐藏。然后构建PPI网络,分数设置为0.4,剔除不符合得分的靶标。利用Barplot绘图函数,对蛋白质连接节点的个数进行技术并绘制直方图,寻找核心靶点。
2.1.5 基因本体(gene ontology,GO)功能及京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析 利用R 3.6.0软件进行GO功能富集分析,从靶细胞的分子功能、细胞成分和生物过程确定基因富集的功能,值与富集程度呈正相关。用R将结果绘制成相应的直方图和气泡图,选取筛选校正后<0.05的富集结果。利用KEGG途径富集分析获得枢纽靶点作用的途径。
2.1.6 分子对接 将小分子药物的mol2格式的文件导入AutoDockTools(Version 1.5.7),对小分子药物进行平衡电荷、将非极性氢原子与相对应的碳原子合并等修饰获得3D结构,然后转化为PDBQT格式的文件。从蛋白质数据库(https://www.rcsb.org/,Protein Data Bank,PDB)获取EGFR(ID:1M17)、Caspase-3(ID:4QUB)、Cyclin D1(ID:5VZU)的晶体结构。通过AutoDockTools对受体蛋白进行去水、加氢、平衡电荷等预处理后转化为PDBQT格式的文件。利用AutoDockTools对小分子药物和配体蛋白进行分子对接,将受体和配体的PDBQT文件导入AutoDockTools,构建对接口袋。在大分子上设置中心,并设置、和的参数以保证蛋白质完全被覆盖。将输出的最大结合模式数设置为20。分子对接后生成活性位点位置,并计算结合能和氢键数。结合能为负值说明小分子药物配体可以与受体靶点蛋白自发结合,结合能越小说明结合越稳定,结合能<−17.782 kJ/mol即为能较好结合。用OpenBabel将对接好的文件转换为PDB格式,通过PyMOL(3D,Version 2.2.0)和LigPlot(2D)对偶联模型进行可视化,并展示氢键,这2种模型都被广泛应用于可视化对接结果,包括配体与蛋白质主链或侧链元件之间的对接位点和氢键相互作用模式。
2.2 鸦胆子苦醇治疗CRC的作用研究
2.2.1 细胞培养 HCT116细胞用含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的DMEM培养基,于37 ℃、5% CO2的培养箱中培养。
2.2.2 动物模型的制备 BALB/c-Nu小鼠右背侧sc 100 μL HCT116细胞(2×106个),待肿瘤生长体积为80~100 mm3,小鼠随机分为对照组和鸦胆子苦醇(2 mg/kg)组,每组6只。鸦胆子苦醇溶于1% DMSO和20% β-环糊精中,给药组ip药物,对照组ip等体积的DMSO和β-环糊精,每隔1 d给药1次。每隔1 d记录肿瘤大小和小鼠体质量,当肿瘤大小达到2000 mm3时,采用颈椎脱位法处死小鼠,收集肿瘤,测量肿瘤体积和质量,采集小鼠眶后静脉窦全血。
2.2.3 Western blotting检测肿瘤组织细胞周期、侵袭、迁移、增殖及EGFR/PI3K/Akt通路相关蛋白表达 取各组小鼠肿瘤组织,加入含蛋白酶抑制剂和磷酸酶抑制剂的预冷RIPA裂解液提取蛋白,12 000 r/min离心10 min,取上清,采用BCA蛋白浓度测定试剂盒测定蛋白浓度。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,用5%脱脂牛奶室温封闭30 min,分别加入EGFR(1∶1000)、PI3K(1∶1000)、Akt(1∶1000)、CDK4(1∶1000)、cyclin B1(1∶1000)、cyclin D1(1∶1000)、cleaved Caspase-3(1∶1000)、Bax(1∶2000)、Bcl-2(1∶1000)、MMP7(1∶1500)、MMP2(1∶1000)、GAPDH(1∶20 000)抗体,4 ℃孵育过夜;加入二抗(1∶20 000),室温孵育1 h。使用电化学发光试剂盒显影,采用成像仪及Image J 2.1软件分析条带灰度值。
2.2.4 肝肾功及血常规指标检测 采用Shinova血液学分析仪分析小鼠的肝功能指数、肾功能指数和血常规指标,包括丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、γ-谷氨酰转肽酶(γ-glutamyl transpeptidase,γ-GT)、总胆汁酸(total bile acid,T-BIL)、白蛋白(albumin,ALB)、血尿素氮(blood urea nitrogen,BUN)、肌酐(creatinine,CREA)、尿酸(uric acid,UA)、白细胞(white blood cell,WBC)、红细胞(red blood cell,RBC)、血小板(platelet,PLT)和血红蛋白(haemoglobin,HGB)。
3 结果
3.1 网络药理学分析及分子对接
3.1.1 鸦胆子活性成分及对应靶点的获取 通过TCMSP检索共获得67个活性成分,以OB≥30%、DL≥0.18作为补充条件筛选,共获得15个鸦胆子主要活性成分(表1)。收集活性成分对应的靶点,去除重复值后共获得34个靶点。

表1 鸦胆子活性成分
3.1.2 CRC相关的靶点及与药物交集靶点的获取 Genecard数据库中检索到人类CRC相关的靶点共9410个,经过用Venn 2.1.0得到32个鸦胆子与CRC的交集靶点(图1),包括EGFR、Caspase-3、cyclin D1、CDK4、MMP-9和血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)等。
3.1.3 “活性成分-CRC”网络的构建 通过Cytoscape 3.7.2可视化“活性成分-CRC”网络(图2),包含37个节点和97个连接。椭圆节点表示靶点,方框节点表示活性成分,灰色线表示节点间相互作用。

图1 鸦胆子活性成分-CRC靶点Venn图

椭圆节点表示靶点,方框节点表示活性成分,灰色线表示节点间相互作用
3.1.4 PPI网络分析 将32个鸦胆子与CRC交集靶点输入STRING,构建PPI网络(图3),共获得32个节点和152条节点之间的连线。节点是鸦胆子与CRC交集靶点编码的蛋白,节点的连线越多,表示相互作用越多,靶点的作用越重要。根据节点的连线数量,通过Barplot计算并统计前30个靶点(图4),前3名为EGFR、Caspase-3和cyclin D1。
3.1.5 GO功能和KEGG通路富集分析 如图5所示,鸦胆子治疗CRC主要涉及细胞凋亡、自噬、基因表达负调控、蛋白磷酸化以及蛋白结合、转录因子结合等,主要作用于PI3K/Akt信号通路、肿瘤坏死因子(tumor necrosis factor,TNF)信号通路和p53信号通路等。
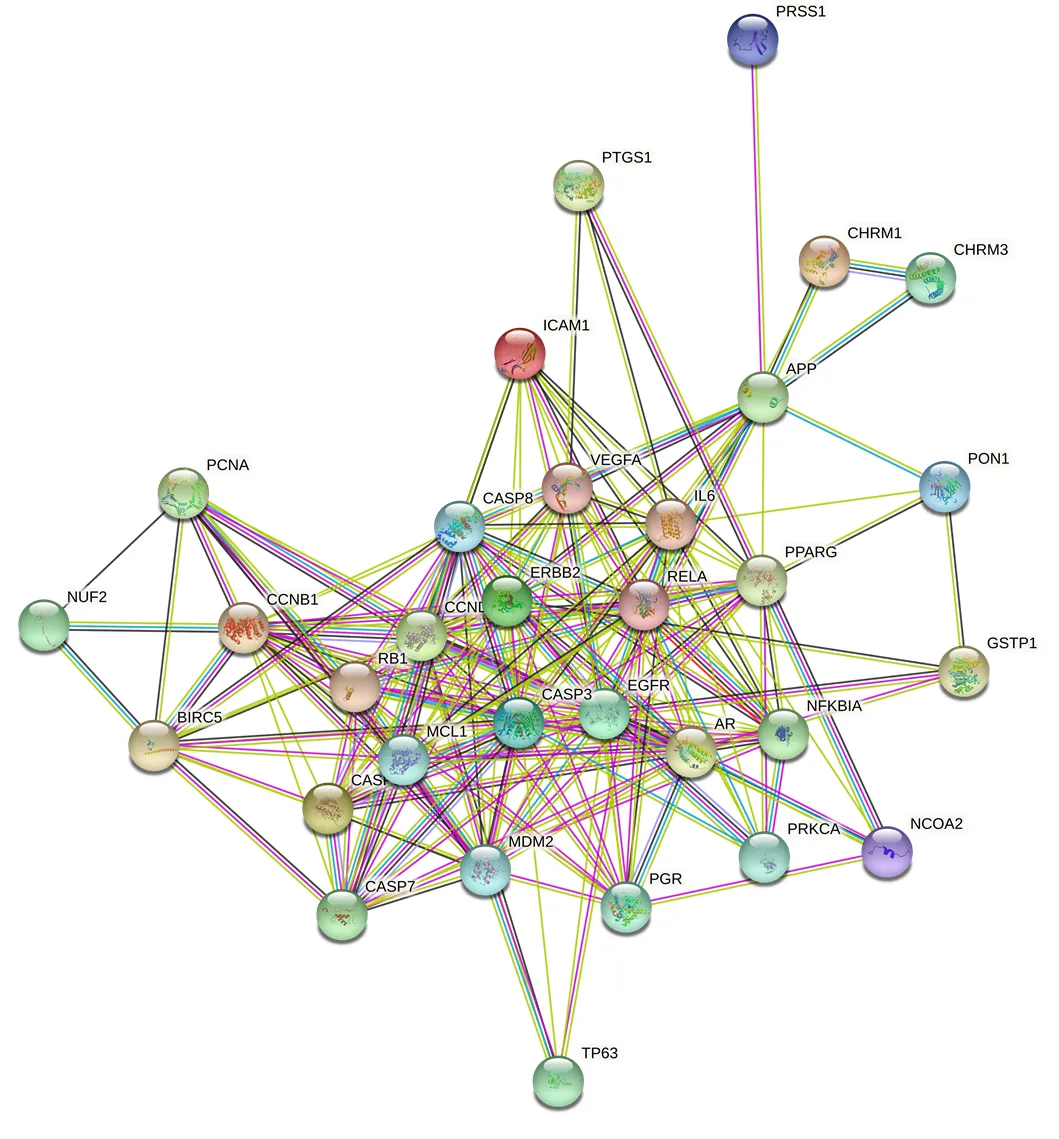
图3 PPI网络

图4 PPI网络靶点分析
3.1.6 分子对接 选取PPI网络中排名前3名的靶点EGFR、Caspase-3及cyclin D1,分别与鸦胆子治疗CRC的4个关键活性成分进行分子对接(图6),LigPlot将结果二维可视化,标明氢键的个数、长度及小分子药物配体连接的氨基酸残基(图7)。一般认为,小于−17.782、−20.92或−29.288 kJ/mol的结合能分别表明配体与受体之间有一定的、好的或较强的结合活性。结合能反映了受体和配体之间结合的可能性。结合能越低,受体与配体的亲和力越高,构象越稳定。其中,鸦胆子苦醇与EGFR的结合能最低(−37.530 5 kJ/mol)。与鸦胆子苦醇和木犀草素相比,鸦胆子苷B和β-谷甾醇与3个靶点蛋白的结合能均较高,亲和力较低。鸦胆子苦醇与EGFR、Caspase-3及cyclin D1的结合能分别为−37.530 5、−33.137 3、−30.710 6 kJ/mol,平均结合能为−33.792 8 kJ/mol。木犀草素与EGFR、Caspase-3及cyclin D1的结合能为−26.652 1、−30.585 0、−25.689 8 kJ/mol,平均结合能为−27.642 3 kJ/mol。

图5 GO功能(A) 和KEGG通路(B) 富集分析(前20)

图6 鸦胆子苦醇、木犀草素与靶点蛋白EGFR、Caspase-3和cyclin D1的3D分子对接结果

图7 鸦胆子苦醇、木犀草素与靶点蛋白EGFR、Caspase-3和cyclin D1的2D分子对接结果
3.2 鸦胆子苦醇抗CRC的作用验证
3.2.1 鸦胆子苦醇对荷瘤裸鼠模型肿瘤生长的影响 如图8所示,与对照组比较,鸦胆子苦醇组裸鼠肿瘤生长速度被明显抑制(<0.01),证明了鸦胆子苦醇对CRC具有明显的抑制作用。
3.2.2 鸦胆子苦醇对荷瘤裸鼠模型肿瘤组织细胞周期、侵袭、迁移、增殖及EGFR/PI3K/Akt通路相关蛋白表达的影响 如图9所示,与对照组比较,鸦胆子苦醇组肿瘤组织中EGFR、PI3K、Akt、CDK4、cyclin D1、MMP9、MMP7和Bcl-2蛋白表达水平均显著降低(<0.01),cyclin B1、cleaved Caspase-3、Bax蛋白表达水平均明显升高(<0.01),Bax/Bcl-2值显著升高(<0.01)。

与对照组比较:**P<0.01,下图同

图9 鸦胆子苦醇对荷瘤裸鼠模型肿瘤组织EGFR、PI3K、Akt、CDK4、cyclin D1、cyclin B1、MMP9、MMP7、cleaved Caspase-3、Bax和Bcl-2蛋白表达的影响(, n = 3)
3.2.3 鸦胆子苦醇对荷瘤裸鼠生物安全性评价 为研究鸦胆子苦醇对荷瘤裸鼠代谢器官的影响,检测对照组和鸦胆子苦醇组荷瘤裸鼠的肝功能指标(ALT、AST、ALB、γ-GT、T-BIL)及肾功能指标(BUN、CREA、UA)和血常规指标(WBC、RBC、PLT、HGB),如图10所示,与对照组比较,鸦胆子苦醇组荷瘤裸鼠肝、肾功能和血常规指标均无显著差异。

图10 鸦胆子苦醇的生物安全性评估(, n = 3)
4 讨论
本研究通过网络药理学分析鸦胆子的主要活性成分及其抗CRC的潜在机制,共获得鸦胆子苦醇、木犀草素、鸦胆子苷B、β-谷甾醇4个小分子药物活性成分和EGFR、Caspase-3、cyclin D1等32个核心靶点。KEGG通路富集分析表明鸦胆子抑制CRC可能与PI3K/Akt通路、TNF信号通路和p53信号通路等相关。在4个活性成分中,鸦胆子苦醇和木犀草素对应的靶点明显多于鸦胆子苷B和β-谷甾醇。将网络药理学预测的核心成分鸦胆子苦醇及木犀草素与关键靶点蛋白进行分子对接,2个核心成分与EGFR、Caspase-3和cyclin D1蛋白的活性结合位点的结合能均小于−16.736 kJ/mol,表明核心成分与关键的靶点蛋白之间可以自发结合且具有较强的结合活性。在筛选的4种鸦胆子活性成分中,鸦胆子苦醇和木犀草素均可与EGFR相互作用,EGFR是多种靶向药物的治疗靶点,如吉非替尼和厄洛替尼用于治疗非小细胞肺癌,拉帕替尼用于治疗晚期或转移性乳腺癌[19]。本研究发现,木犀草素与EGFR的Lys721、Glu738、Ala731形成3个氢键,鸦胆子苦醇与EGFR的Ile917形成1个氢键。木犀草素和鸦胆子苦醇对EGFR的亲和力表明木犀草素-EGFR、鸦胆子苦醇-EGFR相互作用的有效性。
鸦胆子苦醇是鸦胆子的主要活性成分。已有研究证实,鸦胆子苦醇可以阻断PI3K/Akt通路的信号传导,抑制胃癌等多种癌症的发生发展[20]。网络药理学分析结果表明,鸦胆子苦醇可通过EGFR/PI3K/ Akt通路抗CRC。进一步通过Western blotting实验验证了鸦胆子苦醇可以使该级联通路明显失活从而达到抑制CRC,验证了网络药理学预测结果。本研究通过构建裸鼠移植瘤模型,研究了鸦胆子苦醇对CRC的治疗作用。鸦胆子苦醇明显抑制荷瘤裸鼠模型体内肿瘤的生长,同时与代谢相关的肝脏功能和肾脏功能未受到明显的影响,血常规指标也没有观察到显著差异。表明鸦胆子苦醇具有很好的抑制CRC肿瘤细胞生长的作用。细胞周期与肿瘤的发展密切相关,主要由G1/G0和G2/M期组成,由cyclin/CDK复合物和CDK抑制剂协调。研究表明,鸦胆子苦醇通过作用于CDK4和cyclin D1调节非小细胞肺癌的G1/G0期,cyclin D1表达的降低导致G1/G0期细胞的阻滞[21],与本研究的结果一致,表明鸦胆子苦醇能够诱导肿瘤细胞的G1/G0期阻滞,从而抑制肿瘤细胞增殖。诱导细胞凋亡是抑制肿瘤发展的关键环节,受Caspase和Bcl-2家族蛋白的调控,Bcl-2家族蛋白包括促凋亡效应蛋白如Bax和抗凋亡效应蛋白如Bcl-2。促凋亡效应蛋白在凋亡应激源的作用下导致线粒体外膜通透化,释放细胞色素C来切割Caspase-3,从而导致不可逆的细胞凋亡。鸦胆子苦醇可通过上调cleaved Caspase-3表达和Bax/Bcl-2值,促进多种肿瘤细胞凋亡[22],与本研究结果一致,表明鸦胆子苦醇可诱导肿瘤细胞凋亡,可能涉及线粒体凋亡途径。肿瘤转移是肿瘤患者死亡的相关因素。细胞外基质被MMP修饰和降解,从而导致肿瘤细胞的分离和迁移。本研究发现,鸦胆子苦醇能够降低肿瘤组织中MMP7和MMP9的表达,具有抑制肿瘤细胞侵袭和迁移的能力,与鸦胆子苦醇对胃癌SGC-7901细胞的作用一致[19]。
药物的积累和清除可能损害器官。因此,通过对小鼠的血液生化指标来评估鸦胆子苦醇是否具有潜在的毒性作用。结果显示,肝、肾功能和血常规指标未见药物引起的显著性差异。因此,鸦胆子苦醇是一种安全、有效、有前景的抗肿瘤佐剂。然而,本研究有几个局限性:①来自在线数据库的信息是基于审查和预测的数据,因此,未经证实和未记录的化合物或靶点可能未被列入本研究中;②目前对鸦胆子15种化合物的定量测定研究尚不完全,因此,未来应进行内容确定的研究;③鸦胆子苦醇虽然为鸦胆子抗CRC的最重要的生物活性成分,但不能完全代表鸦胆子,因此,需要进一步的研究来探索鸦胆子体内外治疗CRC的潜在分子机制。
本研究先通过网络药理学阐明了鸦胆子抗CRC最重要的4个生物活性成分(鸦胆子苦醇、木犀草素、鸦胆子苷B、β-谷甾醇)和3个重要靶点(EGFR、Caspase-3、cyclin D1),主要作用于EGFR/ PI3K/Akt信号通路;通过分子对接技术验证了活性成分与靶点的结合能力,发现鸦胆子苦醇是鸦胆子抗CRC的关键成分;体内实验进一步证明了鸦胆子苦醇抗CRC的作用及分子机制,为鸦胆子治疗CRC提供了实验依据,并为从中药中探究活性成分、核心靶点和潜在机制提供了方法。
利益冲突 所有作者均声明不存在利益冲突
[1] Malki A, ElRuz R A, Gupta I,. Molecular mechanisms of colon cancer progression and metastasis: Recent insights and advancements [J]., 2020, 22(1): 130.
[2] Weitz J, Koch M, Debus J,. Colorectal cancer [J]., 2005, 365(9454): 153-165.
[3] Haraldsdottir S, Einarsdottir H M, Smaradottir A,. Colorectal cancer-review [J]., 2014, 100(2): 75-82.
[4] Jin J Y, Chen B, Zhan X Y,. Network pharmacology and molecular docking study on the mechanism of colorectal cancer treatment using Xiao-Chai-Hu-Tang [J]., 2021, 16(6): e0252508.
[5] Wang Q, Jiao L J, Wang S F,. Maintenance chemotherapy with Chinese herb medicine formulas. with placebo in patients with advanced non-small cell lung cancer after first-line chemotherapy: A multicenter, randomized, double-blind trial [J]., 2018, 9: 1233.
[6] Mao D, Feng L, Huang S Q,. Meta-analysis of Xihuang Pill efficacy when combined with chemotherapy for treatment of breast cancer [J]., 2019, 2019: 1-14.
[7] Liu X D, Tian S, Liu M,. Wogonin inhibits the proliferation and invasion, and induces the apoptosis of HepG2 and Bel7402 HCC cells through NF‑κB/Bcl-2, EGFR and EGFR downstream ERK/AKT signaling [J]., 2016, 38(4): 1250-1256.
[8] Ni M W, Liu X K, Meng Z Q,. A bioinformatics investigation into the pharmacological mechanisms of javanica oil emulsion injection in non-small cell lung cancer based on network pharmacology methodologies [J]., 2020, 20(1): 174.
[9] 刘志华, 陈晓燕, 袁磊, 等. 鸦胆子油乳注射液联合AP方案治疗晚期非小细胞肺癌的临床研究[J]. 现代药物与临床, 2022, 37(11): 2551-2555.
[10] Yu X Q, Shang X Y, Huang X X,. Brusatol: A potential anti-tumor quassinoid from[J]., 2020, 12(4): 359-366.
[11] Ren D, Villeneuve N F, Jiang T,. Brusatol enhances the efficacy of chemotherapy by inhibiting the Nrf2-mediated defense mechanism [J]., 2011, 108(4): 1433-1438.
[12] Guo S B, Zhang J L, Wei C R,. Anticancer effects of brusatol in nasopharyngeal carcinoma through suppression of the Akt/mTOR signaling pathway [J]., 2020, 85(6): 1097-1108.
[13] Song Q L, He Z Q, Li B,. Melatonin inhibits oxalate-induced endoplasmic reticulum stress and apoptosis in HK-2 cells by activating the AMPK pathway [J]., 2020, 19(20): 2600-2610.
[14] 邬琪, 孙薇, 王力玄, 等. 鸦胆子中苦木素类化学成分及其药理作用研究进展[J]. 中草药, 2021, 52(20): 6431-6441.
[15] Bagheri E, Hajiaghaalipour F, Nyamathulla S,. The apoptotic effects offruit extract against HT29 cells associated with p53 upregulation and inhibition of NF-κB translocation [J]., 2018, 12: 657-671.
[16] Zhang B Y, Liu G Y, Wang X,. Identification of molecular targets and potential mechanisms of Yinchen Wuling San against head and neck squamous cell carcinoma by network pharmacology and molecular docking [J]., 2022, 13: 914646.
[17] 牛明, 张斯琴, 张博, 等.《网络药理学评价方法指南》解读 [J]. 中草药, 2021, 52(14): 4119-4129.
[18] Liu J Q, Liu J, Tong X L,. Network pharmacology prediction and molecular docking-based strategy to discover the potential pharmacological mechanism of Huai Hua San against ulcerative colitis [J]., 2021, 15: 3255-3276.
[19] Zhang H P, Pan J B, Zhang C,. Network understanding of herb medicine via rapid identification of ingredient-target interactions [J]., 2014, 4: 3719.
[20] Chen H, Jiang T, Chen H,. Brusatol reverses lipopolysaccharide-induced epithelial-mesenchymal transformation and induces apoptosis through PI3K/Akt/ NF-κB pathway in human gastric cancer SGC-7901 cells [J]., 2021, 32(4): 394-404.
[21] Xie J H, Lai Z Q, Zheng X H,. Apoptotic activities of brusatol in human non-small cell lung cancer cells: Involvement of ROS-mediated mitochondrial-dependent pathway and inhibition of Nrf2-mediated antioxidant response [J]., 2021, 451: 152680.
[22] Wang T T, Dou Y X, Lin G S,. The anti-hepatocellular carcinoma effect ofoil in ascitic tumor-bearing mice: The detection of brusatol and its role [J]., 2021, 134: 111122.
Mechanism ofin treatment of colorectal cancer based on network pharmacology and molecular docking
ZHAO Wei-xin, WANG Qing, WANG Meng-qi, JI An-xuan, ZHENG Jing-ying, ZHAO Shu-hua
Department of Obstetrics and Gynecology, Second Hospital of Jilin University, Changchun 130022, China
To explore the active components, key targets and potential mechanisms ofin treatment of colorectal cancer by network pharmacology combined with molecular docking andverification.The active components, corresponding targets and colorectal cancer-related targets ofwere retrieved and collected from the public database. The active components, component-disease intersection targets and possible signal pathways ofin treatment of colorectal cancer were analyzed through network pharmacology. Binding ability of active components to target protein was predicted by molecular docking. The effect and mechanism ofactive components in treatment of colorectal cancer were further verified byexperiments.Among the 15 components that met the screening conditions, four bioactive components (brusatol, luteolin, bruceoside B, β-sitosterol) and 32 therapeutic targets ofwere screened. The epidermal growth factor receptor (EGFR), cystein-asparate protease-3 (Caspase-3) and cyclin D1 were the key targets ofin the treatment of colorectal cancer. EGFR/phosphatidylinositol 3-kinase (PI3K)/protein kinase B (Akt) signaling pathway may played an important role ofin treatment of colorectal cancer. The results of molecular docking showed that all four bioactive components could bind well, and average binding energy of brusatol with three key targets was the most negative and the binding was the most stable, which may be the most effective active component ofagainst colorectal cancer. The results of animal experiments showed that compared with control group, brusatol significantly inhibited the volume and weight of transplanted tumor in nude mice (< 0.01), down-regulated the protein expression levels of EGFR, PI3K and Akt in tumor tissues (< 0.01), down-regulated cyclin D1 and cyclin-dependent kinase 4 (CDK4) expressions (< 0.01), up-regulated the expressions of tumor cell apoptosis related protein such as cleaved Caspase-3 and B-cell lymphoma-2 associated X protein (Bax)/B-cell lymphoma-2 (Bcl-2) (< 0.01), down-regulated the expressions of migration and invasion related proteins such as matrix metalloproteinase 9 (MMP9) and MMP7 (< 0.01); There was no significant difference in liver function, renal function and blood indexes of nude mice in brusatol group.can treat colorectal cancer through multiple targets and channels, and its main active component is bruceol. Its mechanism may be related to inhibiting EGFR/PI3K/Akt signaling pathway, thus causing G1/G0phase block, inhibiting proliferation, invasion and migration, and promoting cell apoptosis.
(L.) Merr.; brusatol; colorectal cancer; network pharmacology; molecular docking; luteolin; bruceoside B; β-sitosterol; epidermal growth factor receptor; cystein-asparate protease-3; cyclin D1
R285.5
A
0253 - 2670(2023)06 - 1850 - 10
10.7501/j.issn.0253-2670.2023.06.017
2022-10-29
吉林省发展和改革委员会项目(2014G073);吉林省直厅局项目(2019SCZT040);吉林省科技厅基础处项目(20200201589JC)
赵韦欣,女,硕士,研究方向为妇产科学。Tel: 18438611878 E-mail: zhaoweixinxin@163.com
郑晶莹,博士。E-mail: zheng_jy@jlu.edu.cn
赵淑华,女,教授,硕士生导师。E-mail: zhaoshuhua-1966@163.com
[责任编辑 李亚楠]

