竹节参鲨烯环氧酶基因的克隆及生物信息学分析
李鹏飞,黄朝康,杨小林, 4,牛腾飞, 4,陈军峰, 4,赵淑娟, 3, 4,王峥涛, 3, 4,王如锋, 3, 4*
• 药材与资源 •
竹节参鲨烯环氧酶基因的克隆及生物信息学分析
李鹏飞1, 2,黄朝康1, 2,杨小林1, 2, 4,牛腾飞1, 2, 4,陈军峰1, 2, 4,赵淑娟1, 2, 3, 4,王峥涛1, 2, 3, 4,王如锋1, 2, 3, 4*
1. 上海中医药大学中药研究所,上海 201203 2. 上海中医药大学 中药新资源与品质评价国家中医药管理局重点研究室,上海 201203 3. 上海中药标准化研究中心,上海 201203 4. 上海中医药大学 中药标准化教育部重点实验室,上海 201203
克隆竹节参鲨烯环氧酶基因(squalene epoxidase,)的全长cDNA序列,进行生物信息学分析和原核表达。设计特异性引物,从竹节参中克隆得到序列;以基因序列作为输入数据,利用多序列同源比对等生物信息学分析工具进行序列分析;构建重组原核表达载体pCold-,转化至大肠杆菌BL21(DE3)中进行蛋白诱导表达;采用实时荧光定量PCR技术分析该基因在竹节参不同组织中的相对表达量。基因开放阅读框长度为1884 bp,编码627个氨基酸,PjSE蛋白相对分子质量为68 639.49,初步预测其具有跨膜结构域,可能定位在叶绿体上;聚丙烯凝胶电泳结果显示诱导表达蛋白的相对分子质量大小与预期结果一致;该基因在竹节参叶中表达量最高,须根次之,根中表达量最低。基因的克隆、生信分析及原核表达研究,不仅有助于丰富竹节参中该类功能蛋白的种类和数量,完善竹节参皂苷类成分的生物合成途径,也为后期开展竹节参皂苷的异源合成提供了可供选择的关键基因元件。
竹节参;鲨烯环氧酶;基因克隆;生物信息学分析;原核表达
竹节参是五加科植物C. A. Mey. 的干燥根茎[1],药用记载最早出现于清代《本草纲目拾遗》[2]。竹节参具有滋补强壮、散瘀止痛、止血祛痰等传统功效,被土家族和苗族等少数民族聚集区美誉为“草药之王”,常用作人参和三七的替代品[3]。竹节参与同科植物人参、西洋参、三七相似,三萜皂苷类成分(以下统称为“人参皂苷”)是其主要的药效成分。研究表明,人参皂苷具有显著的抗炎、抗肥胖、抗衰老、免疫调节和降血糖等药理作用[4],已广泛应用于临床研究与药物开发。
随着近年来对三七、人参、西洋参、竹节参等药用植物三萜代谢途径探究的不断深入[5-6],已基本阐明三萜皂苷的生物合成途径。三萜皂苷苷元母核是由法尼基焦磷酸(farnesyl-pyrophosphate,FPP)在鲨烯合成酶(squalene synthase,SQS)和鲨烯环氧酶(squalene epoxidase,SE)的逐步催化下环合而成[7]。鲨烯环氧酶是三萜皂苷生物合成途径中的限速酶之一。大量研究表明,SE的催化活性和表达量与药用植物三萜类活性成分的产量直接相关[8]。近年来已经从人参、西洋参、三七等药用植物中成功克隆得到多条基因,并开展了较为深入的研究[9],但有关竹节参SE的研究报道尚少。
本研究利用分子克隆技术获得了竹节参鲨烯环氧酶候选基因(squalene epoxidase,),对其序列进行了生物信息学分析,构建了重组原核表达载体并在大肠杆菌中实现了异源表达,同时考察了在不同组织中的相对表达量。该研究为后续开展以三萜皂苷类活性成分为导向的竹节参药用植物生源合成途径解析、分子调控及异源合成奠定了相关基础。
1 材料与试剂
1.1 材料
新鲜竹节参样品采自湖北恩施(30°02′45″N,109°50′13″E),经上海中医药大学王峥涛教授鉴定为五加科植物竹节参C. A. Mey.。标本保存于上海中医药大学中药新资源与品质评价国家中医药管理局重点研究室。
1.2 试剂
Takara Prime ScriptTM1st Strand cDNA Synthesis Kit、Ex Taq DNA Polymerase、Prime STAR Max DNA Polymerase、T4连接酶购自TaKaRa公司,限制性核酸内切酶购于赛默飞世尔科技公司,凝胶回收试剂盒和质粒小提试剂盒购于北京全式金生物技术有限公司,PCR产物纯化试剂盒购于上海捷瑞生物工程有限公司,引物由苏州金唯智生物科技有限公司合成。
2 方法
2.1 总RNA提取及cDNA合成
取约50 mg竹节参根,在液氮中将其研磨粉碎,转移至1.5 mL离心管中,利用RNA提取试剂盒提取竹节参根总RNA,用超微量紫外分光光度计检测其浓度。利用反转录试剂盒将所提取的竹节参总RNA反转录成cDNA,测定浓度,−80 ℃冻存备用。
2.2 PjSE基因克隆及重组质粒构建
根据实验室前期获得的基因序列,选择HI和I作酶切位点,设计基因特异性引物(上游引物:-F:5′-CGCGGATCCATGTTG- TTGGGCTTGGGCGTAAGAT-3′:下游引物:-R:5′-CCGCTCGAGTCAGAATTTGATGTC- ATCTGCAGGA-3′)。以反转录得到的cDNA为模板进行PCR扩增,扩增体系为:ddH2O 8.5 μL,上下游引物各0.5 μL(工作浓度10 μmol/L),cDNA模板0.5 μL,PrimeSTAR Max DNA Polymerase 10 μL;扩增程序为:98 ℃预变性3 min;再进行32个循环:98 ℃变性10 s,55 ℃退火15 s,72 ℃延伸1.5 min;最后72 ℃延伸10 min。用1%的琼脂糖凝胶电泳初步判断目的基因条带,利用PCR产物纯化试剂盒回收目的片段,经超微量紫外分光光度计检测其浓度和260/280值后,利用限制性核酸内切酶HI和I将目的片段连接至pCold表达载体,转化至大肠杆菌BL21(DE3)感受态细胞,挑取单克隆进行PCR验证和双酶切鉴定,重组质粒送基因公司测序。
2.3 PjSE基因的生物信息学分析
以基因核酸序列作为输入数据,利用开放阅读框(open reading frame,ORF) Finder查找ORF;利用ExPASy、NPS、PDBsum、Swiss-Model、TMHMM等在线工具预测基因编码蛋白的相对分子质量、氨基酸序列、等电点、不稳定系数、卷曲螺旋等理化性质,并对蛋白质二级、三级结构、磷酸化和-糖基化位点以及跨膜结构域等性质进行预测分析;同时运用ClustalW软件结合ESPript 3.x在线网站将氨基酸序列与已鉴定功能的SE氨基酸序列进行比对,利用MEGA7.0软件构建分子进化树。
2.4 PjSE基因的原核表达
挑选测序结果正确的菌株,转接至LB液体培养基(含终质量浓度50 mg/mL氨苄霉素)中,在37 ℃,220 r/min条件下培养至6000.6~0.8;加入终浓度为0.25 mmol/L的IPTG,在16 ℃,180 r/min条件下培养20 h,诱导产生PjSE重组蛋白。8000 r/min离心10 min收集菌体,将菌体悬浮于缓冲液(Tris-HCl,pH 7.4)中,采用超高压连续流细胞破碎仪破碎。细胞破碎液于4 ℃、13 000 r/min离心30 min,含有可溶性蛋白的上清液转移至洁净离心管中;取一定量缓冲液重悬沉淀,12 000 r/min离心5 min后,去除上清液,再次加入一定量缓冲液重悬沉淀。分别取10 μL上清液和沉淀重悬液装于PCR小管中,各加入2 μL SDS-PAGE蛋白上样缓冲液,煮沸3 min,制得蛋白电泳样品。采用SDS-PAGE方法检测蛋白表达情况。
2.5 PjSE基因的组织特异性表达水平分析
利用实时荧光定量PCR(qRT-PCR)检测基因在竹节参根、叶、须根中的相对表达量。选用竹节参基因作为内参基因,运用Primer Premier 5.0软件设计引物(基因上游引物:5′-CTCTTTCCATCCCACCTTTCT-3′;下游引物:5′-ATCTTGCTGTTGCTGCCTTTT-3′,基因实时荧光定量PCR上游引物:5′-GGCATCAC- ACTTTCTACAACG-3′;下游引物:5′-GGCAGG- AACATTAAAGGTTTC-3′)。提取竹节参根、叶、须根中的总RNA,反转录合成cDNA,备用,应用实时荧光定量PCR仪进行PCR扩增。反应中体系(10 μL):TB Green Premix Ex Taq II(2×)5 μL、ROX Reference Dye(50×)0.2 μL、基因上游引物0.2 μL、基因下游引物0.2 μL、cDNA 1 μL、ddH2O 3.4 μL。PCR程序:95 ℃、30 s,95 ℃、5s,60 ℃、30 s,40次循环,设置3个重复组别,绘制标准曲线来确定反应性能,运用2−ΔΔCt法来分析基因在不同组织中的相对表达量。
3 结果与分析
3.1 PjSE基因克隆与核苷酸序列分析
以反转录得到的竹节参cDNA为模板,经RT-PCR扩增得到目的片段,电泳条带约为1 884 bp,与目的基因长度相符(图1)。利用ORF Finder对基因cDNA序列进行分析,基因开放阅读框为1 884 bp,编码627个氨基酸。对PjSE蛋白序列在NCBI上进行序列比对,结果显示基因与东方苔草同源相似性为79.92%,与猕猴桃同源相似性为79.8%,与河岸葡萄同源相似性为75.61%。比对结果表明所得基因属于SE家族。
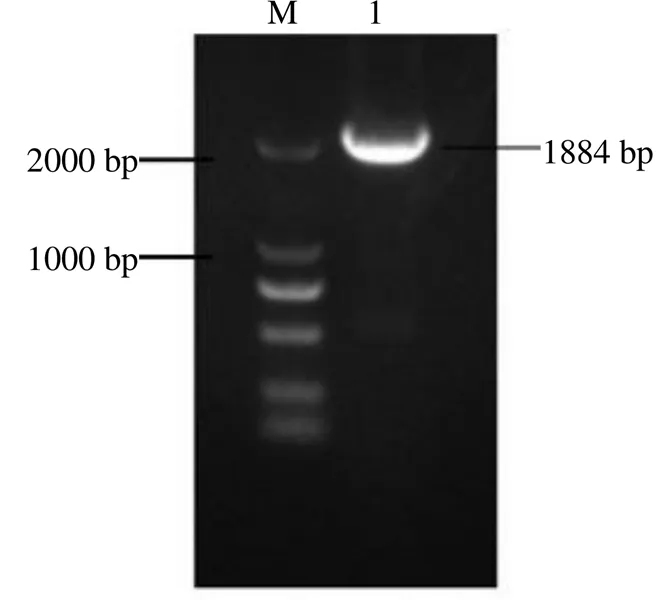
M-Marker 1-PjSE基因全长
3.2 PjSE基因编码蛋白理化性质分析
利用在线软件ExPASy对基因进行理化性质分析,结果显示PjSE相对分子质量为68 639.49,理论等电点为9.20,氨基酸残基中带负电荷的残基总数(Asp+Glu)为52,带正电荷的残基总数(Arg+Lys)为68。蛋白不稳定指数为41.85,可初步判定为不稳定蛋白;脂肪指数为92.57,亲水性总平均值为−0.068,疏水氨基酸的数量多于亲水氨基酸的数量,可初步推断其为疏水蛋白(图2)。
3.3 PjSE蛋白结构功能域和跨膜结构域预测
Conserved domains在线工具分析表明,PjSE在保守区含有1个PLN02985超家族保守结构域,属于SE超家族,推测具有催化鲨烯形成2,3-氧化鲨烯的功能(图3-A)。HMHMM在线工具预测蛋白跨膜结构结果显示,PjSE含有显著的跨膜螺旋区,属于跨膜蛋白(图3-B)。
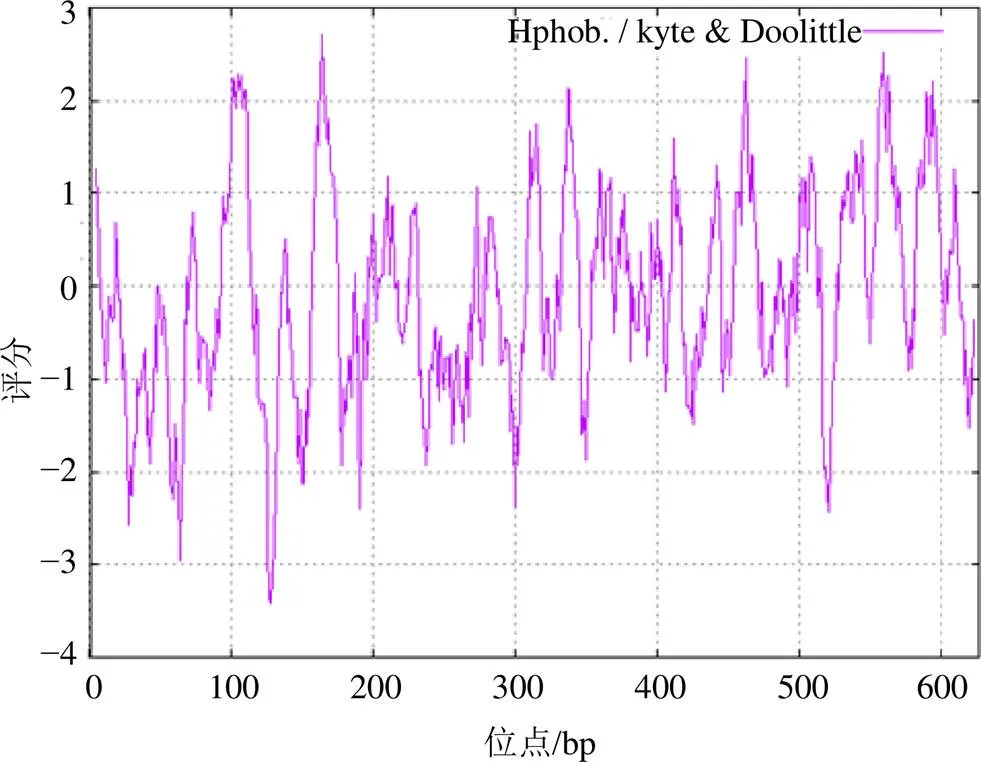
图2 PjSE氨基酸序列的亲水/疏水性质
3.4 PjSE蛋白信号肽分析及亚细胞定位预测
SinalP5.0预测分析PjSE信号肽结果显示,预测存在信号肽的概率仅为0.07%,PjSE不存在信号肽,属于非分泌蛋白,推测该蛋白合成后不发生转运(图3-C)。Plant-mPLoc亚细胞定位预测结果表明,该蛋白可能定位于叶绿体上。
3.5 氨基酸翻译后磷酸化和糖基化修饰
利用在线工具NetPhos 3.1预测竹节参基因编码蛋白中3类氨基酸(Ser、Thr、Tyr)磷酸化位点,结果显示PjSE蛋白中存在62个潜在的氨基酸磷酸化位点(4个酪氨酸磷酸化位点,32个可能的丝氨酸磷酸化位点,26个可能的苏氨酸磷酸化位点),潜在的磷酸化位点在酶发挥功能过程中或可起到重要作用。通过NetNGlyc-1.0预测,处于47、55、118和289位的天冬氨酸可能需要进行-糖基化修饰。
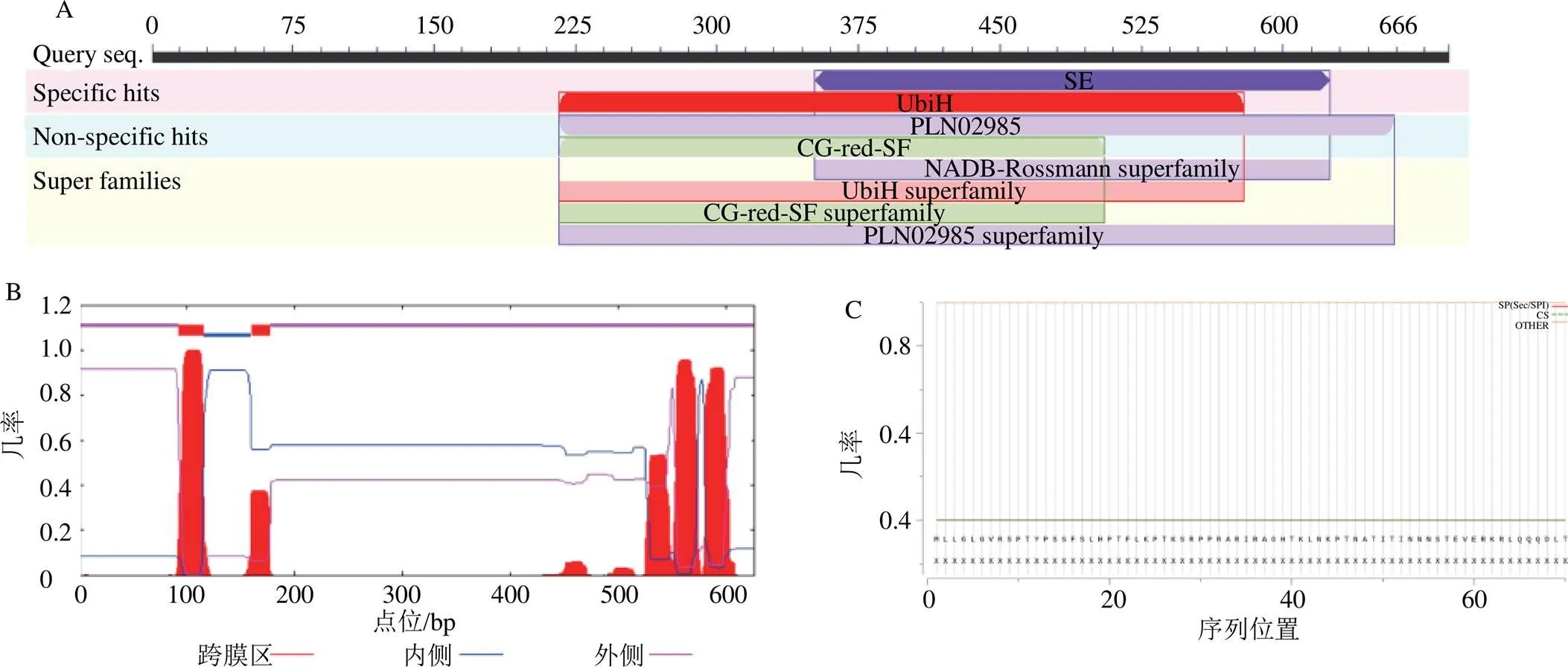
图3 PjSE的结构功能域(A)与跨膜结构域(B) 以及信号肽预测(C)
3.6 PjSE蛋白二级和三级结构分析
如图4所示,PjSE蛋白的二级结构元件中无规卷曲所占的比例最高,有254个氨基酸,占40.51%;α-螺旋包含218个氨基酸,占34.77%;延伸链占据114个氨基酸,为18.18%;β折叠所占比对最低,为6.54%,包含41个氨基酸(图4-A)。
利用SWISS-MODEL在线工具结合PyMOL软件预测得到PjSE蛋白的三维空间模型及活性中心(红色球形结构示意酶的活性中心氨基酸),以人的SE(Human squalene epoxidase,PDB:6c6n.1.A)作为同源模板,氨基酸相似性为47.77%,全球性模型质量评分为0.6(图4-B、4-C)。
利用autodock 4.2.6对PjSE与其主要底物角鲨烯进行分子对接模拟实验。如图4-D和图4-E显示,鲨烯与PjSE中的Asp216、Glu220残基通过氢键连接,且氢键键程均在0.22 mm以内,推测这2个氨基酸可能为PjSE蛋白识别底物小分子并结合的关键氨基酸残基。
3.7 PjSE的氨基酸序列同源比对和系统进化树构建
ESpript 3.0在线工具序列同源比对显示,PjSE氨基酸序列与来源于五加科植物的人参SE(BAD15330.1)、三七SE(ABE73759.1)、西洋参SE(AGK62448.1)的同源性分别为57.04%、56.23%、56.32%;与黄芪SE(AKO83630.1)的同源性为58.76%。图5所示,与其他植物中的SE一样,PjSE也具有保守的NAD(P)结合结构域和底物结合结构域。为预测竹节参SE蛋白的进化关系,在NCBI数据库中选择了来源于不同植物的SE的序列,利用MEGA 7.0软件在bootstrap重复次数为1000次的参数下构建Neighbor-joining系统进化树,结果表明竹节参PjSE和烟草SE蛋白序列关系更为亲近(图6)。

图4 PjSE的二级结构(A)、三级结构(B,C) 和角鲨烯与PjSE分子对接结果(D,E)

图5 竹节参、黄芪、西洋参、楤木、人参和三七SEs氨基酸序列同源性比对

图6 PjSE的系统进化树
3.8 PjSE基因的异源表达
重组菌株表达后收集菌体并进行破碎裂解,取上清液和沉淀重悬液进行SDS-PAGE电泳,结果(图7)显示,经IPTG诱导后的重组表达菌株上清液中出现明显的目的蛋白条带,表明蛋白原核表达成功,且为可溶性蛋白。

M-Marker 1-PjSE上清液 2-PjSE沉淀 3-空载pCold
3.9 竹节参不同部位的PjSE基因表达差异分析
运用qRT-PCR检测竹节参根、叶、须根的基因表达差异。结果显示,基因在竹节参各个组织中均有表达,基因在叶中表达量最高,须根中其次,在根中的表达量最低(图8)。
4 讨论
竹节参中主要药效成分为人参皂苷类成分,该成分主要是通过相关酶对前体物质2,3-氧化鲨烯进行环化、羟基化和糖基化等催化反应而最终合成[11-12]。SE处于人参皂苷生物合成途径的关键节点,SE催化生成的2,3-环氧鲨烯是合成人参皂苷的重要底物,因此在人参皂苷合成途径中发挥重要作用。目前已经从人参、三七等多种药用植物中成功克隆出基因的cDNA序列,并对其调控机制做了大量研究[13]。的表达和皂苷含量直接相关,Choi等[14]在对人参基因组的研究中揭示了鲨烯环氧酶基因的表达量与人参皂苷产量直接相关;Xu等[15]和Han等[16]分别利用化学分离和RNA干扰技术抑制了SE的转录、表达后,证实基因在一定程度上调控了人参皂苷的生物合成。上述研究证实鲨烯环氧酶在皂苷生物合成途径中占据十分重要的地位。

图8 PjSE在竹节参不同组织中的相对表达水平
目前,有关竹节参中基因报道甚少,仍有待进一步拓展挖掘。本研究通过对竹节参基因的克隆及生物信息学分析,挖掘得到一个未经报道的基因,PjSE蛋白具有SE所特有的保守结构域结合位点,可与多种酶结合反应,证实PjSE属于SEs家族[17-18]。序列分析发现PjSE与其他物种的基因具有较高的相似性,相似度均在50%以上,其中与烟草的亲缘关系最高。本研究进一步丰富了药用植物竹节参的基因库,也为竹节参中人参皂苷类成分的生物合成途径解析提供了一定参考。同时本研究还探讨了该基因的原核异源表达体系,构建了重组质粒pCold-PjSE,在大肠杆菌BL21(DE3)中存在可溶性蛋白表达,这为进一步研究基因的分子机制和蛋白功能验证奠定基础。此外,在拟南芥等多种植物中SE的功能研究均采用了酵母系统[19],后续亦可尝试在酵母或植物体内验证PjSE的功能。
近年来,研究人员已经从三七、滇重楼、远志、雷公藤等药用植物中利用qRT-PCR技术证实了SE基因在不同器官中具有不同表达模式[20]。基于以上研究,本实验选取竹节参根、叶和须根3个不同组织作为研究对象,探究了基因的组织特异性表达情况,实验发现基因在叶中表达量最高,不同组织中表达量存在较明显的差异,这为后续考察基因空间表达情况与对应次生代谢产物含量之间的相关关系研究奠定了一定基础,为深入揭示竹节参药用植物中SE在三萜皂苷生物合成途径中的时空分布规律与关键作用机制提供有利线索。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典[S]. 一部. 2020: 126.
[2] 清·赵学敏. 本草纲目拾遗: 十卷[M]. 影印本. 北京: 人民卫生出版社, 1957: 7475.
[3] 马玲, 谭德福. 竹节参的研究概况 [J]. 时珍国医国药, 2005, 16(12): 1306-1307.
[4] 向婷婷, 张长城, 刘朝奇, 等. 竹节参总皂苷干预自然衰老大鼠肝脏炎症的实验研究 [J]. 中国药理学通报, 2017, 33(6): 848-853.
[5] 罗祖良, 张凯伦, 马小军, 等. 三萜皂苷的合成生物学研究进展 [J]. 中草药, 2016, 47(10): 1806-1814.
[6] 陈颖, 孙海燕, 曹银萍. 三萜皂苷生物合成途径研究进展 [J]. 中国野生植物资源, 2012, 31(6): 15-17.
[7] Devarenne T P, Ghosh A, Chappell J. Regulation of squalene synthase, a key enzyme of sterol biosynthesis, in tobacco [J]., 2002, 129(3): 1095-1106.
[8] 吴君贤, 徐睿, 尹旻臻, 等. 山楂果实转录组分析及三萜合成关键酶基因SQE的克隆与生信分析 [J]. 药学学报, 2021, 56(12): 3313-3324.
[9] He F, Zhu Y, He M,. Molecular cloning and characterization of the gene encoding squalene epoxidase in[J]., 2008, 19(3): 270-273.
[10] Paek K Y, Chakrabarty D, Hahn E J. Application of bioreactor systems for large scale production of horticultural and medicinal plants [J]., 2005, 81(3): 287-300.
[11] Yao L, Lu J, Wang J,. Advances in biosynthesis of triterpenoid saponins in medicinal plants [J]., 2020, 18(6): 417-424.
[12] Yan X, Fan Y, Wei W,. Production of bioactive ginsenoside compound K in metabolically engineered yeast [J]., 2014, 24(6): 770-773.
[13] 明乾良, 韩婷, 黄芳, 等. 人参皂苷生物合成途径及其相关酶的研究进展 [J]. 中草药, 2010, 41(11): 1913-1917.
[14] Choi D W, Jung J, Ha Y I,. Analysis of transcripts in methyl jasmonate-treated ginseng hairy roots to identify genes involved in the biosynthesis of ginsenosides and other secondary metabolites [J]., 2005, 23(8): 557-566.
[15] Xu X J, Hu X Y, Neill S J,. Fungal elicitor induces singlet oxygen generation, ethylene release and saponin synthesis in cultured cells ofC. A. Meyer [J]., 2005, 46(6): 947-954.
[16] Han J Y, In J G, Kwon Y S,.Regulation of ginsenoside and phytosterol biosynthesis by RNA interferences of squalene epoxidase gene in[J].2010, 71(1):36-46.
[17] 陈观水, 林思妮, 柯兰兰, 等. 太子参鲨烯环氧酶基因的克隆及其表达分析 [J]. 中草药, 2017, 48(13): 2733-2739.
[18] Gomelsky M, Klug G. BLUF: A novel FAD-binding domain involved in sensory transduction in microorganisms [J]., 2002, 27(10): 497-500.
[19] Rasbery J M, Shan H, LeClair R J,.squalene epoxidase 1 is essential for root and seed development [J]., 2007, 282(23): 17002-17013.
[20] 梁娥. 竹节参内生细菌多样性与鲨烯环氧酶基因(SE)克隆及生物信息学分析 [D]. 贵阳: 贵州师范大学, 2020.
Cloning and bioinformatics analysis offrom
LI Peng-fei1, 2, HUANG Chao-kang1, 2, YANG Xiao-lin1, 2, 4, Niu Teng-fei1, 2, 4,CHEN Jun-feng1, 2, 4, ZHAO Shu-juan1, 2, 3, 4, WANG Zheng-tao1, 2, 3, 4, WANG Ru-feng1, 2, 3, 4
1. Institute of Chinese Materia Medica, Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China 2. The NATCM Key Laboratory for New Resources & Quality Evaluation of Chinese Medicine, Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China 3. Shanghai R&D Center for Standardization of Traditional Chinese Medicines, Shanghai 201203, China 4. The MOE Key Laboratory for Standardization of Chinese Medicines, Shanghai University of Traditional Chinese Medicine Shanghai 201203, China
To clone the full-length cDNA sequence (squalene epoxidase,) of Zhujieshen (), and perform bioinformatics analysis and prokaryotic expression.Specific primers were designed to clone the cDNA sequence offromUsing thegene sequence as input data, sequence analysis was performed using bioinformatics analysis tools such as multiple sequence homology alignment. The prokaryotic expression vector of pCold-was constructed and transformed inBL21 (DE3) competent cells to express recombinant protein. The relative expression ofin different tissues ofwere further determined by quantitative real-time PCR (qRT-PCR).The open reading frame ofwas 1884 bp, encoding 627 amino acids. The relative molecular mass of PjSE was 68639.49. PjSE was predicted to have a transmembrane domain that was most likely to be located in chloroplast. SDS-PAGE showed the relative molecular mass of induced expression protein was consistent with expected protein size. Furthermore, the expression level ofwas completely different in various parts of. The associated results were as follows: the highest in leaves, the second in fibrous root, and the lowest in root.The cloning, bioinformatics analysis and prokaryotic expression ofwill be helpful to enrich the variety and quantity of related functional proteins from, supplement to the biosynthetic pathways of chikusetsusaponins, and provide useful functional gene modules for heterologous biosynthesis in the future.
C. A. Mey.; squalene epoxidase; gene cloning; bioinformatics analysis; prokaryotic expression
R286.12
A
0253 - 2670(2023)06 - 1917 - 07
10.7501/j.issn.0253-2670.2023.06.024
2022-08-09
上海市自然科学基金项目(20ZR1458200);上海市“科技创新行动计划”启明星项目(20QA1408800);上海中医药大学预算内项目(2020LK015)
李鹏飞,硕士研究生,主要从事天然产物生物合成与转化研究。Tel: 18817338926 E-mail: 13984532089@163.com
王如锋,副研究员,主要从事中药资源与生物技术研究。Tel: (021)51322495 E-mail: wrffrw0801@163.com
[责任编辑 时圣明]

