丛枝菌根真菌接种对白车轴草耐盐性的影响
赵艳兰,曾鑫奕,弓晋超,李香君,李旭旭,刘珊,张新全,周冀琼
(四川农业大学草业科技学院,四川 成都 611130)
土壤盐渍化已成为我国农业可持续发展的限制因素之一[1]。当土壤盐含量累积超过0.3%时,农作物的正常生长发育就会受到影响,导致作物低产或不能生长[2]。我国盐渍土壤范围广,面积约9.9133×107hm2,占世界盐渍土面积的10%[3],在土壤中存在各种盐类,其中氯化钠(NaCl)是最普遍的一种[4]。近年来,全球气候变化剧烈,人类活动频繁,耕地盐渍化面积日益增长,加剧了耕地资源紧缺,因此,盐渍土的改良与合理利用成为亟须解决的科学问题[5-6]。
种植耐盐植物,作为一种重要的改良技术可提高盐渍土的生产能力。白车轴草(Trifolium repens)是一种常见的栽培豆科牧草,营养丰富,观赏价值高,可作为牧草栽培、城市绿化、堤岸防护以及药材等[6]。但白车轴草耐盐性差,这在一定程度上限制了其在盐渍土壤上的栽种应用[6-7]。
丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)在土壤中广泛存在,能够在各种各样的生态环境中生长,与世界上大多数的植物形成互惠共生结构[8-9],AMF 进入植物根皮层细胞后侵染植物形成丛枝菌根[10-11],根外菌丝体不断扩大植物根系养分吸收范围,增加养分的吸收效率[12],减轻因盐害造成的损伤,提高植物耐盐性,对植物的生长有促进作用[13-14]。
通过接种AMF 可以提高不同寄主植物的耐盐能力[15],与非盐生植物相比,AMF 和盐生植物具有更高效的共生关系[16]。利用丛植菌根真菌提高植物耐盐性已成为改良盐渍土绿色高效的生物方法之一[2]。研究发现,AMF 主要通过3 个途径提高植物耐盐性:1)通过辅助植物细胞调节体内离子平衡,使细胞内以及细胞间的离子浓度维持在适当的水平[17];2)通过调节植物体内渗透平衡,增加渗透调节物质含量,缓解盐害对植物造成的缺水损伤,维持植物体内正常生理生化过程[18-19];3)通过调节植物抗氧化过程,增强抗氧化能力,降低功能性损害,抵御盐害对植物组织造成的损伤[20-21]。AMF 在促进植物对土壤养分吸收的同时,还能提高土壤微生物的活性,改良盐渍土质量[22]。不少研究证明,AMF 对水果、蔬菜、作物、牧草等[1]具有缓解盐胁迫的作用,但也有一些研究报道,接种AMF 对植物耐盐性并没有显著影响。如Poss 等[23]的研究表明,在盐胁迫条件下,接种了AMF 的洋葱(Allium cepa)在不同水平的磷含量条件下,并不总是促进洋葱的生长发育,在施磷量水平为0.8 和1.6 mol·L-1时,接种与未接种AMF 的洋葱干重没有显著差异,甚至个别未接菌植株干重高于接菌植株[11]。因此,接种AMF 对不同植物或物种的耐盐性影响尚存争议。本试验拟通过温室模拟试验,研究在盐胁迫条件下,接种AMF 对拉丁诺白车轴草生长、抗性机能及生理调节能力的影响,以期提高白车轴草生产性能,为菌根技术的改良及其在盐渍地绿化中的应用提供论据。
1 材料与方法
1.1 试验设计
盆栽试验于2019年5-9 月在四川农业大学成都校区日光温室大棚中进行。采用双因素试验设计,因素1 为AMF 接种,包括两个水平:接种AMF 和不接种AMF;因素2 为盐胁迫,包括两个水平:盐胁迫和无盐胁迫。共有4 个处理,分别为:CK(不接种AMF,无盐胁迫处理);M(接种AMF,无盐胁迫处理);S(不接种AMF,150 mmol·L-1NaCl 胁迫处理);MS(接种AMF,150 mmol·L-1NaCl 胁迫处理)。每个处理重复3 次,共12 盆。
1.2 试验方法
1.2.1 供试草种 拉丁诺白车轴草,购买于四川百绿时代园林绿化有限公司。
1.2.2 育苗 2019年5 月20 日进行白车轴草育苗。选取均匀、饱满、无病虫害的白车轴草草种,用75%的酒精浸泡2 min,蒸馏水冲洗3~5 遍,在灭菌的蛭石上发芽,每隔一天浇水一次[24]。
1.2.3 土壤基质准备 试验土壤采集于四川农业大学教学科研园区,该地年降水量1012 mm,年日照时数1161 h,年均温15.9 ℃,无霜期238 d,属于亚热带湿润季风气候[24]。主要种植的有白车轴草,红三叶(Trifolium pratense),鸭茅(Dactylis glomerata)等多年生豆禾牧草。将原位土与河砂以3∶1 的比例混合均匀,过2 mm 网筛,去除石头和植物残根,放入121 ℃高压蒸汽灭菌锅灭菌2 h,冷却备用[25]。
1.2.4 接种AMF 用未经灭菌的原位土砂混合基质作为接种菌剂。经测定,每20 g 基质包括有124 个AMF孢子,满足接种要求。经高通量测序,原位AMF 菌剂中包括根孢囊霉属(Rhizophagus)和内养囊霉属(Entrophospora)等多种AMF 菌种,可与白车轴草建立共生关系[24]。将种苗移栽到圆形塑料花盆中。用75%的酒精擦洗塑料花盆(18.0 cm×21.5 cm)并晾干,保证其无菌洁净。用未灭菌的土砂混合基质作为AMF 接种处理;用高压灭菌后土砂混合基质作为不接菌处理,并加入100 mL 除去AMF 的土壤微生物群落滤液。该滤液的提取方法为:将水和未灭菌土壤以2∶1 的比例混合并充分搅拌,然后过25 μm 的网筛,研究表明,AMF 的孢子体积大于25 μm,但细菌等其他微生物的体积小于25 μm[26],因此得到的滤液为不含AMF 的土壤滤液。为保持一致,在每盆接种AMF 的处理中加入100 mL 的无菌水。
1.2.5 种苗移栽 种子萌芽25 d 后,将幼苗移栽。每盆移栽15 株长势相同的幼苗,移栽时将各幼苗分布均匀。移栽后于大棚内进行培育,白天温度为(25±1)℃,夜间温度为(15±1)℃。移栽一周后,长势不好的幼苗用长势良好的幼苗进行替换。移栽一个月后每周用Hoagland 培养液补充营养。Hoagland 培养液配方:2.5 mmol·L-1Ca(NO3)2、2.5 mmol·L-1KNO3、1 mmol·L-1MgSO4、0.5 mmol·L-1(NH4)H2PO4、0.1 mmol·L-1EDTA-FeNa、0.2 μmol·L-1CuSO4、1 μmol·L-1ZnSO4、20 μmol·L-1H3BO3、0.005 μmol·L-1(NH4)6Mo27O4和1 μmol·L-1MnSO4[27]。
1.2.6 盐胁迫处理 幼苗生长72 d 时,进行盐胁迫处理。有研究表明,低浓度的NaCl 盐溶液对白车轴草生长具有促进作用,而大于40 mmol·L-1的盐溶液会抑制其生长,盐浓度越高,抑制作用越显著[28-29]。因此本研究用NaCl 配制150 mmol·L-1的盐溶液,对白车轴草进行盐胁迫处理。连续7 d,每天浇50 mL 溶液进行盐胁迫,未胁迫处理浇相同体积的蒸馏水。
1.3 测定指标及方法
1.3.1 白车轴草基本生长性能 待盐胁迫处理15 d 后收获植株,收获前对植物株高进行测量,收获后于105 ℃杀青30 min,然后于65 ℃烘干48 h 至恒重,用电子天平测定白车轴草干重[27]。
1.3.2 叶片相对含水量(relative water content,RWC) 采用烘干法[30]:白车轴草植株收获后,每组处理选取长势一致的白车轴草叶片,剪取约0.1 g 的新鲜叶片,称取鲜重Wf,用普通吸水纸包好,浸入蒸馏水中,避光静置24 h 后取出擦干表面水分称重,记为白车轴草叶片饱和重量(Wt);然后将叶片烘干至恒重,记为白车轴草叶片干重(Wd)。可得RWC=。
1.3.3 叶绿素荧光的测定(PSⅡ最大光能转换效率Fv/Fm) 采用叶绿素荧光系统(Pocket PEA)测定叶绿素荧光参数F0、Fm:测定前对叶片进行30 min 暗处理,先打开测量光测叶片的最小荧光F0,再打开饱和脉冲光测最大荧光Fm[32],计算可变荧光Fv=Fm-Fo[33]。
1.3.4 丙二醛(malondialdehyde,MDA)及电导率(electrolyte leakage,EL) 丙二醛采用硫代巴比妥酸法测定[34]:称取0.4 g 新鲜植物样品,将组织放入液氮研磨破碎,然后加入磷酸缓冲液在冰上充分研磨,转入离心管中,离心后用上清液测定丙二醛含量。植物细胞膜透性通常用相对电导率[35](EL)来表示:剪取白车轴草新鲜洁净叶片0.1 g,用纸包好浸没在装有蒸馏水的试管中,放置24 h 测定初电导率S1。在水浴锅中煮沸直到植物组织完全被杀死后冷却至室温,测定终电导率S2。相对电导率为。
1.3.5 可溶性糖(soluble sugar,SS)和游离脯氨酸(free proline,Pro) 可溶性糖含量采用蒽酮乙酸乙酯比色法测定[36]:称取植物样品0.3 g,加入研钵中,加入蒸馏水和石英砂,研磨后转入试管,放入沸水中水浴,过滤定容,加入蒸馏水,蒽酮和浓硫酸后,在波长620 nm 处比色。采用酸性茚三酮比色法测定游离脯氨酸含量[31]:剪取白车轴草新鲜洁净叶片0.2 g,加入3%的磺基水杨酸溶液5 mL,沸水浴10 min。提取2 mL 上清液,再分别加入2 mL 冰醋酸和2 mL 酸性茚三酮溶液,煮至沸腾30 min。待其冷却,加入4 mL 甲苯溶液,充分振荡30 s,静止片刻后用吸管吸取上层液体至比色杯中,在520 nm 波长处进行比色。
1.4 数据分析与处理
采用Excel 2010 对数据进行统计;用SPSS 24.0 进行方差分析和显著性检验(P<0.05)。分析接种AMF、盐胁迫对白车轴草生长及生理指标相对含水量、相对电导率、PSⅡ最大光能转换效率、可溶性糖、游离脯氨酸、丙二醛含量的影响。用Sigmaplot 12.0 进行绘图,用Canoco 5 进行主成分分析。
2 结果与分析
接种AMF 和盐胁迫均不同程度地对白车轴草的株高、相对电导率、PSⅡ最大光能转换效率、相对含水量、可溶性糖和游离脯氨酸含量产生了显著影响,但二者的交互作用对所有测定指标均无显著影响(表1)。

表1 丛枝菌根真菌及盐胁迫对白车轴草的主要形态和生理指标的方差分析Table 1 Analysis of variance of main morphological and physiological indicators of T.repens by AMF and salt stress
2.1 盐胁迫下AMF 对白车轴草生长情况的影响
白车轴草在盐渍土壤中生长受阻,而接种AMF可缓解盐胁迫造成的影响(表2)。与对照相比,盐胁迫S 处理下白车轴草株高和干重均显著降低,分别下降了49.93%和51.39%,AMF 的接种缓解了盐胁迫毒害作用,白车轴草生长指标均显著提高,株高提高了84.73%,干重增加了5.15 倍。在未胁迫处理下,接种AMF 后白车轴草株高和干重相比对照分别提高了34.85%和2.14 倍。
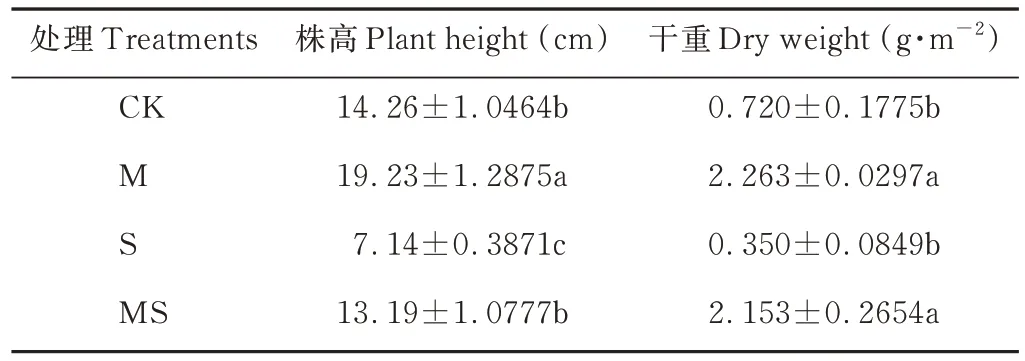
表2 盐胁迫下AMF 对白车轴草生长情况的影响Table 2 Effects of AMF on the growth of T. repens under salt stress
2.2 盐胁迫下AMF 对白车轴草叶片丙二醛含量和相对电导率的影响
盐胁迫显著影响了白车轴草的丙二醛含量和相对电导率(P<0.05),接种AMF 显著影响了相对电导率(P<0.001)(表1)。与CK 相比,盐胁迫S 处理下,丙二醛含量提高了67.84%,相对电导率提高了35.62%,接种AMF 后,丙二醛和相对电导率分别降低了21.60%和29.25%。未胁迫处理下,与CK 相比,接种AMF 丙二醛和相对电导率分别降低了16.96%和33.15%(图1)。
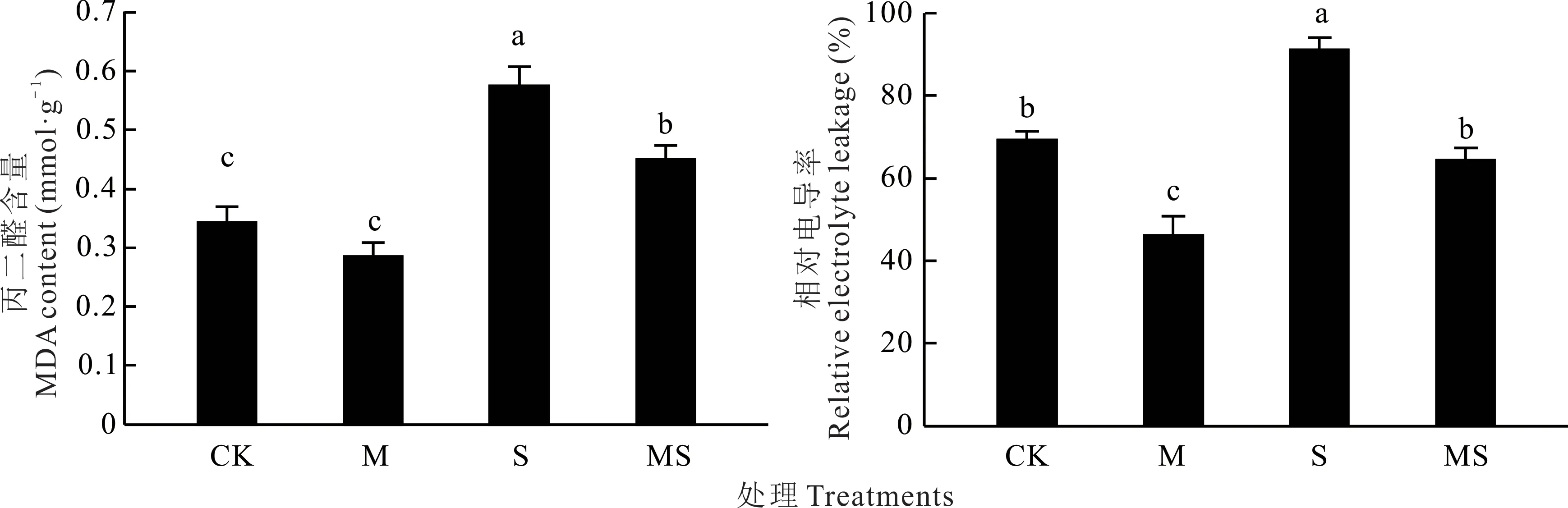
图1 盐胁迫下AMF 对白车轴草叶片丙二醛含量和相对电导率的影响Fig.1 Effects of AMF on malondialdehyde content and relative electrolyte leakage of T. repens leaves under salt stress不同小写字母代表不同处理间差异显著(P<0.05),下同。Different lowercase letters indicate significant differences among different treatments at the 0.05 level,the same below.
2.3 盐胁迫下AMF 对白车轴草PSⅡ最大光能转换效率和相对含水量的影响
由表1 可知,盐胁迫显著影响了PSⅡ最大光能转换效率和相对含水量(P<0.05),接种AMF 极显著影响了PSⅡ最大光能转换效率(P=0.001)。与CK 相比,在盐胁迫处理下,PSⅡ最大光能转换效率增加了7.14%,相对含水量降低了7.46%,接种AMF 后,PSⅡ最大光能转换效率增加了5.53%,相对含水量增加了5.33%。未胁迫处理下,与CK 相比,接种AMF 后,PS Ⅱ最大光能转换效率增加了9.34%,相对含水量增加了2.26%(图2)。
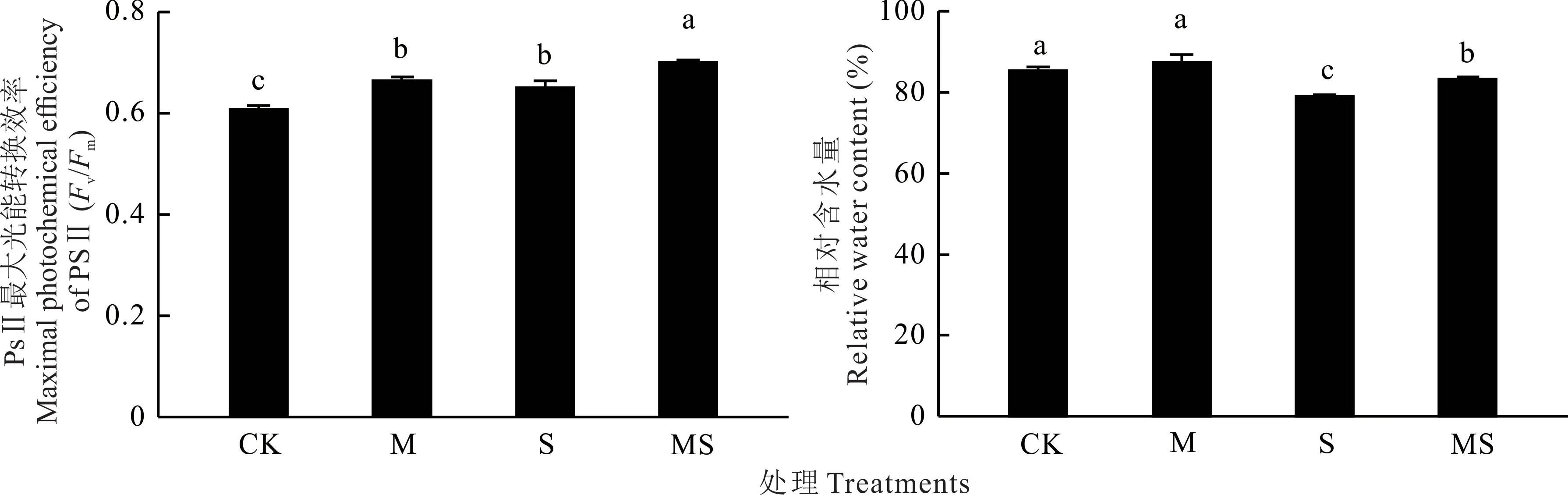
图2 盐胁迫下AMF 对白车轴草PSⅡ最大光能转换效率和相对含水量的影响Fig.2 Effect of AMF on maximal photochemical efficiency of PSⅡand relative water content of T. repens under salt stress
2.4 盐胁迫下AMF 对白车轴草渗透调节物质的影响
盐胁迫和AMF 接种对白车轴草的渗透调节物质脯氨酸和可溶性糖含量都有显著影响。与CK 相比,在盐胁迫处理下,可溶性糖含量提高了33.51%,游离脯氨酸含量显著增加了79.83%。接种AMF 后,可溶性糖含量和游离脯氨酸含量更大,分别增加了32.03%和9.42%。未胁迫处理下,与CK 相比,接种AMF,可溶性糖和游离脯氨酸含量分别增加了24.06%和38.25%(图3)。
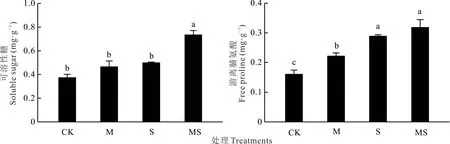
图3 盐胁迫下AMF 对白车轴草可溶性糖和游离脯氨酸的影响Fig.3 Effect of AMF on soluble sugar and free proline of T. repens under salt stress
2.5 盐胁迫下AMF 对白车轴草各变量的主成分分析
通过主成分分析检验白车轴草在盐胁迫下接种AMF 对各变量的影响。第1 主成分和第2 主成分分别解释了所有变量变异比率的82.22%和12.07%。本研究发现,在坐标轴1 中均占有较高载荷(载荷>|0.5|)的变量主要有株高,干重,丙二醛,相对电导率和相对含水量,在坐标轴2 中占有较高载荷的变量主要有PSⅡ最大光能转换效率Fv/Fm,可溶性糖和游离脯氨酸。从结果可知,株高和相对含水量存在正相关关系,PSⅡ最大光能转换效率Fv/Fm和可溶性糖存在正相关关系。接种AMF 对植物株高和相对含水量具有重要影响,盐胁迫对相对电导率的影响最大。盐胁迫后接种AMF 对PSⅡ最大光能转换效率Fv/Fm和可溶性糖含量不同的处理分别分布在不同的象限,说明不同的处理之间存在显著差异(表3 和图4)。
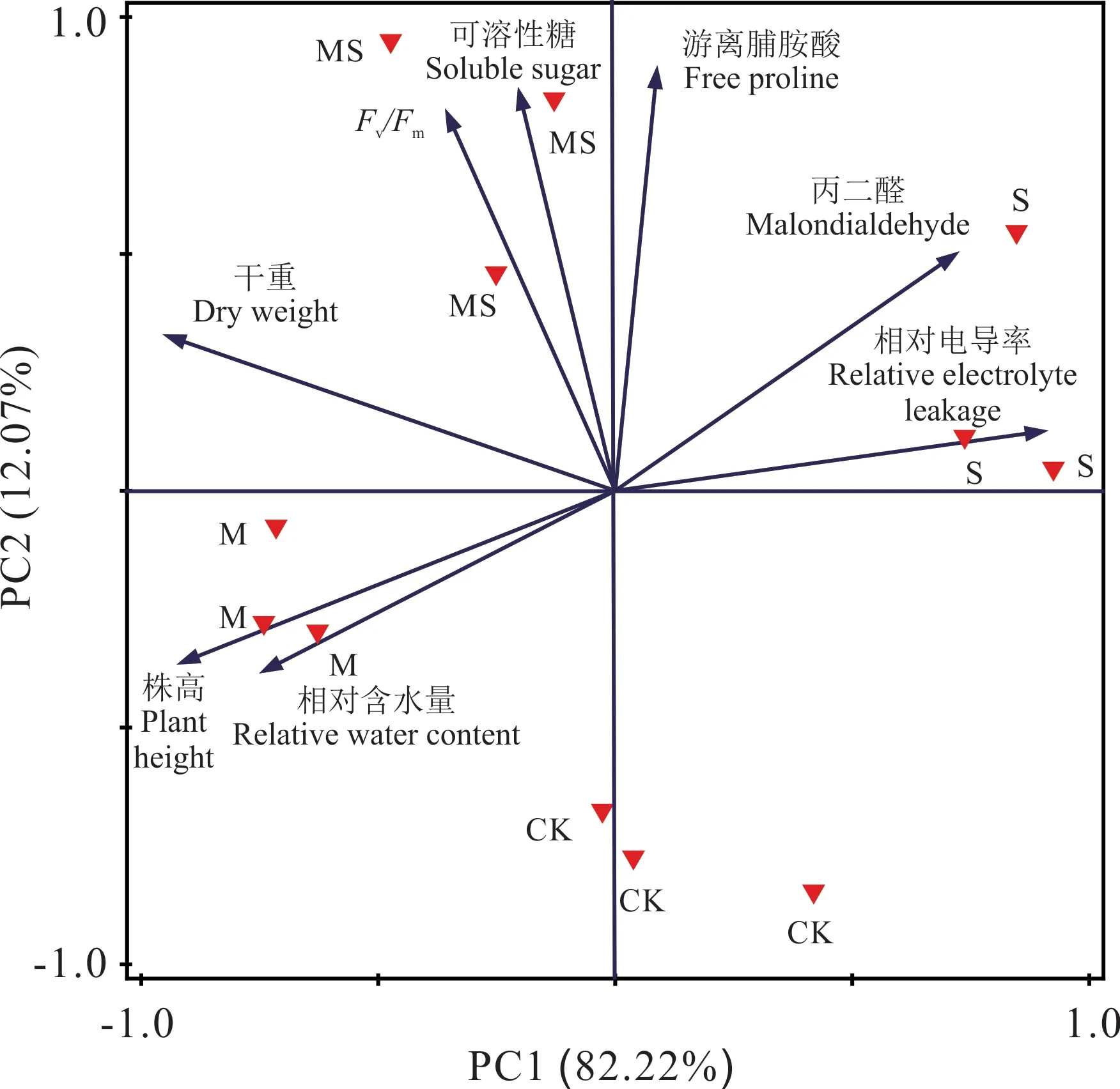
图4 盐胁迫下接种AMF 对白车轴草所有变量影响的主成分分析Fig. 4 Principal component analyses(PCA)of the effect of T. repens under salt stress inoculation with AMF

表3 PCA 中各变量的载荷Table 3 Variable scores values from PCA
3 讨论
许多研究证明,盐胁迫会抑制植物生长发育,使其 生 理 生 化 过 程 紊 乱[37-39]。杨 宏 伟 等[40]在 盐 胁 迫(NaCl)对藜麦(Chenopodium quinoa)种子萌发和幼苗生理特性影响的研究中发现,高浓度氯化钠使植物叶片含水量,脯氨酸,丙二醛和相对电导率等降低,本研究结果与此相符合。在本试验中,盐胁迫下植物株高和生物量显著降低,这说明盐胁迫对白车轴草的生长发育起到了抑制作用,但植物形态变化相对于生理变化具有滞后性。当植物细胞在遭受盐渍环境损伤时,细胞半透膜正常结构和功能遭到破坏,内容物质大量外渗,导致相对电导率增高、膜脂过氧化物丙二醛含量大量累积,从而干扰细胞的正常生命活动。土壤中盐浓度的增加,也会导致植物外部的渗透压降低,植物为了维持细胞渗透压平衡,通过积累渗透调节物质,减少自身的水分流失[41]。因此,为了抵抗盐害,白车轴草通过积累游离脯氨酸和可溶性糖,维持渗透平衡,体现出一定的抗盐性。盐胁迫在影响植物渗透压的同时,还会通过影响植物的其他信号通路来影响细胞的生长,导致生长发育速度滞缓,植株萎蔫甚至死亡[42]。
接种AMF,可提高盐渍土质量,改善宿主植物的生长环境,同时加快植物吸收生长所必需的营养元素,重新建立植物体内新的离子平衡,减少盐胁迫的不利影响,提高植物耐盐性[3]。李丽丽[31]的研究结果表明,接种AMF 增加了盐碱胁迫下的白车轴草的个体生物量,蛋白质含量和光合速率等指标,说明接种AMF 提高了白车轴草的耐盐能力,本研究结果与此一致。本试验接种AMF 真菌后,白车轴草的株高和干重都得到了显著提升。研究表明,AMF 也可能为宿主植物提供生长因子和激素,来改善植物的生长[43]。这验证了AMF 与白车轴草形成的共生关系会促进白车轴草的生长发育[44-45]。
细胞膜是细胞最重要的防护系统,丙二醛和相对电导率是衡量细胞膜受伤程度的重要指标,盐胁迫会影响植物活性氧的自由基平衡,过量的自由基导致膜脂过氧化,生成丙二醛等,损害生物膜[46]。相对电导率越大说明细胞受到伤害越大。本试验中,接种AMF 后,丙二醛含量和相对电导率均显著降低,AMF 对于白车轴草的生长产生了正向效应。这表明AMF 与白三叶形成共生体系后,细胞膜破坏程度减轻,膜透性降低,缓解了盐胁迫对白三叶的负效应[47]。
植物相对含水量是表征植物生长状况的重要指标,本研究中,接种AMF 后,相对含水量显著增加。这可能是因为AMF 通过菌丝来增加根系的吸收范围,增加宿主植物的含水量[12],缓解盐胁迫的损伤[19,48]。植物叶绿素荧光参数的变化在一定程度上反映了环境因子的变化及其对植物光合生理产生的影响。通过测定植物的PSⅡ最大光能转换效率,推测植物对特定环境的适应性和抗逆性是一条较为有效和便捷的途径[49]。本研究中,接种AMF 后,植物的PSⅡ最大光能转换效率增加,说明AMF 可以缓解盐胁迫对植物的负面影响,对植物的生长具有促进作用。
在盐胁迫条件下接种AMF 真菌,促进了白车轴草对水分,无机物和有机物、可溶性蛋白、可溶性糖和游离脯氨酸等的吸收[1],平衡渗透压,保证细胞的正常代谢[33]。本试验中,接种AMF 后白车轴草植株脯氨酸含量显著增加。目前,在盐渍环境中接种AMF 时,脯氨酸的含量变化原因仍有争议,主要存在3 种观点:一些学者认为,在盐胁迫下,植物通过提高体内脯氨酸含量,减少盐害对植物的损伤[39],脯氨酸积累越多,植物耐盐能力越强。例如紫花苜蓿(Medicago sativa)[29]、芹菜(Apium graveolens)[50]、西瓜(Citrullus lanatus)[51]等植物在盐胁迫与接菌的双重作用下,脯氨酸含量普遍显著提高,因此认为AMF 能通过积累脯氨酸来提高植物耐盐性。另一些试验证明,在高盐胁迫下,植物体受盐害影响,会出现脯氨酸含量积累的现象,脯氨酸积累越多,植物遭受盐害越严重,植株在盐胁迫下接种AMF 后,脯氨酸含量降低,植株受盐胁迫伤害程度减轻[52]。还有研究指出,脯氨酸在总有机溶质中的相对丰度较低,在逆境中对抗性的表现并不明显[53]。本试验中,验证了在盐害逆境中,植物通过提高体内脯氨酸含量,减少盐胁迫对植物的损伤这一结论。
4 结论
本研究表明盐胁迫处理导致白车轴草丙二醛含量和相对电导率上升,相对含水量降低,可溶性糖和游离脯氨酸的含量提高,不利于白车轴草的生长发育。在盐胁迫下接种AMF,丙二醛含量和相对电导率下降,PSⅡ最大光能转换效率,相对含水量,可溶性糖和游离脯氨酸含量上升,说明接种AMF 可以减轻盐胁迫对其带来的负面影响,有利于白车轴草的栽种及其在盐渍土地上的绿化推广。本研究结果对今后在盐渍土地种植白车轴草,扩大绿化面积提供了理论依据,同时在微生物菌肥研发和推广中具有重要参考价值。

