Panx1通道参与脉冲电磁场对三叉神经痛镇痛效应的研究
王 盼,司华兴,,娄安新,,赵 菡,邢珂珂,刘小蝶,陈 涛(空军军医大学基础医学院人体解剖与组织胚胎学教研室,陕西 西安 700;西北大学生命科学学院,陕西 西安 70069;延安大学医学院,陕西 延安 76099)
原发性三叉神经痛(trigeminal neuralgia,TN)是一种发病原因不明的头面部神经病理性痛,可导致躯体伤害,引起负性情绪反应和认知损害,严重影响患者的身心健康及生活质量[1]。卡马西平是目前治疗TN的首选药物,仅有69%的患者能获得疼痛缓解,部分患者应用后治疗效果不佳,并且可产生耐药性,以及诱发药物性皮疹、眩晕、复视和共济失调等严重不良反应[2-3];而采用经皮三叉神经根切断术、射频热凝术、微血管减压术等外科方法治疗后,除复发率较高的问题外,还存在术后面部麻木、面神经功能障碍及听力异常等风险[4]。脉冲电磁场(pulsed electromagnetic field,PEMF)作为美国食品药品监督管理局批准的一种无创、经济、安全的物理治疗手段,最初主要用于治疗骨不连及骨折延迟愈合[5]。近年来多项临床研究证明,PEMF能够明显缓解骨质疏松和关节炎引起的各类慢性疼痛[6];动物实验结果也揭示PEMF能够明显缓解骨质疏松和关节炎的疼痛,同时并未导致明显的不良反应[7],然而PEMF是否能够对TN产生显著的镇痛效果尚未见报道。
三叉神经脊束核尾侧亚核(trigeminal caudal subnucleus,Vc)是口面部痛温觉信息传递及整合的关键核团,在TN的发病机制中起到重要的作用[8]。Panx1通道在静息状态下保持关闭状态,若开放则与多种病理过程关系密切,如局部缺血时神经元的死亡、NMDA受体的兴奋性毒性、炎性小体的激活等[9]。近期有研究表明小胶质细胞中Panx1通道的开放在慢性痛的发生及中枢敏化过程中发挥重要作用,在脊髓背角的小胶质细胞中通过抑制Panx1的表达可抑制IL-1β的释放且不影响其上游P2X7R离子通道的功能,可显著缓解慢性关节疼痛,为临床上靶向Panx1治疗关节炎引起的慢性痛提供了有力的理论支持[10]。神经元内NMDAR与Panx1关系密切,激活的NMDAR可引起Src激酶的升高,导致突触后致密区大量分布的Panx1通道开放,伴随着腺苷三磷酸(adenosine triphosphate,ATP)的释放及Ca2+内流等跨膜流动。该机制在癫痫发作、局部缺血缺氧等中枢神经系统病理过程中起到重要作用[11]。近期有研究表明在下齿槽神经损伤造成的口面部异常疼痛的SD大鼠中,三叉神经节内的NMDAR1(NR1)、p-Src及Panx1表达均显著升高[12]。因此,笔者推测NMDAR1与Panx1是PEMF治疗TN的重要作用靶点,在PEMF治疗TN的病理生理过程中具有重要作用。综上,本研究拟探索Vc神经元内Panx1参与PEMF对TN的镇痛效应及其潜在机制。
1 材料与方法
1.1 材料
本实验所使用的C57BL/6J小鼠均来自空军军医大学实验动物中心,8~10周龄,体质量22~26 g。实验室饲养环境:温度22~26 ℃,湿度40%左右,饮食和饮水自由充足,光照自动控制,昼夜交替节律为12 h,实验室正常通风换气。所有实验均按照空军军医大学动物护理委员会、实验动物护理行政小组批准的方案进行(许可证号:IACUC-20210901)。
1.2 方法
1.2.1 实验分组 实验分为假手术组、TN组和TN+PEMF组,每组10只小鼠。
1.2.2 TN动物模型建立 采用眶下神经结扎以建立TN模型鼠。C57小鼠注射20 g/L戊巴比妥钠麻醉后仰卧位固定,手术区域皮肤消毒。无菌操作,于鼠口腔内沿左侧龈颊边缘,平第一磨牙水平向口鼻方向纵向切开约0.5 cm长切口,暴露眶下神经并分离周围组织,用两根6-0铬线疏松结扎,两线相距2 mm。术后6-0丝线缝合切口并消毒。假手术组不进行结扎,其他操作相同仅剥离眶下神经。PEMF发生系统由信号发生器及HelmHoltz线圈构成(GHY-III,FMMU,专利号ZL02224739.4)[13-14]。本研究中各组小鼠均被放入PEMF加载装置线圈的中央,假手术组及TN组小鼠在加载过程中未开启信号发生器,而TN+PEMF组小鼠受到每日2 h,共计7 d的15 Hz、5 Gauss的PEMF刺激。
1.2.3 口面部机械痛测定 测试前将小鼠置于自制金属网格笼中适应30 min,用Von Frey丝测量小鼠触须垫区域的机械刺激反应。不同克重Von Frey丝分别为0.008、0.020、0.040、0.070、0.160、0.400、0.600、1.000、1.400、2.000 g。以出现头部撤退反应的最小刺激强度作为机械刺激强度阈值,每次刺激间隔最少为15 s。
1.2.4 自发痛行为测定 面部理毛行为是口面部自发性痛觉过敏的特征,因此在本研究中将统计小鼠口面部理毛时间评定自发痛行为。小鼠置于适应测试笼中20 min后,用摄像机记录小鼠行为10 min,统计并计算单侧不对称理毛持续时间。
1.2.5 免疫荧光染色 7 d后常规麻醉固定取材,使用冰冻切片机切至30 μm。驴血清封闭后使用含Panx1抗体血清孵育切片4 ℃过夜,用PBS漂洗后加入荧光二抗室温孵育4 h,裱片后使用荧光封片剂封片,在荧光显微镜及共聚焦显微镜下观察拍照。
1.2.6 Western blotting检测 麻醉后切取对侧的Vc脑组织,裂解后离心提取蛋白,使用BCA法进行蛋白定量,并将样品煮沸使蛋白变性。SDS-PAGE凝胶电泳分离蛋白质,然后利用恒流湿转法进行转膜。封闭后孵育一抗于4 ℃冰箱过夜(鼠抗NR1,1 ∶1 000,Invitrogen公司;兔抗Panx1,1 ∶1 000,Invitrogen公司;兔抗p-Src,1 ∶1 000,CST公司)。二抗室温孵育后进行发光显影并采集图像,利用ImageJ软件进行条带灰度分析。
2 结果
2.1 PEMF刺激缓解TN小鼠口面部机械痛及自发痛
本研究使用眶下神经结扎模型进行TN小鼠造模(图1A),以确定PEMF对于TN是否有镇痛效应。结果显示,TN组小鼠的机械痛阈明显降低、面部理毛活动时间明显增加(P<0.05,图1B),提示TN小鼠通过眶下神经结扎后表现出明显的口面部异常疼痛;而TN+PEMF组小鼠受到15 Hz、5 Gauss、2 h/d、7 d的PEMF刺激后,机械痛阈值上升及面部理毛时间明显下降(P<0.05,图1B),以上结果表明PEMF刺激可显著缓解机械痛及自发痛。

A:图例显示TN组小鼠行眶下神经结扎步骤,平第一磨牙水平纵向切开0.5 cm暴露眶下神经后使用两根铬线疏松结扎;B:TN组小鼠机械痛及自发痛明显异常,而PEMF刺激可显著缓解机械痛及自发痛。TN组:三叉神经痛组;TN+PEMF组:三叉神经痛加脉冲电磁场治疗组。n=6, aP<0.05。图1 PEMF刺激对TN小鼠机械痛阈值及面部理毛时间的影响
2.2 PEMF刺激减少TN小鼠Vc内Panx1的表达
免疫荧光染色结果显示,Panx1主要分布在Vc的Ⅲ层(图2A),而非Ⅰ~Ⅱ层,提示Panx1可能与机械痛直接相关。染色结果显示,TN组小鼠Vc内Panx1、NeuN共同标记的细胞明显增多(图2B),提示TN组小鼠Vc神经元内Panx1的表达升高(P<0.05);而TN+PEMF组与TN组相比则显示出较少的Panx1及NeuN共标细胞(P<0.05,图2B),表明神经元内Panx1的表达有所降低。

A:假手术组、TN组及TN+PEMF组小鼠Vc荧光染色图及脑图谱示意图;B:Vc内DAPI、Panx1及NeuN免疫荧光染色图,其中DAPI为蓝色、Panx1为红色、NeuN为绿色。TN组:三叉神经痛组;TN+PEMF组:三叉神经痛加脉冲电磁场治疗组。标尺为200 μm。n=3, aP<0.05。图2 Vc神经元中Panx1分布表达的免疫荧光染色
2.3 PEMF下调TN小鼠Vc内NR1-Src-Panx1通路
NR1与突触可塑性及慢性痛的发生关系密切,通过Western blotting进一步检测了三组小鼠Vc内NR1、p-Src以及Panx1的表达变化。结果显示,眶下神经结扎后Vc内三种分子的表达TN组相比假手术组均升高(P<0.01),且TN+PEMF组三种分子的表达与TN组相比显著降低(P<0.01,图3),提示PEMF刺激可以显著下调TN小鼠Vc内NR1-Src-Panx1通路。
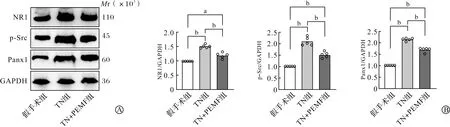
A:Western blotting检测图;B:Western blotting检测统计图。TN组:三叉神经痛组;TN+PEMF组:三叉神经痛加脉冲电磁场治疗组。n=5, aP<0.05, bP<0.01。图3 PEMF刺激对TN小鼠Vc内NR1、p-Src以及Panx1蛋白水平的影响
3 讨论
TN是一种多发于中老年人群的常见头面部神经病理性痛,临床症状多表现为单侧面部三叉神经支配区域内的严重、短暂性刺痛和复发性疼痛。随着我国人口老龄化及现今工作生活压力的不断增加,TN的发生率逐年增长,已成为亟需解决的严重社会问题。PEMF被证明可显著缓解骨质疏松和关节炎引起的疼痛,但其是否可有效治疗TN尚未见报道。
1985年,第一篇关于1 500 Gauss的电磁场可以减弱吗啡的镇痛效果的研究发表后逐渐引起学者重视[15],随后多项关于PEMF对于疼痛的动物及临床试验却得出了完全不同的结论:镇痛、促痛、无效均有报道。经过梳理后可以初步得出:对于疼痛的作用的不一致主要是由于所加载的PEMF的参数如频率、强度及加载时间等的不同引起的差别[16-18]。本实验结果显示特定频率的刺激具有显著的镇痛效应(15 Hz,5 Gauss,2 h/d,7 d),同时此参数在课题组的前期研究中被验证对于破骨细胞及骨细胞的凋亡具有抑制作用从而抑制骨吸收作用,具有骨质疏松治疗意义[14],近期研究亦表明PEMF刺激可促进脑出血后血肿清除,从而减轻炎症反应[13]。
Panx1是继Connexin、Innexin后于2000年发现的新型缝隙连接蛋白Pannexin家族成员之一,且被发现广泛分布在哺乳动物中枢神经系统的各种类型细胞中,在神经系统发育及神经系统疾病的发生和发展中发挥重要作用[19]。本研究中探明了PEMF刺激对于TN的潜在作用效果。我们使用眶下神经结扎模型构建TN小鼠模型,对小鼠施加15 Hz、5 Gauss的PEMF刺激后显示其可显著缓解TN小鼠口面部的机械痛和自发痛,提示PEMF对于TN口面部疼痛具有明显的治疗效应。并且免疫荧光染色结果显示TN小鼠Vc神经元内Panx1表达明显增加,而PEMF刺激后Panx1表达明显降低。既往研究显示TN模型大鼠中三叉神经节内Panx1的表达升高[20],与本研究结果一致;而用siRNA抑制其表达可以明显缓解TN[21]。本研究进一步探索了TN小鼠中Panx1相关通路分子的表达变化,明确了PEMF刺激可以下调TN小鼠Vc内NR1-Src-Panx1通路从而达到镇痛的效果,对于揭示TN的致病原理以及PEMF治疗TN的临床治疗可提供理论和实验依据。

