六味降脂汤对NAFLD 大鼠肝脏脂肪酸代谢及LXRα-SREBP-1c-FAS 信号通路的影响
全德森,柯尊丽,张远哲,黎豫川,马晶鑫,刘林潇,田维毅,蔡 琨*
(1.贵州中医药大学基础医学院,贵州贵阳 550025; 2.贵州中医药大学第二附属医院药学部,贵州贵阳 550025)
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是最常见的慢性肝病,以弥漫性肝细胞大泡性脂肪变为病理特征的临床综合征,随着肥胖和2 型糖尿病(T2DM)的流行,其患病率正逐年上升[1-2],如不及时治疗,极易进行性发展成为肝炎、肝硬化甚至肝癌[3]。研究表明LXRα 是一种对脂肪和胆固醇代谢具有重要作用的转录因子,与脂质代谢密切相关[4],可通过上调下游因子SREBP-1c 的表达来诱导NAFLD 的发生[5],并刺激其下游因子FAS 的表达,进一步加剧NAFLD的发展[6]。根据NAFLD 的症状、病因病机,中医学将其归属于“肝癖” “胁痛” 等范畴,该病机包含“肝郁脾虚、湿热内蕴、痰瘀互结”[7]。六味降脂汤以《圣济总录》 中古方“茵陈蒿散” 为依据,经历代医家发挥加味而来,具有清热利湿、健脾化痰、活血化瘀之功,且前期临床病例收集研究提示六味降脂汤降脂作用明显,能够有效下调TC、TG及LDL-C 水平,并发现针对初期非酒精性脂肪肝患者呈现出较好的临床疗效,能调节血脂,保护肝功能,可显著改善NAFLD 患者临床症状[8]。但六味降脂汤具体通过何种机制来治疗NAFLD 尚未明确,故本实验以高脂饲料合并高脂乳剂灌胃建立NAFLD 大鼠模型,探究六味降脂汤是否通过影响LXRα-SREBP-1c-FAS 信号通路来干预NAFLD,以期为临床应用提供科学实验依据。
1 材料
1.1 实验动物 SPF 级SD 雄性大鼠42 只,6~8周龄,体质量180~200 g,购自长沙市天勤生物技术有限公司,实验动物生产许可证号SCXK(湘)2019-0014。大鼠于贵州中医药大学实验动物研究所SPF 级动物房喂饲,实验操作流程严格遵循动物实验伦理委员会的相关法规和各项规定,并通过贵州中医药大学实验动物福利伦理审查(审批号20210003)。
1.2 药物 六味降脂汤由茵陈、丹参、绞股蓝、生山楂、决明子、荷叶组成,饮片(由贵州同济堂中药饮片有限公司生产,符合2015 年版《中国药典》 规定,生产批号分别为200628、200617、200707、201126、201015、200806)均购自贵州中医药大学第二附属医院。阿托伐他汀钙片(北京嘉林药业股份有限公司,10 mg/粒,国药准字H19990258,生产批号AA2003033)。
1.3 试剂 总胆固醇(TC)、甘油三酯(TG)、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、超氧化物歧化 酶(SOD)、丙二醛(MDA)、游离脂肪酸(NEFA)检测试剂盒(南京建成生物工程研究所有限公司,货号A111-1-1、A110-1-1、C009-2-1、C010-2-1、A001-3、A003-1、A042-2-1);苏木素-伊红(HE)、改良油红O 染色试剂盒(北京索莱宝科技有限公司,货号G1120、G1261);PrimeScriptTMRT reagent Kit with gDNA Eraser、TB Green® Premix Ex TaqTMⅡ试剂盒(日本TaKaRa 公司,批号AL21115A、AL51019A);二甲苯(天津致远化学试剂有限公司,批号202150101);柠檬酸盐缓冲液、PBS 缓冲液、DAB试剂盒、二抗(批号ZLI-9065、ZLI-9062、ZLI-9018、SP9001,北京中杉金桥生物技术有限公司);苏木素染液(批号LM10N13,北京百灵威科技有限公司);LXRα、SREBP-1c 一 抗(批号NBP2-66938、NB100-2215,美国Novus 公司);FAS一抗(批号GR3210604-1,英国Abcam 公司)。
1.4 仪器 Verioskam Flash 多功能酶标仪、Sorvall ST 40R 高速低温离心机、NanoDrop Lite Printer 分光光度计(美国Thermo 公司);DM4B 型显微镜、EG1150C 型石蜡包埋机、RM2265 型病理切片机、CM1950 型冰冻切片机(德国Leica 公司);CBCL-24 冷冻研磨仪(上海测博生物科技发展中心);CFX 96 TOUCH 型实时荧光定量聚合酶链式反应仪(美国 Bio-Rad 公司);BA410 型显微镜、BA400Digital 数码三目摄像显微摄像系统(麦克奥迪实业集团有限公司)。
2 方法
2.1 动物分组及造模 42 只大鼠适应性喂养1 周后,采用随机数字表法分为空白组、模型组、阿托伐他汀组及六味降脂汤低、中、高剂量组,每组7只。造模期间,空白组给予普通饲料喂养,其余各组给予高脂饲料合并高脂乳剂喂养(HD001b 高脂饲料购自北京博泰宏达生物技术有限公司,批号2020 110601;高脂乳剂配方为将30 g 猪油加热至液体状态,依次加入胆固醇5 g、蛋黄粉5 g、猪胆酸钠1 g、丙硫氧嘧啶0.5 g、葡萄糖5 g、吐温80 2 mL,最后加蒸镏水定容至200 mL,即得,现配现用)建立NAFLD 模型,以模型组大鼠生化指标水平及肝脏病理切片中出现大小不一的脂滴和气球样变为造模成功标准[9]。
2.2 药物制备及给药 根据前期临床实践研究发现六味降脂汤最优配伍比例为茵陈、丹参、绞股蓝、生山楂、决明子、荷叶各20 g。将全方煎煮2次,第一次加9 倍量蒸馏水浸泡30 min 后,武火煮沸,文火煮30 min,过滤取滤液,第二次加7 倍量蒸馏水,武火煮沸,文火煎煮25 min,过滤后取滤液,合并2 次滤液,浓缩至生药量1.07 g/mL,冷却后4 ℃冷藏备用。给药干预期间,依据《药理实验方法学》 中人与大鼠体表面积系数法换算大鼠用药剂量,换算出六味降脂汤低、中、高剂量组大鼠每天给药剂量分别为5.4、10.7、21.4 g/kg;阿托伐他汀组每天给药剂量为0.9 mg/kg,药物以蒸馏水配制成所需浓度的药液;空白组与模型组给予等量蒸馏水灌胃,给药容量为10 mL/kg。制备NAFLD 模型6 周,给药干预2 周,定期记录体质量,调整给药体积,给药与造模同时进行,共计8 周。
2.3 标本采集 8 周实验结束后,以10%水合氯醛(4 mL/kg)麻醉大鼠,腹主动脉取血,静置30 min后3 500 r/min 离心10 min,吸取血清冷藏备用,用于血清生化指标检测;迅速剖取大鼠肝脏,拍照称重,并剪取大小适宜的肝组织,置于冻存管中,液氮保存,用以检测肝组织中各mRNA及蛋白表达情况;另取1 cm×1 cm×0.5 cm 大小的肝组织以4% 多聚甲醛固定,用于病理形态学的观察。
2.4 血清生化指标检测 酶联免疫检测仪检测血清ALT、AST、SOD 活性及MDA、NEFA 水平,根据说明书取96 孔板,设置空白、标准品及样品孔,且均设置3 个复孔,与工作液充分反应后,将96孔板置于酶联免疫检测仪中进行检测,根据其光密度(OD)值,计算标准曲线公式,将各组均值带入公式,再计算得出待测样品的值,操作方法均按照试剂盒说明书进行。
2.5 肝脏脂质水平检测 酶联免疫检测仪检测肝组织TC、TG 水平,操作方法均按照试剂盒说明书进行。
2.6 大鼠肝脏指数 腹主动脉采血后,颈椎脱臼处死大鼠,迅速剖取肝脏,生理盐水清洗表面,用滤纸吸干后称取肝脏湿重,计算肝脏指数,公式为肝脏指数=肝脏湿重/体质量×100%[10]。
2.7 HE 染色观察肝组织病理学变化 取出于4%多聚甲醛固定液中的大鼠肝脏,常规石蜡包埋、切片、脱蜡、水化后,苏木素染色,分化后伊红染色,经脱水、透明后滴加中性树胶封片,光镜下观察。通过NAFLD 活动度积分(NAFLD activity score,NAS)评价各组大鼠肝组织脂肪变性、小叶炎症和气球样变程度[11],评分范围0~8(总分),评分越高表明脂肪变性、小叶炎症、气球样变程度越高,见表1。

表1 NAS 评分标准Tab.1 NAS scoring standard
2.8 油红O 染色观察肝脏脂质沉积情况 剪取大小适宜肝组织,于4%多聚甲醛固定液中固定4 h,脱水(20% 蔗糖溶液4 h,30% 蔗糖溶液过夜),OCT 冷冻包埋,冰冻切片,室温干燥10 min,蒸馏水浸洗1 min,分化液分化2 min,油红O 染液浸染20 min(避光),60%异丙醇分化10 s,蒸馏水洗涤,苏木素复染5 min,1%盐酸分化5 s,流水冲洗返蓝,甘油明胶封片,显微镜检,图像采集。
2.9 RT-qPCR 法检测肝组织LXRα、SREBP-1c、FASmRNA 表达 按照RNA 提取试剂盒说明书提取大鼠肝脏总RNA,按反转录试剂盒说明书反转录为cDNA 后加入扩增反应体系,进行PCR 扩增,程序设定为95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s,共40 个循环。按2-ΔΔCT法计算各基因相对表达量。引物由生工生物工程(上海)股份有限公司设计合成,序列见表2。

表2 引物序列Tab.2 Primer sequences
2.10 免疫组化法检测肝组织LXRα、SREBP-1c、FAS 蛋白表达 取各组大鼠肝组织,4%多聚甲醛固定,4~6 h 后更换固定液,石蜡包埋切片,免疫组化操作流程按病理检验标准操作程序进行,用BA400Digital 数码三目摄像显微摄像系统进行图像采集,先于100 倍镜下观察完整切片组织,随后每张切片选择3 个区域采集400 倍显微图像,采用Image J 数据图像分析系统计算每张图像阳性面积占比。
2.11 统计学分析 通过SPSS 26.0 软件进行处理,实验数据以(±s)表示,组间比较采用t检验,多样本均数比较采用单因素方差分析,当满足正态性及方差齐性时用LSD 检验,若不满足正态或方差不齐时,采用非参数检验。P<0.05 表示差异有统计学意义。
3 结果
3.1 NAFLD 大鼠模型的评判 6 周造模结束后,与空白组比较,模型组大鼠血清ALT、AST 活性均升高(P<0.05,P<0.01),见表3。如图1 所示,空白组大鼠肝组织中央静脉周围的肝细胞形态一致,单行排列,呈索状,排布有序,并呈放射状分布,细胞核圆且居中,胞浆分布均匀;模型组大鼠肝细胞排列紊乱,胞浆疏松肿胀呈空泡化,胞内见大小不等的空泡,脂肪变性明显,观察到有广泛较大的脂肪滴,肝细胞核被挤压而明显偏位,伴有炎性细胞浸润。根据血清生化水平及病理切片提示NAFLD 模型建立成功。
表3 各组大鼠血清ALT、AST 活性比较(U/L,±s,n=5)Tab.3 Comparison of serum ALT and AST activities in each group of rats(U/L,±s, n=5)

表3 各组大鼠血清ALT、AST 活性比较(U/L,±s,n=5)Tab.3 Comparison of serum ALT and AST activities in each group of rats(U/L,±s, n=5)
注:与空白组比较,*P<0.05,**P<0.01。
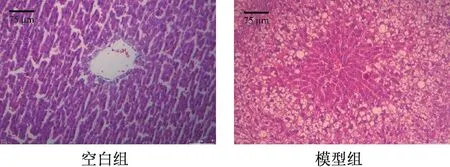
图1 各组大鼠肝组织病理形态变化(HE,×200)Fig.1 Pathological changes of liver tissue in rats of each group(HE,×200)
3.2 六味降脂汤对NAFLD 大鼠血清ALT、AST、SOD 活性及MDA 水平的影响 与空白组比较,模型组大鼠血清ALT、AST 活性升高(P<0.01);与模型组比较,阿托伐他汀组大鼠血清ALT 活性无明显变化(P>0.05),AST 活性降低(P<0.01),六味降脂汤各剂量组血清ALT、AST 活性降低(P<0.05,P<0.01);与阿托伐他汀组比较,六味降脂汤各剂量组大鼠血清ALT 活性降低(P<0.05,P<0.01)。在抗氧化能力方面,与空白组比较,模型组大鼠血清SOD 活性降低(P<0.01),MDA 水平升高(P<0.01);与模型组比较,阿托伐他汀组及六味降脂汤低、中剂量组大鼠血清SOD 活性均升高(P<0.05,P<0.01),各给药组 MDA 水平均降低(P<0.01),见表4。
表4 六味降脂汤对NAFLD 大鼠血清ALT、AST、SOD 活性及MDA 水平的影响(±s, n=7)Tab.4 Effects of Liuwei Jiangzhi Decoction on serum ALT,AST,SOD activities and MDA levels of NAFLD rats(±s,n=7)

表4 六味降脂汤对NAFLD 大鼠血清ALT、AST、SOD 活性及MDA 水平的影响(±s, n=7)Tab.4 Effects of Liuwei Jiangzhi Decoction on serum ALT,AST,SOD activities and MDA levels of NAFLD rats(±s,n=7)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与阿托伐他汀组比较,△P<0.05,△△P<0.01。
3.3 六味降脂汤对NAFLD 大鼠肝组织TC、TG及血清NEFA 水平、肝脏指数的影响 与空白组比较,模型组大鼠肝组织TC、TG 及血清NEFA 水平、肝脏指数均升高(P<0.01);与模型组比较,各给药组大鼠肝组织TC、TG 水平及血清NEFA 水平降低(P<0.05,P<0.01),六味降脂汤低、中剂量组大鼠肝脏指数均降低(P<0.05);与阿托伐他汀组比较,六味降脂汤低剂量组大鼠肝组织TC 水平及各剂量组TG 水平降低(P<0.05,P<0.01),六味降脂汤高剂量组大鼠血清NEFA 水平升高(P<0.01),见表5。
表5 六味降脂汤对NAFLD 大鼠肝组织TC、TG 及血清NEFA 水平、肝脏指数的影响(±s, n=7)Tab.5 Effects of Liuwei Jiangzhi Decoction on levels of hepatic TC and TG,serum NEFA,and liver index of NAFLD rats(±s, n=7)

表5 六味降脂汤对NAFLD 大鼠肝组织TC、TG 及血清NEFA 水平、肝脏指数的影响(±s, n=7)Tab.5 Effects of Liuwei Jiangzhi Decoction on levels of hepatic TC and TG,serum NEFA,and liver index of NAFLD rats(±s, n=7)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与阿托伐他汀组比较,△P<0.05,△△P<0.01。
3.4 六味降脂汤对NAFLD 大鼠肝组织病理形态学的影响 肉眼观察可见空白组大鼠肝组织呈红褐色,质软而脆;模型组大鼠肝组织体积略增大,边缘圆钝,色黄,包膜紧张光滑,质地油润;与模型组比较,各给药组大鼠肝组织病变情况得到不同程度的改善。HE 染色显示空白组大鼠肝组织结构完整,肝血窦位于肝索细胞之间,大小不等,并与中央静脉相互连通,中央静脉周围的肝细胞形态一致、单行排列、呈索状、排布有序、并呈放射状分布,胞核圆且居中,胞浆分布均匀;与空白组比较,模型组大鼠肝组织可观察到明显的脂肪变性、小叶炎症、气球样变等病理变化,NAS 评分升高(P<0.01);与模型组比较,各给药组大鼠肝组织损伤程度减轻,肝细胞结构排列较为完整有序,脂肪空泡数量有着不同程度的减少,肝组织脂肪蓄积及细胞空泡化得到明显改善,NAS 评分降低(P<0.01)。油红O 染色显示空白组大鼠肝组织中未见橘红色脂滴;模型组肝组织内出现广泛大量的橘红色脂滴,体积较大,且部分脂滴融合成片,提示肝组织内存在大量脂质沉积;与模型组比较,各给药组大鼠肝组织内脂滴密度有所减少,脂质沉积情况得到改善,见图2~3。
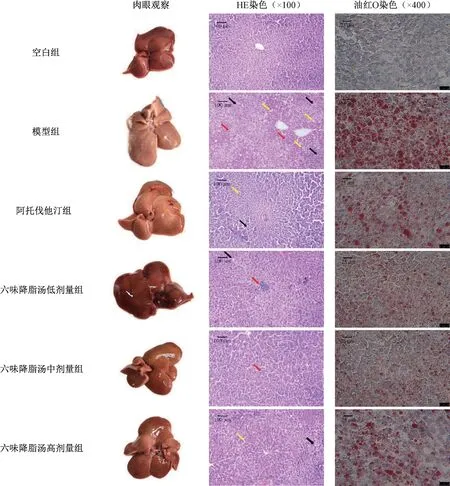
图2 各组大鼠肝组织病理形态观察Fig.2 Pathological observation of liver tissue of rats in each group
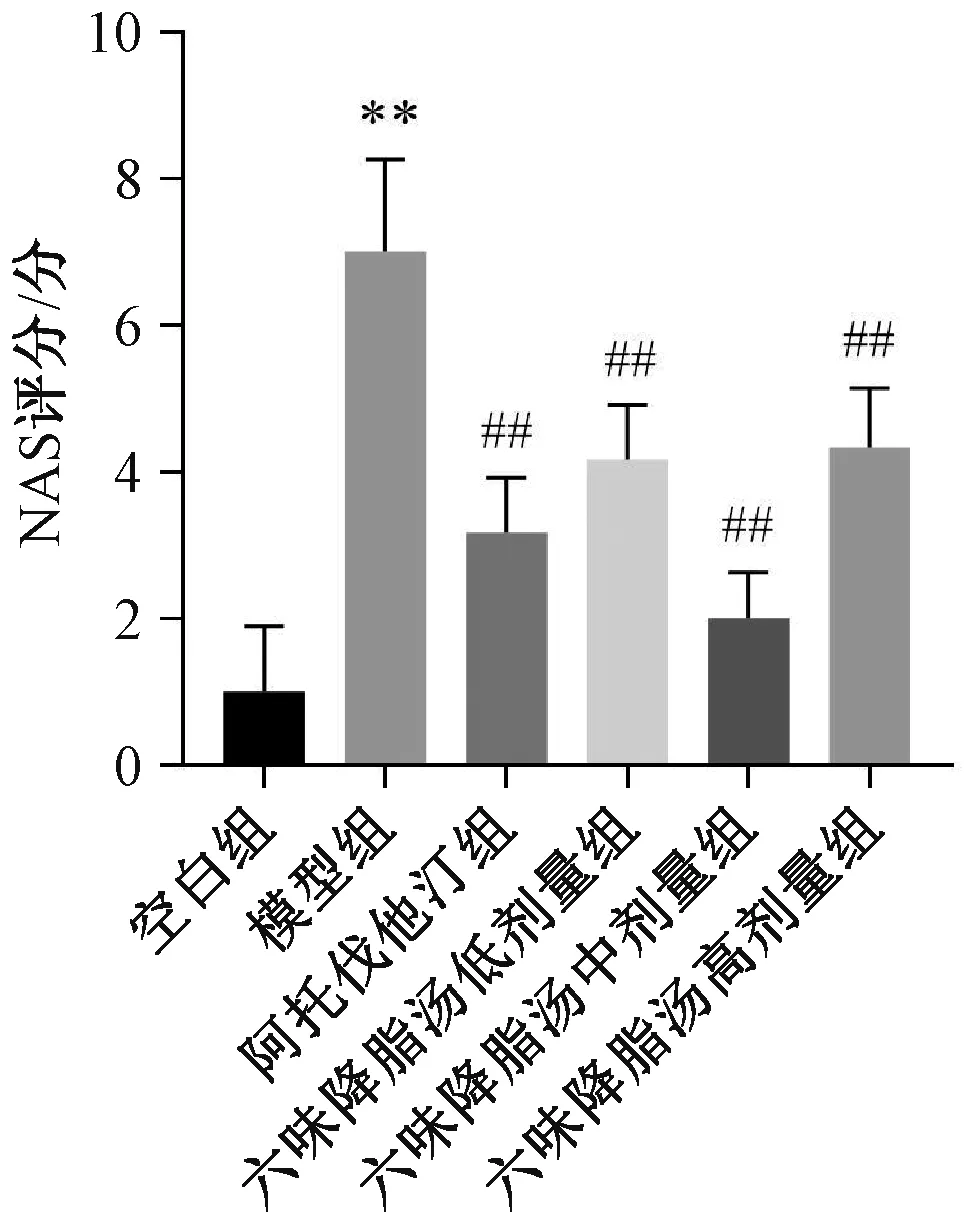
图3 六味降脂汤对NAFLD 大鼠肝组织NAS 评分的影响(±s, n=6)Fig.3 Effects of Liuwei Jiangzhi Decoction on hepatic NAS score of NAFLD rats(±s, n=6)
3.5 六味降脂汤对NAFLD 大鼠肝组织LXRα、SREBP-1c、FASmRNA 表达的影响 与空白组比较,模型组大鼠肝组 织LXRα、SREBP-1c、FASmRNA 表达均升高(P<0.01);与模型组比较,各给药组大鼠肝组织LXRα、SREBP-1c、FASmRNA表达均降低(P<0.01);与阿托伐他汀组比较,六味降脂汤中剂量组LXRα、FASmRNA 表达升高(P<0.05,P<0.01),见图4。
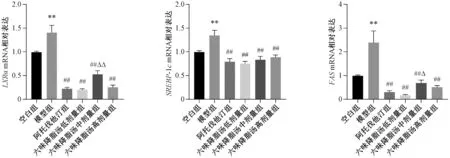
图4 六味降脂汤对NAFLD 大鼠肝组织LXRα、 SREBP-1c、 FAS mRNA 表达的影响(±s, n=3)Fig.4 Effects of Liuwei Jiangzhi Decoction on the hepatic mRNA expressions of LXRα, SREBP-1c and FAS of NAFLD rats(±s, n=3)
3.6 六味降脂汤对NAFLD 大鼠肝组织LXRα、SREBP-1c、FAS 蛋白表达的影响 IHC 结果显示,阳性表达为肝细胞胞浆及胞膜有棕黄色颗粒沉着,与空白组比较,模型组大鼠肝组织SREBP-1c、FAS 阳性表达率升高(P<0.01),LXRα 表达无明显变化(P>0.05);与模型组比较,各给药组大鼠肝组织SREBP-1c、FAS 阳性表达率降低(P<0.01),阿托伐他汀组LXRα 阳性表达率降低(P<0.05),六味降脂汤各剂量组LXRα 表达无明显变化(P>0.05);与阿托伐他汀组比较,六味降脂汤高剂量组SREBP-1c、FAS 阳性表达率升高(P<0.05,P<0.01),见表6、图5。Western blot 结果显示,与空白组比较,模型组大鼠肝组织SREBP-1c 蛋白表达升高(P<0.01);与模型组比较,各给药组大鼠肝组织SREBP-1c 蛋白表达降低(P<0.05,P<0.01);与阿托伐他汀组比较,六味降脂汤低剂量组大鼠肝组织SREBP-1c 蛋白表达升高(P<0.05),见图6。
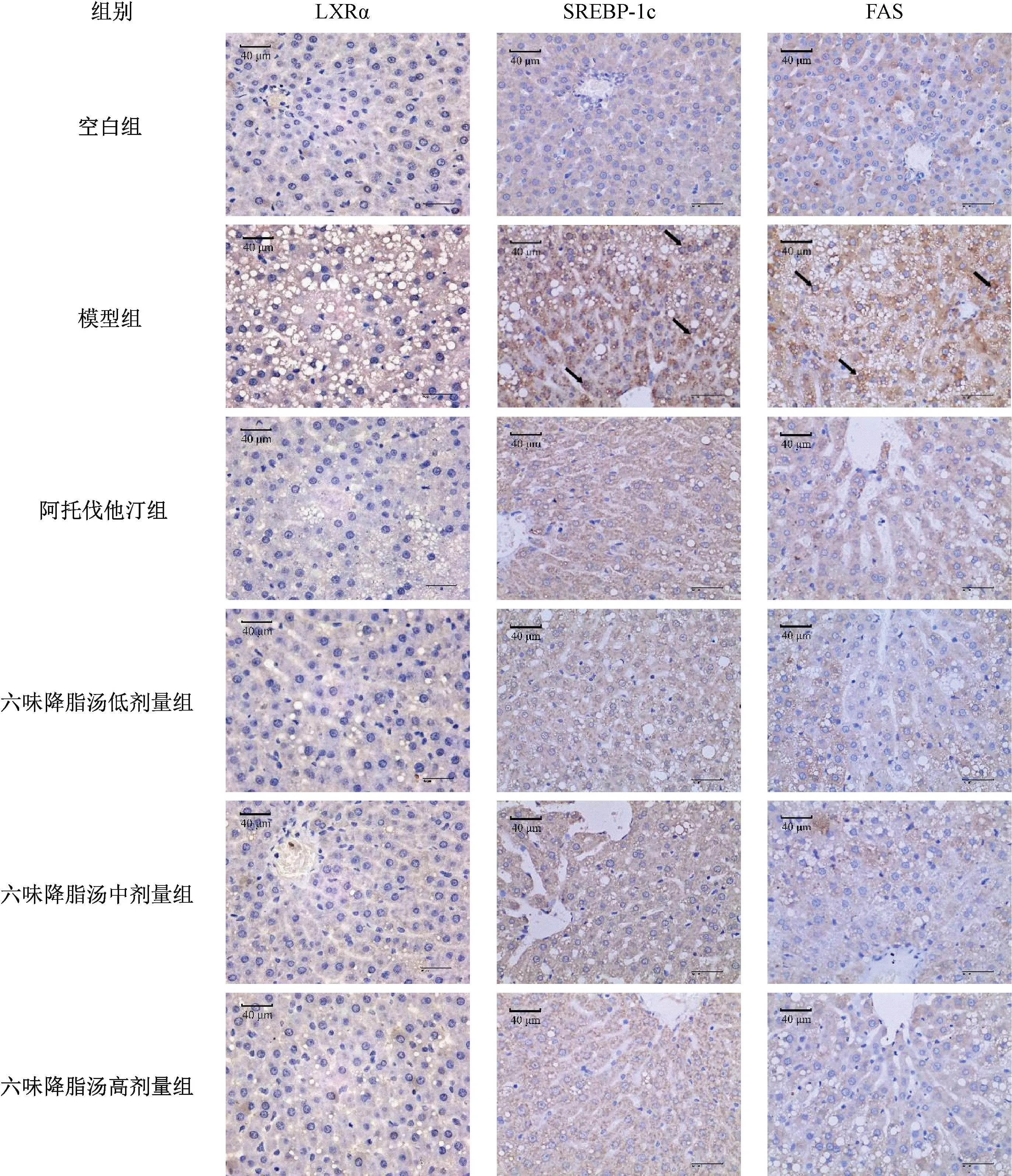
图5 各组大鼠肝组织LXRα、SREBP-1c、FAS 阳性表达观察(IHC,×400)Fig.5 Observation on the hepatic positive expressions of LXRα,SREBP-1c and FAS of rats in each group(IHC,×400)

图6 六味降脂汤对NAFLD 大鼠肝组织SREBP-1c 蛋白表达的影响(±s,n=3)Fig.6 Effects of Liuwei Jiangzhi Decoction on the hepatic protein expression of SREBP-1c of NAFLD rats(±s, n=3)
表6 六味降脂汤对NAFLD 大鼠肝组织LXRα、SREBP-1c、FAS 阳性表达率的影响(%,±s, n=3)Tab.6 Effects of Liuwei Jiangzhi Decoction on the hepatic positive expression rate of LXRα,SREBP-1c and FAS of NAFLD rats(%,±s, n=3)

表6 六味降脂汤对NAFLD 大鼠肝组织LXRα、SREBP-1c、FAS 阳性表达率的影响(%,±s, n=3)Tab.6 Effects of Liuwei Jiangzhi Decoction on the hepatic positive expression rate of LXRα,SREBP-1c and FAS of NAFLD rats(%,±s, n=3)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与阿托伐他汀组比较,△P<0.05,△△P<0.01。
4 讨论
中医学中本无NAFLD 的病名,但根据症状、病因病机及致病特点等,将其归属于“肝癖” “胁痛” 等范畴[7],推测NAFLD 初期发病病位在肝,责之于脾,久则导致肝失疏泄,湿热痰瘀痹阻于肝络。六味降脂汤由茵陈、丹参、绞股蓝、生山楂、决明子、荷叶组成,方中茵陈苦寒降泄,善清肝胆之热而利湿,兼理肝胆之郁为君药;丹参入心、肝二经,活血化瘀,二药合用共奏清热利湿化瘀之功,共为君药;绞股蓝益气健脾,以助茵陈化湿祛痰,君臣相配,相辅相成,使化湿祛痰之力益彰;生山楂助丹参活血化瘀,兼有化浊降脂之效,与绞股蓝同为臣药;决明子润肠通便兼以清肝,使湿热之邪有其通路,而全方偏苦寒沉降,取荷叶轻清之性,使之升降相应,阴阳相济,两药共为佐使。该方诸药相伍,升降相应、补泄兼施、阴阳相济,共奏清热利湿、健脾化痰、活血化瘀之功。本实验结果显示六味降脂汤各剂量给药后,能降低NAFLD大鼠血清ALT、AST 活性及NEFA 水平,调节脂代谢紊乱,提升其抗氧化能力,尤以在降低ALT 活性方面较阳性组(阿托伐他汀)效果显著。以上结果表明,六味降脂汤能改善NAFLD 大鼠肝脏脂质沉积,提升其抗氧化能力及保护肝功能,减缓NAFLD 病变的发展。
肝脏是人体内关键代谢器官,参与内源性脂肪的合成及转运[12],而LXRα 是肝脏脂肪新生的调节因子[13],当LXRα 过表达可激活调控脂肪代谢的SREBP-1c 及控制脂肪酸合成的重要调节因子FAS,导致大量脂肪酸内流集聚于肝脏,诱发NAFLD[14-15]。SREBP-1c 主要存在于肝细胞内质网及核膜上,在调节糖脂代谢方面具有重要意义[16]。当敲除ob/ob 小鼠SREBP-1 基因后,肝脏TG 水平较未敲除小鼠下降50%,提示SREBP-1 极大地促进了NAFLD 形成[17]。而FAS 是促使脂肪酸合成的关键因子,其表达受其上游核转录因子SREBP-1c的调控,下调NAFLD 大鼠SREBP-1c、FAS 基因表达,可减轻脂肪酸诱导的氧化应激和肝脏脂质沉积[18]。本研究结果显示,模型组大鼠肝组织SREBP-1c、FAS 蛋白表达较空白组均升高,提示高脂饮食合并高脂乳剂灌胃可能通过激活SREBP-1c-FAS 信号通路,促使脂质合成且堆积于肝脏,从而导致NAFLD,与陈丽如[19]研究结果趋同;六味降脂汤干预后NAFLD 大鼠肝组织SREBP-1c、FAS 蛋白表达均下降,而各组大鼠肝组织LXRα 蛋白表达无明显变化,据相关研究显示SREBP-1c 亦作为腺苷酸活化蛋白激酶(AMPK)信号分子的下游蛋白[20],活化的AMPK 可抑制SREBP-1c 的入核[21],因此推断六味降脂汤干预后可能通过上调AMPK 抑制SREBP-1c 及其下游脂肪酸合成相关因子的表达,从而调控肝脏脂肪酸代谢和抗氧化应激,进而干预NAFLD。此外六味降脂汤治疗NAFLD 也可能是组方中不同药理作用交汇调控的结果,但还需进一步实验验证。
综上所述,六味降脂汤具有调控肝脏脂肪酸代谢,减轻氧化应激反应,从而治疗NAFLD 的作用,其潜在机制可能与抑制SREBP-1c-FAS 信号通路有关。

