四川地区29家医院临床分离真菌的菌种分布及耐药性监测
李彦 邓劲 康梅
摘要:目的 了解2022年四川地區临床分离真菌的菌株分布以及其对常用抗真菌药物的耐药率,促进四川地区抗真菌药物的合理选择。方法 收集2022年1月1日—2022年12月31日全国真菌病监测网四川省29家医院临床分离的非重复真菌菌株,参照美国临床和实验室标准协会(CLSI)推荐标准,运用WHONET 5.6及Microsoft Excel进行数据统计与分析。结果 该研究共收集非重复真菌菌株16969株,其中念珠菌属占86.95%(14755/16969);隐球菌属占0.47%(80/16969);曲霉菌占8.07%(1371/16969);其他酵母占4.49%(763/16969)。在念珠菌属中,白念珠菌(63.36%,9350/14755)、光滑念珠菌(15.09%,2222/14755)及热带念珠菌(6.44%,951/14755);在隐球菌属中,新生隐球菌占97.50%(78/80);在曲霉菌中,烟曲霉占比最多(56.16%,770/1371)。所有念珠菌属对两性霉素B、棘白菌素的耐药率或非野生型占比相对较低,光滑念珠菌和热带念珠菌对唑类药物的耐药率或非野生型占比相对较高。新生隐球菌对两性霉素B的非野生型占比为10.29%,略高于唑类药物和氟胞嘧啶。曲霉菌总体对两性霉素B和唑类药物以及卡泊芬净的非野生型占比相对较低。结论 四川省2022年临床分离的真菌以念珠菌属为主,光滑念珠菌和热带念珠菌对唑类药物耐药率或非野生型占比相对较高,需进行动态监测。
关键词:真菌感染;抗生素;耐药率;菌种分布
中图分类号:R51文献标志码:A
Distribution and drug resistance monitoring of clinical fungi isolated
from 29 hospitals in Sichuan area
Li Yan1,2, Deng Jin1 and Kang Mei1
(1 Experimental Medicine Department of West China Hospital, Sichuan University, Chengdu 610041;
2 Meishan Peoples Hospital, Meishan 620000)
Abstract Objective The distribution of clinically isolated fungi strains and their resistance rate to commonly used antifungal drugs in Sichuan in 2022 was studied to promote the rational selection of antifungal drugs in Sichuan. Methods From January 1, 2022 to December 31, 2022, non-duplicative fungal strains isolated from 29 hospitals in Sichuan Province of the National Mycosis Surveillance Network were collected and analyzed using WHONET 5.6 and Microsoft Excel according to the recommended standards of the American Clinical and Laboratory Standards Institute (CLSI). Results A total of 16,969 non-repeating fungal strains were collected in this study, among which Candida accounted for 86.95% (14,755/16,969), Cryptococcus accounted for 0.47% (80/16969), Aspergillus accounted for 8.07% (1371/16,969), and other yeast accounted for 4.49% (763/16,969). Among the Candida genera are Candida albicans (63.36%, 9,350/14,755), Candida glabra (15.09%, 2,222/14,755) and Candida tropicalis (6.44%, 951/14,755). In Cryptococcus, Cryptococcus neoformans accounted for 97.50% (78/80). Among Aspergillus, Aspergillus fumigatus accounted for the largest proportion (56.16%, 770/1,371). The resistance rate or proportion of non-wild type to amphotericin B and echinocinomycin was relatively low in all Candida genera, while the resistance rate or proportion of non-wild type to azole drugs was relatively high in Candida glabrata and Candida tropicalis. The proportion of the non-wild type of Cryptococcus neoformenosa to amphotericin B was 10.29%, which was slightly higher than that of azole drugs and fluorocytosine. The proportion of non-wild type to amphotericin B, azole and carpofungin in Aspergillus was relatively low. Conclusion Candida was the main fungus isolated in Sichuan Province in 2022. Candida glabrata and Candida tropicalis had relatively high resistance rates to azole drugs or a high proportion of non-wild types, which required dynamic monitoring.
Key words Fungal infection; Antibiotics; Drug resistance rate; Strain distribution
近年来,由于激素、广谱抗生素、免疫抑制剂的广泛应用和临床上免疫功能低下人群逐年增多,真菌感染的发生率显著上升[1-2],并且全球每年发生超过1.5亿例严重的真菌感染病例,每年因真菌感染造成的全球死亡人口达到约170万[3-4]。随着抗真菌药物特别是唑类药物如氟康唑、伊曲康唑、伏立康唑等在临床上的大量使用,真菌耐药现象日趋严重,真菌有高适应性特点,在体内形成生物被膜、转变成菌丝后任可高度耐药,耐药性已经成为真菌感染治疗失败的主要原因之一[5]。临床上常见的致病性真菌类型包括念珠菌、隐球菌和曲霉等[6-7],念珠菌属中的白念珠菌一直是临床上真菌感染的常见病原菌,但是近年来非白念珠菌(non-albicans Candida,NAC)的感染也逐渐增加[8-9],值得注意的是非白念珠菌通常比白念珠菌更能抵抗抗真菌药物[10-11]。真菌感染的流行病学和耐药率呈现明显的地域性差异,故监测本地区的真菌流行病学和耐药率并加以分析显得尤为重要。
本研究对2022年全国真菌病监测网四川省29家医院提供的真菌病原学数据进行整理,该29家医院涵盖了川东、川南、川西、川北和川中地区,且均为三级甲等综合医院,监测数据具有较为显著的区域代表性。统计分析了所有菌株的菌种来源和分布情况,以及不同标本类型的菌种构成比。分析了念珠菌属、隐球菌属和曲霉菌等不同菌种对目前临床常用的9种抗真菌药物(两性霉素B、氟康唑、伊曲康唑、伏立康唑、泊沙康唑、氟胞嘧啶、卡泊芬净、米卡芬净和阿尼芬净)的敏感率和耐药率,以研究本地区真菌感染菌株的流行病学和耐药率,为本地区临床有效诊治真菌感染提供数据支持。
1 材料与方法
1.1 菌株来源
收集2022年1月1日—2022年12月31日四川省29家医院临床分离的真菌菌株19633株,剔除同一患者的重复菌株后,共获得16969株真菌菌株。
1.2 试剂和仪器
鉴定仪器和试剂:VITEK 2 Compact全自动细菌培养鉴定仪和VITEK MS质谱仪(Bio-Merieux公司)。
药敏试剂:ATB Fungus 3 (Bio-Merieux公司),酵母菌生化—药敏试验卡(湖南长沙天地人),Sensititre YeastOne (ThermoFisher Scientific公司)。
1.3 方法及药敏结果判断标准
真菌菌株的筛选严格按照《全国临床检验操作教程》(第四版)进行操作[12],由于29家医院采用的鉴定或药敏试剂并不完全一致,因此各单位所采用的方法学存在一定差异,但药敏结果均统一采用美国临床和实验室标准协会(Clinical and Laboratory Standards Institute, CLSI)文件推荐的相关判断标准进行解读,念珠菌属(除光滑念珠菌对伏立康唑外)对氟康唑、伏立康唑、卡泊芬净、米卡芬净和阿尼芬净的折点参考CLSI M27M44S-ED3[13],曲霉菌中烟曲霉对伏立康唑的折点参考CLSI M38M51S-ED3[14],念珠菌属对伊曲康唑、泊沙康唑、两性霉素B,光滑念珠菌对伏立康唑,新生隐球菌对两性霉素B、氟胞嘧啶、氟康唑、伊曲康唑、伏立康唑、泊沙康唑,曲霉菌(除烟曲霉对伏立康唑外)对两性霉素B、卡泊芬净、伊曲康唑、泊沙康唑的流行病学界值(ECV)参考CLSI M57S-ED4[15],以白念珠菌ATCC 90028、近平滑念珠菌ATCC 22019作为药敏质控菌株。
1.4 数据分析
数据分析Whonet5.6软件及Microsoft Excel。
2 结果
2.1 送检样本患者的性别、年龄、科室分布情况
此次实验共收集16969株非重复真菌菌株,其中来源于男性患者的菌株数量10013株(59.00%),来源于女性患者的菌株数量6956株(41.00%)。从年龄分布来看,65岁以上群体10836株(63.85%),35~64岁群体4772株(28.12%),35岁以下群体1361株(8.03%),菌株主要来源于高龄群体。
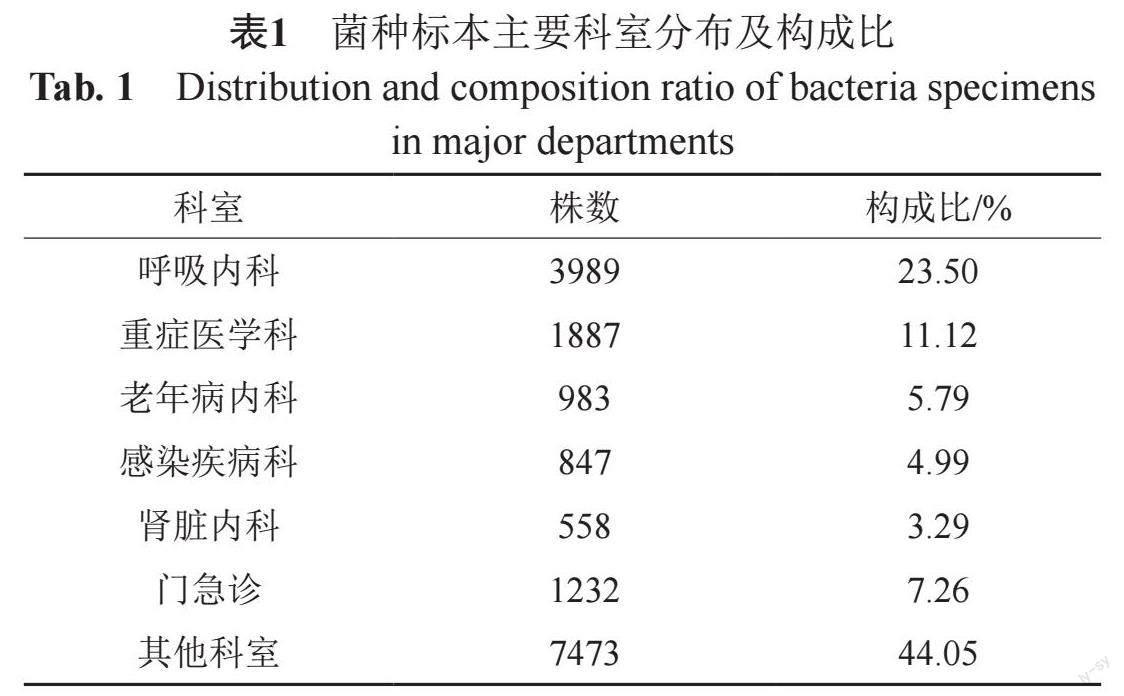
从科室分布来看,菌株来源以住院部来源为主,占92.74%(15737/16969);门急诊次之,占7.26%(1232/16969);其中住院部菌株来源数量以呼吸内科最多占23.5%(3989/16969),见表1。
2.2 标本类型分布及菌种构成比
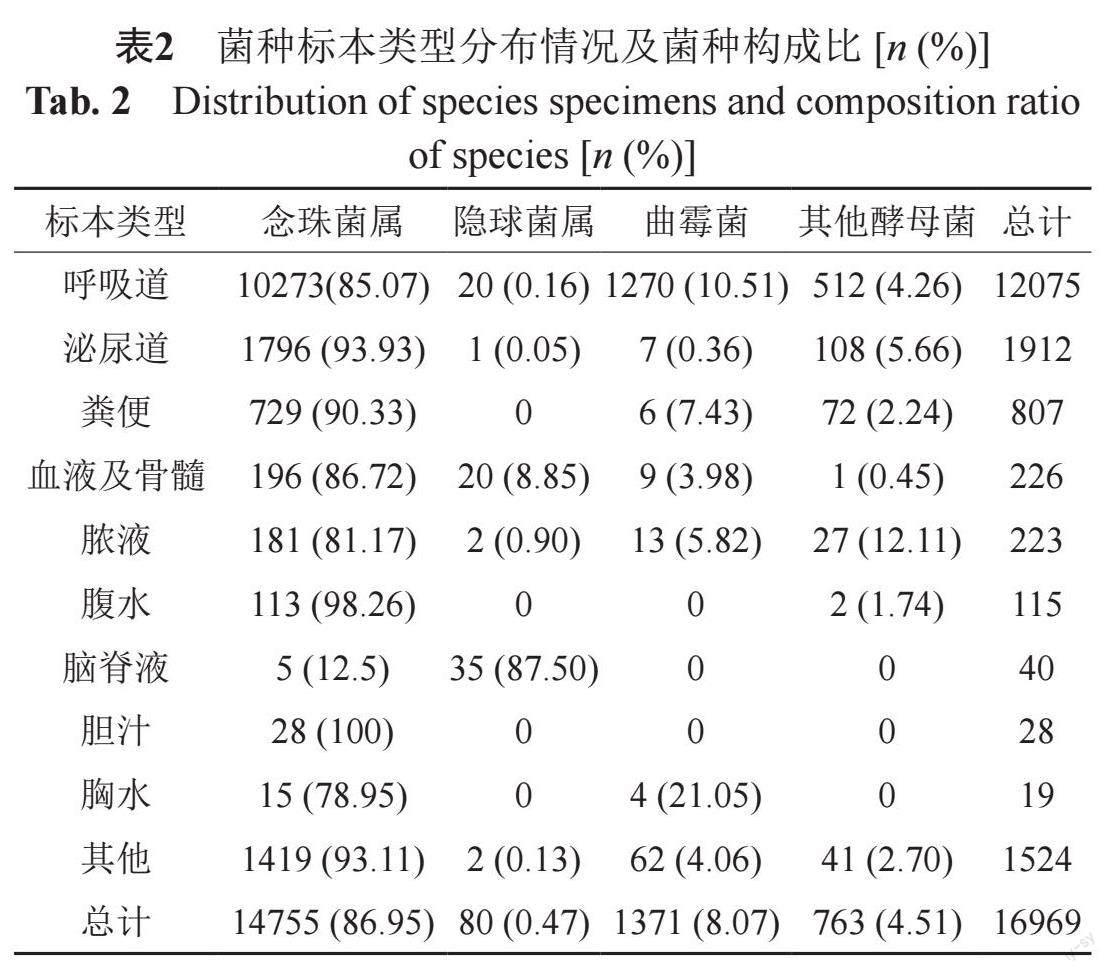
分离菌株以念珠菌属居多。其中念珠菌属、曲霉菌、其他酵母菌主要分离自呼吸道;隐球菌属主要分离自脑脊液。见表2
2.3 不同菌种对抗真菌药物的敏感性
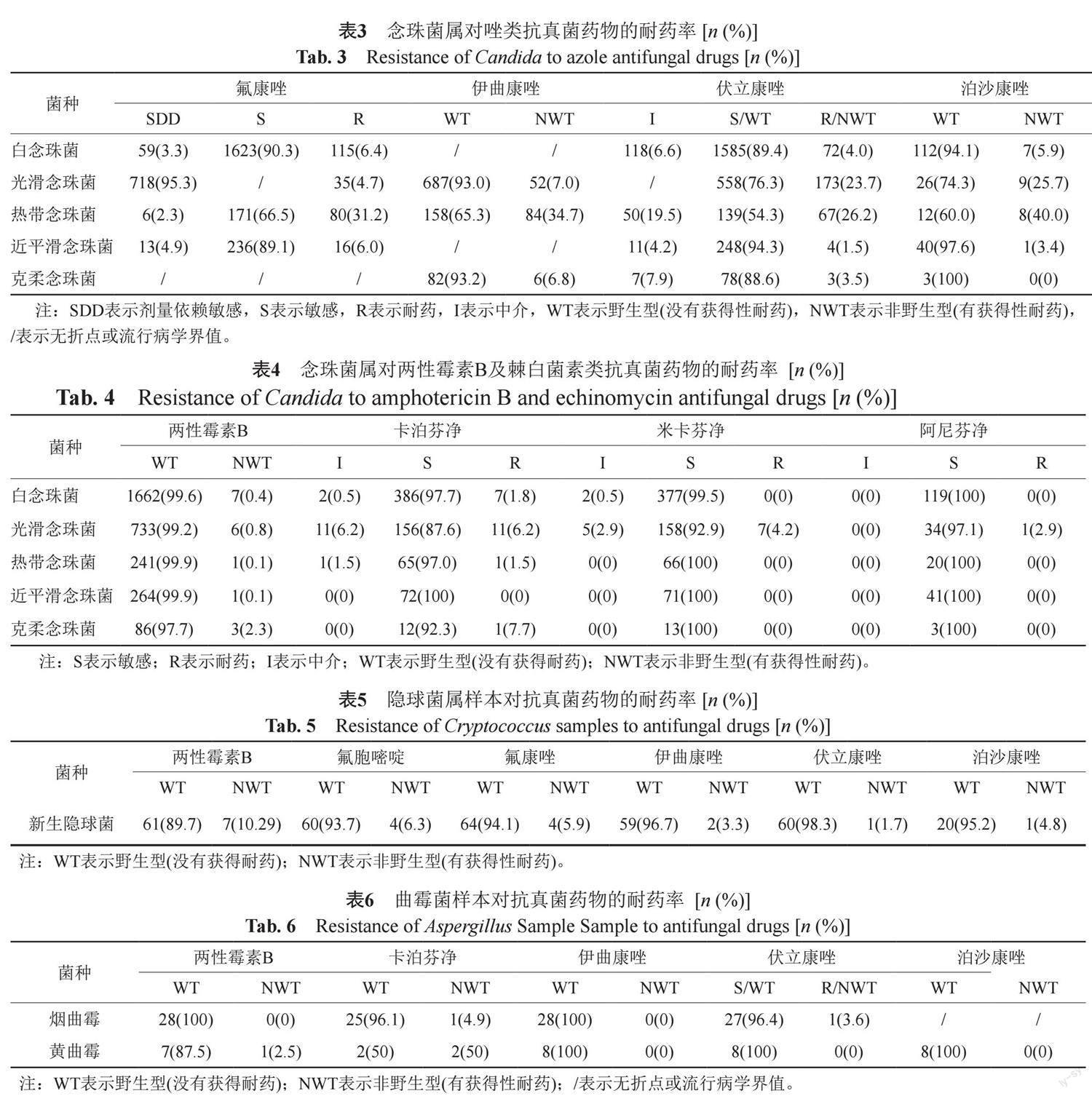
药敏统计数据均来自于血液及无菌体液分离菌株。在念珠菌属中(表3~4),白念珠菌、近平滑念珠菌、克柔念珠菌对抗真菌药物均具有较好的体外抗菌活性。光滑念珠菌对伏立康唑和泊沙康唑的非野生型占比较高,热带念珠菌对所有唑类药物的耐药率或非野生型占比均较高。
在隐球菌属中(表5),新生隐球菌对氟胞嘧啶和唑类药物的非野生型菌株占比介于1.7%~6.3%之间,对两性霉素B的非野生型菌株占比则略高,为10.29%。
在曲霉菌中(表6),烟曲霉对两性霉素B、卡泊芬净和唑类药物的非野生型菌株占比介于0至4.9%之间。黄曲霉对两性霉、唑类药物的非野生型菌株占比介于0至2.5%之间,但对卡泊芬净的非野生型占比达到50%。
3 讨论
通过对此次数据进行分析,分离菌株以念珠菌为主,且各类念珠菌感染均主要来自于呼吸道,这一结论与2021年本地区真菌监测数据类似[16],这是由于呼吸道是与外界相通的开放系统,更容易引起念珠菌属的定植,只有当机体免疫力下降时,定植的念珠菌才会致病,但近年来人们发现念珠菌的呼吸道定植与肺功能受損和恶化、意外体重减轻以及平均住院周期的延长具有一定的相关性[17]。在念珠菌属中白念珠菌占比最多,其原因可能是白念珠菌繁殖较快,其菌丝和芽管不易被吞噬,致病性强,容易引起感染,且能分泌出溶血磷脂酶,这有助于白念珠菌的黏附和渗透并最终侵入宿主细胞[18],光滑念珠菌和热带念珠菌的检出率分列第二和第三,有研究表明近年来非白念珠菌的感染率逐年增高[19],非白念珠菌的分离率上升与不同因素有关,例如持续抗真菌药物暴露、住院患者使用导管、癌症、年龄和地理分布等[20]。分离菌株主要来源于高龄患者,在高龄、基础疾病(糖尿病、COPD等)和免疫功能低下等多重因素下,高龄患者标本真菌检出率相对更高,临床医生应对存在真菌感染高危因素的患者给予足够的重视,及时了解其发生趋势、菌种分布及抗真菌药物耐药率,以期合理选择抗真菌药物。真菌感染分布于各个科室,检出最高的科室依次是呼吸内科、重症监护室和老年病内科,这3个科室由于广谱抗菌药物、侵入性治疗(如中央静置导管、导尿管和机械通气)以及所收治患者通常年龄较大且免疫力低下等因素,是真菌感染的重点防治科室。
在念珠菌属中,白念珠菌、近平滑念珠菌、克柔念珠菌对抗真菌药物均具有较好的体外抗菌活性,热带念珠菌对所有唑类药物的耐药率或非野生型占比均较高,但热带念珠菌对唑类药物的耐药率或非野生型占比呈现较为明显的地域性差异,如在北美地区热带念珠菌对氟康唑耐药率为2.9%[21],与本研究的31.2%有较大差异,推测上述差异产生的原因是由于菌株的地理分布差异所造成的药物压力选择所致(北美地区热带念珠菌分离占比低于中国地区)[9]。
CHIF-NET的数据显示中国热带念珠菌的氟康唑耐药率从2010年到2014年急剧增加(从6%到20%)[22],在此次实验中热带念珠菌对氟康唑的耐药率已经达到31.2%,有研究显示在中国地区热带念珠菌的唑类耐药83%由ERG11基因突变造成[23],值得注意的是根据最新的CLSI文件M27M44S-ED3[13],有些试剂盒无法覆盖热带念珠菌对氟康唑的折点,建议各医院对照折点选择满足临床并符合监测要求的药敏试剂盒。光滑念珠菌对伏立康唑和泊沙康唑的非野生型占比较高(23.7%和25.7%),需进行动态监测,但需要指出的是流行病学界值与临床治疗效果之间的相关性尚需更多的临床数据来进行验证,光滑念珠菌对卡泊芬净和米卡芬净耐药率由2021年的9.7%和7.3%[16]下降至6.2%和4.2%,但由于光滑念珠菌对卡泊芬净和米卡芬净的药敏数据量相对较少,且卡泊芬净体外药敏试验结果在不同实验室间差异很大,当与使用CLSI文件M27M44S-ED3[13]中描述的参考方法比较时,发现有假耐药的现象,导致这种差异的原因目前尚不清楚,因此需要各地区采用更加统一且符合监测要求的仪器与试剂,并进行动态监测。值得注意的是两性霉素B虽然对临床常见的念珠菌属均有较好的体外抗菌活性,但是两性霉素B主要经尿和胆汁排出,长期使用会导致其积聚在肾脏组织中,进而破坏肾脏组织细胞膜的通透性,并伤害肾脏和肾上腺,同时其不良反应还包括肝毒性、低钾血症和白细胞减少等[24],因此并不建议两性霉素B作为念珠菌属的常规经验用药。
在隐球菌属中,唑类药物及氟胞嘧啶均有良好的体外抗菌活性,但隐球菌属对两性霉素B的非野生型菌株占比达到了10.29%,比雷瑶等[25]的研究数据(2015年四川地区两性霉素非野生型菌株占比3.3%)升高了6.99%,证明在这7年四川地区隐球菌属的两性霉素非野生型菌株占比升高幅度较大,在隐球菌脑膜炎的治疗上,常采用两性霉素或两性霉素联合氟胞嘧啶一期诱导治疗后,再使用氟康唑进行巩固维持治疗[26],本地区非野生型菌株占比的逐年上升需要引起临床关注,在诱导治疗过程中尽量考虑两性霉素B与氟胞嘧啶或氟康唑的联用[26],以减少诱导性耐药的产生,且为了更准确的评估本地区念珠菌属的流行病学数据,建议各监测医院将菌株收集之后统一送中心实验室进行检测。
在此次29家监测医院中,仅有四川大学华西医院一家医院对曲霉菌进行了药敏实验,曲霉菌总体对伏立康唑、卡泊芬净和两性霉素B显示出较高的体外敏感性,但通过对比本地区2021年的数据[16],烟曲霉对两性霉素B非野生型占比下降较大(由2021年的39.1%下降到2022年的0%),黄曲霉对卡泊芬净非野生型占比升高较大(由2021年的0%升高到2022年的50%),推测是由于烟曲霉和黄曲霉的药敏数据量较少产生的统计误差所致,近年来侵袭性肺曲霉菌感染发病率逐渐升高,且许多国家也报道了新冠肺炎(COVID-19)合并肺曲霉病和毛霉菌肺炎的病例[27],因此对曲霉菌的监测显得尤为重要,未来需要更多地市州的监测数据以评估曲霉菌的流行病学。
近年来真菌药物耐药率的增加需要引起足够的关注,临床不仅需要规范抗真菌治疗方案,还需要紧密结合实验室药物敏感性结果调整治疗方案,一方面提高治疗效果,另一方面减少不规范用药导致的耐药率增加。
上述数据来源于四川地区29家医院,该29家医院并未采用统一仪器以及试剂,这对实验结果可能产生偏差。
致谢:感谢广安市人民医院江海燕、 四川大学华西第二醫院旷凌寒、成都市第三人民医院彭溪、成都医学院第一附属医院杨向贵、四川省肿瘤医院倪苏娇、西南医科大学附属医院张帮勤、广元市中心医院冯金芳、乐山市人民医院王燕玲、绵阳市第三人民医院马瑜珊、 德阳市人民医院陈宗耀、内江市第一人民医院钟涵宇、攀枝花市中心医院吴贤丽、 遂宁市中心医院黎昆、西昌市人民医院王玲、雅安市人民医院高伟、资阳市第一人民医院朱军、自贡市第一人民医院陈喻、四川省医学科学院殷琳、达州市中心医院孙昌君、绵阳市中心医院罗军、自贡市第四人民医院李玉梅、成都市第二人民医院张弦、南充市中心医院张兵、川北医学院附属医院谢宁、攀枝花市中西医结合医院王俊、成都市双流区第一人民医院郭培玲和甘孜藏族自治州人民医院陈丰银等同仁对本文的支持与帮助。
参 考 文 献
Yang Y, Guo F, Kang Y, et al. Epidemiology, clinical characteristics, and risk factors for mortality of early-and late-onset invasive candidiasis in intensive care units in China[J]. Medicine, 2017, 96(42): e7830.
Meis J F, Voss A. Candida auris in an Intensive Care Setting[J]. N Engl J Med, 2019, 380(9): 890-891.
Kainz K, Bauer M A, Madeo F, et al. Fungal infections in humans: The silent crisis[J]. Microb Cell, 2020, 7(6): 143-145.
Friedman D Z P, Schwartz I S. Emerging fungal infections: New patients, new patterns, and new pathogens[J]. J Fungi, 2019, 5(3): 67.
Perlin D S, Rautemaa-Richardson R, Alastruey-Izquierdo A. The global problem of antifungal resistance: prevalence, mechanisms, and management[J]. Lancet Infect Dis, 2017, 17(12): e383-e392.
Brown G D, Denning D W, Gow N A R, et al. Hidden killers: Human fungal infections[J]. Sci Transl Med, 2012, 4(165): 165rv13.
Lockhart S R, Guarner J. Emerging and reemerging fungal infections[J]. Semin Diagn Pathol, 2019, 36(3): 177-181.
Pappas P G, Lionakis M S, Arendrup M C, et al. Invasive candidiasis[J]. Nat Rev Dis Prim, 2018, 4(1): 18026.
Xiao M, Sun Z Y, Kang M, et al. Five-year national surveillance of invasive candidiasis: species distribution and azole susceptibility from the China Hospital Invasive Fungal Surveillance Net (CHIF-NET) study[J]. J Clin Microbiol, 2018, 56(7): e00577-18.
Arendrup M C, Patterson T F. Multidrug-resistant candida: Epidemiology, molecular mechanisms, and treatment[J]. J Infect Dis, 2017, 216(3): S445-S451.
Perlin D S, Rautemaa-Richardson R, Alastruey-Izquierdo A. The global problem of antifungal resistance: prevalence, mechanisms, and management[J]. Lancet Infect Dis, 2017, 17(12): e383-e392.
尚紅, 王毓三, 申子瑜, 等. 全国临床检验操作流程(第四版)[M]. 北京: 人民卫生出版社, 2014.
Clinical & Laboratory Standards Institute. Performance Standards for Antifungal Susceptibility Testing of Yeasts M27M44S[M]. 3nd Edition. CLSI Publishes, 2022.
Clinical & Laboratory Standards Institute. Performance Standards for Antifungal Susceptibility Testing of Filamentous Fungi M38M51S[S]. 3nd Edition. CLSI Publishes, 2022.
Clinical & Laboratory Standards Institute. Epidemiological Cutoff Values for Antifungal Susceptibility Testing, M57S[M]. 4nd Edition. CLSI Publishes, 2022.
张弦, 邓劲, 肖玉玲. 2021年四川省临床分离真菌的菌种分布及耐药性监测[J]. 国际检验医学杂志, 2023, 44(5): 518-522.
Pendleton K M, Huffnagle G B, Dickson R P. The significance of Candida in the human respiratory tract: Our evolving understanding[J]. Pathog Dis, 2017, 75(3): ftx029.
Chin V K, Lee T Y, Rusliza B, et al. Dissecting Candida albicans infection from the perspective of C. albicans virulence and omics approaches on host-pathogen interaction: A review[J]. Int J Mol Sci, 2016, 17(10): 1643.
孙伟, 苏建荣. 无菌部位念珠菌感染的菌群分布特点及药敏分析[J]. 临床和实验医学杂志, 2015, 14(20): 1741-1743.
Gómez-Gaviria M, Ramírez-Sotelo U, Mora-Montes H M. Non-albicans Candida species: Immune response, evasion mechanisms, and new plant-derived alternative therapies[J]. J Fungi, 2022, 9(1): 11.
Pfaller M A, Diekema D J, Turnidge J D, et al. Twenty years of the SENTRY antifungal surveillance program: results for Candida species from 1997—2016[J]. Open Forum Infect Dis, 2019, 6(Supplement_1): S79-S94.
Fan X, Xiao M, Liao K, et al. Notable increasing trend in azole non-susceptible candida tropicalis causing invasive candidiasis in China (August 2009 to July 2014): Molecular epidemiology and clinical azole consumption[J]. Front Microbiol, 2017, 8: 464.
Fan X, Xiao M, Zhang D, et al. Molecular mechanisms of azole resistance in Candida tropicalis isolates causing invasive candidiasis in China[J]. Clin Microbiol Infect, 2019, 25(7): 885-891.
徐貝雪, 刘泉波. 抗真菌药物临床应用及研究进展[J]. 现代医药卫生, 2022, 38(14): 2435-2440.
雷瑶, 肖玉玲, 何超, 等. 四川地区隐球菌临床分离株基因型和耐药性分析[J]. 四川大学学报(医学版), 2015, 46(1): 82-86.
温海. 隐球菌感染诊治专家共识[J]. 中国真菌学杂志, 2010, 5(2): 65-68.
Salmanton-García J, Sprute R, Stemler J, et al. COVID-19-associated pulmonary aspergillosis[J]. Emerg Infect Dis, 2021, 27(4): 1077-1086.

