氨氮急性胁迫对斑石鲷幼鱼行为模式和血液学参数的影响❋
张盛坤,徐进虎,孙雪倩,刘怡君,李 丽,2,李文升,庞尊方,田相利,2❋❋
(1.海水养殖教育部重点实验室(中国海洋大学),山东 青岛 266003;2.青岛海洋科学与技术试点国家实验室,山东 青岛 266237;3.莱州明波水产有限公司,山东 烟台 261442)
在水产养殖中,氨氮是蛋白质分解代谢的主要产物,占鱼类释放的含氮废物的50%以上[1]。氨氮积累是集约化水产养殖的主要问题之一。由于蛋白质饲料的大量投喂或水体的更新频率较低,氨氮可能会在水体中积累达到极高浓度[2]。水体中氨氮的积累会对水产养殖动物产生多种胁迫,导致鱼类神经元功能和大脑活动的改变,机体缺氧、厌食、生长迟缓、能量代谢紊乱、离子平衡破坏、抗病力减弱,以及鳃上皮组织病变[3]。
水生动物行为模式往往是生理和生态因素相互作用的综合反映,是评估污染物对鱼类和其他水生动物种群影响的优良重要之一[4]。环境污染物胁迫可影响猎物-捕食者的相互作用、求偶和其他重要行为,导致个体或种群在远低于产生形态或生理变化的毒物水平下发生破坏/混乱[5]。鱼类行为的改变也可以作为识别突发环境污染的一项敏感指标[6]。了解自然和非自然状态下鱼类的特定行为模式,对于水产养殖中的应激管理非常重要[7]。血液学参数是各种环境压力下鱼类健康状况的重要指标[8-9]。由于血液在营养、氧气和代谢废物的运输中起着重要作用,血液学参数可提供鱼类健康状况的关键信息[10]。在环境污染物胁迫下的鱼类的行为和生理受多种因素的影响,开展不同环境污染物胁迫下鱼类行为模式和血液学研究有着重要的价值。
斑石鲷(Oplegnathuspunctatus)隶属石鲷科(Oplegnathidae)石鲷属(Oplegnathus),体表呈黑褐色,具有不规则黑斑,主要分布于太平洋东北部的中国、朝鲜、日本等温热带近岸中下层海域,常见其栖息于近岸珊瑚礁或岩礁丛中[11]。斑石鲷肉质细腻,营养丰富,具有较高的食用价值和观赏价值,是新兴的名贵水产品种。目前山东、福建、广东、海南等沿海地区已经初步形成一定的斑石鲷养殖规模。对于斑石鲷的研究目前主要集中在基础生物学、生态学、苗种培育及病害防控等方面[12-15],在斑石鲷应对环境胁迫方面的研究尚不多见。基于此,本文研究了氨氮胁迫对斑石鲷行为模式和血液学参数的影响,以期为斑石鲷养殖管理及健康养殖技术的提高提供参考。
1 材料与方法
1.1 实验动物
本研究所用的斑石鲷幼鱼购自烟台莱州明波水产有限公司,斑石鲷幼鱼平均体长为(11.71±0.37)cm,平均体质量为(42.87±3.87)g,养殖用水为经过滤、消毒处理后的自然海水。实验前,斑石鲷幼鱼在实验室条件下先暂养10 d。暂养期间,光照周期为12 h光照∶12 h黑暗,水温控制在22~24 ℃,盐度在30~31,溶氧水平为7.2~7.4 mg/L。每天9:00和18:00各投喂一次,投喂量为实验鱼体质量的1.5%,投喂后1 h清理残饵粪便,每天换水一次,换水量为总水量50%左右。暂养结束后挑选质量、大小相似的健康斑石鲷幼鱼用于实验。
1.2 实验设计
正式实验前,对不同氨氮浓度对斑石鲷幼鱼影响进行了预实验,测得24 h-LC50为18.57 mg/L。根据预实验的结果,本研究设置了3个氨氮胁迫组,即6、12和18 mg/L,以氨氮浓度0 mg/L作为对照组,实验期间各处理组氨氮浓度基本保持稳定(见表1)。每个处理组分别设置三个重复,每个重复随机放入8尾规格相似的斑石鲷幼鱼。实验前停食24 h,实验期间不喂食,光照、水温、盐度和溶氧等条件同暂养期。胁迫实验开始前,先分别对各处理组的斑石鲷幼鱼行为拍摄1 h,作为氨氮胁迫前斑石鲷幼鱼行为的初始状态,之后对斑石鲷幼鱼进行8 h的氨氮胁迫。胁迫期间,利用摄像机对每个重复进行持续拍摄。最后将拍摄得到的视频分割成每个时长为10 min、分辨率为800像素×800像素的视频片段,再利用idtracker.ai[16]软件对这些视频片段进行数据化处理,得到鱼体中心点像素坐标。经过计算后,分别得到平均游泳速度、运动时间百分比、平均角速度、平均曲率、个体间距离和离散度6个行为参数。拍摄结束后,从每个玻璃鱼缸随机抽选3尾鱼,用MS-222麻醉后进行静脉抽血,测定血常规参数和血清生化指标。
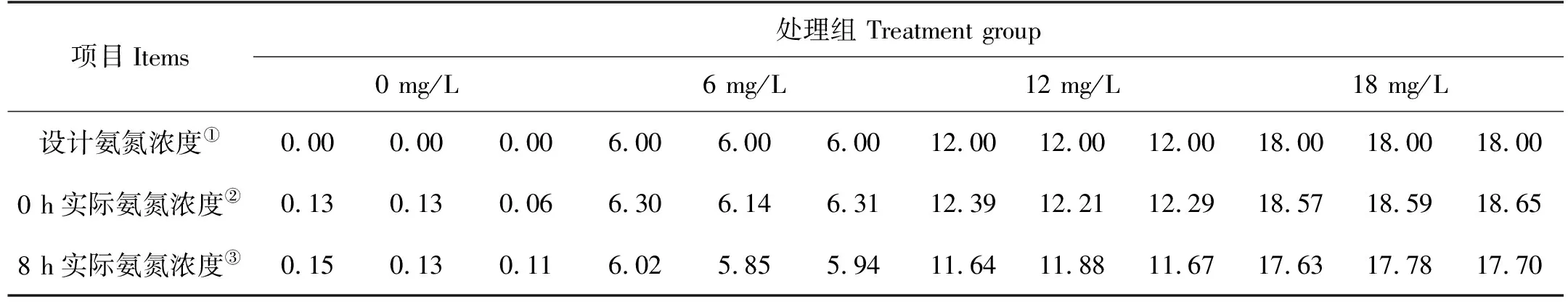
表1 实验前后各处理组水体中氨氮浓度变化
1.3 实验装置
本研究所用实验装置由养殖装置和录像装置两部分组成。其中,养殖装置为一个75 cm×60 cm×45 cm的玻璃水族箱,被过滤棉和分隔板缝合而成的隔离板分隔成60 cm×60 cm和15 cm×60 cm两部分,前者为拍摄区,后者为增氧区。隔离板可起到阻隔气泡的作用,可防止增氧区产生的气泡对拍摄产生影响。在养殖区外壁贴有白色不透明玻璃膜,以防止外界环境对斑石鲷幼鱼的可能视觉刺激。录像设备分为摄像头和录像机两部分,摄像头固定在养殖区的正上方,正对水面拍摄,拍摄视频帧率为25帧/s。实验装置具体如图1所示。
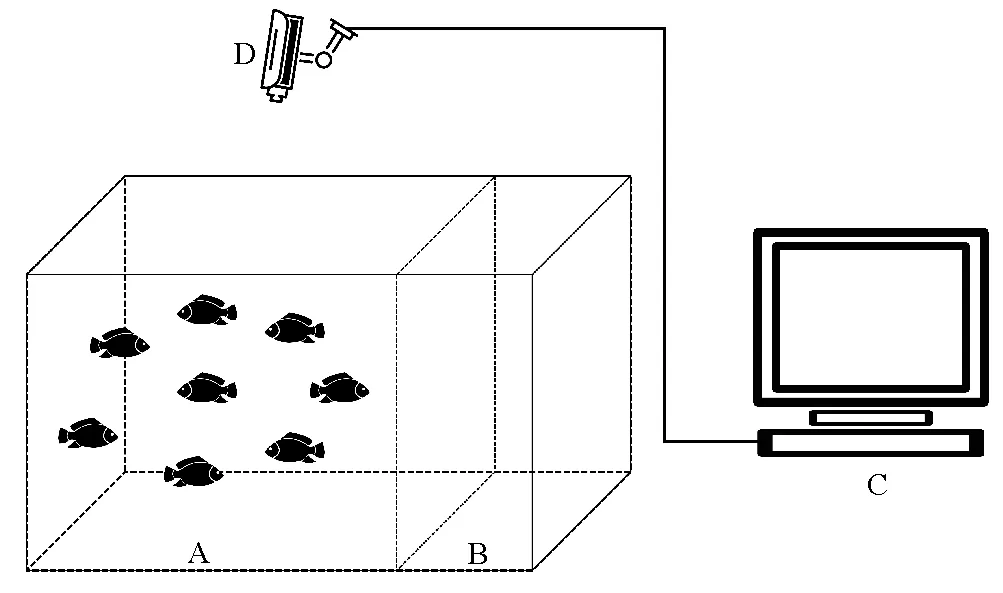
(A.拍摄区;B.增氧区;C.录像机;D.摄像头。A.Shooting area; B.Oxygenation zone; C.Video recorder; D.Camera.)
1.4 测定方法及主要参数
1.4.1 行为参数的测定 将拍摄后剪辑的视频片段导入视频分析软件idtracker.ai中,根据斑石鲷幼鱼的运动轨迹,输出斑石鲷幼鱼在每一帧图像中的像素坐标,再将该坐标单位转换成厘米后,利用相关公式进行计算,可得到鱼体平均游泳速度、运动时间百分比、平均角速度、平均曲率、个体间距离和离散度等主要行为参数。主要计算公式如下:
(1)平均游泳速度VS(cm/s):
(1)
平均游泳速度表示鱼群在一定时间内的活跃程度[17]。式中:Δx(t)为坐标x临近点间的差异;Δy(t)为坐标y临近点间的差异;dt为两个坐标点的时间间隔。
(2)运动时间百分比PM(%):
(2)
运动时间百分比反映鱼类的活跃程度[18],计算时将单尾鱼的游泳速度大于等于1 cm/s时设定为运动状态,游泳速度小于1 cm/s则定义为静止状态[19]。式中:T1表示鱼类进行游泳运动(游泳速度超过1 cm/s)的总时间,T2表示实验观察时间(每个视频片段的时长,即600 s)[20]。
(3)平均角速度VA((°)/s):
(3)
平均角速度反映鱼类改变运动方向的频率[19]。式中,Δx(t)为坐标x临近点间的差异,Δy(t)为坐标y临近点间的差异,25为每秒的帧数。
(4)平均曲率M((°)/m):
(4)
平均曲率表示游泳轨迹的弯曲程度,平均曲率越大表示运动的不规则性越高[19]。式中,Δx(t)为坐标x临近点间的差异,Δy(t)为坐标y临近点间的差异。
(5)个体间距离DI(cm):
(5)
个体间距离表示鱼群中个体之间的平均距离(cm),用于评价群体凝聚力[21]。该数值越小,鱼群的群体凝聚力越强。式中,xi和xj为鱼群中第i、j条鱼在t时刻的横坐标值,yi和yj为鱼群中第i、j条鱼在t时刻的纵坐标值,n=8。
(6)离散度SL(cm):
SL=
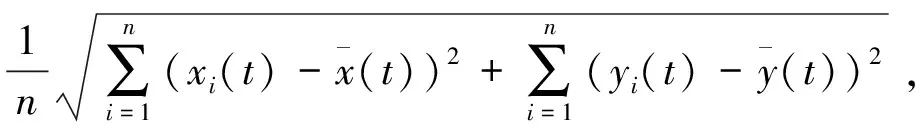
(6)
1.4.2 血液生理生化参数的测定 本研究测定的斑石鲷幼鱼的主要血液学参数包括血常规参数和血清生化指标。其中,血常规参数包括白细胞数量、血红蛋白含量、红细胞数量、红细胞压积,利用BC-1800 blood biochemical analyzer(Mindray,Delhi,India)全自动血液分析仪进行分析测定;血清生化指标包括葡萄糖、甘油三脂、总胆固醇、总蛋白、白蛋白、尿酸、乳酸脱氢酶、谷丙转氨酶、谷草转氨酶、碱性磷酸酶,使用CABAS C-311全自动生化分析仪进行分析测定。
1.5 数据处理
采用IBM SPSS Statistics 25.0数据处理软件对实验数据进行处理分析,结果以平均值±标准差的形式表示。对数据的正态性和方差齐性进行检验后,利用单因素方差分析(ANOVA)和Duncan’s多重比较对数据间差异显著性进行分析,并以P<0.05代表差异显著。同时,利用Spearson相关分析对实验期间斑石鲷幼鱼各行为参数的变化之间的相关性及胁迫8 h 后各行为参数和血液学参数之间的相关性进行分析。
2 结果
2.1 氨氮胁迫下斑石鲷幼鱼行为参数
实验期间不同氨氮浓度下斑石鲷幼鱼游泳速度的变化情况如图2所示。可以看出,对照组斑石鲷幼鱼平均游泳速度总体上比较稳定;6 mg/L组斑石鲷幼鱼的平均游泳速度呈随时间高低波动的状态,在8 h时与对照组无显著差异(P>0.05);12 mg/L组斑石鲷幼鱼平均游泳呈先上升后下降的趋势,在3 h达到最高,之后持续下降,8 h时显著低于对照组和6 mg/L组(P<0.05);18 mg/L组斑石鲷幼鱼平均游泳速度在0~1 h保持稳定,之后持续下降,然后保持在较低水平,在8 h时与12 mg/L处理组无显著差异(P>0.05),但显著低于对照组和6 mg/L处理组(P<0.05,见图2A)。在整个胁迫期间,斑石鲷幼鱼平均游泳速度随氨氮浓度的升高而显著下降(P<0.05,见图2B)。
不同氨氮浓度下斑石鲷幼鱼运动时间百分比随时间的变化如图3所示。可以看出,对照组斑石鲷幼鱼的运动时间百分比除在氨氮胁迫6 h时出现明显降低,其余时间基本保持稳定;6 mg/L胁迫组在1 h时显著降低,之后保持相对稳定,但总体上一直低于对照组;12 mg/L组在0~4 h之间持续下降,在4~7 h之间保持相对稳定,在7~8 h之间略有增加,但在2~8 h期间均显著低于其他处理组(P<0.05);18 mg/L组在0~1 h之间迅速降低,在1~3 h之间则显著增加,在3~8 h保持相对稳定并与对照组无显著差异(P>0.05,见图3A)。在整个胁迫期间,6和12 mg/L组斑石鲷幼鱼运动时间百分比均显著低于对照组(P<0.05),其中12 mg/L组最低,18 mg/L组与对照组无显著差异(P>0.05,见图3B)。
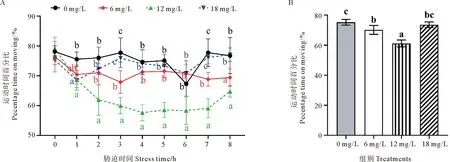
(A.不同氨氮浓度下斑石鲷幼鱼运动时间百分比随时间的变化;B.整个胁迫期间斑石鲷幼鱼的平均运动时间百分比。A.Changes of the percentage time on moving of juvenile spotted knifejaw with time under different ammonia nitrogen concentrations; B.The percentage time on moving of juvenile spotted knifejaw during the whole stress period.)
不同氨氮浓度下斑石鲷幼鱼平均角速度变化见图4。各处理组平均角速度均随胁迫时间的延长而呈现出小幅波动,但基本都维持在3~5(°)/s之间(见图4A)。在整个胁迫期间各处理组无显著差异(P<0.05,见图4B)。

(A.不同氨氮浓度下斑石鲷幼鱼平均角速度随时间的变化;B.整个胁迫期间斑石鲷幼鱼的总平均角速度。A.Changes of average angular velocity of juvenile spotted knifejaw with time under different ammonia nitrogen concentrations; B.Average angular velocity of juvenile spotted knifejaw during the whole stress period.)
不同氨氮浓度下斑石鲷幼鱼平均曲率的变化如图5所示。可以看出,对照组和6 mg/L组斑石鲷幼鱼平均曲率一直维持在较低水平;12 mg/L组在0~5 h之间保持相对稳定,在6 h时迅速增加,显著高于其他处理组(P<0.05),7和8 h虽有所下降,但仍显著高于其他处理组(P<0.05);18 mg/L组总体上呈现先增加后降低的趋势,在4 h时达到最高,显著高于其他处理组(P<0.05),在4~8 h之间持续降低,但在8 h时仍显著高于对照组和6 mg/L组(P<0.05,见图5A)。在整个胁迫期间,6 mg/L组和对照组无显著差异(P>0.05),而12和18 mg/L组斑石鲷幼鱼平均曲率则显著高于对照组(P<0.05,见图5B)。
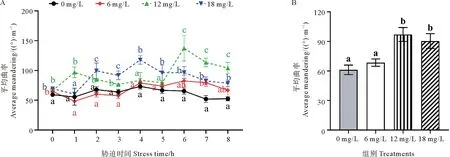
(A.不同氨氮浓度下斑石鲷幼鱼平均曲率随时间的变化;B.整个胁迫期间斑石鲷幼鱼的总平均曲率。A.Changes of average meandering of juvenile spotted knifejaw with time under different ammonia nitrogen concentrations; B.Average meandering of juvenile spotted knifejaw during the whole stress period.)
不同氨氮浓度下斑石鲷幼鱼个体间距离的变化如图6所示。对照组斑石鲷幼鱼个体间距离保持相对稳定;6 mg/L组在0~1 h之间迅速降低,在1~4 h之间保持相对稳定,在4~8 h之间则持续增加,到8 h时个体间距离与对照组无显著差异(P>0.05);12 mg/L组在1~2 h之间增加,之后维持相对稳定,并在2~8 h之间期间总体上高于其他处理组;18 mg/L组在0~1 h之间显著降低,在1~4 h显著增加,在4~8 h之间则保持相对稳定并与对照组无显著差异(P>0.05,见图6A)。在整个胁迫期间,6 mg/L组斑石鲷幼鱼个体间距离显著低于对照组(P<0.05),12 mg/L组显著高于对照组(P<0.05),而18 mg/L组与对照组无显著差异(P>0.05,见图6B)。

(A.不同氨氮浓度下斑石鲷幼鱼个体间距离随时间的变化;B.整个胁迫期间斑石鲷幼鱼的平均个体间距离。A.Changes of inter-individual distance of juvenile spotted knifejaw with time under different ammonia nitrogen concentrations; B.Inter-individual distance of juvenile spotted knifejaw during the whole stress period.)
不同氨氮浓度下斑石鲷幼鱼分布离散度的变化如图7所示。对照组斑石鲷幼鱼离散度保持相对稳定;6 mg/L组在0~1 h之间迅速降低,在1~4 h之间保持相对稳定,在4~8 h之间则持续增加,到8 h时离散度与对照组无显著差异(P>0.05);12 mg/L组在1~2 h之间增加,之后维持相对稳定,并在2~8 h之间期间总体上高于其他处理组;18 mg/L组在0~1 h之间显著降低,在1~4 h持续回升,在4~8 h之间则保持相对稳定并与对照组无显著差异(P>0.05,见图7A)。在整个胁迫期间,6 mg/L组斑石鲷幼鱼离散度显著低于对照组(P<0.05),12 mg/L组显著高于对照组(P<0.05),而18 mg/L 组与对照组无显著差异(P>0.05,见图7B)。
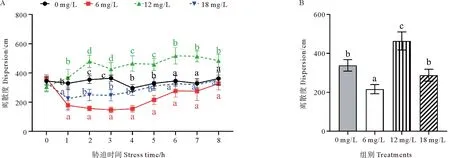
(A.不同氨氮浓度下斑石鲷幼鱼离散度随时间的变化;B.整个胁迫期间斑石鲷幼鱼的离散度。A.Changes of dispersion of juvenile spotted knifejaw with time under different ammonia nitrogen concentrations; B.Dispersion of juvenile spotted knifejaw during the whole stress period.)
2.2 氨氮胁迫下斑石鲷幼鱼行为参数之间的相关性
表2显示的是不同处理组内各行为参数之间的相关性分析。可以看出,对照组与各胁迫组的个体间距离和离散度均显著正相关(P<0.05)。氨氮胁迫组与对照组在行为参数的相关性上存在一些共性差异:对照组斑石鲷幼鱼平均游泳速度与运动时间百分比、平均角速度与曲率均呈显著正相关关系(P<0.05),而在各胁迫组中,上述指标均未见显著相关(P>0.05);对照组平均游泳速度与平均曲率未见显著相关(P>0.05),而在各胁迫组中,斑石鲷幼鱼平均游泳速度与平均曲率均呈显著负相关关系(P<0.05)。
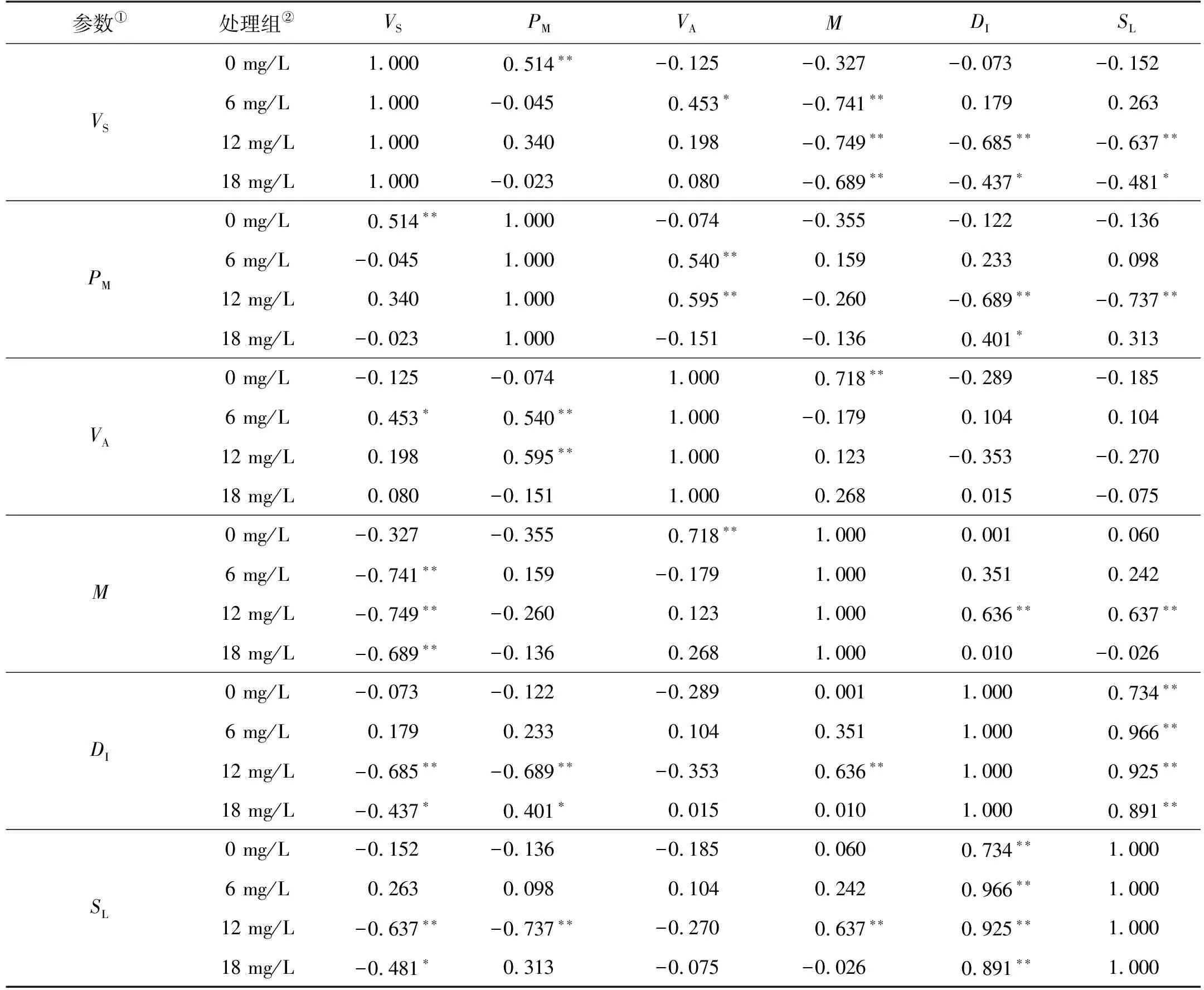
表2 不同处理组各行为参数之间的相关性
各胁迫组斑石鲷幼鱼之间在行为参数的相关性上也存在差异。其中,6 mg/L组斑石鲷幼鱼平均游泳速度与平均角速度呈显著正相关关系(P<0.05),运动时间百分比与平均角速度也呈显著正相关关系(P<0.05);12 mg/L组斑石鲷幼鱼平均游泳速度、运动时间百分比和平均曲率均与个体间距离和离散度呈显著负相关关系(P<0.05),运动时间百分比与平均角速度则呈显著正相关关系(P<0.05);18 mg/L组平均游泳速度、运动时间百分比与个体间距离呈显著负相关关系(P<0.05),平均游泳速度与曲率呈显著负相关关系(P<0.05)。
2.3 氨氮胁迫对斑石鲷幼鱼血液生理生化参数的影响
氨氮胁迫对斑石鲷幼鱼血液生理生化参数的影响见表3。可以看出,随着氨氮浓度的升高,斑石鲷幼鱼血液中白细胞数量、血红蛋白浓度和红细胞数量均经历了下降-上升-下降的过程。其中,6 mg/L组白细胞数量、血红蛋白浓度和红细胞数量显著低于对照组(P<0.05);12 mg/L组白细胞数量、血红蛋白浓度和红细胞数量与对照组无显著差异(P>0.05);18 mg/L组白细胞数量、血红蛋白浓度和红细胞数量均显著低于对照组(P<0.05)。12 mg/L组红细胞压积显著高于对照组,6和18 mg/L组与对照组无显著差异(P>0.05)。各胁迫组斑石鲷幼鱼血清中的葡萄糖、总胆固醇、白蛋白和总蛋白浓度均与对照组无显著差异(P>0.05)。6和12 mg/L组乳酸脱氢酶活性显著低于对照组(P<0.05),18 mg/L组显著高于对照组(P<0.05)。6和12 mg/L组谷丙转氨酶活性显著低于对照组(P<0.05),18 mg/L组显著高于对照组(P<0.05)。6和12 mg/L组谷草转氨酶活性显著低于对照组(P<0.05),18 mg/L组与对照组无显著差异(P>0.05)。血清中甘油三酯、尿酸浓度和碱性磷酸酶活性均呈随氨氮浓度升高而升高的趋势。
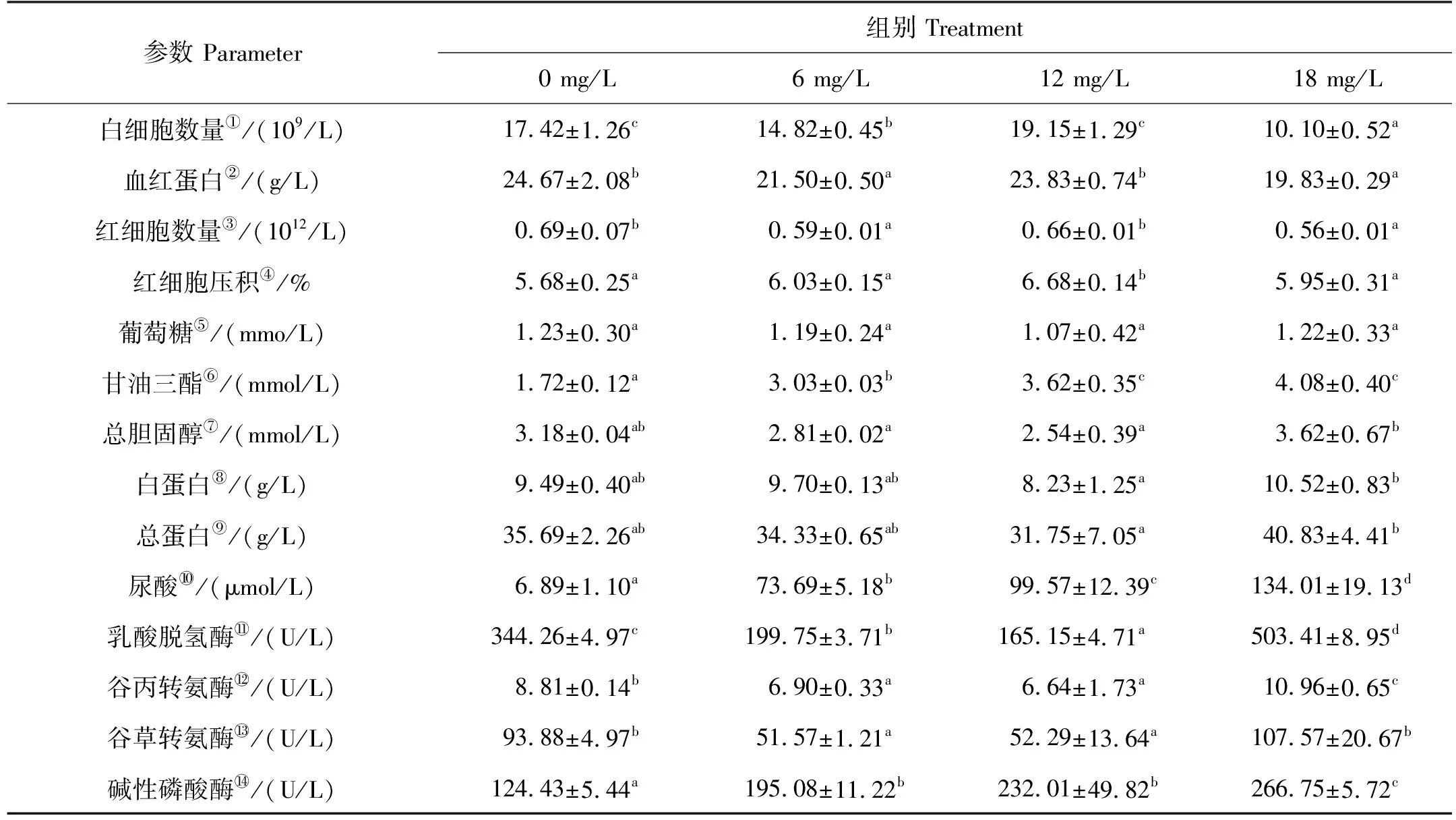
表3 氨氮胁迫对斑石鲷幼鱼血液生理生化参数的影响
2.4 斑石鲷幼鱼的行为特征与血液学参数的相关性分析
氨氮胁迫8 h后斑石鲷幼鱼行为参数与血液学参数之间的相关性分析结果见表4。可以看出,斑石鲷幼鱼平均游泳速度与甘油三酯、尿酸浓度和碱性磷酸酶活性呈显著负相关(P<0.05);运动时间百分比与总胆固醇浓度及乳酸脱氢酶、谷草转氨酶活性呈显著正相关(P<0.05);平均曲率与红细胞压积、甘油三酯、尿酸浓度和碱性磷酸酶活性呈显著正相关(P<0.05);而平均角速度、个体间距离和离散度与各种血液学参数的相关性均不显著(P>0.05)。总之,平均游泳速度、运动时间百分比和平均曲率均与多种血液学参数存在显著相关关系。

表4 斑石鲷幼鱼行为参数和血液学参数之间的相关性
3 讨论
3.1 氨氮急性胁迫对斑石鲷幼鱼行为模式的影响
鱼类行为的改变可以作为识别突发环境污染的敏感指标[6],因此深入了解自然和非自然状态下鱼类的特定行为模式的差异对于水产养殖中的应激管理非常重要[7]。通常,正常状态和非正常状态下鱼类的行为会存在明显差异。鱼类群体在正常条件下游动活跃、分布均匀,各行为参数的变化不大[17],但在恶劣环境条件下,则会表现出活跃性降低、不稳定游动增加、底部活动时间长和凝聚力增强等防御性策略[23]。在本研究中,主要使用游泳速度、运动时间百分比、角速度、游泳轨迹曲率、个体间距离和个体分布的离散度等行为学参数研究了不同氨氮浓度下斑石鲷幼鱼行为变化的总体特征。平均游泳速度是鱼类行为学研究中常用的指标,运动时间百分比反映鱼类的活跃程度,平均角速度则反映鱼类改变运动方向的频率。游泳轨迹的曲率是反映不稳定运动的重要指标,指每游动1 m的总转弯角度,较高的曲率度意味着较高的“之”字形游泳行为[24]。个体间距离反映了鱼类个体之间的聚集程度,而离散度则反映了个体分布的均匀程度。研究表明,环境污染物胁迫可导致水生动物的行为模式发生明显改变。例如,氨氮胁迫使虹鳟(Oncorhynchusmykiss)平均游泳速度显著降低[20],本研究中斑石鲷幼鱼的游泳速度随氨氮浓度的升高而显著降低,表明氨氮胁迫导致斑石鲷幼鱼的行为活动明显受到抑制。与C60纳米颗粒胁迫导致斑马鱼(Daniorerio)的曲率显著升高相似[24],本研究也发现中浓度和高浓度氨氮胁迫(12和18 mg/L)使斑石鲷幼鱼的曲率显著上升,而且从胁迫初期的逃避行为向不活跃状态转变的过程中一直伴随着曲率的增加,表明其运动轨迹的不规则性增加[21]。更紧密的集群一般反映出水生动物更高的焦虑水平[25]。本研究发现,6 mg/L氨氮胁迫下斑石鲷幼鱼个体间距离显著降低,而12和18 mg/L下鱼类个体间距离则出现不同程度的增加,这表明低浓度的氨氮胁迫增加了斑石鲷幼鱼的焦虑水平,而中、高浓度氨氮胁迫反而降低了斑石鲷幼鱼的焦虑程度。这种现象在其他研究中也有发现,例如高浓度苯并芘暴露显著增加了斑马鱼个体间距离,而低浓度暴露则没有出现[5];在石油中暴露24 h降低了大西洋黄鱼(Micropogoniasundultus)的群体凝聚力,使其焦虑行为明显降低[26]。程淑红等发现环境污染物刺激会使尼罗罗非鱼(Oreochromisniloticus)群体的离散程度增大[22],本研究也发现12 mg/L氨氮胁迫下斑石鲷幼鱼分布的离散程度会显著增加。综合本研究结果,氨氮胁迫下斑石鲷幼鱼的平均游泳速度、曲率、个体间距离、离散度这4个行为参数的变化比其他参数更明显,可作为表征斑石鲷幼鱼对不同浓度氨氮胁迫行为响应的关键指标。
本研究发现斑石鲷幼鱼在不同的氨氮浓度下行为参数随时间的变化呈现出不同的特征。对照组斑石鲷幼鱼总体上呈现出活跃且散漫的状态,游泳速度较高,各行为参数在实验期间变化不大;在低浓度氨氮胁迫下,斑石鲷幼鱼经历了游泳速度波动和集群凝聚力增强到逐渐恢复的过程,个体间距离和离散度先降低再恢复;在中浓度氨氮胁迫下,斑石鲷幼鱼在前期表现出明显的逃避行为,游泳速度保持在较高水平,同时伴随着运动时间的减少和个体间距离、离散度的增加,后期则呈现出活跃性降低状态,运动时间维持在较低水平并伴随平均游泳速度降低和平均曲率的增加;而在高浓度氨氮胁迫下,斑石鲷幼鱼在整个实验期间表现出从逃避行为到活跃性降低和游泳轨迹曲率增加,再到行为呆滞、对反应降低的行为变化过程,前期平均游泳速度降低和平均曲率增加,后期平均游泳速度维持在较低水平,平均曲率则逐渐降低。可以看出,斑石鲷幼鱼在低氨氮浓度下可逐步适应环境胁迫,在中浓度胁迫初期表现出快速游泳和四散逃离的逃避行为,经过一定时间的持续胁迫后,这种行为会被明显的不活跃所代替。而在高浓度胁迫下,斑石鲷幼鱼初期的活动行为便受到抑制,活跃性明显降低,但在实验结束时,除了平均游泳速度显著降低外,其他各指标均反而又趋同于对照组,这种对高浓度氨氮毒性刺激下行为反应的缺失,可能与高浓度氨氮胁迫下斑石鲷幼鱼机体生理机能已受到严重破坏、无法有效调节有关。与此相似,在不同浓度氨氮胁迫下的尼罗罗非鱼也表现出了类似的行为特征[17]。这一结果表明,氨氮胁迫对斑石鲷幼鱼行为的影响存在明显时间和剂量效应,即在低浓度或短时间氨氮胁迫下,斑石鲷幼鱼能通过机体调节逐渐适应胁迫环境,表现出积极的适应性行为,但随着氨氮浓度的增加和胁迫时间的延长,氨氮的毒性效应逐渐超过鱼体的调节阈值,导致鱼类的行为受到抑制。
为了加深对不同氨氮胁迫下斑石鲷幼鱼行为特征的理解和精准表征,本研究对斑石鲷幼鱼各行为参数进行了相关性分析。结果表明,各胁迫组和对照组的个体间距离和离散度均呈显著正相关关系,说明斑石鲷幼鱼的集群凝聚力和分布的均匀程度呈现出协同变化趋势。各胁迫组平均游泳速度与平均曲率间均存在显著负相关关系,但对照组上述参数之间则未见显著相关。结合各胁迫组平均游泳速度和曲率变化情况,可以看出,游泳速度下降和曲率增加可能是斑石鲷幼鱼对氨氮胁迫响应的典型行为特征。
3.2 急性氨氮胁迫对斑石鲷幼鱼血液学参数的影响
血液学参数是用来评估暴露于环境污染物中鱼类健康状况的关键指标[27]。氨氮胁迫可导致鱼类循环系统中氨的积累。由于氨与血液中的血红蛋白有很高的亲和力,它会取代氧气,从而影响某些血液学特性,导致鱼体呈缺氧状态[28]。白细胞是鱼类的主要免疫细胞,能吞噬异物并产生抗体,具有抵抗病原体入侵的作用,其数量或功能的改变可导致机体免疫功能的变化[29]。本研究发现,6 mg/L氨氮胁迫下斑石鲷幼鱼血液中白细胞数量、血红蛋白浓度和红细胞数量均出现不同程度降低,说明即使是低浓度氨氮短时间胁迫也会对斑石鲷幼鱼血液指标产生明显影响;而在12 mg/L氨氮胁迫下,斑石鲷幼鱼上述血液学参数相比6 mg/L氨氮胁迫均出现显著增加,说明斑石鲷幼鱼在中浓度氨氮胁迫下处于应激状态,机体通过增强供氧水平和免疫力来增强对环境的适应力;但在高浓度氨氮胁迫下,斑石鲷幼鱼血液中白细胞数量、血红蛋白浓度和红细胞数量均显著低于其他处理组,这一结果可能会导致机体非特异性免疫力降低和组织缺氧[1],斑石鲷幼鱼在实验结束前表现出的低活跃性特征就可能与组织缺氧有关。
血糖作为一种直接供能物质,可为环境胁迫下鱼体维持内环境稳定、提高渗透调节和物质代谢提供能量保障[30]。本研究中氨氮胁迫下斑石鲷幼鱼血糖浓度与对照组相比未见显著差异,而甘油三酯浓度则均显著高于对照组,这可能与斑石鲷幼鱼通过加速脂肪分解来提高机体能量供给以维持血糖稳定和应对氨氮胁迫有关[31-32]。尿酸是嘌呤代谢的终产物,血清尿酸含量可直接反映机体蛋白质分解代谢水平[33]。在本研究中,斑石鲷幼鱼血清尿酸含量随氨氮浓度的升高而升高,表明为应对氨氮胁迫,斑石鲷幼鱼对能量的需求提高,大量蛋白质用于分解代谢。
乳酸脱氢酶活性可反映机体能量代谢的水平,肌体受损会导致乳酸脱氢酶活性增高[34-35]。本研究中,18 mg/L氨氮胁迫下斑石鲷幼鱼血清中乳酸脱氢酶活性显著上升,说明高浓度氨氮胁迫导致斑石鲷幼鱼表现出了疲劳损伤症状[34]。谷丙转氨酶和谷草转氨酶是存在于细胞膜、细胞质和线粒体中的关键酶。当肝细胞膜和线粒体膜受损时,膜通透性增加,谷丙转氨酶和谷草转氨酶被释放进入血液中[36]。在18 mg/L氨氮胁迫下,斑石鲷幼鱼血清谷丙转氨酶和谷草转氨酶均不同程度高于对照组,表明高浓度氨氮急性胁迫可能导致斑石鲷幼鱼的肝脏功能受到损害。碱性磷酸酶是鱼类重要的非特异性免疫标志酶之一,主要存在于肝脏、肾脏和血红细胞中[37]。高浓度氨氮可造成细胞损伤,导致血浆中碱性磷酸酶活性在短时间快速升高[38]。本研究各胁迫组石斑鱼幼鱼碱性磷酸酶活性均显著高于对照组,表明各处理组斑石鲷幼鱼均出现了不同程度的细胞损伤。
鱼类行为是机体各种生理现象在外部表现的综合结果[39]。本研究对氨氮胁迫8 h后斑石鲷幼鱼个体行为参数和血液学指标进行了相关分析。结果表明,表征斑石鲷幼鱼行为特征的平均游泳速度和平均曲率与总胆固醇、尿酸浓度及碱性磷酸酶活性均显著相关,而运动时间百分比则与总胆固醇浓度和乳酸脱氢酶、谷草转氨酶活性显著相关。由此可见,氨氮胁迫下斑石鲷幼鱼的行为模式与机体生理状态直接相关。本研究中,在高浓度氨氮胁迫下,斑石鲷幼鱼在实验结束前对氨氮胁迫缺乏行为反应,这种现象可能与鱼类机体生理功能的严重受损有关。
4 结语
氨氮胁迫会导致斑石鲷幼鱼行为模式发生明显改变,主要表现为平均游泳速度降低和平均曲率升高。同时氨氮胁迫导致斑石鲷幼鱼的血液参数发生改变,造成机体不同程度的生理损伤。平均游泳速度、运动时间百分比和平均曲率与多种血液学参数显著相关,这显示出斑石鲷幼鱼在氨氮胁迫下行为模式变化与其生理状态改变直接相关。

