cd36基因在斑马鱼抗鳗弧菌免疫调控中的作用❋
李 梦,王 敏,钟慎杰,邢泽宇,刘振辉
(中国海洋大学海洋生命学院,海洋生物多样性与进化研究所,山东 青岛 266003)
清道夫受体(Scavenger receptors, SR)由一个结构多样的跨细胞膜糖蛋白家族组成。根据蛋白的多个结构域,它们被分为8个类别(A~H)[1]。CD36(或称为脂肪酸转位酶,FAT)属于B族清道夫受体,具有两个跨膜结构域、一个胞外环和两端较短的胞内尾巴[1-4],是该家族中第一个被成功鉴定的。它在巨噬细胞、血小板、脂肪细胞、内皮细胞和上皮细胞中表达[1]。CD36能与多种配体结合,包括:天然的、氧化的和乙酰化的低密度脂蛋白[2,5];带负电的磷脂质[6]、长链脂肪酸、血栓反应蛋白-1[7];纤维样淀粉状蛋白和凋亡细胞[8-9]。因此,它与多种生理过程有关,如血管生成、脂质代谢和饮食偏好等[5]。有大量的关于CD36介导了修饰的LDL内吞,其在泡沫细胞形成、动脉粥样硬化和阿尔茨海默病中作用的研究[1,10-12]。
对哺乳动物CD36的研究发现,其在先天性免疫和宿主识别外源性病原体和调节炎症细胞因子的产生中具有重要作用[13-17]。CD36已经被证实是识别脂磷壁酸(LTA)和某些甘油酸二酯的必要辅助受体,能激活TLR2/6(Toll like receptor2/6)[18]。在小鼠巨噬细胞中敲除Cd36基因,会减少细菌诱导的IL-6的分泌[19]。对于子宫内膜异位者,其腹腔巨噬细胞内Cd36表达量明显降低,细胞吞噬功能也有明显受损[20]。CD36受体可与Src家族中蛋白酪氨酸激酶(PTKs)家族的Fyn、Yes和Lyn 3个成员结合,而这3个成员已被证实是血小板中参与激活MAPK的上游GTPases[21-22]。也有报道,CD36以不依赖于TLR2/4的方式通过JNK途经介导抗细菌免疫信号[13]。此外,在以果蝇为模型的实验中,CD36家族成员被证明是机体吞噬微生物和高效清除细菌所必需的[23-24]。
鱼类的生理反应与哺乳动物有明显的不同,类似地,鱼类免疫反应的分子机制可能也与哺乳动物不同[25-27]。事实上,CD36在鱼类免疫反应中的确切功能仍是一个需要进一步探究的课题。例如,cd36基因并不在成年鲤鱼的免疫器官和细胞中表达[28];但在斑马鱼体内cd36被证实能够与细菌结合[28],并且敲除cd36基因的斑马鱼幼鱼会更易被细菌感染[29]。通过本实验,发现注入鳗弧菌后,突变体斑马鱼(cd36-/-)的活跃度和存活率明显低于野生型斑马鱼(WT)。在cd36-/-斑马鱼中,与抗原呈递相关的基因mhc1和cd8、穿孔素基因perforin、补体系统关键基因c3和细胞因子基因il4的表达均明显下调。本研究为CD36在鱼类抗菌免疫中的功能提供了新证据。
1 材料与方法
1.1 斑马鱼和鳗弧菌
实验所用动物均遵循中国海洋大学动物保护与使用委员会制定的伦理准则(许可证号码, SD2007695)。本研究前期利用TALENs技术从斑马鱼AB系中建立了斑马鱼cd36敲除突变株(cd36-/-)[30]。斑马鱼在标准鱼类养殖设施中饲养和繁殖,并保持L∶D=14 h∶10 h黑暗的光周期。
实验所用鳗弧菌为中国海洋大学张晓华教授所赠。菌株在2216E培养液中28 ℃扩大培养24 h,4 ℃、8 000g离心20 min收获,用0.01 mol/L生理盐水(PBS,pH=7.2)重悬,终浓度1×108CFU/mL。
1.2 鳗弧菌刺激
随机抽取突变体(cd36-/-)和野生型(WT)成年斑马鱼每组各10尾(0.40±0.05)g,腹腔注射活鳗弧菌20 μL(1×108CFU/mL)。注射24 h后监测疾病症状、活动能力和死亡率。该实验独立重复进行3次。
1.3 转录组测序
斑马鱼在组织采集前24 h开始禁食。每组随机选取3条突变体(cd36-/-)和3条野生型(WT)成年斑马鱼(0.40±0.05)g,每条鱼腹腔注射活鳗弧菌20 μL(1×108CFU/mL)。注射后4 h,将每组3条鱼的头肾组织混合并提取RNA,每组准备3个独立的样本用于转录组测序。
用RNAiso plus(TaKaRa)试剂盒按说明书指导提取总RNA,用Agilent 2100 RNA Nano 6000试剂盒(Agilent Technologies, CA, USA)检测RNA提取质量。使用结合寡核苷酸(dT)的磁珠富集mRNA,反转录cDNA片段,通过添加单个‘A’碱基进行末端修复。连接产物经琼脂糖凝胶电泳筛选,PCR扩增后送AnnoroadTechnology公司(Beijing, China)通过Illumina HiSeq 4000A平台测序。
测序结果结合local BLAST programsagainst NCBI non-redundant(nr)protein、Swiss-Prot/TrEMBL、Clusters of Orthologous Groups(COG/KOG)、Gene Ontology(GO)和 Kyoto Encyclopedia of Genes and Genomes(KEGG)等数据库对差异表达基因进行功能注释。
1.4 差异表达基因(DEGs)鉴定
采用RPKM(Reads per kb per million reads)方法计算和标准化基因丰度[31],跨组别的差异表达基因通过edgeR软件包鉴别(http://www.r-project.org/)。基因表达变化量≥2倍且错误率(FDR)>0.05时,认为是显著表达。利用GO数据库,通过计算差异表达基因参与生物学过程、细胞组分、分子功能的超几何分布,进行功能分类注释和富集分析[32],最后,用KEGG数据库获得代谢通路注释信息[33]。以上分析均以P<0.05作为统计学显著性的阈值。
1.5 实时荧光定量PCR(qRT-PCR)
如前所述,用RNAiso plus试剂盒(TaKaRa)从斑马鱼肠组织中提取总RNA[34]。经DNA酶消化处理后,用PrimeScript RT试剂盒和gDNA Eraser试剂(TaKaRa)根据厂家提供的说明,合成cDNA链,同时加入不含逆转录酶的样品作为对照。合成的cDNA产物在-20 ℃保存待用。
用实时荧光定量PCR(qRT-PCR)检测mhc1、cd8、perforin、c3和il4的表达,根据基因序列,利用Primer Premier 5.0程序设计各基因特异性引物(见表1)。选择肌动蛋白(actin)基因作为内标参考。cDNA模板定量后,使用Power SYBR Green PCR Master Mix(Takara)在ABI 7500 real-time PCR系统(Applied Biosystems)上进行实时PCR反应,具体步骤如前所述[35]。采用对比CT值法计算mhc1、cd8、perforin、c3和il4相对于actin基因的表达水平(2-ΔΔCT)[36]。所有qRT-PCR实验均样本均设置3个平行样,并独立重复3次。

表1 文中用到的引物序列
1.6 统计分析
通过GraphPad Prism 5软件对所得数据采用配对样本T检验进行统计分析,差异性P<0.05被认为是有显著差异的。所有数据均以标准差(mean±S.D.)表示。
2 结果
2.1 cd36-/-斑马鱼更易感染鳗弧菌
分别对突变型(cd36-/-)和野生型(WT)斑马鱼腹腔注射20 μL浓度为1×108CFU/mL的鳗弧菌溶液。感染鳗弧菌后6 h内未发现斑马鱼死亡,但突变体斑马鱼的移动性明显低于野生斑马鱼,且病害症状更加严重,主要表现为体表较明显的红肿充血(见图1(A))。注射后7 h,突变体开始死亡,而野生斑马鱼在注射后8.5 h开始死亡。因此注射后8.5 h,突变体斑马鱼的存活率明显低于野生斑马鱼(见图1(B))。
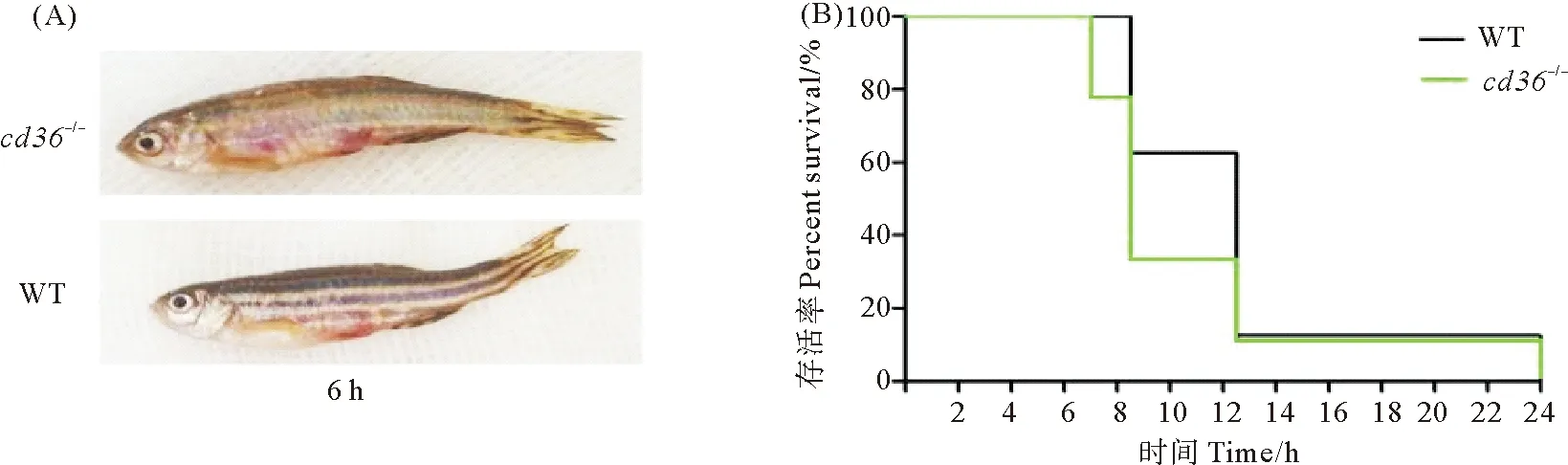
图1 突变体(cd36-/-)和野生型(WT)斑马鱼在被鳗弧菌攻击后的发病症状(A)及存活率(B)比较(n=10)
2.2 鳗弧菌刺激cd36-/-和野生斑马鱼后,对差异表达基因的转录组分析
为了探讨cd36在免疫过程中的分子机制,本文作者取腹腔注射了浓度为1×108CFU/mL鳗弧菌菌液的野生型和cd36-/-斑马鱼的头肾组织,进行了转录组测序分析。FPKM(Fragments per kilobase per millon mapped fragments)即每百万片段中来自某一基因每千碱基长度的片段数目被用来评估cd36-/-与野生斑马鱼的基因表达量是否满足分析要求。通过分析发现,与野生型斑马鱼相比,突变体中有1 517个基因表达上调,3 801个基因表达下调(见图2(A))。为了更好地了解差异表达基因在免疫过程中的作用,本文作者对这些基因进行了GO和KEGG富集分析。
GO注释数据库可以对突变型和野生型样本的差异表达基因进行统计分析,按照功能被分为三方面,分别为生物学过程、细胞组分和分子功能。与野生型斑马鱼相比,突变体中的差异表达基因主要与细胞过程、生物调节、代谢过程和应激反应相关(见图2(B))。图3(A)显示了通过GO富集分析后,被挑选出的与免疫过程相关的差异表达基因。这些基因在防御反应中起着关键作用,值得注意的是,在28个差异表达基因中有7个基因被归类到T淋巴细胞的免疫过程中(见图3(A)、表2)。这表明cd36可能参与了调节T细胞免疫。

表2 通过GO富集分析挑选出的与免疫系统相关的差异表达基因(cd36-/- vs WT)
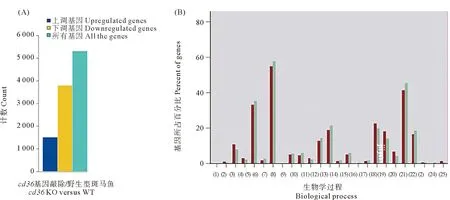
((A)差异表达基因的数量。(B)GO注释数据库对样本的差异表达基因按照生物学过程的功能进行统计分析。红色表示差异表达上调基因占总差异表达上调基因的比例;绿色表示差异表达下调基因占差异表达总下调基因的比例。(1)生殖;(2)细胞杀伤;(3)免疫系统过程;(4)行为;(5)代谢过程;(6)细胞增殖;(7)细胞过程;(8)氮利用;(9)生殖过程;(10)生物黏附;(11)信号;(12)多细胞生物过程;(13)发育过程;(14)生长;(15)运动;(16)色素沉积;(17)节律过程;(18)刺激反应;(19)定位;(20)多有机体过程;(21)生物调节;(22)细胞组成的组织或生物发生;(23)细胞聚集;(24)解毒作用;(25)参与化学突触传递的突触前过程。(A)The count of the differential expressed genes.(B)GO analysis of differentially expressed genes.The DEGs were enriched in GO biological process.Red stands for the proportion of differentially expressed up-regulated genes to the total differentially expressed up-regulated genes; Green stands for the proportion of differentially expressed down-regulated genes to the total differentially expressed down-regulated genes.(1)Reproduction;(2)Cell killing;(3)Immune system process;(4)Behavior;(5)Metabolic process;(6)Cell proliferation;(7)Cellular process;(8)Nitrogen utilization;(9)Reproductive process;(10)Biological adhesion;(11)Signaling;(12)Multicellular organismal process;(13)Developmental process;(14)Growth;(15)Locomotion;(16)Pigmentation;(17)Rhythmic process;(18)Response to stimulus;(19)Localization;(20)Multi-organism process;(21)Biological regulation;(22)Cellular component organization or biogenesis;(23)Cell aggregation;(24)Detoxification;(25)Presynaptic process involved in chemical synaptic transmission.)

((A)28个差异表达中有7个基因被归类到T淋巴细胞的免疫过程中(图中下划线示出)。(B)—(F)在鳗弧菌的攻击下,突变体(cd36-/-)和野生型(WT)斑马鱼头肾组织中mhc1uba(B)、cd8(C)、perforin(D)、c3(E)和il4(F)基因表达量的比较。(A)7/28 of the DEG genes were assigned to the immune process of T lymphocyte(Underlined part in this figure).(B)—(F)Comparison of the expression of mhc1uba(B), cd8(C), perfoin(D), c3(E)and il4(F)in intestinal tissues between the mutant type(cd36-/-)and wild type(WT)zebrafish challenged by Vibrio anguillarum.)
通过KEGG分析找出差异性显著的基因富集的信号通路,与野生斑马鱼相比,突变体斑马鱼中差异表达较明显的基因主要富集在补体系统、系统性红斑狼疮、细胞因子之间的相互作用和病毒致癌机理等与免疫相关的信号途径中(见图4),反映了cd36在免疫应答中起到调节作用。
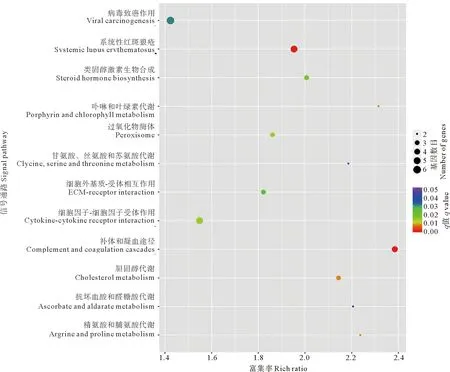
图4 差异表达基因的12条信号通路KEGG分析
2.3 cd36-/-斑马鱼的mhc1uba、cd8、穿孔素、c3和il4基因表达下调
本研究通过实时荧光定量PCR技术进一步证实,cd36基因敲除对斑马鱼免疫相关基因的表达产生影响。与野生型(WT)斑马鱼相比,突变型(cd36-/-)斑马鱼的抗原提呈相关基因mhc1uba和cd8、穿孔素基因、补体系统关键基因c3和细胞因子基因il4的表达水平显著下调(见图3(B)—(F))。
3 讨论
目前对cd36免疫功能的研究主要以哺乳动物为研究对象,探究了cd36在识别、递呈、吞噬和清除细菌方面的功能。例如,过表达cd36的HEK293T细胞与金黄色葡萄球菌和大肠杆菌的结合能力分别提高了3和2倍[16];在小鼠巨噬细胞中过表达cd36也增强了对大肠杆菌和金黄色葡萄球菌的摄取,产生了更高水平的tnf-α和mip-2,增强了下游免疫因子的级联反应和巨噬细胞的吞噬作用,因而认为CD36是细菌的吞噬受体[13,24];另外,cd36基因敲除小鼠在摄取凋亡巨噬细胞方面存在明显缺陷[37]。而关于cd36抗细菌免疫的功能在鱼类中的报道较少。2015年,Fink等发现cd36基因并不在鲤鱼的免疫器官和免疫细胞中表达,似乎显示其与免疫功能关系不大[27];但同时他们又发现cd36却在斑马鱼的免疫细胞中表达,且敲降cd36的斑马鱼清除细菌的能力下降[27]。后者与本研究在斑马鱼中的研究结果一致。
本文作者前期的研究发现,cd36基因在斑马鱼的免疫组织中有表达,且CD36可与细菌结合[29],表明斑马鱼CD36可能参与抗细菌免疫。在本研究中,用鳗弧菌攻击斑马鱼发现,与野生型斑马鱼相比,cd36基因敲除斑马鱼发病速度更快,细菌感染病症更明显,存活率更低,进一步证明CD36参与了斑马鱼的抗细菌免疫,发挥正向调控作用。这与CD36在哺乳动物中的识别细菌和调节炎症细胞因子的产生功能相一致,揭示了CD36在抗细菌免疫反应中的保守性。转录组测序结果显示,在鳗弧菌感染的条件下,敲除cd36基因引起了斑马鱼大量基因表达的上调或下调。这些差异表达的基因主要富集在补体系统、系统性红斑狼疮、细胞因子之间的相互作用和病毒致癌机理等信号途径中。腹腔注射鳗弧菌后,通过实时荧光定量技术检测,cd36基因敲除斑马鱼中mhc1uba、cd8、il4、c3和穿孔素(perfoin)的基因表达量明显低于野生型斑马鱼。在免疫过程中,MHC1和CD8在向杀伤性T细胞呈递抗原中发挥重要作用;白细胞介素IL4能刺激活化B细胞和T细胞的增殖,增强B细胞的抗原提呈能力;C3是先天免疫补体系统的关键因子;穿孔素主要储存在细胞毒性T细胞(CTL)和自然杀伤细胞(NK)的胞浆颗粒中,是杀伤靶细胞的主要效应分子。据此可以推测,CD36可能通过调控斑马鱼的先天性免疫系统和适应性免疫系统,尤其可能通过调节T细胞免疫而发挥抗细菌免疫作用。本研究为进一步研究CD36在免疫防御中的作用及分子机制奠定了基础。

