预后营养指数指导下的营养管理干预在食管癌根治术患者中的应用
郭峰杰,孙爱英,于丹丹
(河南省肿瘤医院 河南郑州450000)
食管癌是临床常见消化道肿瘤,全球每年约30万人死亡[1]。我国是食管癌高发地区,饮食不规律是食管癌病发的主要因素[2]。癌症会使自身营养成分大量消耗,机体处于高分解代谢与负氧平衡状态,存在体重减轻与营养不良状况,进而引发免疫功能下降与并发症发生,影响患者生存质量[3-4]。胸腹腔镜联合食管癌根治术是临床治疗食管癌主要方式,但机体术后处于应激状态,增加能量消耗,减少营养物质合成,影响患者术后康复效果[5]。因而,针对食管癌根治术后患者给予科学营养支持,改善机体营养状态具有重要作用。预后营养指数(PNI)可有效反映癌症患者手术风险、营养状况与预后评估,在胃癌、肺癌等恶性肿瘤患者中广泛应用[6]。基于此,本研究旨在分析PNI指导下的营养管理干预在食管癌根治术患者中的应用效果。现报告如下。
1 资料与方法
1.1 临床资料 前瞻性选取2021年1月1日~2022年1月1日在本院行胸腹腔镜联合食管癌根治术患者240例为研究对象。纳入标准:①符合食管癌[7]诊断标准;②依从性好,临床配合度高;③患者及家属均知情同意并签署承诺书。排除标准:①重要脏器功能不全;②合并其他恶性肿瘤;③广泛转移;④临床资料不完整;⑤免疫功能疾病;⑥存在认知障碍,不能配合本研究。按随机数字表法分为研究组和对照组各120例。研究组男62例、女58例,年龄(57.62±8.20)岁;体质量指数(BMI)(20.98±2.18);受教育程度:初中及以下51例(42.5%),高中及以上69例(57.5%);病理类型:腺癌13例(10.83%),鳞癌107例(89.17%);病变部位:食管中段68例(56.67%),食管下段52例(43.33%)。对照组男67例、女53例,年龄(56.86±8.10)岁;BMI(21.16±2.23);受教育程度:初中及以下59例(49.17%),高中及以上61例(50.83%);病理类型:腺癌8例(6.67%),鳞癌112例(93.33%);病变部位:食管中段71例(59.17%),食管下段49例(40.83%)。两组一般资料比较差异无统计学意义(P>0.05)。本研究取得伦理委员会审查审批同意。
1.2 方法
1.2.1 对照组 给予常规营养管理。向患者介绍合理饮食的重要性与注意事项,术前3 d以营养丰富、易消化食物为主,术前1 d以流质饮食为主,术日常规禁饮食。术后6 h以高热量、高蛋白质流质饮食为主,术后24 h根据个体差异循序渐进增加高纤维、高蛋白等易消化食物,少量多餐,由半流质饮食逐渐过渡到普通饮食。必要时给予静脉输注复方氨基酸注射液、水溶性维生素与脂肪乳注射液等营养物质。
1.2.2 研究组 给予PNI指导下的营养管理干预。
1.2.2.1 组建营养干预小组 干预小组由临床主治医师、具有营养师资格证且工作5年以上营养师、工作5年以上护士组成,由护士长担任组长,负责落实营养管理,临床主治医师、营养师负责制订并实施个体化营养管理方案。营养师为小组主导,熟练掌握PNI概念、营养评估方式、对应营养干预方法,疗效评估。小组成员均需熟练应用PNI评估,定期举行营养护理查房,并进行案例谈论分析,每2周1次,对肠内外营养实施进行质控,每周1次抽查,每个月开展1次,培训内容包括营养干预过程遇到问题,最新文献研究报告,并讨论分析,以促进干预方式持续改进。
1.2.2.2 PNI评估营养风险 由临床医生与营养师对患者进行评估。PNI=血清白蛋白数值(g/L)+外周血淋巴细胞总数(×109/L)×5,≥50代表营养状态正常、45~49代表轻度营养不良、40~44代表显著营养不良、<40代表重度营养不良。根据评估结果,临床主治医师与营养师经会诊共同制订个性化营养支持方案;在术后第1天、与术后每3 d对患者进行PNI评估,并及时调整营养支持方案。
1.2.2.3 制订营养干预方案 ①营养状态正常(PNI≥50):以日常饮食习惯为主,进食高维生素、高蛋白等饮食,忌食油腻、生冷、辛辣刺激食物。②轻度营养不良(PNI 45~49):根据患者个体总热卡需求量,并结合饮食习惯,遵循高维生素、高蛋白质、适量脂肪原则下制订食谱,蛋白质与脂肪含量占食物总量30%~40%,三餐间隔不超过6 h,三餐能量摄入比适宜为3∶4∶3,严格按食谱饮食。③显著营养不良(PNI 40~44):在轻度营养不良营养支持方案基础上增加使用肠内营养制剂(能全素、能全力、瑞能、康全力等),口服每次200~250 ml,500 ml/d,患者总能量摄入根据肠内营养制剂口服量酌情调整。④重度营养不良(PNI<40):在支持营养支持方案及肠内营养制剂基础上联合肠外营养支持干预(静脉输注复方氨基酸注射液、水溶性维生素与脂肪乳注射液等营养物质),或根据患者情况在必要条件下给予经鼻置入肠内营养导管行肠内营养注入,但重度营养不良者初始能量供给<10 kcal/(kg·d),后逐渐增加。每日总热卡需求量=基础能量消耗(BEE)×活动系数×应激系数×体温系数×校正系数。BEE根据H-B公式计算得出。活动系数在卧床时为1.20,床边活动时为1.25,正常轻度活动时为1.30;癌症应激系数根据患者病情程度确定,范围为1.10~1.45,体温系数在正常体温范围内为1.0,体温每超过正常体温1 ℃则体温系数增加0.1;校正系数:女性1.19,男性1.16。
1.2.2.4 营养干预方案实施 患者入院后进行PNI营养评估,根据评估结果制订个性化营养支持方案,建立营养档案。术前3 d开始实施方案,之后每3 d评估1次,根据最新结果调整方案至患者出院。出院后每次于患者化疗前1 d进行PNI评估,制订营养方案,于化疗期间实施方案,延续到术后3个月。术后6 h以高热量、高蛋白质流质饮食为主,术后24 h根据个体差异循序渐进增加高纤维、高蛋白等易消化食物,少量多餐,由半流质饮食逐渐过渡到普通饮食。责任护士指导、监督患者按照营养干预方案严格控制进食,由空腹检查项目可指导患者检查结束后加食牛奶、鸡蛋等食物,指导部分患者于4~8 ℃环境下保存营养制剂,口服时加温至38 ℃左右(12 h内服完),禁止直接瓶饮;加强肠外营养导管护理,发生并发症及时处理。且责任护士需每天记录患者营养支持方案执行情况,每个月1次例会对方案中发现问题进行总结讨论,并改进方案及调整干预流程。
1.3 观察指标 ①营养状态:采用PNI评估患者不同时点营养状态分布情况。②营养学指标:抽取5 ml空腹静脉血,离心取上清液,通过ELISA检测白蛋白(ALB)、前白蛋白(PA)、转铁蛋白(TRF)、血红蛋白(Hb)与视黄醇结合蛋白(RBP)水平。③免疫指标:抽取患者治疗前与治疗6个月后肘静脉血,离心后其上清液,使用流式细胞仪检测CD8+、CD4+、CD3+,计算CD4+/CD8+。④术后恢复:包括肠鸣音恢复时间、首次排气时间、首次进食固体食物时间、首次排便时间。⑤术后并发症:包括切口感染、肺部感染、吻合口瘘。

2 结果
2.1 两组不同时间营养状况比较 见表1。

表1 两组不同时间营养状况比较[例(%)]

续表
2.2 两组不同时间营养指标比较 见表2。

表2 两组不同时间营养指标比较
2.3 两组不同时间免疫功能比较 见表3。

表3 两组不同时间免疫功能比较
2.4 两组恢复指标比较 见表4。
表4 两组恢复指标比较
2.5 两组术后并发症发生率比较 见表5。
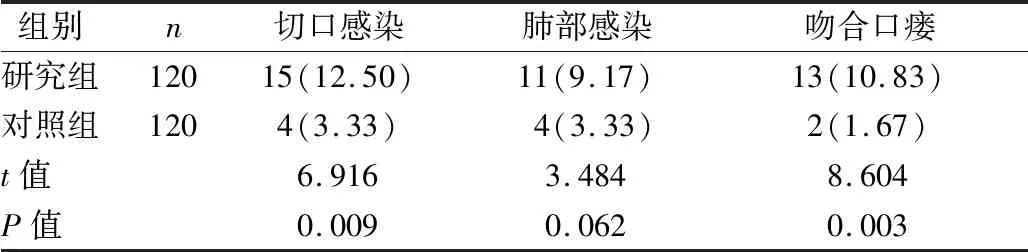
表5 两组术后并发症发生率比较[例(%)]
3 讨论
据相关统计数据显示,我国食管癌新增病例25.8万,死亡病例19.3万,且因食管生理功能与解剖部位特殊,是营养风险高发恶性肿瘤[8]。且营养不良会使患者手术耐受能力降低,手术风险增加[9]。行胸腹腔镜联合食管癌根治术手术创伤与消化道重建等因素影响致使术后营养不良状况加剧[10]。既往研究显示,手术可使食管癌营养风险增加,且营养不良是诱发食管癌术后并发症、降低预后生存率的主要因素,及时给予患者营养支持可改善术后营养状况[11]。
基于此,本研究创新性提出将PNI指导下的营养管理干预运用于食管癌根治术,结果提示PNI指导下的营养管理干预可促进食管癌根治术后患者营养状态恢复。分析原因,术后1 d患者因手术创伤与术前长时间禁食,机体能量消耗增加,营养物质合成减少,因而术后1 d患者营养状态正常者减少。而PNI指导下的营养管理干预根据患者实际营养状况对其进行针对性营养支持治疗,满足其营养需求,利于提高躯体功能;而针对重度营养不良患者PNI指导下的营养管理干预给予其肠内外营养支持,全面为其提供营养支持,且能促进胃肠激素分泌与胃肠道蠕动,帮助胃肠道功能早期恢复,保障机体营养吸收[12]。且PNI指导下的营养管理干预术后每3 d进行1次评估,可对患者营养状态进行动态监测,并根据评估结果适当调整营养支持方案,有利于全方面防护营养治疗[13]。且重复测量方差分析提示PNI指导下的营养管理干预可改善患者营养状态。
既往诸多文献显示,营养学指标与免疫功能具有相关性,机体营养状况改善可促进免疫功能改善[14]。本研究结果提示,PNI指导下的营养管理干预可改善患者免疫功能。分析原因,营养支持可增加细胞营养底物,满足机体正常代谢,促使免疫功能改善,研究组营养状态及免疫功能改善均更明显。且研究组肠鸣音恢复时间、首次排气时间、首次进食固体食物时间、首次排便时间均短于对照组(P<0.05)。分析原因,PNI指导下的营养管理干预可较准确评估机体世界能量消耗与营养状态,在满足机体营养需求的同时进行营养结构调整,进行营养合理配比,促进营养状态改善,进而促进机体功能恢复;且PNI指导下的营养管理干预给予患者合理补充维生素A、C、E,可促进组织再生修复[12-13]。本研究还显示,研究组切口感染发生率、吻合口瘘发生率均低于对照组(P<0.05)。分析原因,食管癌根治术术后机体应激,会引发免疫功能与机体功能紊乱,且术后营养状态不佳会加速机体营养消耗,进一步降低机体免疫力,增加并发症发生风险。而PNI指导下的营养管理干预改善机体营养状态,符合机体正常生理代谢需求,利于免疫功能与生物功能完整性提高,进而术后并发症发生率降低。
综上所述,PNI指导下的营养管理干预应用于食管癌根治术患者中,可有效改善机体营养状态,提高免疫功能,降低术后并发症发生风险,促进术后恢复。本研究不足之处在于未进行长期效果随访,因此仍有待进一步研究验证。

