中药调控缺血性脑卒中后紧密连接的研究进展
陈婷玉苏凯奇阮晓迪房 璐张钰涵刘 昊冯晓东*
(1.河南中医药大学,郑州 450046;2.河南中医药大学第一附属医院康复中心,郑州 450000)
缺血性脑卒中(ischemic stroke,IS)在所有卒中类型中发病率最高,约占79.1%[1],并有逐年递增的趋势。高血压、糖尿病、高脂血症、肥胖、吸烟、缺乏运动等,均是引发IS的危险因素[2]。生理条件下,由多种蛋白质相互作用形成的紧密连接通过参与调节相邻内皮细胞之间的溶质运动(即细胞旁扩散)来维持内环境稳态[3-4]。而脑组织在缺氧缺血环境中通过炎症反应和氧化/亚硝化应激产生大量的促炎介质和氧化因子,严重破坏血脑屏障中TJ链的完整性[5];TJ链断裂导致内皮细胞的细胞旁扩散屏障通透性大大增加,进一步加重了脑血管源性水肿和出血性转化,继而形成恶性循环[6]。
中药被广泛应用于治疗脑血管疾病,且疗效显著。研究发现,中药及其活性成分可以多方位、多途径修复缺血性脑卒中后TJ损伤,降低脑梗死和水肿体积,进而改善IS的预后。因此,本文以脑微血管内皮细胞间的TJ为着眼点,对中药从炎症反应和氧化/亚硝化应激两个重要方面防治BBB损伤减轻IS后神经功能障碍的研究现状作一综述,以期为临床试验中发现中药干预IS发挥作用的新靶点提供理论依据。
1 TJ的成分与结构基础
TJ的形成主要涉及特定的跨膜蛋白,即密封蛋白(claudin)、闭合蛋白(occludin),二者通过与胞浆蛋白(zonula occludens, ZO)的相互作用与细胞骨架相连[7],从而形成电荷选择性孔道,仅允许离子和不带电分子通过。
1.1 密封蛋白claudin
claudin是TJ中最为丰富的一类跨膜蛋白,通过同一膜内的顺式配对(在一个细胞的质膜内)或跨膜反式配对(跨相邻细胞的质膜)排列形成延伸链,跨越并封闭相邻内皮细胞[8]。claudin的C端与辅助蛋白ZO的PDZ结构域相连。目前已知人体中存在23种claudin,其中claudin-1、-3、-5、-12广泛分布于脑微血管内皮细胞。在大鼠的脑毛细血管中,claudin-5比 claudin-12的mRNA表达水平大约高出750倍,主要控制分子量<0.8×103的小分子溶质的细胞旁扩散运动,是调节血脑屏障(blood brain barrier, BBB)内皮细胞运动和离子通透性的关键因子[9-11]。脑组织缺血缺氧破坏了claudin-5蛋白的排列结构,导致BBB通透性增大,加重血管源性脑水肿。然而,有研究发现在脑水肿发生后,靶向抑制claudin-5通过增加了BBB选择通透性起到减轻水肿改善认知障碍的效果[12]。因此,针对IS后不同时段开发靶向调控claudin-5的药物治疗脑水肿可能具有很大前景。
1.2 闭合蛋白occludin
occludin是分子量为60×103~65×103的完整膜蛋白,包括两个细胞外环(ECL)、一个细胞内环。occludin的ECL1含有大量酪氨酸和甘氨酸残基,酪氨酸残基参与形成氢键发挥疏水作用,而甘氨酸残基则为TJ提供灵活性。ECL2富含酪氨酸残基,含有两个半胱氨酸,在氧化环境中形成二硫键,在缺氧环境下发生同源寡聚化;其胞质内的C端形成卷曲螺旋结构与ZO和肌动蛋白细胞骨架相连[13-14]。occludin异常降解会增加血脑屏障通透性,加重中枢神经系统疾病的进程。
1.3 胞浆蛋白ZO
ZO是一种普遍存在的支架蛋白,其谷氨酸激酶区与occludin的C端相连,并通过PDZ区与claudin的C端共同参与TJ的组装。ZO还调节内皮细胞顶端细胞骨架的组成和功能并连接周围的肌动蛋白。敲除犬肾上皮细胞中的ZO-1,细胞接触形态发生显著改变,肌动蛋白定位重新分布,TJ链的染色区域由曲变直,结构复杂性降低,对大于3.7Å溶质的渗透性增高;在重组ZO-1后,连接接触点的曲折度有所增加,降低了BBB的通透性[15]。由此说明,ZO不仅参与内皮细胞TJ的组成还维持了TJ正常的复杂结构。
2 缺血性脑卒中与TJ
IS后发生的炎症反应、氧化/亚硝化应激等均会影响TJ的数量和空间结构[16],加重脑组织BBB屏障的损伤,提高死亡率。
2.1 炎症反应与TJ
脑组织缺血时,促炎和抗炎细胞因子的表达迅速增加,其中肿瘤细胞坏死因子-α(tumor necrosis factor-α, TNF-α)、白介素-1β(interleukin-1β, IL-1β)和干扰素-β(interferon-β, IFN-β)等均是影响TJ的关键介质[17]。缺血因素增加基质金属蛋白酶(matrix metalloproteinase,MMP)-2的分泌进而松解TJ网状链但不改变其在内皮细胞裂隙内的位置,使得BBB通透性可逆性增加;继发的神经炎症产生多种炎性因子刺激MMP-9的分泌,起到进一步降解occludin、ZO-1以及诱导claudin-5重分布的作用[18-20]。小胶质细胞分泌的TNF-α以剂量依赖性方式激活MMP-2和MMP-9直接或间接调节天冬氨酸半胱氨酸蛋白水解酶-3(caspase-3)介导的TJ损伤和BBB高渗透性[21-22]。此外,研究者在培养人脑微血管内皮细胞实验中发现,p38/丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号通路密切参与了TNF-α和脂多糖(lipopolysaccharide, LPS)下调occludin磷酸化水平的过程[23-24]。LPS 还通过激活蛋白激酶C(protein kinasec, PKC)、Rho相关卷曲形成蛋白激酶1(Rhoassociated coiled forming protein kinase 1, ROCK1)破坏脑微血管内皮细胞TJ复合物的完整性[25]。缺血性脑卒中后,IL-1β的上调一方面激活了磷脂酶A2降解花生四烯酸,破坏内皮细胞磷脂双分子层结构;另一方面,诱导细胞核因子-κB(nuclear factorκB, NF-κB)/p65的核转位使周细胞分泌MMP-9,下调occludin、claudin-5和ZO-1的表达,造成TJ结构紊乱[26-27]。
由此可得,促炎因子通过降解TJ或下调其表达和磷酸化水平增加BBB通透性加重脑缺血损伤。然而,抗炎因子IFN-β1a和IFN-β1b则有效地防止了IFN-γ诱导的TJ解体,维持BBB屏障作用[28-29]。Krüppel 样因子4(Krüppel-like factor 4, KLF4)在IS发生后通过调节黏附分子的表达、抑制氧糖剥夺(oxygen-glucose deprivation, OGD)条件下的TNF-α诱导的NF-κB磷酸化,上调claudin-5和ZO-1的表达水平,进而减轻脑缺血引起的神经炎症[30]。
2.2 氧化/亚硝化应激与TJ
氧化应激和亚硝化应激可以通过多种途径强力破坏TJ组成的内皮细胞屏障。活性氧(reactive oxygen species,ROS)和活性氮(reactive nitrogen species, RNS)均是缺血诱导产生的自由基,在氧化/亚硝化应激损伤中发挥关键作用。ROS降低跨内皮电阻值(transendothelial electrical resistance, TEER)、下调ZO-1和claudin-5的表达并中断了二者连续排列的共定位生理结构[31]。一氧化氮(NO)和过氧亚硝酸盐(ONOO-)是典型的RNS。脑组织缺血缺氧后H2O2、NO大量产生,不仅降低了ZO-1和occludin的表达,还将二者的相互作用部位从细胞间隙转移至细胞质内,进一步加重BBB屏障功能的损伤[32]。NO还影响半胱氨酸与Zn2+的相互作用,暴露Zn2+的活性位点进而活化MMP-9;与此同时,NO与超氧阴离子发生反应生成ONOO-,激活MMP-9和MMP-2降解TJ和细胞外基质导致BBB结构的破坏[5]。氧化应激还通过酪氨酸激酶途径诱导occludin-ZO-1和钙粘蛋白-β-连环蛋白复合物的酪氨酸磷酸化与TJ的重新分布[33]。血管内皮生长因子(vascular endothelial growth factor, VEGF)在脑组织缺氧后表达增加,与VEGF受体(VEGFR)-2结合后激活内皮一氧化氮合酶(endothelial nitric oxide synthase, eNOS)通路下调ZO-1和occludin的表达发挥血管通透性调节剂的作用[34-35];在IS急性期,VEGF还可以剂量依赖性地增加MMP-9活性、降低occludin和claudin-5蛋白的表达[36]。VEGF对MMP-9活性和TJ损伤的增强效应可由血管紧张素-1(angiotensin-1, Ang-1)抑制[37]。核转录因子-E2相关因子2(nuclear factor erythroid 2-related factor 2, Nrf2)可以调节内源性抗氧化过程,上调ZO-1和occludin,维持BBB的完整性[38]。
由此可得,在IS发生后,炎症和氧化因子的释放继而引发的MMPs的激活是影响TJ降解和重塑的主要原因。明确上述病理过程与TJ的相互作用机制对于发现保护缺血性脑卒中后血脑屏障破坏、减轻神经系统损伤的新药物至关重要(见图1)。

图1 中药对缺血性脑卒中TJ的保护机制Figure 1 Protective mechanism of traditional Chinese medicine on tight junction in ischemic stroke
3 中药干预对缺血性脑卒中后TJ的影响
中药可以更好的适应复杂的人体环境,从宏观的角度发挥神经保护作用。近年来许多基础研究显示中药单体及其提取物、中药复方通过抑制炎症反应和氧化/亚硝化应激等过程修复缺血性脑卒中后TJ的损伤,预防并减轻大脑功能损害。
3.1 中药单体及其提取物
现将保护缺血性脑卒中后TJ的中药活性成分依据不同的功效分类为清热类药、活血类药、补肾类药、升阳类药等,并就其保护机制进行详述(见表1)。
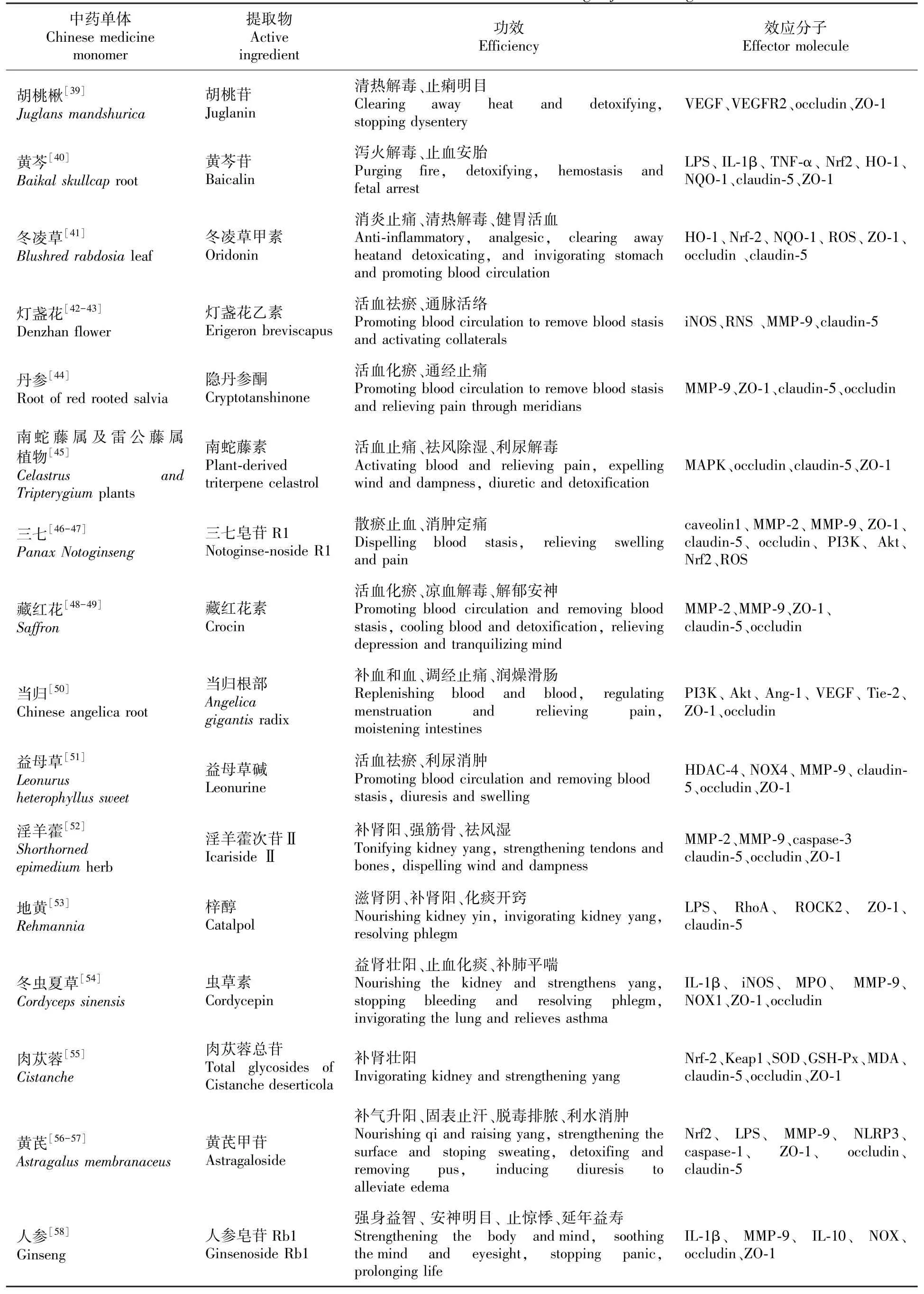
表1 中药单体及其提取物对缺血性脑卒中TJ调控的效应Table 1 The effects of Chinese medicine monomers and their extracts on tight junction regulation of ischemic stroke.
3.1.1 清热类药
胡桃楸有清热解毒、止痢明目的功效。Liu等[39]用其提取物胡桃苷(Juglanin)预处理可通过抑制缺氧诱导的VEGF和VEGFR2的增加提高大脑中动脉栓塞(middle cerebral artery occlusion, MCAO)模型小鼠的occludin和ZO-1蛋白的含量;并将体外实验中细胞死亡率由21.6%降低至12.3%。外源性VEGF-A(属VEGF家族)抵消了胡桃苷对内皮细胞以及TJ的保护作用,证实胡桃苷作用于VEGF/VEGFR2信号通路恢复occludin和ZO-1的正常表达减少内皮细胞损伤。
黄芩有泻火解毒、止血安胎的功效。黄芩的提取物黄芪苷,一方面抑制LPS诱导IL-1β和TNF-α的产生引起的血脑屏障中TJ的减少,起到“节流”的效果,并上调claudin-5和ZO-1蛋白的表达发挥“开源”的作用;另一方面激活Nrf2信号通路降低氧化应激水平,上调Nrf2、HO-1和醌氧化还原酶-1(nadph quinine oxidoreductase 1, NQO-1)的表达,以此来减轻炎症反应与氧化应激对脑组织的损伤[40]。
冬凌草有消炎止痛、清热解毒、健胃活血的功效。冬凌草甲素有效增加缺血性脑卒中后血红素加氧酶-1(heme oxygenase-1, HO-1)和Nrf-2所调控的抗氧化因子NQO-1的表达,降低同侧大脑中的ROS水平,促进Nrf-2的核转位防止氧化应激诱导的内皮损伤。除此之外,冬凌草甲素还可防止外周炎性细胞浸润并减少IS后的神经炎症进而保护TJ[41]。
3.1.2 活血类药
灯盏花具有活血化瘀,通脉止痛的功效。灯盏花素注射液是以灯盏花乙素为主要成分的一种中药制剂。灯盏花注射液减少缺血引发的诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)的合成,抑制MMP-9的活化;3,5-二咖啡酰奎宁酸(灯盏花的化学成分之一)通过减少iNOS的活化和自由基的生成两种途径抑制MMP-9的表达和活化,从而减少claudin-5的降解。由此得出,灯盏花素减轻脑缺血损伤的分子机制主要是通过ROS/RNSMMPs-TJ信号通路保护血管内皮细胞间的TJ实现[42-43]。
丹参有活血化瘀、通经止痛的功效,其提取物隐丹参酮通过抑制MMP-9上调ZO-1、claudin-5和occludin的表达,从而改善OGD/R诱导的TEER值的降低和内皮通透性的增加[44]。
南蛇藤属有祛风除湿活血止痛、利尿解毒的功效。Luo等[45]以OGD诱导脑内皮细胞发生缺氧性损伤,发现南蛇藤素通过激活MAPK信号通路以浓度依赖性的方式恢复缺氧诱导的TEER损失,并上调内皮细胞中occludin、claudin-5和ZO-1的表达。
三七有活血祛瘀、通脉活络的功效。Liu等[46]发现体外实验中,三七皂苷R1激活质膜微囊caveolin-1/MMP2/9通路,恢复质膜中ZO-1、claudin-5的表达,并介导occludin和caveolin-1的重分布。此外,研究证实PI3K/Akt/Nrf2信号通路在三七皂苷抑制ROS生成和TJ降解,保护脑微血管内皮细胞免受OGD/R诱导的BBB破坏中发挥重要作用[47]。
藏红花有活血化瘀、凉血解毒、解郁安神的功效。在脑缺血动物模型中,藏红花素预处理可以显著改善缺血所致的脑损伤,阻断MMP-2和MMP-9对TJ的破坏[48]。同时,藏红花素还可以抑制氧化应激和炎症级联反应[49],而这两者与TJ的损伤密不可分。
当归有补血和血,调经止痛,润燥滑肠的功效。当归根部(Angelica gigantis radix, AGR)通过激活PI3K/Akt通路显著增加Ang-1、VEGF、酪氨酸蛋白激酶受体-2(Tie-2)、ZO-1和occludin的表达,降低了缺血诱导的BBB 通透性和神经元死亡[50]。
益母草有活血祛瘀、利尿消肿的功效。益母草碱是益母草的提取物,研究证实,通过调节组蛋白去乙酰化酶-(histone acetylation, HDAC-)4/NOX4/MMP-9-TJ信号通路,上调claudin-5、occludin和ZO-1改善神经功能缺损[51]。
3.1.3 补肾类药
淫羊藿具有补肾阳、强筋骨、祛风湿的功效。淫羊藿次苷Ⅱ(icarisideⅡ, ICS-Ⅱ)作为主要提取物之一,可以提高卒中后大鼠神经元存活率,维持海马、皮质、纹状体神经元的结构完整。分子对接结果显示ICS-Ⅱ可以直接结合MMP-2、MMP-9,调控皮质和纹状体中MMP-2、MMP-9与基质蛋白酶抑制剂 1(tissue inhibitors of metalloproteinases, TIMP1)的平衡并抑制半胱氨酸天冬氨酸蛋白酶3(caspase-3)依赖的凋亡途径,显著增加claudin-5、occludin、ZO-1蛋白表达[52]。
地黄有滋肾阴、补肾阳和化痰开窍的功效。将地黄中提取的梓醇与LPS、脑微血管内皮细胞(brain microvascular endothelial cells, BMECs)共培养24 h后,梓醇显著逆转了LPS造成的BMECs核固缩、细胞轮廓模糊、肌动蛋白带锯齿状断裂、ZO-1和claudin-5表达大幅减少的现象;增加了内皮细胞数目,恢复了细胞骨架形态,并重构细胞间的TJ。该实验进一步发现梓醇拮抗LPS保护TJ蛋白的过程与其阻断 RhoA/ROCK2 信号通路的作用密不可分[53]。
虫草有益肾壮阳、止血化痰、补肺平喘的功效。虫草素抑制 IL-1β、iNOS、髓过氧化物酶(myeloperoxidase, MPO)和MMP-9的表达,降低创伤性脑损伤后NOX1的表达和活性,保护紧密连接蛋白ZO-1和occludin的丢失[54]。
肉苁蓉有补肾壮阳的功效。研究者发现肉苁蓉总苷通过上调细胞核中Nrf-2的水平并下调其负调节因子Keap1,增加SOD和GSH-Px活性,降低MDA含量,减轻氧化应激损伤,进而显著上调claudin-5、occludin和ZO-1的表达维持BBB的完整性[55]。
3.1.4 升阳类药
黄芪具有补气升阳、固表止汗、脱毒排脓、利水消肿的功效。黄芪甲苷可以激活 Nrf2 信号通路减轻LPS 对ZO-1、occludin和claudin-5的破坏,同时抑制炎症反应并阻止单核细胞的粘附,从而保护BBB的物理屏障[56]。有研究发现,黄芪甲苷还参与调节MMP-9进而介导炎性小体NLRP3/caspase-1信号通路减轻缺氧缺血诱导新生大鼠的脑损伤[57]。因此可以合理的猜想黄芪甲苷对TJ的保护作用可能与其对MMP-9的调控存在时空交叉作用。
人参有强身益智、安神明目、 延年益寿的功效。人参皂苷Rb1(GS-Rb1)是30多种人参皂苷中含量最为丰富的一类。研究人员对MCAO模型小鼠腹膜内注射GS-Rb1后发现GS-Rb1可以有效抑制脑组织因缺血诱发的炎症和氧化反应。其不仅使促炎因子IL-1β、MMP-9表达下降、抗炎标志物IL-10表达增多;还抑制了NOX活性减轻了氧化损伤,起到保护同侧皮质中occludin和ZO-1的作用[58]。
3.2 中药复方
大量基础研究表明,中药复方可以多方位多靶点地抑制炎症反应与氧化/亚硝化应激进而修复缺血性脑卒中后TJ的损伤,保护血脑屏障,减轻神经功能障碍(见表2)。
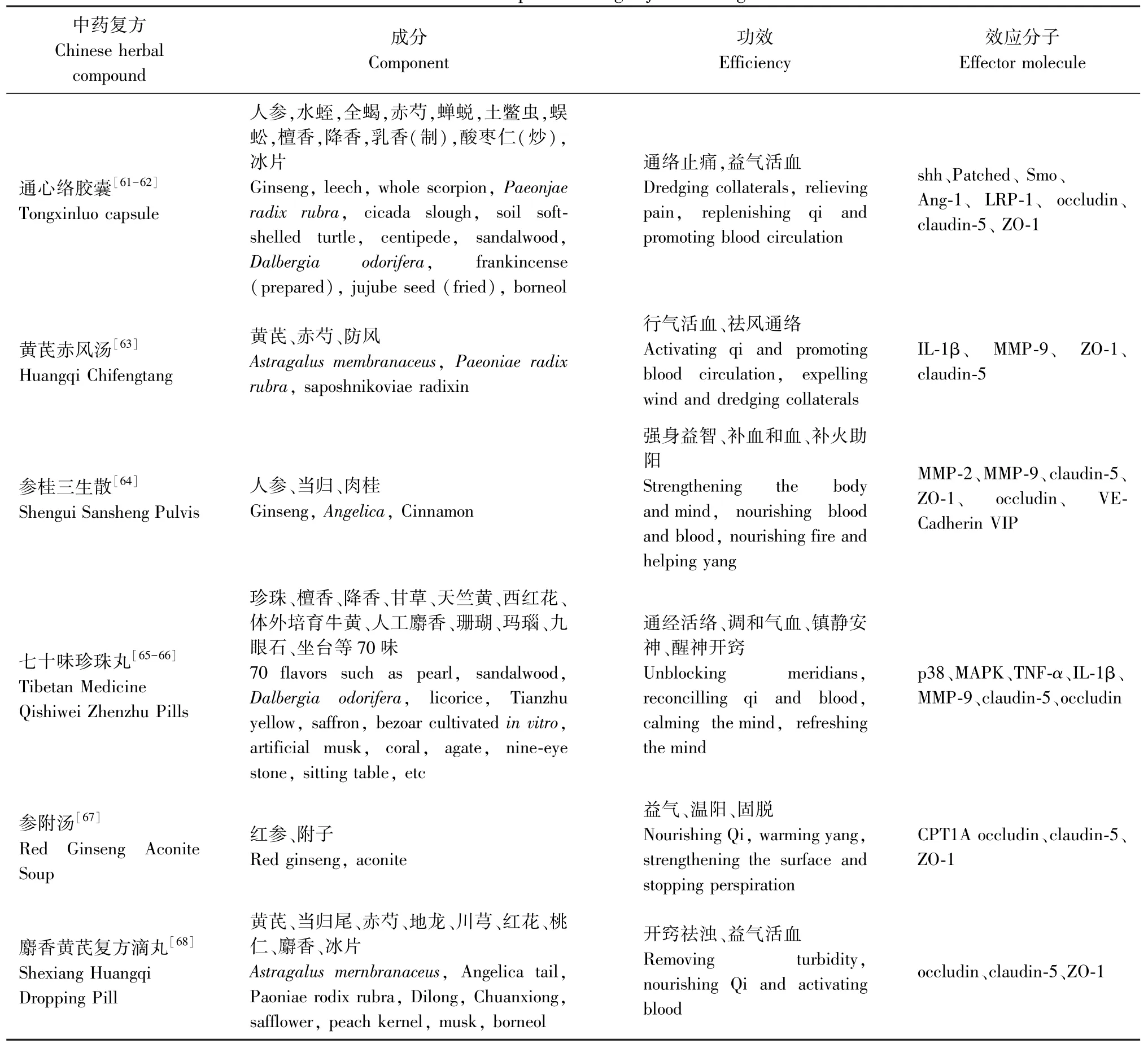
表2 中药复方对缺血性脑卒中紧密连接调控的效应Table 2 Effect of Chinese herbal compound on tight junction regulation of ischemic stroke
通心络胶囊由12种中药成分组成,有通络止痛、益气活血的功效。星形胶质细胞分泌的血浆音猬因子(shh)与其受体Patched和Smoothened(Smo)蛋白共同构成shh通路。在缺血条件下shh诱导Ang-1的产生,修复脑微血管内皮细胞之间受损的TJ,起到保护大鼠缺血性脑卒中后BBB屏障进而减轻脑水肿的作用[59-60]。通心络胶囊可以激活shh通路,增加大脑内皮中TJ的表达。在环巴胺(Smo及其下游信号分子的阻断剂)与通心络胶囊联合给药时,通心络胶囊对TJ的上调作用消失[61]。此外,通心络胶囊还可以下调低密度脂蛋白受体相关蛋白-1(LDL-receptor related protein 1, LRP-1)的水平,继而增加occludin、claudin-5和ZO-1的表达,并减少梗死区BBB的渗漏[62]。
黄芪赤风汤由黄芪、赤芍、防风3味中药配制而成, 有行气活血、祛风通络的功效。黄芪赤风汤可以降低MCAO大鼠脑组织中IL-1β含量,抑制炎症反应进程,下调MMP-9表达水平,提高ZO-1、claudin-5蛋白的表达,改善脑缺血状态[63]。
参桂三生散,由人参、当归和肉桂组成,通过抑制MMP-2、MMP-9的表达以及TJ和钙粘蛋白(VECadherin)的降解,增强内皮间连接复合物的稳定性。该过程伴随着血管活性肠肽(vasoactive intestinal peptide, VIP)与其受体含量的增加,使用血管活性肠肽拮抗剂加剧了BMECs的细胞旁屏障损伤证实,参桂三生散保护TJ减轻脑缺血损伤除了作用于MMPs外,还与血管活性肠肽密切相关[64]。
七十味珍珠丸,含有70多种药材,是治疗脑血管疾病常用的藏药方剂。七十味珍珠丸可激活脑缺血再灌注模型大鼠p38/MAPK信号通路下调其脑组织中TNF-α、IL-1β和MMP-9水平,稳定TJ的成分[65-66]。
参附汤是益气温阳固脱的代表方剂。张伟[67]发现,参附汤通过上调脂肪酸氧化(fatty acid oxidation, FAO)的限速酶肉碱棕榈酰转移酶1A(carnitine palmitoyl transferase 1A, CPT1A)的水平保护缺血再灌注损伤大鼠的TJ,且其作用优于人参和附子单味中药单独引发的保护效应。然而脂肪酸氧化与TJ的相互作用机制仍需进一步阐明。
麝香黄芪复方滴丸是在补阳还五汤的基础上添加麝香、冰片配置而成。张运克等[68]发现麝香黄芪复方滴丸上调MCAO大鼠大脑中occludin、claudin-5、ZO-1的表达进而修复BBB损伤,实现保护脑组织、降低脑水肿的作用。
4 小结与展望
随着研究的深入,学者们逐渐证实TJ可作为中药治疗IS的效应靶点。本文经分类总结后发现,中药单体常选用清热类、活血类、补肾类、升阳类药物,其作用机制与抑制IS后炎症与氧化亚硝化反应、抑制MMPs的激活、上调抗氧化因子的表达等有关,对紧密连接蛋白claudin、occludin、ZO起到一定的保护作用。同时经归纳分析得出,对IS后上述3个蛋白起作用的中药复方大多具有通络止痛、益气活血、醒神开窍的功效。
中药疗法作为一种有效的保护血脑屏障TJ的防治手段,被广泛应用于基础研究,但是对其作用机制梳理过程中也发现很多不足之处:大部分研究仅观察了中药对脑内皮细胞间TJ蛋白表达的改变,其产生影响的复杂机制仍需深入探讨;其次,多数实验采用基因与人类同源性较高的鼠类作为研究IS与血脑屏障相互影响的对象[69],仍缺乏临床试验研究,未来还需建立中医症候群模型实验与临床试验研究,以更进一步的揭示中药治脑病的科学作用。因此,在现有的研究基础上,明确中药调控IS后TJ的具体保护机制,进一步筛选和研发改善IS后神经功能损伤的药物至关重要。

