基于脂代谢和炎症反应探讨两种湿热证痛风性关节炎大鼠模型的构建
甘 斌李华南李 松章晓云陈 宇顾 兵张云开刘永乾邵子晨
(1.江西中医药大学临床医学院,南昌 330004;2.江西中医药大学附属医院,南昌 330006;3.江西科技师范大学生命科学学院,南昌 330013)
痛风性关节炎(gouty arthritis,GA)是最常见的由晶体诱发的自身炎症性疾病之一,其特征是单钠尿酸盐(monosodium urate,MSU)晶体沉积于关节和(或)非关节结构中诱发[1]。全球患病率在1%~4%之间[2]。随着国民经济提高和饮食习惯的改变,我国GA的患病率呈显著上升趋势,患病率数据显示已达1136.24/100 000[3],且愈趋于年轻化[4]。一般来说,根据机体对MSU晶体炎症反应的临床表现可分为四期[5]:持续性高尿酸血症期、剧烈疼痛的急性炎症性关节炎期(GA发作期)、无痛无症状期(临界期)以及MSU晶体引起的持续性炎症期(慢性GA)和痛风石(Tophi)期,其中GA发作期在临床中最为常见[6]。
古代医学认为病之总者为病,而一病总有数证。94版《中医病症诊断疗效标准》[7]根据GA阶段性本质的症状集合将其概括为四证:湿热蕴结证、痰浊阻滞证、瘀热阻滞证、肝肾阴虚证。本课题组临床观察发现湿热证GA占比73.14%[8],这可能与江西人体质多属湿热质相关。江西省位于北回归线附近,属长江中下游地区,地形南高北低,雨量偏多,日照充足,为亚热带湿润气候;此外江西人饮食重油重辣,多食油脂等厚味之品,长此已久,故江西人体质偏湿热质。既往湿热内伤伏邪理论在临床学术研究中占首要,余邪伏于里遇诱因(外邪)而发-外邪入里、内湿为合,这也是湿热证最基础的病机[9]。
目前西医临床一线治疗急性期GA主要口服皮质内固醇、非甾体抗炎药或秋水仙碱等对症治疗[5],这些药物可迅速控制疼痛并抑制炎症,但使用时普遍受肾功能不全和心血管等诸多合并症的限制[10],此外还存在胃肠道和肾毒性等副作用。中药自古以来就用于GA治疗[11],从单味中药或中药组方中分离出的部分化学成分具有多靶点、低毒等特点,在GA防治中展示出良好前景[12]。动物模型是开展药物研究的重要载体,将“病”和“证”相结合构建接近人体湿热证GA(急性发作期GA)病证结合动物模型更是深入研究湿热证参与GA急性发作的病理生理机制及中药药效评价的基础[13]。尽管单独的“湿热证”模型和“GA”模型造模方式繁多,但尚无公认合理成熟的湿热证GA病证结合动物模型造模方法。基于此,本实验以雄性SD大鼠为造模对象,从脂代谢和炎症反应出发探讨两种不同湿热证GA病证结合模型造模差异,以期为筛选稳定且具备可重复性的湿热证GA病证结合大鼠模型提供客观数据支持。
1 材料和方法
1.1 实验动物
SPF级健康雄性SD大鼠44只,6周龄,体重180~200 g,由江西中医药大学实验动物科学技术中心提供[SCXK(赣)2018-0001],饲养于江西中医药大学实验动物科学技术中心[SYXK(赣)2017-0004]。实验过程通过了江西中医药大学实验动物伦理委员会审查(JZSYDWLL-20200901),并严格遵循实验动物3R原则。于江西中医药大学动物中心无特定病原体级屏障系统内采用昼夜间断12 h/12 h照明方式饲养,温度(23±2)℃,相对湿度(55±3)%。所有大鼠均由江西中医药大学实验动物科学技术中心的工作人员检疫并适应性饲养1周后开始造模。适应性饲养期间大鼠自由饮水、进食,同时每3 d更换高温灭菌后的玉米芯垫料。
1.2 主要试剂与仪器
正常普通基础饲料:成分为玉米30%,小麦25.5%,豆粕20%,酪蛋白10%,鱼粉5%,蜜糖酵母2.5%,油2.5%,磷酸氢钙2%,生长预混料1%,石粉1%,食盐0.3%,氯化胆碱0.2%;高脂高糖饲料:在上述正常普通基础饲料基础上添加糖、黄油和鱼粉,具体成分为58.9%普通基础饲料、黄油15%,绵糖15%、蛋黄粉5%,鱼粉5%,胆固醇1%,猪胆盐0.1%。
TG、TC、LDL-C、HDL-C(批号分别为:20210118、20210115、20210118、20210304,南京建成生物工程研究所);NF-κB、IL-1β、TNF-α、IL-6(批号分别为:YX-201406R、 YX-091203R、 YX-201407R、 YX-091206R,上海赫澎生物科技有限公司);红星二锅头白酒(批号:20160424,北京红星股份有限公司);冠生园蜂蜜(批号:GB14963,上海冠生园蜂制品有限公司);鼠伤寒沙门菌(批号:ATCC14028,美国菌株保藏中心);戊巴比妥钠(批号:SIGMA-P3761,美国Sigma-Aldrich公司)。
人工气候箱(批号:MGC-350-HP-2,上海一恒科学仪器有限公司);全波长多功能酶标仪(批号:3001-1950,美国Thermo公司);高速冷冻离心机(批号:C2500-RC,美国Labnet公司)。
1.3 实验方法
1.3.1 MSU混悬液的配置
向关节腔内注射MSU混悬液是湿热证GA病证结合模型中“GA”模型诱导的关键。按照黄火高[14]的方法并结合MSU晶体在不同pH值环境下的形态改变[15]对其配制方法进行改良,具体步骤如下:将4.5 mL NaOH溶液(浓度:0.5 moL/L)加入400 mL超纯水中,加入2 g尿酸,用磁力搅拌器缓慢加热并不断搅拌,直至尿酸完全溶解。随后将温度保持在60℃用1 moL/L的HCl溶液调pH=7.2,室温冷却后置于4℃冰箱过夜冷藏,隔日滤去上清,盛入蒸发皿中经水浴锅干燥,干燥后用碾钵碾成细末并通过250 μm孔径金属网筛过筛,经高温高压灭菌后用无菌EP管收集。以无菌生理盐水配成浓度20 mg/mL MSU混悬液,使用前置于高压灭菌锅内灭菌30 min,现配现用。
1.3.2 实验分组及干预
健康SD雄性大鼠44只,经由江西中医药大学实验动物科学技术中心的工作人员检疫并适应性喂养1周后按随机数字表法分为4组:正常对照组、GA对照组、模型组A、模型组B。除正常对照组和GA对照组10只外其余各组每组12只(根据预实验中大鼠死亡率评估增加20%)。
正常对照组:在屏障实验室恒温恒湿环境内普通饲料喂养,自由饮水21 d。
GA对照组:喂饲方式同正常对照组,第18天以大鼠踝关节外侧两骨突出为注射定位点,将抽取了MSU混悬液注射器配6号注射器针头,针头斜面朝关节腔沿胫骨前肌内侧向下插至关节腔,有落空感时停止进针且回抽无血后注入50 μL MSU溶液(浓度:20 mg/mL)以对侧关节囊鼓起为注入标准,诱导GA模型。
模型组A:第一阶段即高脂高糖和高温高湿阶段制备湿热证模型,给大鼠饲以高脂高糖饮食,并在高脂高糖饲料喂养的基础上,用200 g/L蜂蜜水自由饮用,且白酒1 mL/100 g和猪脂1.5 mL/100 g交替灌服,共持续14 d。从第8天开始每日上午8:00放入人工气候箱中,温度为(32±2)℃,相对湿度95%,8 h,共持续14 d;第二阶段制备GA“病”模型,在第18天造模同GA对照组。通过上述复合多因素造模方式制备湿热证GA病症结合大鼠模型。
模型组B:第一阶段即高脂高糖阶段联合生物因素干预制备湿热证模型,给大鼠饲以高脂高糖饮食,并在高脂高糖饲料喂养的基础上,加用200 g/L蜂蜜水自由饮用,且白酒1 mL/100 g和猪脂1.5 mL/100 g交替灌服,共持续14 d。于第10天灌服鼠伤寒沙门氏菌液(10 mL/kg,每毫升109个),第15天加强一次(5 mL/kg);第二阶段制备GA“病”模型,在第18天造模同GA对照组。通过上述复合多因素造模方式制备湿热证GA病症结合大鼠模型。
1.3.3 观测指标
(1)一般情况观测及统计造模后各组死亡率
确定以第1、8、15、21天同一时刻对大鼠表征进行观察,包括:①精神状态;②饮食饮水;③毛色;④大小便等情况;最后造模结束统计大鼠死亡率。
(2)踝关节肿胀的测定
周长法:使用缚线测量注射MSU混悬液前0 h及造模后4、8、12、24、48及72 h后大鼠踝关节划线部位的周长。以造模前后周长的差值作为肿胀度变化,即肿胀度=造模后周长-造模前周长。
(3)大鼠步态分析
①步态改变分级:在造模后,请1名骨科医生(不知分组情况)观察大鼠步态的改变并按步态分级标准计分:正常步态为0级;轻度跛行,右足稍呈弯曲态行走为1级;中度跛行,右足弯曲明显,轻挨地面行走为2级;重度跛行,右足脱离接触面甚至三足步态行走为3级。
②炎症指数评分标准:正常为0级,记作1分;关节皮肤出现红斑,轻度肿胀,骨性标志可见为Ⅰ级,记作2分;肿胀皮肤出现褶皱,骨性标志消失,但肿胀未跨出关节部位为Ⅱ级,记作3分;关节皮肤呈暗红且关节以外肢体也出现肿胀为Ⅲ级,记作4分。
(4)血清制备,脂代谢指标和炎症因子检测
造模后第21天,各组大鼠禁食不禁水12 h,3%戊巴比妥钠腹腔注射麻醉后腹主动脉采血,将采血管略倾斜静置2 h,3000 r/min × 15 min离心,收集上层血清于-80℃中保存。严格按照ELISA试剂盒检测血清TG、TC、HDL-C、LDL-C、IL-1β、IL-6、TNFα、NF-κB的表达情况。
1.4 统计学方法
采用SPSS 26.0软件对数据进行分析,采用平均数±标准差(±s)表示,运用单因素方差分析对各组间统计数据进行比较。组间多重比较,若满足方差齐性采用LSD法检验,反之则采用Dunnett’sT3检验;以α=0.05为检验水准,P<0.05表示具有统计学意义,P<0.01表示具有极显著统计学差异。采用Graphpad Prism 8.0.2软件绘图。
2 结果
2.1 各组大鼠一般情况观察
正常对照组:喂养期间精神状态好,活动正常,毛色柔顺亮泽,双目炯炯有神,体重增加平稳,饮食、大小便均正常;GA对照组:由于前期未参与高糖高脂饲料和湿热证阶段造模,故表征均正常,注射MSU后首先出现烦躁不安并用舌头舔舐右足,右后肢弯曲明显,轻挨地面行走甚至抬离地面,随后精神萎靡,蜷缩在角落;模型组A和模型组B:大鼠逐渐出现活动力减弱,毛发粗糙疏松、毛色暗淡,前7 d体重逐渐增加随后增势缓慢且饮食减少尤其在放入人工气候箱后大部分出现精神倦怠、嗜睡,毛发枯槁潮湿掉毛,体重及饮食均减少,大便较正常组量少甚至不成型、溏便。在第18天注射MSU后合并GA对照组造模症状。与模型组A相比,模型组B大鼠在灌服鼠伤寒沙门氏菌后大鼠体重不增反减,大便粪质稀溏味臭。
2.2 实验大鼠死亡及其解剖分析
纳入的44只大鼠,其中有4只(模型组A死亡1只,模型组B死亡3只)大鼠在造模过程中死亡,模型组A死亡率8.3%,模型组B死亡率25%。
2.3 各组大鼠踝关节肿胀度测定比较
由表1可见,组内比较:正常对照组在4 h肿胀程度达到高峰,随后肿胀程度逐渐回落,到72 h基本恢复,可能是由于注射生理盐水引起的非病理性肿胀,后期生理盐水被自体吸收。GA对照组、模型组A和模型组B在4、8、12 h肿胀程度逐渐增大,并于12 h达到高峰,随后肿胀程度逐渐回落。组间比较:与正常对照组比较,造模后4、8、12、24、48、72 h,GA对照组、模型组A和模型组B的踝关节肿胀明显增大(P<0.01)。这与前人研究相一致[16-17],提示造模成功。模型组A在不同时间点与模型组B比较均不具备统计学意义(P>0.05)。
表1 各组大鼠不同时间点踝关节周长法肿胀度测量变化(±s,mm)Table 1 Measure the changes of ankle joint swelling degree at different time points in each group of rats based on the circumference method
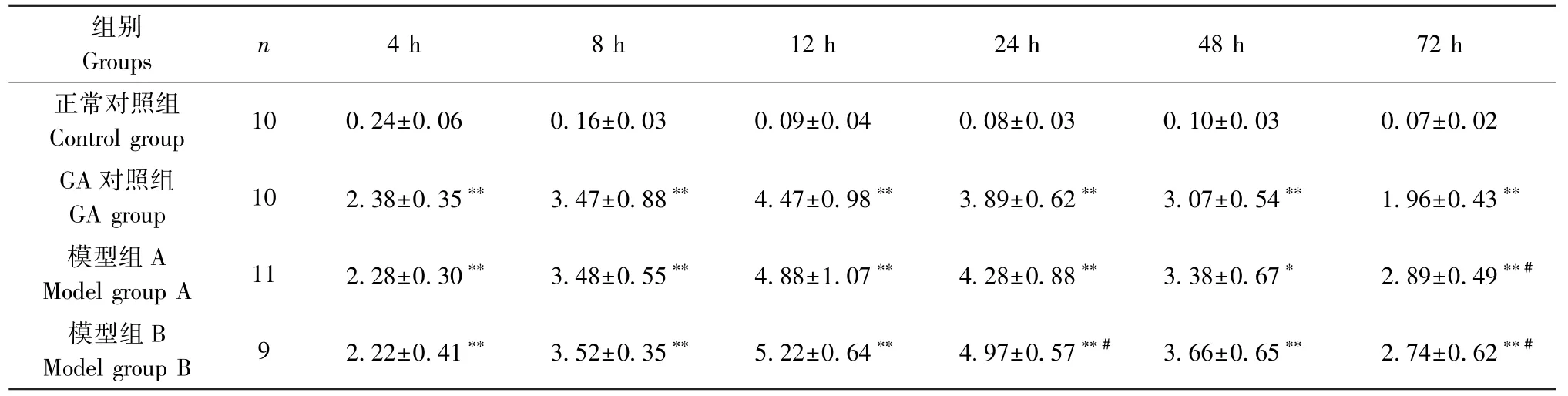
表1 各组大鼠不同时间点踝关节周长法肿胀度测量变化(±s,mm)Table 1 Measure the changes of ankle joint swelling degree at different time points in each group of rats based on the circumference method
注:与正常对照组相比, *P<0.05, **P<0.01;与GA对照组相比, #P<0.05。Note. Compared with the control group, *P<0.05, **P<0.01. Compared with the GA group, #P<0.05.
组别Groups n 4 h 8 h 12 h 24 h 48 h 72 h正常对照组Control group 10 0.24±0.06 0.16±0.03 0.09±0.04 0.08±0.03 0.10±0.03 0.07±0.02 GA对照组GA group 10 2.38±0.35** 3.47±0.88** 4.47±0.98** 3.89±0.62** 3.07±0.54** 1.96±0.43**模型组A Model group A 11 2.28±0.30** 3.48±0.55** 4.88±1.07** 4.28±0.88** 3.38±0.67* 2.89±0.49**#模型组B Model group B 9 2.22±0.41** 3.52±0.35** 5.22±0.64** 4.97±0.57**# 3.66±0.65** 2.74±0.62**#
2.4 各组大鼠步态分级和炎症指数评分比较
由表2可见GA对照组、模型组A和模型组B大鼠步态等级大部分被评为Ⅲ级。由图1可见,与正常对照组比较,GA对照组、模型组A和模型组B炎症指数存在显著差异性(P<0.01),说明“GA”病模型复制成功。且进一步说明大鼠步态分级和炎症指数的改变主要与MSU注射后引发右踝关节的炎症改变相关。
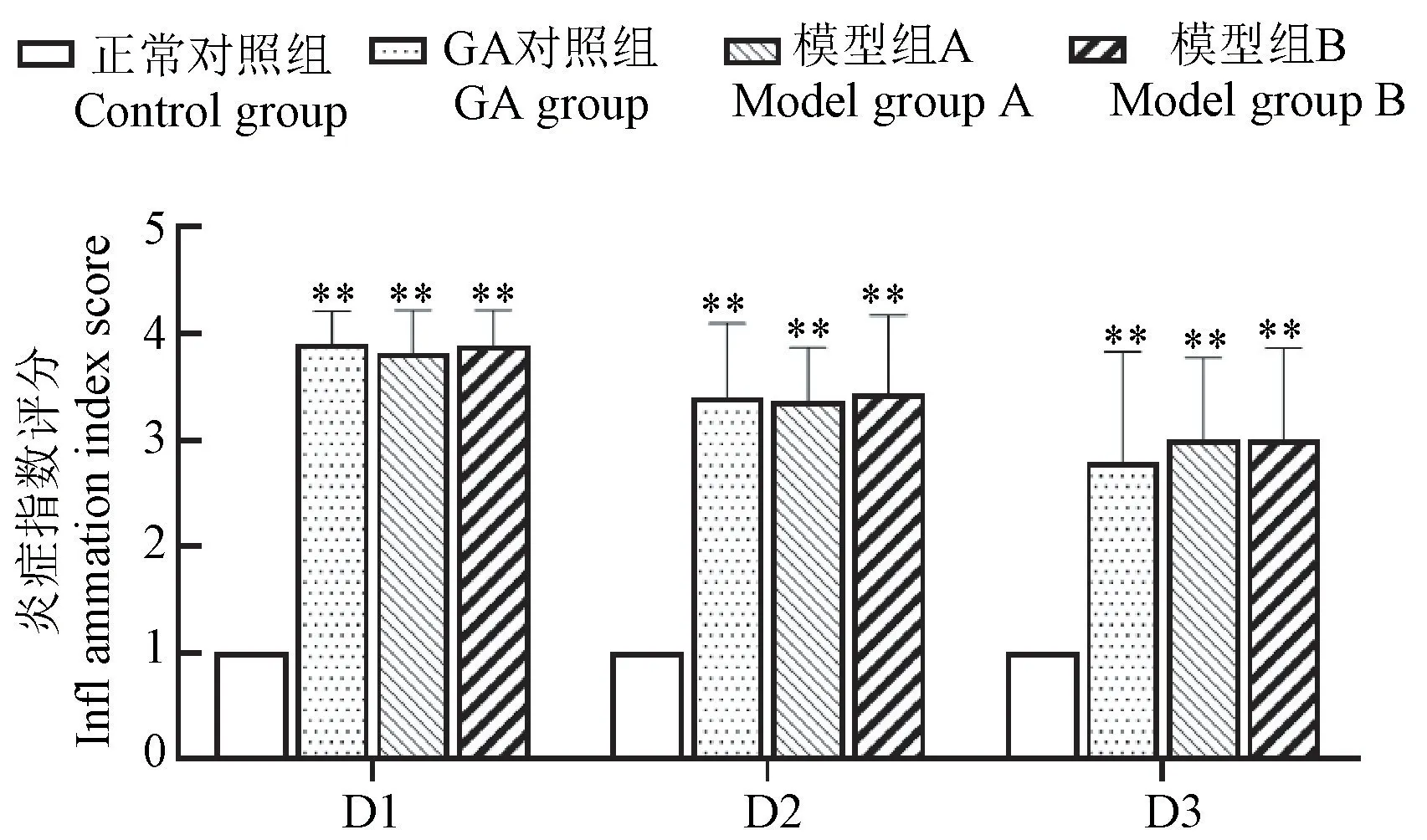
图1 各组大鼠注射MSU混悬液后关节炎症指数评分柱状图Figure 1 The score of ankle joint inflammation index in each group after inject MSU suspension
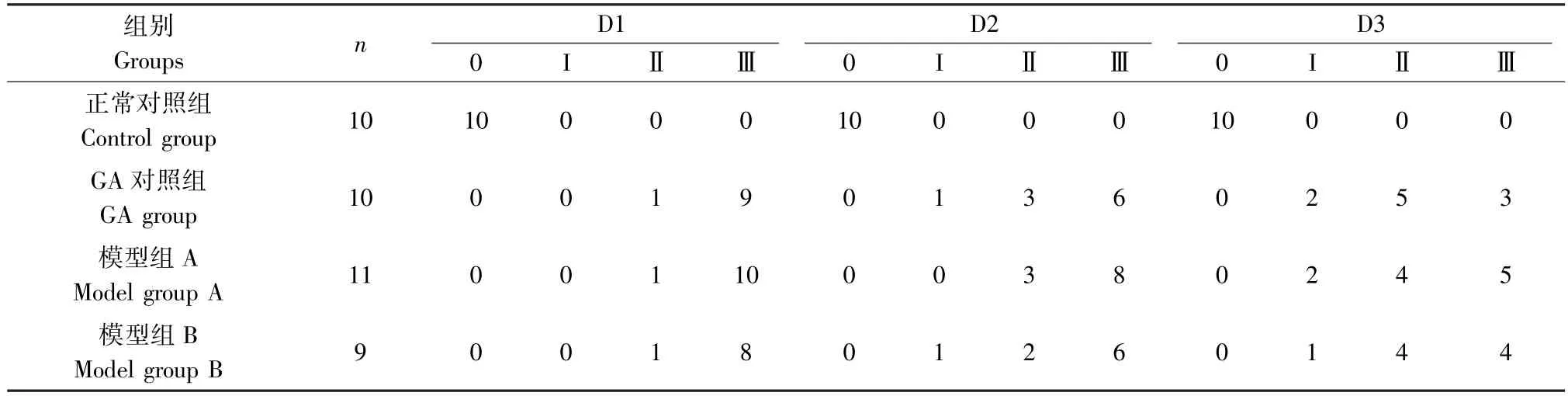
表2 注射MSU混悬液后各组大鼠踝关节步态分级情况Table 2 Ankle gait classification of rats in each group after inject MSU suspension
2.5 各组大鼠脂代谢指标表达比较
由表3可知,模型组A和模型组B的TG、TC和LDL-C均高于正常对照组和GA对照组,HDL-C则显著低于正常对照组和GA对照组,差异有统计学意义(P<0.05)。与模型组A相比,模型组B的TG和HDL-C趋势有所升高,TC和LDL-C趋势降低,但差异无统计学意义(P>0.05)。
表3 各组大鼠血脂代谢改变情况(±s,mmol/L)Table 3 Changes of blood lipid metabolism in rats in each group
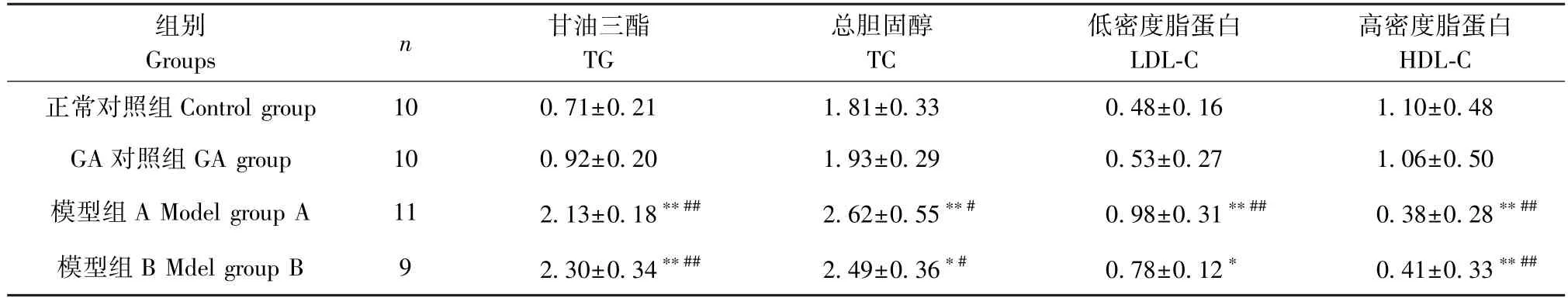
表3 各组大鼠血脂代谢改变情况(±s,mmol/L)Table 3 Changes of blood lipid metabolism in rats in each group
注:与正常对照组相比, *P<0.05, **P<0.01;与GA对照组相比, #P<0.05, ##P<0.01。Note. Compared with the control group, *P<0.05, **P<0.01. Compared with the GA group, #P<0.05, ##P<0.01.
组别Groups n 甘油三酯TG总胆固醇TC低密度脂蛋白LDL-C高密度脂蛋白HDL-C正常对照组Control group 10 0.71±0.21 1.81±0.33 0.48±0.16 1.10±0.48 GA对照组GA group 10 0.92±0.20 1.93±0.29 0.53±0.27 1.06±0.50模型组A Model group A 11 2.13±0.18**## 2.62±0.55**# 0.98±0.31**## 0.38±0.28**##模型组B Mdel group B 9 2.30±0.34**## 2.49±0.36*# 0.78±0.12* 0.41±0.33**##
2.6 各组大鼠免疫炎症因子表达比较
由表4可知,与正常对照组相比,GA对照组、模型组A和模型组B的NF-κB、IL-1β、IL-6和TNFα水平均显著升高(P<0.01),这提示模型复制成功。与GA对照组相比,模型组A的NF-κB和TNFα水平有所升高(P<0.05),模型组B的NF-κB、IL-1β、IL-6和TNF-α水平有所升高(P<0.05),这提示两种病证结合模型造模方式或可刺激机体产生慢性炎症反应。与模型组A相比,模型组B的IL-1β、IL-6和TNF-α水平有所升高(P<0.05),这或许可以作为两种病证结合模型炎症反应量化指标。
表4 各组大鼠NF-κB、IL-1β、IL-6和TNF-α改变情况(±s,pg/mL)Table 4 The level of NF-κB, IL-1β, IL-6, TNF-α in rats of each group

表4 各组大鼠NF-κB、IL-1β、IL-6和TNF-α改变情况(±s,pg/mL)Table 4 The level of NF-κB, IL-1β, IL-6, TNF-α in rats of each group
注:与正常对照组相比, *P<0.05, **P<0.01;与GA对照组相比, #P<0.05, ##P<0.01;与模型组A相比, aP<0.05, aaP<0.01Note. Compared with the control group, *P<0.05, **P<0.01. Compared with the GA group, #P<0.05, ##P<0.01. Compared with the model group A, aP<0.05, aaP<0.01.
组别Groups n 核因子-κB NF-κB白细胞介素 1β IL-1β白细胞介素-6 IL-6肿瘤坏死因子-α TNF-α正常对照组Control group 10 391.69±22.99 46.13±10.68 32.76±5.81 4.86±1.26 GA对照组GA group 10 680.10±29.07** 361.50±8.58** 143.1±10.67** 58.81±6.53**模型组A Model group A 11 738.74±49.33**# 366.70±12.48** 146.5±11.09** 64.78±5.93**#模型组B Model group B 9 741.15±52.59**# 430.00±12.50**##aa 168.9±6.61**##aa 71.26±4.44**##a
3 讨论
《素问·至真要大论篇》指出:“诸湿肿满,皆属于脾”[18];《素问·阴阳应象大论篇》指出:“中央生湿……其藏为脾”[18],可见脾与湿密切相关;清代薛生白言“湿热乃阳明太阴同病也”,以上均说明湿热证病位多责之于脾胃[19]。湿热证病程多缠绵反复,系饮食内伤致脾失健运,水液运化机能失职,导致水液留滞、内湿内生,复感外邪,内外相引,故病湿热[20]。这也和《素问·奇病论篇》中:“甘者,肥美之所发”,指出甘为湿之应,常食膏粱厚味,易生湿蕴热,病因病机相吻合。总结以上对湿热证病因病机的论述,在本实验中模型组A和模型组B均通过自由饮用蜂蜜水,猪脂、白酒隔日灌服14 d,以损其脾胃,复刻脾失健运,水液运化失职,导致内湿自生。模型组A给予高温高湿外环境,模型组B通过外邪(鼠伤寒沙门氏菌)从口鼻而入,模拟中医传统病因,内外相引,故病湿热。从症状表现来看,模型组A和模型组B大鼠均出现便溏的临床表现,这提示脾胃运化机能障碍,升降失序,清浊不分。根据现有的模型评判标准,可认为模型组A和模型组B均复制身重困倦、腹胀纳呆、便溏的湿热证表现。
众所周知,高尿酸血症是GA最主要的危险因素,但临床研究表明,许多高尿酸血症患者不会发展为GA,也不会形成MSU晶体,甚至终身无症状。另有研究表明,约70% GA患者虽血尿酸值正常,但临床却表现出GA急性发作症状。这说明只有当关节内MSU晶体沉积并与中性粒细胞相作用时,才会导致以中性粒细胞为首的先天免疫系统被激活,进而引发GA发作[21-22]。临床上GA起病急骤,发作时可导致患者关节红肿、剧烈疼痛和运动障碍等症状,通常在7~10 d后缓解,患者自行恢复。此外本次实验造模使用的大鼠为啮齿类动物,与灵长类不同在于其自身存在可将尿酸代谢为尿囊素的尿酸酶[23],故非长期刺激,而只是一过性刺激难以建立以高尿酸血症为基础的GA动物模型[24]。MSU晶体作为诱发GA发作的关键物质,因此目前建立GA动物模型最经典方法便通过向关节腔内注射外源性MSU晶体。该造模方式不仅操作简便、模型稳定而且与临床GA患者急性发作症状相吻合。根据本实验结果,注射MSU晶体混悬液2 h后模型逐渐形成,12h后模型效果达到峰值,此后即使不做干预,红肿热痛症状亦逐渐缓解。这提示本实验GA模型复制与临床GA急性发作相符合,这也提示临床GA发作12 h内是治疗的黄金时间可极大地缓解GA发作症状。
湿邪为有形之邪,血脂便是其生化物质基础之一,脂代谢紊乱则表明脾失健运,导致运化水湿、分清泌浊的功能失职,为湿热证的发展创造了内在条件[25]。吕文亮等[26]采用“人工气候箱+肥甘饮食+鼠伤寒沙门菌”法建立湿热证模型可引发血循环中LDL-C升高而HDL-C降低。李华锋等[27]和阙铁生等[28]采用“高脂饮食+高温高湿+大肠埃希菌灌胃”法制备的温病湿热证中TC、TG、LDL-C水平显著增加,HDL-C水平显著减少。由此可见脂代谢紊乱是湿热证特征之一。此外临床横断面研究表明脂代谢异常是GA诱发因素之一[29]。本实验中模型组A和模型组B的TG、TC和LDL-C水平显著高于正常对照组和GA对照组,HDL-C水平则显著低于正常对照组和GA对照组,说明两种造模方式均发生脂代谢紊乱,大鼠出现湿热证表现,且对GA发作有促进作用。
GA属炎症性疾病的一种,其最大特征是MSU晶体沉积诱发炎症发作。先天免疫在GA发作的自我缓解机制中发挥重要作用,单核/巨噬细胞是先天免疫系统的重要细胞组分。MSU晶体作为一种“危险信号”因子,在GA发作的启动、放大和维持中发挥重要作用,主要与IL-1β、IL-6和TNF-α等促炎因子相关[30]。这些促炎因子主要由于单核/巨噬细胞被MSU晶体诱导活化而产生。有生物活性的成熟IL-1β被当作GA发作的始动因子,其可通过活化IL-1受体通路刺激炎症因子和趋化因子,募集大量中性粒细胞。TNF-α可激活中性粒细胞和淋巴细胞,从而促进其他细胞因子的合成和释放,也可诱导细胞凋亡。此外TNF-α可刺激黏附因子的大量分泌,随后黏附因子与白细胞共同作用损伤关节细胞和关节软骨[31],这可能与GA患者剧烈疼痛相关。Liu等[32]发现MSU晶体刺激单核细胞,可刺激单核细胞分泌IL-1β和TNF-α,且呈时间依赖性。另有研究表明IL-6有助于诱发GA炎症,是激活MSU介导的NLRP3炎性体激活所必需的炎症因子[33]。患者IL-6表达检测可反映GA病情发展变化[34]。徐晓辰等[35]探讨GA患者不同时间点血清炎性因子的变化,结果表明IL-1β、IL-6及TNF-α在炎症过程中可能存在共同作用。研究报道,30年前David Baltimore和Ranjan Sen发现一个在炎症反应过程中的关键转录因子,即NF-κB,其含了一个二聚体转录因子家族,对炎症反应的调控以及几乎所有生物中细胞的增殖、生化和凋亡都至关重要[36]。MSU晶体、促炎因子(如:IL-1β、IL-6和TNF-α)和脂多糖等胞外刺激均可诱导NF-κBp65转入细胞核,促进靶基因转录表达[37]。研究表明MSU晶体主要通过两种途径诱导NF-κB活化:(1)在大多数细胞中,其通常以p65/p50二聚体形式存在,p65主要承担NF-κB转录活性。MSU晶体可能与toll样受体2和toll样受体4结合,导致NF-κBp65的核易位,最终诱导NF-κB活化。(2)MSU晶体可诱导由核苷酸结合寡聚化结构域、亮氨酸重复序列和热蛋白结构域组成的NLRP3炎症小体的活化,活化的NLRP3炎症小体可激活效应蛋白胱冬肽酶-1,最终导致成熟IL-1β的产生[38]。成熟的IL-1β能够通过IL-1受体通路诱导NF-κB的活化。以上诸多文献均证明NF-κB、IL-1β、IL-6和TNF-α在GA发作中的重要作用,同时也有研究表明湿热证与炎症密切相关[39]。本实验结果表明IL-6、IL-1β、TNF-α和NF-κB表达呈现模型组B>模型组A>GA对照组>正常对照组,说明模型组A、模型组B和GA对照组大鼠均表现出明显炎症反应。此外模型B炎症因子IL-6、IL-1β和TNF-α表达高于模型组A,总体而言说明生物因子与单纯湿热环境相比,生物因子对于炎性因子的启动可反应“热”致病因子靶点所在。
综上所述,本研究结果表明两种造模方式均可诱导湿热证“证”和GA“病”的临床表现。从脂代谢和炎症因子指标观察二者既有共性也有各自特点,但毋庸置疑高脂高糖饮食是脂代谢紊乱的直接影响因素,且脂代谢可作为“湿”致病因子靶点,炎性因子可作为“热”致病因子靶点。综合比较生物因子对于大鼠炎症影响更明显,可作为湿热证GA病证结合模型中“热”靶点量化评价指标。将“病”和“证”相结合制备湿热证痛风性关节炎病证结合模型可为探明中医药治疗作用和机理研究提供可行的动物模型选择。

