靛蓝对脂多糖诱导的THP-1细胞的抗炎作用
赖家文,林丽云,王东翔,林钰,黎倩,杨丽红,陈健勤,刘靖
炎症是机体遭受各种内外刺激后的一种防御性反应,巨噬细胞是机体固有免疫的重要组成部分,同时也是产生炎症反应的重要细胞。现代研究[1]表明,巨噬细胞在炎症性疾病的发生和炎症维持中具有关键作用。因此从抗炎的角度研究和开发具有巨噬细胞保护作用的药物对炎症性疾病的治疗具有重要意义。
中药板蓝根、大青叶、青黛都具有清热解毒、凉血等功效[2-4],现代研究早已证实以上3种中药均具有良好的抗炎作用,中药单体靛蓝(indigo, IDG)是他们的共同主要有效活性成分之一[5-6]。近些年研究[7]发现,靛蓝具有抗炎和抗肿瘤作用,但目前对于其治疗临床炎症性疾病的研究相当罕见,靛蓝对脂多糖(lipopolysaccharide, LPS)诱导THP-1细胞炎性反应的影响更是未见报道。基于此,本研究采用LPS建立THP-1细胞炎症模型,观察靛蓝对LPS诱导的炎症反应的影响,以期从细胞水平发掘靛蓝的抗炎作用,为靛蓝治疗炎症性疾病的开发和临床合理应用提供实验依据。
1 材料与方法
1.1细胞系 人巨噬细胞系(THP-1来源),购自于武汉大学典型培养物保藏中心。
1.2药物及主要试剂 靛蓝(Indigo,IDG,纯度100%)购自成都瑞芬思生物科技有限公司;RPMI 1640培养基、胎牛血清、青链双抗、胰蛋白酶均购自美国Gibco公司;磷酸脂多糖(LPS)、二甲基亚砜(DMSO)均购自美国Sigma公司;MTT试剂盒、BCA试剂盒均购自上海碧云天公司; ELISA试剂盒包括:人IL-23p19 (Cat # 88-7237-86)、人IL-6(Cat # 88-7066-22)、人IL-8(Cat # 88-8086-22)、人TNF-α (Cat # 88-7346-88)、IL-1β (Catalog # 88-7261-88)及Prestained Protein Ladder均购自美国Thermo Scientific公司:Trizol Reagent、M-MLV试剂盒均购自美国Invitrogen 公司;Recombinant RNase Inhibitor、dNTP Mixture、SYBR Premix Ex Taq Ⅱ MasterMix均购自日本TaKaRa公司;本实验中所用的一抗:兔抗人Nrf2(16396-1-AP)、HO-1(10701-1-AP)均购自于Proteintech公司(武汉,中国)。二抗:山羊抗兔(#32460)购自美国Thermo Scientific公司。ECL化学发光显色液购自美国BIO-RAD公司。
1.3主要仪器 HealForce HF90 型二氧化碳培养箱(香港力康生物医疗科技控股集团)、ABI 7500 型荧光定量PCR仪器(美国Applied Biosystems 公司)、酶标仪(德国Eppendorf公司)、C-Digit化学发光扫描仪(美国LI-COR公司)。
1.4细胞培养 THP-1使用RPMI-1640(含10%胎牛血清,青、链霉素,谷氨酰胺及非营养必需氨基酸)培养,于37 ℃、5% CO2条件下进行常规培养和传代操作。
1.5THP-1炎症损伤模型制备 取对数生长期的THP-1细胞按2×106个/孔培养于6孔板,培养24 h后,加入终浓度为20 ng/mL LPS刺激24 h制备THP-1细胞炎症损伤模型。
1.6RNA的提取、逆转录及定量PCR 每个培养孔加入250 μL Trizol Reagent,按说明书提取RNA,以Nanodrop 2000超微量紫外/可见光光度计(美国Thermo Scientific公司)测定RNA浓度;按M-MLV说明书进行逆转录。使用SYBR Premix Ex Taq Ⅱ Master Mix配制20 μL定量PCR反应体系。每个反应使用模板cDNA 0.5 μg。使用ABI 7500 型荧光定量PCR仪器进行扩增及定量检测;扩增条件为95 ℃ 15 s,60 ℃ 1 min,40个周期。以融解曲线判断是否存在非特异扩增。每个样品测3个重复孔,检测结果取均值。引物序列见表1。
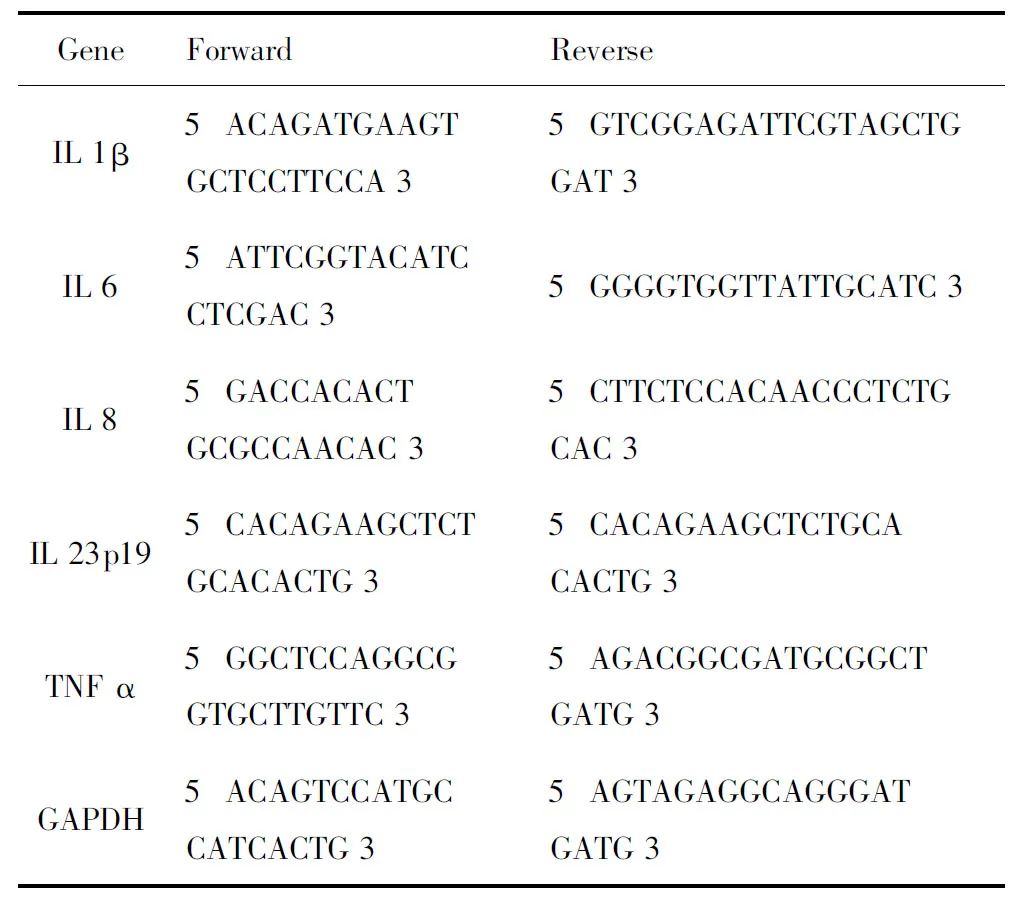
表1 定量PCR引物序列表Tab.1 Real-time PCR primer sequences.
1.7酶联免疫吸附实验(ELISA) 不同浓度的靛蓝干预1 h后,收集各组细胞培养上清,用ELISA试剂盒检测其中IL-1β、IL-6、IL-8、IL-23p19和TNF-α细胞因子的含量,具体操作按说明书进行。
1.8Western blot实验检测 收集THP-1细胞,按RIPA裂解液说明书得到总蛋白,BCA法定量后进行聚丙烯酰胺凝胶电泳。电泳后将条带电转至0.2 μm PVDF膜上。5%牛血清白蛋白室温封闭3 h,加入适当浓度的一抗4 ℃孵育过夜,再置于1∶1 000稀释的辣根过氧化物酶标记的二抗溶液中室温孵育2 h,洗膜后加入ECL发光液显色,美国LI-COR公司的C-Digit化学发光扫描仪进行扫描拍照。照片通过使用ImageJ软件进行光密度分析。计算时采用各指标与β-actin的光密度比值的相对表达量。
1.9统计学处理 使用 SPSS26.0 统计学软件根据数据性质进行统计分析。计量资料进行K-S(Kolmogorov-Smirnor)检验,是否符合正态分布,以P>0.05认为符合正态分布。对于符合正态分布的数据采用单因素方差分析,其中符合正态分布且方差齐的数据,两两比较采用LSD检验;对于方差不齐的数据,两两比较使用Tamhance′sT2检验;对于不符合正态分布的数据,采用非参数检验的“Indepen-dent-SamplesKruskal-WallisText”。检验结果P<0.05为差异具有统计学意义。使用Graphpad prism 8.0作图。
2 结果
2.1靛蓝对LPS诱导的THP-1细胞炎症相关因子mRNA表达的影响 与空白组比较,LPS刺激24 h后,IL-1β、IL-6、IL-8、IL-23p19及TNF-α mRNA的表达均显著增高(P<0.05)。0.4 μmol/L和4 μmol/L浓度的靛蓝干预后均可下调LPS诱导的IL-1β、IL-6、IL-8、IL-23p19和TNF-α的mRNA表达水平(P<0.05);40 μmol/L浓度的靛蓝亦可显著抑制IL-6、IL-23p19、TNF-α的转录(P<0.01),对IL-1β和IL-8的抑制作用虽无统计学意义,但较LPS组相比,仍表现出抑制作用。结果表明,靛蓝可通过下调相关炎症因子的转录,阻断LPS诱导的炎症反应,发挥对THP-1细胞的保护作用,其中0.4 μmol/L和4 μmol/L这两个浓度作用效果更明显,见图1。

Note: Compared with blank group#P<0.05, ##P<0.01, ####P<0.000 1;compared with LPS group *P<0.05, **P<0.01, ***P<0.001, ****P<0.000 1.图1 靛蓝对各细胞因子mRNA表达的影响Fig.1 Effects of indigo on mRNA expression of cytokines
2.2靛蓝对LPS刺激的THP-1细胞培养上清中炎症细胞因子含量的影响 经LPS刺激后,培养上清中的IL-1β、IL-6、IL-8、IL-23p19、TNF-α这4种炎症细胞因子的含量均显著升高(P<0.001)。4 μmol/L的靛蓝对上述炎症因子的表达均有显著抑制作用(P<0.05),而0.4 μmol/L和40 μmol/L浓度的靛蓝亦可显著抑制IL-1β、IL-8、IL-23和TNF-α的表达(P<0.05),但它们下调IL-6的表达差异无明显统计学意义。说明不同浓度的靛蓝均可发挥一定的抗炎作用,其中4 μmol/L浓度的靛蓝作用效果最明显,见图2。
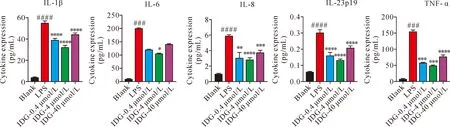
Note: Compared with blank group###P<0.001,####P<0.000 1;compared with LPS group *P<0.05, **P<0.01, ***P<0.00 1,****P<0.000 1.图2 靛蓝对细胞培养上清中各炎症因子表达含量的影响Fig.2 Effects of indigo on the expression of inflammatory factors
2.3靛蓝对Nrf2/HO-1细胞信号通路的影响 LPS可显著抑制Nrf2、HO-1信号通路相关蛋白的表达,且其差异具有统计学意义(P<0.01),而靛蓝处理后可增加Nrf2、HO-1信号通路的表达(P<0.05);提示靛蓝可能通过刺激Nrf2/HO-1信号通路,参与抑制LPS诱导的THP-1细胞相关炎症反应,见图3。

Note: Compared with blank group #P<0.05, ##P<0.01, ####P<0.000 1;compared with LPS group *P<0.05, **P<0.01, ****P<0.000 1.图3 靛蓝对THP-1细胞中Nrf2、HO-1蛋白表达含量的影响Fig.3 Effects of indigo on the content of Nrf2 and HO-1 proteins
3 讨论
近年来,很多常用中药及其有效活性成分都被证实可从免疫调节、抑制炎症、促进细胞凋亡等不同方面发挥治疗作用,从植物中发掘新型抗炎药物,研究其抗炎作用并探讨其机制,是当今研究热点之一。靛蓝是常用清热解毒中药板蓝根、大青叶、青黛的共同有效活性成分,虽有初步研究表明靛蓝具有抗炎作用,但大部分仅停留在网络药理、动物实验等层面,在细胞层面研究较少,具体机制仍不清楚。
THP-1 细胞可经过诱导分化为成熟的巨噬细胞,常用于单核细胞和巨噬细胞相关的机制研究中[8]。LPS是一种来自革兰氏阴性细菌外膜的特异性抗原复合物,是免疫系统最有效的激活剂之一[9]。LPS能与巨噬细胞表面的Toll样受体4(Toll-like receptor 4, TLR4)结合,激活相关炎症信号通路,促使IL-1β、IL-6、IL-8、TNF-α、IL-23等炎性细胞因子的表达,引起机体过度的免疫反应和炎症损伤,是建立THP-1细胞炎症模型公认的造模方法之一[10]。本实验采用LPS刺激THP-1细胞24 h以模拟THP-1巨噬细胞炎症模型,通过ELISA及qRT-PCR方法检测发现,用20 ng/mL浓度的LPS刺激24 h后,THP-1细胞中IL-1β、IL-6、IL-8、IL-23p19及TNF-α的表达均有不同程度的升高,且与空白组相比差异具有统计学意义(P<0.05),说明本实验的炎症模型构建成功。有趣的是,本实验结果表明,靛蓝干预后,可以显著抑制IL-1β、IL-6、IL-8、IL-23p19及TNF-α的表达,且在低浓度时就具有较好的抑制作用,说明靛蓝具有良好的抗炎效果,是治疗炎症性疾病的潜力药物。
炎症损伤可引起细胞活性氧升高,而过量的ROS可诱导CD4+T淋巴细胞向辅助性T(helper T cell,Th)17细胞增殖分化,进而分泌大量炎症因子如IL-17、IL-22、TNF-α等,扩大炎症反应[11-12]。多种炎症性疾病使用抗氧化剂药物治疗后可取得较好的疗效[13-14]。Nrf2/HO-1信号通路是防御氧化应激的重要通路之一,在生理条件下,Nrf2主要存在于细胞质中;刺激后,Nrf2将迅速转移到细胞核中,并且通过激活靶基因启动子区的抗氧化反应元件进一步激活HO-1的表达,以防止细胞氧化损伤,从而缓解损伤及炎症反应[15]。在某些炎症性疾病如银屑病、特应性皮炎、炎症性肠病等的发病机制中,已证实某些促炎细胞因子如IL-17、IL-1β和TNF-α等可产生过量的活性氧代谢产物,导致相关免疫细胞激活,进一步刺激炎症的发展[16]。本实验表明靛蓝可诱导Nrf2、HO-1的表达,说明靛蓝可以激活Nrf2/HO-1信号通路,可能通过抗氧化应激途径发挥抗炎作用;但其是否确实清除了细胞中的ROS,以及其抑制相关炎症因子的表达与其抗氧化作用之间的关系,仍需进一步实验探索。
巨噬细胞对调控皮肤微环境变化和宿主炎症反应的过程至关重要。本研究从治疗银屑病的常用中药板蓝根、大青叶、青黛的共同有效成分靛蓝入手,探索中药单体靛蓝对巨噬细胞炎症反应的作用。实验首次证实靛蓝在LPS诱导的THP-1细胞炎症模型上的治疗效果,同时首次证明靛蓝可下调Nrf2/HO-1信号通路,提示靛蓝可能是抗炎的潜力药物,同时也为青黛、大青叶、板蓝根等中药治疗银屑病提供新的科学依据。

