环境DNA技术在长江口鱼类多样性分析中的应用
王汝贤 杨 刚 耿 智 赵 峰 冯雪松 张 涛
(1. 中国水产科学研究院东海水产研究所, 农业农村部东海与长江口渔业资源环境科学观测实验站, 上海 200090; 2. 上海海洋大学, 水产与生命学院, 上海 201306; 3. 上海市崇明东滩自然保护区管理事务中心, 上海 202150)
群落属性(如物种组成和丰富度、相对丰度、功能指标)的准确评估是基础生态学研究和环境监测的基本要求, 准确掌握水生生物的结构功能信息及其时空分布动态是在典型水域(湖泊、河口和海洋等)开展生物多样性保护的重要前提和基础[1]。鱼类是水生生态系统的关键类群之一, 同时也是长期影响和评估栖息地条件的良好指标, 因为它们的寿命相对较长且具有流动性, 对人类的干扰很敏感[2]。掌握鱼类群落结构多样性及分布特征不仅可以对其进行有效的保护进而促进水生生态系统的可持续利用, 还能为评价环境污染、水上工业开发和渔业捕捞等人为干扰因素对水生生态系统造成的影响提供现实依据[3]。
长江口是我国鱼类生物多样性最丰富、渔产潜力最高的河口, 是海洋生物营养物质的重要来源地, 许多鱼类在此进行觅食、繁衍和栖息[4]。近年来, 由于长期的过度捕捞、污染排放及大规模的海洋开发活动, 对长江口敏感的生态系统造成持续压力, 导致长江口水域的生态环境不断恶化, 渔业资源呈现衰退趋势, 特有的珍稀水生生物濒临灭绝[5]。为了保护长江渔业资源, 2020年1月1日起长江流域332个水生生物保护区全面禁止生产性捕捞, 禁捕工作的开展使得获取渔业资源数据愈发困难。同时, 生物多样性调查是一项繁重的长期任务, 其每年都存在一定的变化, 以往的传统调查数据已无法满足当前的研究[6]。因此, 我们迫切需要一种通用的方法, 它能够在空间和时间上对群落结构进行比较。
环境DNA(eDNA)指生物体遗留在周围环境中的遗传物质, 可以是多种来源的线粒体或核DNA,包括脱落的肠道和皮肤细胞、尿液、黏液、卵子或精子等, 它允许我们在不直接观察或捕获整个生物体的情况下检测物种的存在或最近的存在[7]。eDNA技术最近被认为是一种非常有效的、非破坏性的方法, 常用于监测水生生态系统中物种和群落的时空分布[8]。各种技术如常规PCR(PCR)、定量PCR(qPCR)和数字液滴PCR(ddPCR)等方法均已被用于检测河流、湖泊、水库和海洋中的环境DNA[9—11]。eDNA技术的发展将促进更低成本、非侵入性的鱼类监测[12]。与之相比传统的鱼类监测方法(电捕鱼、刺网和声学调查等)可能存在形态识别、检测概率低等问题使得无法充分准确地提供理想信息[13]。
目前, eDNA技术在长江口鱼类多样性调查中已有初步应用。Zhang等[14]2018年首次在长江口及其邻近水域利用环境DNA技术进行渔业科学研究的尝试, 在春、夏和秋3个季节分别鉴定出18、12和33种鱼类, 得出鱼类群落结构在不同季节存在显著差异。Jia等[15]在2019年同样利用eDNA技术对长江口鱼类资源进行了季节变化分析, 其在春、夏、秋和冬4个季节分别鉴定出20、16、5和45种鱼类, 四季鱼类种类组成差异较大。然而, 这两项研究均只采用了单一的eDNA技术进行调查, 为了更加准确地探讨eDNA技术在长江口水域的应用前景, 本研究将eDNA技术与传统底拖网调查方法结合, 通过对两种调查方法结果的比较, 以期对eDNA技术在长江口水域的适用情况做出的准确的评价, 为进一步完善长江口水域生态系统的结构功能信息及为该水域的生态修复工作提供有效帮助。
1 材料与方法
1.1 环境样品采集
本实验在长江口及其邻近海域设置采样站点(图 1), 于2021年5月22—27日进行水样采集, 在水样采集的同时进行底拖网调查。调查网具为单船底拖网, 网口周长50 m, 最小网目尺寸30 mm, 船速3 kn, 拖网时长1h。eDNA样品采集时, 每个站点使用1000 mL的采样瓶重复采集3瓶表层水样品。采用0.45 μm的混合纤维素滤膜现场对水样进行真空抽滤, 在12h内完成抽滤, 最大程度降低水样中环境DNA的降解。若水样较为浑浊时, 可进行二次过滤来提高eDNA富集程度, 先采用1 μm孔径的滤膜进行初次过滤, 然后再用0.45 μm孔径的滤膜再过滤一次[16]。在每份样品过滤后, 将滤膜保存在2.0 mL的无菌离心管中, 置于-20℃冰箱冷冻保存, 每次抽滤前需对滤膜接触面冲洗, 避免不同站点间eDNA的交叉污染。若现场抽滤水样可能对样品造成污染, 可向水样中加入醋酸钠来缓解DNA降解, 尽快将水样带回实验室抽滤。滤膜经干冰冻存运输至实验室后, 采用DNeasy Blood & Tissue Kit剂盒(Qiagen, 69506)并参照说明书对滤膜上的DNA进行提取。为防止空气中外源DNA对样品造成污染, 所有操作均在超净工作台中进行。所得总DNA经0.8 %琼脂糖凝胶电泳检测, 并采用紫外分光光度计定量,最后将提取的DNA样品置于-80℃保存备用。

图1 长江口水域采样站Fig. 1 Water sampling station in Yangtze River Estuary
1.2 目的基因扩增与高通量测序
采用鱼类通用引物MiFish-U-F: 5′-GTCGGTA AAACTCGTGCCAGC-3′和 MiFish-U-R: 5′-CATA GTGGGGTATCTAATCCCAGTTTG-3′[17]对环境DNA样品进行PCR扩增, 该引物扩增区域为12S rDNA,扩增后的DNA序列长度约为163—185 bp。PCR扩增总体系为25 μL, 其中包括: DNA模板10 ng、正反引物(5 μmol/L)各0.5 μL、2 μL dNTPs (2.5 mmol/L)、5×缓冲液4 μL、TaqDNA聚合酶0.5 μL。PCR反应程序为: 94℃预变性10min, 94℃变性30s, 55℃退火30s, 72℃延伸45s, 最后72℃延伸10min, 反应循环数为30。扩增完成后, 经2%琼脂糖凝胶电泳纯化回收样品, 然后在Illumina Miseq测序平台(Illumina,美国)上进行双端测序。
1.3 数据分析
将PCR扩增后并经高通量测序的序列采用DADA2方法进行初步处理, 包括: 去除引物、质量过滤、拼接和去除嵌合体等, 剩余序列经QIIME2软件按照≥97%进行聚类, 聚类结果称为操作分类单元(Operational taxonomic unit, OTU)。采用Brocc注释算法[18]对获得的OTUs序列进行物种分类学注释, 注释结果进行人工校对手动去除非鱼类信息,筛选出比对至鱼类且identity值≥97%,E-value≤10-5的OTU, 将鉴定结果为同一物种的OTU进行合并, 无法比对至种的OTU则向上一级如属、科进行分类统计, 并得到相应的OTU丰度表。再运用QIIME2软件对去除singleton后的特征表进行统计,实现各样本在门、纲、目、科、属、种六个分类水平上的组成分布的可视化, 展示不同分类单元的序列丰度及种类数。本研究还通过QIIME2软件对样本序列量进行分析, 计算相关的Alpha多样性指数, 如Chao1指数、Observed_species指数、Shannon指数和Simpson指数等, 以此综合评价各站点间鱼类丰富度及多样性。
2 结果
2.1 物种组成
18站点环境样品经PCR扩增后共获得7117247条原始序列, 经去噪、拼接和去除嵌合体后剩余6501632条高质量序列, 按照97%相似性聚类后得到1599个代表性OTU序列。经MitoFish、NCBI数据库比对和注释, 共在18个站点54个水样中鉴定出55种鱼类, 手动筛选并删除非长江口鱼类后, 剩余45种长江口鱼类, 隶属于10目21科41属[4]。在目级水平比较中, 鲈形目(Perciformes)种类最多,总计17种, 约占检测鱼类总数的37.8%; 其次是鲤形目(Cypriniformes)12种, 约占26.7%; 而仙女鱼目(Aulopiformes)、灯笼鱼目(Myctophiformes)、鲉形目(Scorpaeniformes)和巨口鱼目(Stomiiformes)检测到的种类最少, 各种均仅有1种(表 1)。

表1 基于eDNA技术在长江口18站点检测到的鱼类物种表Tab. 1 List of fish species detected at 18stations in the Yangtze Estuary based on eDNA Technology
基于各采样点eDNA扩增后的序列丰度, 图 2展示了丰度前10位的优势鱼类物种, 分别为中国花鲈(Lateolabrax maculatus)、刀鲚(Coilia nasus)、凤鲚(Coilia mystus)、蒙古鲌(Chanodichthys mongolicus)、日本鳀(Engraulis japonicus)、小黄鱼(Larimichthys polyactis)、鳙(Hypophthalmichthys nobilis)、青鱼(Mylopharyngodon piceus)、尖头鱥(Phoxinus oxycephalus)和睛尾蝌蚪虾虎鱼(Lophiogobius ocellicauda)。其中, 中国花鲈(L. mactus)、刀鲚(C. nasus)和凤鲚(C. mystus)在所有站点中均检测到。

图2 各站点优势鱼类物种组成Fig. 2 Composition of dominant fish species at each site
2.2 鱼类物种多样性分析
生态学家通常使用Alpha多样性指数来表征物种在生境内的多样性, 以Chao1[19]和Observed_species指数表征组间丰富度, 以Shannon[20]和Simpson[21]指数表征组间多样性。本研究通过分析上述指数,综合评价各采样点间鱼类丰富度及多样性关系。表 2反映鱼类群落多样性的Alpha多样性指数。其中, Chao1指数的平均值为119.69(变幅为84.00—192.43), Observed_species指数的平均值为90.28(变幅为57.50—137.9), 两个指数分布趋势基本一致; Simpson指数平均值为0.7369(变幅为0.4580—0.8725), Shannon指数平均值为2.98(变幅为 1.79—3.71), 两者分布趋势也基本对应, 但不同采样点间仍有一定差异。
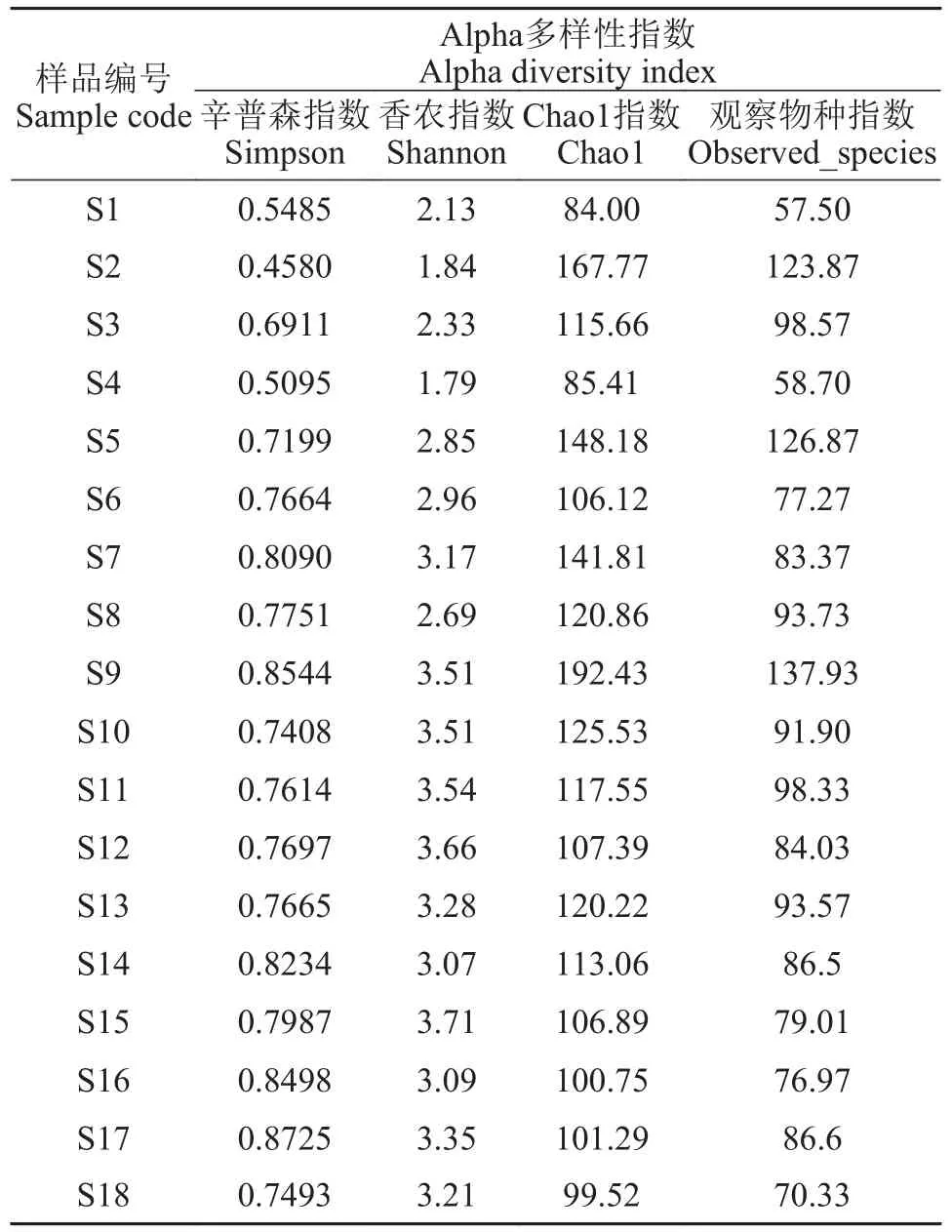
表2 长江口水域鱼类物种相对丰度的Alpha多样性指数Tab. 2 Alpha diversity index of fish species relative abundance in the Yangtze River Estuary
使用R软件将Chao1指数与Observed_species指数分别绘制成差异检验箱线图(图 3), 其P值分别为0.099和0.105, 均大于0.05, 表明各站点间鱼类丰富度之间无显著性差异; 将Shannon指数与Simpson指数分别绘制成差异检验箱线图(图 4), 其P值分别为0.01和0.028, 均小于0.05, 表明各站点间鱼类多样性之间存在显著性差异。

图4 18站点间鱼类多样性Fig. 4 18 inter site fish diversity
利用R软件绘制前20种鱼类丰度的物种组成热图(图 5), 不同站点间鱼类物种组成存在差异。从样本聚类上看, 地理上S3和S4站点最先聚在一起,两个采样点分别位于崇明岛南北侧, 均位于长江口内侧, 生境条件较为相似; 而与S3和S4物种组成差异最大的为站点S15, 两者地理差异较远, 生境差异较大。从物种聚类上看, 棘头梅童鱼(Collichthys lucidus)和大黄鱼(Larimichthys crocea)最先聚在一起,除在S15有较高的相对丰度, 在其余站点的相对丰度均较低。此外, 刀鲚(C. nasus)和凤鲚(C. mystus)聚类程度较高, 并且其相对丰度和分布频率最高。

图5 长江口水域属水平鱼类组成热图Fig. 5 Heat map of fish composition in the Yangtze River Estuary
2.3 环境DNA技术与底拖网法比较
本次底拖网调查共捕获33种鱼类, 隶属于11目16科29属, 其中以鲈形目(Perciformes)数量最多, 共计11种, 约占检测数量的33%; 其次是鲤形目(Cypriniformes), 共计5种, 约占检测数量的15%, 底拖网检测的优势目与eDNA检测结果相同。环境DNA方法与底拖网方法共获得13目26科54属60种鱼类,在eDNA检测结果中的灯笼鱼目(Myctophiformes)和巨口鱼目(Stomiiformes)两个目的鱼类在拖网中未能检测到; 底拖网检测中的鲑形目(Salmoniformes)、胡瓜鱼目(Osmeriformes)和鲀形目(Tetraodontiformes)的各种鱼类在eDNA中均未检测到(表 3)。

表3 基于eDNA技术与底拖网法的鱼类物种数比较表Tab. 3 Comparison of fish species based on eDNA technology and bottom trawl method
eDNA和底拖网法共检测到60种鱼类, 其中有18种鱼类是在两种方法中均检测到的,占鱼类总数的30%, 剩余鱼类分别占总数的45%和25%(图 6)。两种方法均检测到的鱼类分别为长吻(Leiocassis longirostris)、刀鲚(C.nasus)、凤鲚(C.mystus)、银鲳(Pampus argenteus)、似鳊(Pseudobrama simoni)、窄体舌鳎(Cynoglossus gracilis)、焦氏舌鳎(Cynoglossus joyneri)、髭缟虾虎鱼(Tridentiger barbatus)、孔虾虎鱼(Trypauchen vagina)、小眼绿鳍鱼(Chelidonichthys spinosus)、龙头鱼(Harpadon nehereus)、小黄鱼(L.polyactis)、翘嘴鲌(Culter alburnus)、鳙(Hypophthalmichthys nobilis)、黄鲫(Setipinna taty)、棘头梅童鱼(C.lucidus)、日本带鱼(Trichiurus japonicus)和海鳗(Muraenesox cinereus)。可见eDNA技术在检测鱼类数量上优于底拖网法。

图6 eDNA技术与底拖网法获得鱼类总数比较Fig. 6 Comparison of total fish number obtained by eDNA technology and bottom trawl method
两种方法进行α多样性比较时, 底拖网18个站点的平均Simpson指数为0.51, 而eDNA技术测定的平均Simpson指数为0.74, eDNA技术的Simpson指数显著大于底拖网方法(P<0.001); 底拖网8个站点的平均Shannon指数为1.44, eDNA 技术的平均Shannon指数为2.98, eDNA技术的Shannon指数显著大于底拖网方法(P<0.01; 图 7)。两种指数均表示eDNA技术所检测的长江河口鱼类群落α多样性显著大于底拖网方法。

图7 基于Simpson指数与Shannon指数的长江口鱼类α多样性Fig. 7 Fish in the Yangtze Estuary based on Simpson index and Shannon index α Diversity
3 讨论
3.1 基于环境DNA的长江口鱼类物种组成
长江口作为我国最大的河口[22], 近年来由于多种人为因素, 使得其渔业资源锐减, 自2020年1月1日起长江流域332个水生生物保护区全面禁止生产性捕捞, 同时对部分特定物种进行增殖放流来恢复其野外种群数量[23]。通过传统资源调查方法难以准确评估长江口渔业资源恢复情况, 因此本研究采用环境DNA技术来分析长江口鱼类组成及多样性。通过对长江口18站点水样环境DNA的提取、扩增和高通量测序, 共检测出55种鱼类, 其中包括45种长江口鱼类, 以及10种非长江口鱼类, 非长江口鱼类分别为点篮子鱼(Siganus guttatus)、名古屋吻虾虎鱼(Rhinogobius nagoyae)、斯丹氏鱥(Phoxinus steindachneri)、短体副鳅(Homatula potanini)、腹翼鲭(Gasterochisma melampus)、刀鲬(Platycephalus cultellatus)、多鳞白甲鱼(Onychostoma macro-lepis)、尼氏裸灯鱼(Gymnoscopelus nicholsi)、革首南极鱼(Notothenia coriiceps)和裘氏鳄头冰鱼(Champsocephalus gunnari)。检测出非长江口鱼类可能有三种原因: (1)因为在现场过滤水样, 船舱空气中悬浮颗粒含有上述鱼类DNA污染了滤膜; (2)部分采样地点靠近航道附近, 过往船只排出的水体中也可能含有上述鱼类DNA; (3)长江口是西太平洋沿岸最大的候鸟驿站, 鸟类迁徙时排出的粪便中也可能含有上述鱼类DNA。
eDNA技术检测到的45种长江口鱼类隶属于10目21科41属, 在所有检测到的鱼类物种中, 中国花鲈(L. mactus)、刀鲚(C. nasus)和凤鲚(C. mystus)的相对序列丰度最高, 其次是长吻(L.longirostris)和蒙古鲌(C.mongolicus)等。所得序列中还检测出部分长江口水域相对丰度较少的鱼类物种, 包括中国(Sillago sinica)和细条银口天竺鲷(Jaydia lineata)等。此外本次调查中eDNA技术在长江口部分站点检测到了尖头鱥(P. oxycephalus)的存在, 尖头鱥是山区溪流型鱼类, 在江苏、浙江、太湖等部分水域有所分布[24], 目前未在长江口水域发现其存在, 但含有其DNA的水体可能随长江流至河口, 因为eDNA可以在水体中维持几天到几周的时间, 但在许多情况下维持时间未超过一个月[25], 在长江口近岸水域可能检测到其存在。其次也可能因为本次实验采用的是鱼类通用引物, 在对鱥属鱼类准确性检测上存在一定的误差。
3.2 基于环境DNA的长江口鱼类多样性分析
表2列举了反映鱼类群落丰富度及多样性的Alpha指数。其中, Chao1和Observed_species指数用于表示鱼类丰富度。本研究中Chao1指数为84.00—192.43, Observed_species指数为57.50—137.9, 两个指数分布趋势基本一致。其中S9站点两者指数值均最高, 表明该站点鱼类群落丰富度最高, S1站点两者指数值最低, 表明该站点鱼类群落丰富度最低。这可能与两者的地理位置相关, S9站点位于崇明岛与横沙岛之间, 处在长江口外侧, 受涨落潮影响, 不同的生境的鱼类在这里觅食, 而S1站点位于长江口最内侧, 即使涨潮鱼类涌入口内, 也只有极少的鱼进入最内侧, 致使该点鱼类丰富度最低。但是, 高通量测序无法直观反映环境中的具体生物量,仅通过扩增序列的相对数量来展示样品间丰度是否存在差异。目前, 已有相关研究采用荧光定量PCR(qPCR)技术对水环境中物种的生物量进行估算。例如Takahara等[26]率先利用eDNA技术进行物种生物量评估, 以鲤为检测目标, 成功得出eDNA浓度与鲤生物量之间呈正相关, 可以将eDNA 技术用于野外条件下生物量估算。Evans等[27]测定了野外9种生物(包括 8种淡水鱼类和1种两栖动物)的6个线粒体基因片段序列, 发现序列拷贝数与上述生物的丰度存在正相关关系。但是, 采用eDNA技术进行生物量评估仍具有一定的挑战性, 影响eDNA 释放和降解的因素有很多(温度、光照和抑制剂等), 并且这些因素造成eDNA降解的速率各不相同, 需要进一步探究这些因素间的相关性, 从而使生物量评估结果更加准确可靠。
Alpha多样性指数中的Shannon和Simpson指数均能显示鱼类多样性水平, 本研究中的Simpson指数为0.4580—0.8725, Shannon指数为1.79—3.71, 两者分布趋势也基本相同。采用R软件对所有站点鱼类多样性进行分析, 结果表明18站点间鱼类多样性之间存在显著差异。此外本次调查结果Shannon和Simpson指数与Chao1和Observed_species指数均未出现极值,表明本次实验采样步骤及环境DNA提取方法较为可靠, 未对环境DNA样品造成较大影响。单次采样结果可能无法准确描述长江口鱼类多样性, Zhang等[14]及Jia等[15]在2018年与2019利用eDNA技术对长江口鱼类资源进行季节变化分析时, 发现不同季节间的鱼类多样性均存在显著性差异。本研究后续将继续在不同季节进行采样, 分析长江口鱼类多样性的季节性变化, 综合评价长江口的鱼类多样性。
3.3 基于两种不同采样方法的结果分析
有研究表明, 在水生生态系统中, eDNA技术检测到的物种数量等于或大于传统方法检测到的物种数量[28,29]。本研究采用eDNA技术在长江口18站点中检测到10目21科41属45种鱼类, 底拖网法共鉴定出11目16科29属33种。两种方法总共鉴定出60种长江口鱼类, 均以鲈形目(Perciformes)最多, 其次是鲤形目(Cypriniformes), 其中有18种鱼类是在环境DNA与底拖网中都检测到的, 占鱼类总数的30%, 环境DNA技术与底拖网法中剩余鱼类分别占总数的45%和25%。底拖网中有15种鱼类在环境DNA中未鉴定出的, 这可能与使用的引物有关, Mi-Fish引物设计的原始实验协议是使用来自日本冲绳县水族馆四个水族箱的海水样本, 其对海洋鱼类的分类具有显著效果。虽然Zhang等[14]、Zou等[30]和Ahn等[31]将eDNA技术用于河口生态均取得了一定的效果, 但长江口水域还栖息着中华鲟(Acipenser sinensis)、淞江鲈(Trachidermis fasciatus)和胭脂鱼(Myxocyprinus asiaticus) 等诸多珍稀濒危物种, 在此次调查中均未检测出。因为在数据分析时为确保数据的准确性, 在三个平行样本中只有当一个物种至少在两个样本的PCR中扩增并检测出来才被确定存在, 仅存在一个PCR重复的物种则被剔除[32],所以eDNA技术在长江口珍稀濒危物种的检测方面有待考究。后续将采用MiFish引物对其进行单独扩增来验证其在长江口水域鱼类序列扩增的通用性。此外在密切相关的同源物种之间缺乏Mi-Fish序列(MiFish引物干扰的高变区)的变异, 这不可避免地会导致对物种丰富度的检测的降低[33]。同时, Miya等[17]指出, 在eDNA技术可能成为鱼类生物多样性研究的主流技术之前, 其中一个必须要解决的问题是参考序列数据库的完整性和准确性, 全球水生环境中已知的鱼类有32000多种, 存在巨大的差异性, 目前数据库的完整性和准确性远远不能令人满意[34]。目前, 长江口鱼类序列比对需在MitoFish、NCBI等数据库进行, 其对长江口部分特有物种鉴定可能存在差异, 建立长江口鱼类鉴定数据库也是目前亟需完成的任务, 使得在长江口鱼类鉴定时有据可依。虽然本研究的eDNA结果并不能包含所有底拖网法鉴定出的鱼类, 但不可否认eDNA技术是检测沿海水域鱼类系统的有力工具。
4 总结
eDNA技术在监测鱼类生物多样性方面简便快捷, 相比于传统资源调查方法的耗时费力, eDNA技术在鱼类生物多样性监测及保护中有巨大应用潜力。本研究利用eDNA技术和底拖网法对长江口鱼类多样性进行了调查, 两种方法在所有采样点共检测到60种鱼类, 其中eDNA技术检测到45种, 底拖网法检测到33种, 与底拖网法相比, eDNA技术可以检测到更多的鱼类。尽管环境DNA技术无法完全替代传统的鱼类调查方法, 但可以作为传统调查方法的一种助力, 采用环境DNA技术可减少传统监测对长江口生态系统的干扰, 缩短调查周期, 将两者结合观察又可快速准确地反映长江口鱼类多样性及其空间分布。这些研究结果拓展了外界对长江口水域生物多样性的认识, 为长江口鱼类多样性的管理和保护提供了新的重要数据。此外, eDNA技术在长江口鱼类组成的季节性变化监测中具有很大的潜力, 继续开展调查有利于该地区的海洋资源保护、渔业可持续发展、水产品加工和社会经济稳定等。尽管eDNA技术存在一定的局限性, 特别是在定量方面, 但将eDNA技术应用于海岸带鱼类群落的多样性评估及季节性变化研究可能是海洋生物多样性长期监测的重要途径。

