两种饵料条件下点篮子鱼幼鱼酶活力及其消化道菌群比较
孙艳秋 李 琪 刘鉴毅 , 庄 平 , 杨 俊 彭彪彪 秦 搏 赵 峰 , 冯广朋 , 黄晓荣 ,
(1. 上海海洋大学水产科学国家级实验教学示范中心, 上海 201306; 2. 中国水产科学研究院东海水产研究所, 上海 200090;3. 农业农村部东海与长江口渔业资源环境科学观测实验站, 上海 200090; 4. 上海长江口渔业资源增殖和生态修复工程技术研究中心, 上海 200090)
点篮子鱼(Siganus guttatus)隶属于鲈形目(Perciformes), 篮子鱼科(Siganidae), 篮子鱼属(Siganus),是一种广盐、暖水性鱼类, 主要产于中国南海海域及印度-太平洋的热带、亚热带海域, 从珊瑚礁到河口水域均有分布[1]。点篮子鱼是偏植食性的海水杂食性鱼类, 喜食浒苔等藻类, 对环境的适应能力较强。在进行网箱养殖时, 扮演清道夫的角色, 在清洁网箱、改善水质等方面发挥着重要作用。除此以外, 点篮子鱼的经济效益也十分可观, 环境适应性强、养殖技术较简单、病害少、生长速度快。目前点篮子鱼的经济效益和生态效益已经引起人们的重视[2]。
浒苔(Enteromorpha prolifera)又称青苔, 是一种常见的大型丝状藻类, 可在短时间内(1—2周)使池中藻丝纵生。浒苔及刚毛藻等丝状藻类在我国沿海较为常见, 是滤食性贝类养殖池塘常见的敌害生物, 一旦暴发, 不但影响养殖品种的生长, 还会引起生物疾病甚至危害养殖品种的生存, 造成经济损失[3]。我国北方正在尝试利用点篮子鱼摄食浒苔的特点, 将浒苔视作点篮子鱼的天然饵料, 从而控制贝类养殖池塘中浒苔大面积暴发的问题, 进而改善养殖水体环境, 从而减少养殖户的经济损失。
目前, 对点篮子鱼饵料条件的研究主要集中于人工饵料[4], 有研究将浒苔作为添加剂加入人工饲料中饲喂黄斑篮子鱼[5,6], 但将浒苔作为天然饵料饲喂点篮子鱼的研究较少, 仅赵峰等[2]和宋超等[7]研究了摄食浒苔对点篮子鱼的肌肉营养成分、生长性能及消化酶活性的影响, 但是未见摄食浒苔对点篮子鱼免疫能力及消化道菌群影响的相关报道。本研究以室内养殖缸模拟贝类养殖池塘, 套养点篮子鱼, 对人工饲料和浒苔两种饵料条件下点篮子鱼的生长、相关酶活性及消化道菌群进行比较,以期为点篮子鱼的推广养殖及后续生态养殖模式的构建提供参考资料。
1 材料与方法
1.1 试验材料与设计
试验所用的点篮子鱼来自中国水产科学研究院东海水产研究所海南琼海研究中心, 空运至江苏赣榆研究中心, 暂养2月后, 选取体质较为健壮, 规格一致的幼鱼用于试验, 其初始体质量为(2.02±0.13) g, 体长为(40.17±0.81) mm。
试验模拟小型贝类养殖池塘: 在文蛤养殖中套养点篮子鱼。文蛤来自江苏赣榆当地贝类养殖池塘, 试验采用规格为1 m3的圆形养殖桶, 桶底部铺设3—5 cm厚的砂土, 沉淀后引入海水, 文蛤的养殖密度为200粒/m2, 暂养1周后开始试验。试验设置2个饵料组, 分别为人工饲料组和浒苔组, 其中人工饲料组投喂“微粒子”配合饲料, 浒苔组投喂浒苔鲜样; 每组设置3个平行, 每个平行放入70尾鱼。试验共计70d, 每天7:00—9:00和15:00—17:00投喂, 观察并记录其摄食情况。试验期间水温17.2—29.4℃,盐度28—30, pH 8.0±0.3, 溶氧5 mg/L以上。
1.2 样品采集
饵料样本: 分别取3份人工饲料及浒苔, 其中浒苔鲜样经0.22 μm孔径滤膜抽滤, 采用灭菌的镊子装入无菌袋中, 立即放入-80℃超低温冰箱中保存,用于微生物多样性分析。
消化道样本: 在试验结束后, 点篮子鱼幼鱼饥饿处理24h, 每组从3个平行中随机抽取样品15 尾用丁香酚麻醉, 测量体质量和体长, 在无菌环境下采用75%酒精擦拭体表, 随即于冰盘上解剖, 将去除内容物的胃、幽门盲囊和肠的前、中、后段分为两份, 其中一份与肝脏用预冷的灭菌生理盐水冲洗,液氮速冻后置于-80℃冰箱中保存, 用于消化酶及非特异性免疫酶活性分析; 另一份液氮速冻后置于-80℃冰箱中保存, 用于微生物多样性分析。
1.3 生长及消化道酶活指标测定
生长指标测定: 为了跟踪监测点篮子鱼生长指标, 分别在养殖开始时(8月21日)、试验30d时(9月20日)和试验结束时(10月30日)共测定3次, 获得体质量及体长等数据后, 计算增重率(WGR, %)、特定生长率 (SGR, %/d)和存活率(SR, %)。
WGR=(Wn-W0)/W0×100
SGR=[ln(Wn)-ln(W0)]/n×100
SR=Sn/S0×100
式中,Wn表示试验进行n天时点篮子鱼质量;W0表示试验初始质量;Sn表示试验n天成活尾数;S0表示试验初始投放尾数。
酶活指标测定: 将消化道各组织样本冰上解冻后分别称重, 按1∶9 (w/v)的比例加入适当的预冷匀浆液, 在冰浴条件下组织匀浆机匀浆, 在4℃条件下2000 r/min离心20min, 取上清液作粗酶提取液, 消化酶(胃蛋白酶、胰蛋白酶、淀粉酶和脂肪酶)、非特异性免疫酶(酸性磷酸酶ACP、碱性磷酸酶AKP、超氧化物歧化酶SOD和溶菌酶LZM)的测定方法均由南京建成生物工程研究所试剂盒提供, 具体操作按照说明书严格执行。蛋白浓度用考马斯亮蓝染色法测定, 酶标仪及紫外分光光度计测定吸光度值。
1.4 微生物测定
总DNA提取: 采用 QIAamp DNA Mini Kit(QIAGEN, 德国)试剂盒对组织样本和饵料样本提取微生物总DNA。
PCR扩增及高通量测序: 将通过各试剂盒提取的微生物总DNA进行PCR扩增, 采用引物338F (5′-ACTCCTACGGGAGGCAGCA-3′)和 806R (5′-GGACTACHVGGGTWTCTAAT-3′)对样品序列为16S rDNA V3—V4 高变区序列进行扩增。PCR反应体系25 μL: 5×反应缓冲液5 μL、5×高GC缓冲液5 μL、Q5高保真DNA聚合酶0.25 μL、dNTP(10 mmol/L)2.0 μL、正、反引物各 1.0 μL、DNA模板1.0 μL,补双蒸水至25 μL。PCR反应条件: 98℃预变性30s;之后进入扩增循环98℃变性30s, 50℃退火30s,72℃延伸30s, 重复25—27个循环; 最后72℃延伸5min。PCR反应在PCR反应仪9700(Applied Biosystems®GeneAmp®, CA, 美国)上进行。经琼脂糖凝胶电泳检测合格后, 构建文库, 通过Illumina MiSeq平台对群落DNA片段进行双端(Paired-end)测序。
通过高通量测序得到的下机数据, 运用QIIME2(2019.4)软件切除序列的引物片段, 弃去未匹配引物的序列, 并进行质控、去噪、拼接和去嵌合体。使用R语言脚本, 对全部样本中所包含的高质量序列的长度分布进行统计, 处理后获得高质量序列;将相似度≥97%的序列归为1个可操作分类单元(Operational taxonomic units, OTU), 选取每个OTU的代表性序列, 并进行物种分类学注释。对OTUs代表序列进行物种组成、Alpha多样性和Beta多样性分析, 在各分类水平上进行个体和群体水平的菌群丰度分析。最后用 R 语言进行 PCA 统计分析和作图。
1.5 数据处理
采用单因素方差分析(One-way ANOVA)方法对结果数据进行统计分析, 利用Duncan’s检验对同一摄食下点篮子鱼幼鱼不同消化道组织间的差异性进行多重比较, 采用T-test检验对不同饵料组点篮子鱼幼鱼相同消化道组织间进行差异性分析, 显著性水平为P<0.05。所有数值均采用平均值±标准误(mean±SE) 表示。
2 结果
2.1 两种饵料条件下生长指标比较
人工饲料与浒苔对点篮子鱼幼鱼生长的影响见表 1。结果显示, 养殖期间两组点篮子鱼的存活率均为100%。人工饲料组点篮子鱼幼鱼的增重率、特定生长率均显著高于浒苔组(P<0.05)。人工饲料与浒苔均可满足点篮子鱼幼鱼生长所需的基本营养需求。

表1 两组点篮子鱼幼鱼的生长性能差异Tab. 1 Differences in growth performance of juvenile Siganus guttatus between the two groups
2.2 两种饵料条件下消化酶活性特征比较
如图 1所示, 两组胃蛋白酶、胰蛋白酶和淀粉酶活性均在肝脏中最低, 显著低于其他各部位的3种酶活力(P<0.05)。两饵料组胃蛋白酶活性均在肠道中最高, 且人工饲料组胃蛋白酶活性随着肠道走向逐渐降低; 两饵料组相比, 浒苔组点篮子鱼幼鱼胃及中肠部位的胃蛋白酶活力均显著高于人工饲料组(图 1a)。浒苔组胰蛋白酶活性随着消化道走向依次升高, 在肠中活性最高。中肠部位的胰蛋白酶活性浒苔组显著高于人工饲料组 (P<0.05; 图 1b)。浒苔组点篮子鱼幼鱼后肠淀粉酶活性最高, 前肠次之, 二者显著高于消化道其他部位(P<0.05)。浒苔组前肠、后肠淀粉酶活性均显著高于人工饲料组(P<0.05)。由图 1d可见人工饲料组点篮子鱼幼鱼各部位脂肪酶活性均高于浒苔组。人工饲料组脂肪酶活性在胃中最高, 肝脏次之, 肠中脂肪酶活性随着肠道的走向依次增高。浒苔组脂肪酶活性也随肠道走向依次升高, 但中、后肠无显著性差异(P>0.05); 浒苔组脂肪酶活性肝脏中最高, 胃次之,两者之间差异不显著 (P>0.05)。

图1 两组点篮子幼鱼不同部位消化酶活性Fig. 1 Digestive enzyme activities in different parts of juvenile Siganus guttatus in two groups
2.3 两种饵料条件下免疫酶活性特征比较
如图 2a所示, 点篮子鱼幼鱼消化道中ACP主要分布在肠中, 胃部ACP活性最低, 显著低于其他消化器官(P<0.05)。两饵料组相比, 浒苔组点篮子鱼消化道中ACP活性均略高于人工饲料组, 肝脏中ACP活性显著高于人工饲料组(P<0.05)。点篮子鱼幼鱼碱性磷酸酶(AKP)活性主要分布于肠道, 浒苔组各部位AKP酶活性均显著高于人工饲料组(P<0.05), 浒苔组中肠AKP酶活性最高, 后肠次之。人工饲料组点篮子鱼幼鱼LZM酶活力在肠道中最高,且随肠道走向依次降低(图 2c)。浒苔组点篮子鱼幼鱼LZM酶分布与人工饲料组相似, 前肠中最高,中肠、后肠次之, 但三者之间差异性不显著(P>0.05);两饵料组相比, 人工饲料组点篮子鱼幼鱼肝脏LZM酶活力显著高于浒苔组, 而后肠LZM酶活力则显著低于浒苔组(P<0.05), 其他部位均无显著性差异。浒苔组点篮子鱼幼鱼各部位SOD酶活性均高于人工饲料组, 其中浒苔组中、后肠超氧化物歧化酶(SOD酶)活性最高(图 2d)。

图2 两组点篮子幼鱼不同部位非特异性免疫酶活性Fig. 2 Non-specific immune enzyme activities in different parts of juvenile Siganus guttatus in two groups
2.4 两种饵料条件下消化道菌群结构特征
本试验共采集24个生物样本, 经高通量测序平均每个样本获得128131条序列, 对测序数据过滤、去噪、拼接和去除嵌合体后平均每个样本有高质量序列100964条, 经归类操作得到13192个OTUs,平均序列长度为422 bp。
Alpha多样指数分析稀释曲线显示了样品中所测得OTU数量随着样品序列的增多而变化的情况。如图 3所示, 随着横坐标序列的增加, 纵坐标趋于一个稳定值, 表明测序数据量合理可靠。通过计算在同一样本中检测到的随机选择扩增子序列的覆盖率(Goodscoverage指数)来评估抽样的完整性,Goodscoverage指数反应测序深度, 指数越接近于1,说明测序覆盖深度越深, 本研究中各样品覆盖指数均为0.99, 覆盖率水平表明该研究测序几乎覆盖样品中所有物种。

图3 两组样品物种丰度稀释曲线Fig. 3 Species abundance dilution curves of samples in two groups
如表 2所示, Chao 1指数表征物种丰富度, Shannon表征多样性, 两指数越大, 样品物种越丰富。两饵料组均为后肠菌群的多样性指数最高, 与饲料组相比, 浒苔组除后肠外其他部位菌群相对丰度均高于饲料组, 消化道菌群整体多样性较饲料组高。

表2 两组点篮子鱼幼鱼消化道菌群多样性Tab. 2 Diversity of the digestive tract flora of juvenile Siganus guttatus in two groups
Beta 多样指数分析将所有样本中相对丰度小于1%的物种归为其他。图 1所示为各样本在门分类水平的细菌群落组成图, 组内取均值。两饵料组点篮子鱼幼鱼消化道各部位变形菌门(Proteobacteria)的相对丰度最高, 占绝对优势, 然后依次是厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)。与人工饲料及饲料组点篮子鱼肠道相比, 浒苔及浒苔组点篮子鱼幼鱼肠道未发现梭杆菌门。相较于浒苔, 饲料表面的优势菌门增加了疣微菌门(Verrucomicrobia)、放线菌门(Actinobacteria); 而饲料组与浒苔组相比, 消化道疣微菌门和放线菌门的相对丰度也有所增加(图 4)。
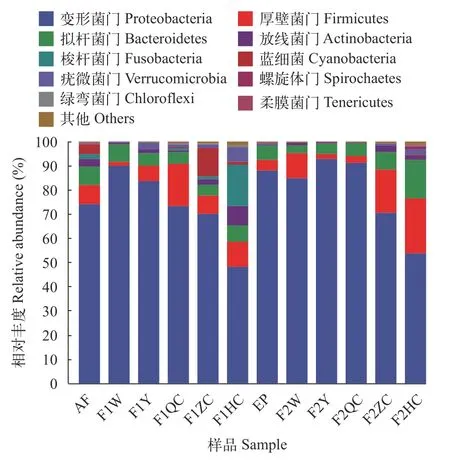
图4 点篮子鱼幼鱼消化道各部位优势菌门组成Fig. 4 The composition of the dominant bacteria phyla in each part of the digestive tract of the juvenile Siganus guttatus
肠道菌群相似程度用物种丰度聚类热图展示(图 5), 人工饲料表面的嗜冷杆菌属(Psychrobacter)相对丰度最高, 浒苔表面的氢噬菌属(Hydrogenophaga)相对丰度最高。相对于人工饲料组消化道菌群, 浒苔组消化道菌群表现出较大差异。

图5 属水平物种丰度聚类热图Fig. 5 Clustering heat map of species abundance at genus level
3 讨论
3.1 两种饵料条件对点篮子鱼生长性能的影响
有研究表明, 饵料不同会对鱼类的生长和存活产生影响[7,8]。试验解剖发现, 与浒苔组相比, 饲料组点篮子鱼幼鱼腹部和肠壁上附有更多的脂肪, 这与人工饲料含有的粗脂肪含量更高有关。点篮子鱼是以植食性为主的杂食性鱼类, 对食物的要求不严格, 对外界营养物质变化的适应能力较强, 当饲喂不同类型的饵料时均能正常生长和存活[4], 这与徐树德等[9]对黄斑篮子鱼(Siganus canaliculatus)的研究结果类似。宋超等[7]认为, 人工饲料粗蛋白和粗脂肪组成更符合点篮子鱼的营养需求, 故人工饲料组幼鱼的生长快于浒苔组。在本研究中, 人工饲料和浒苔组幼鱼成活率均为100%, 但增重率分别为(132.18±1.03)%和(77.23±0.29)%, 特定生长率分别为(1.20±0.04)%和(0.82±0.02)%, 表明人工饲料与浒苔的营养基本能够满足点篮子鱼幼鱼的生长和生存需求, 另一方面也证实了点篮子鱼对这两种饵料具有较好的适应能力, 该结果与宋超等[7]的研究结果相同, 与郭同旺等[10]对中华倒刺鲃(Spinibarbus sinensis)的研究较为一致。
3.2 两种饵料条件对点篮子鱼消化和免疫能力的影响
消化酶活性与鱼类的生长密切相关, 它能够直接反应鱼类的营养状况, 是鱼类消化能力的一个重要指标[11,12]。而消化酶活性受鱼种类、鱼体生理阶段、运动情况[13]、生存环境[14]和饵料条件[7,15]等多种因素的影响。本试验所用点篮子鱼选自同一批幼鱼, 其生长环境及管理方法基本相同, 仅饵料存在差异。两饵料组点篮子鱼幼鱼胃蛋白酶活性均是肠中活性最高, 浒苔组胰蛋白酶活性为肠中较高, 而饲料组胰蛋白酶活性各部位均较高, 其中饲料组胃及幽门盲囊的胰蛋白酶活性显著高于浒苔组; 两饵料组消化道各部位均检测到了淀粉酶活性, 且浒苔组幼鱼各部位淀粉酶活性均高于饲料组,但仅胃、肠部位淀粉酶活性有显著性差异; 两饵料组幽门盲囊和前肠脂肪酶活性均表现极低, 幼鱼消化道各部位饲料组脂肪酶活性均高于浒苔组。该结果表明, 对点篮子鱼幼鱼蛋白质和淀粉消化起重要作用的是胃、肠和幽门盲囊, 对脂肪消化起重要作用的是胃、肠和肝脏。饲料组幼鱼对脂肪的消化能力高于浒苔组, 但对淀粉的消化能力低于浒苔组。这与李瑾等[16]对中华鲟(Acipenser sinensis)脂肪酶和淀粉酶的分布结果较为相似; 但与宋超等[7]对网箱养殖点篮子鱼幼鱼的消化道酶活研究中脂肪酶的分布不同, 宋超等[7]发现对脂肪消化起重要作用的是肠、幽门盲囊和肝脏。浒苔粗纤维及碳水化合物含量高于人工饲料, 有研究表明鱼类消化酶活性大小及分布会根据饲料中蛋白、脂肪及其他营养物质含量水平进行适应性调整, 饲料中蛋白及脂肪水平适当升高时, 鱼类蛋白酶及脂肪酶活性会随之适当升高, 以充分消化、吸收该类营养物质[17]。同理, 浒苔的碳水化合物含量较高, 而脂肪相对缺乏, 因此浒苔组幼鱼对脂肪的消化能力小于饲料组,而对淀粉的消化能力大于饲料组; 但对蛋白的消化能力未发现相似的规律, 这可能与此次实验所用人工饲料中的蛋白组成与浒苔中蛋白含量差值较小相关。
鱼类属于进化程度较低的变温动物, 非特异性免疫系统是抵抗疾病感染的最主要手段[18]。相关报道指出, 摄食条件可在一定程度影响鱼类的免疫酶活力[19,20]。碱性磷酸酶(AKP) 及酸性磷酸酶(ACP)都是生物体内重要的两种代谢调控酶[8,21], 在免疫反应中发挥重要的作用, 同时与水产动物机体的生长密切相关, 也与鱼体营养的吸收、利用有重要关联[22,23]。有研究表明, 在体外条件下, 浒苔多糖能够明显地增强免疫反应[24]。在本研究中, 浒苔组肠道AKP和ACP 活性均略高于人工饲料组, 这可能与浒苔鲜样中有更为丰富的微量元素及浒苔多糖有关。整体来看两组各部位ACP酶活性高于AKP活性, 这可能与点篮子鱼自身特点及发育阶段有关。LZM酶是鱼类非特异性免疫系统中重要的组成部分[25],与机体免疫功能密切相关。两试验组各部位均有较高的LZM活性, 但饲料组与浒苔组相同部位LZM活性无显著性差异。SOD为清除氧自由基的重要抗防御性功能酶, 增强吞噬细胞的吞噬能力、促进免疫球蛋白的产生和保护细胞免受氧化损伤[26], 可作为衡量鱼类对外界环境适宜程度的重要生理指标。浒苔组各部位SOD酶活性均高于饲料组, 中、后肠SOD酶活性最高, 表明摄食浒苔后点篮子鱼幼鱼肠道SOD酶活性有所升高, 有益于促进点篮子鱼产生免疫球蛋白, 提升免疫力。周胜强等[5]在饲料中添加浒苔对黄斑蓝子鱼进行饲喂, 发现鱼体抗氧化能力有所提高, 结合本研究结果, 可进一步研究在人工饲料中添加浒苔饲喂点篮子鱼, 以实现生长快、免疫力强的目标, 并研究人工饲料与浒苔的最佳配比, 为点篮子鱼饵料的研究提供数据支撑。
3.3 两种饵料条件对点篮子鱼消化道菌群影响
肠道菌群能够通过肠-脑神经影响生物体的消化吸收、生长代谢和免疫调节等机能[27], 微生物多样性降低表明群落功能稳定性变差, 生物患病风险增大[28]。在本研究中, 两种饵料条件下, 菌群多样性随消化道延伸呈上升趋势, 该结果与姜燕等[29]对大黄鱼的研究相反。除后肠外, 浒苔组消化道其他部位Chao1指数、Shannon指数均高于人工饲料组(P<0.05), 物种丰度聚类热图也发现, 相对于人工饲料组, 浒苔组消化道菌群表现出较大差异, 该结果表明浒苔组消化道菌群多样性整体较高, 比人工饲料组具有更高的微生物群落功能稳定性。Li等[15]发现, 池塘养殖中发病塘养殖对象肠道微生物多样性降低, 进一步证明了微生物的多样性在养殖中的重要作用。赵柳兰等[30]在对下建鲤(Cyprinus carpio var. jian)的肠道菌群研究中发现, 养殖模式的不同也会对鱼类肠道微生物产生影响, 也有研究表明鱼类肠道微生物在纤维素物质的消化和营养物质的吸收代谢方面发挥着重要作用[31,32],许多研究发现水体环境[33,34]和饵料[35—37]可影响鱼类肠道菌群组成。
对饲料和浒苔表面菌群的组成分析发现, 饲料及浒苔的共有优势菌门变形菌门、厚壁菌门和拟杆菌门, 饲料表面增加了疣微菌门和放线菌门。对饲料组和浒苔组点篮子鱼幼鱼消化道菌群的组成分析发现了相同的差异: 两组消化道共有优势菌门也为变形菌门、厚壁菌门和拟杆菌门, 饲料组消化道增加了疣微菌门和放线菌门。这一发现表明, 点篮子鱼幼鱼的消化道菌群优势菌门与饵料表面的菌群有关。张志标等[38]通过PCR-DGGE指纹图谱分析发现, 篮子鱼肠道内的微生物多样性与浒苔表面的微生物多样性聚为一类, 相似性高达60%, 进一步佐证了本研究结果。也有研究表明, 金头鲷(Sparus aurata)的肠道菌群结构受植物蛋白的影响,但其多样性未受影响[39], 本研究中摄食浒苔的点篮子鱼肠道菌群的结构变化是否与浒苔本身的植物蛋白有关还有待进一步研究。许多研究表明, 疣微菌门和放线菌门都属于海洋益生菌, 其中放线菌与抗生素的生产有关[40,41], 疣微菌门可参与异化硫循环、无机氮循环等, 具有重要的生态价值[42]。浒苔组后肠中也检测到了疣微菌门(2.47%)和放线菌门(1.75%)的存在, 但其丰度低于饲料组后肠中的相对丰度; 且浒苔组幼鱼消化道其他部位未检测到疣微菌门的存在, 可能与水体环境或自身有关, 其中原因还有待进一步研究。
4 结论
点篮子鱼对外界营养物质变化的适应能力较强, 饲喂不同饵料也能正常生长和存活, 摄食浒苔的点篮子鱼较摄食人工饲料的生长缓慢, 但其对浒苔中的淀粉消化能力增强, 浒苔的营养足够满足点篮子鱼的生长需求, 且摄食浒苔的点篮子鱼幼鱼免疫能力也更强。点篮子鱼幼鱼的肠道菌群受食性影响, 摄食浒苔的幼鱼消化道菌群多样性整体较高,比摄食人工饲料的幼鱼具有更高的微生物群落功能稳定性。点篮子鱼摄食浒苔这一习性生态价值显著, 可以进一步研究在浒苔泛滥的贝类养殖池塘中套养一定密度的点篮子鱼, 从而减少养殖户的经济损失; 同时深入研究点篮子鱼-浒苔-贝类的生态养殖模式并进行推广, 经济价值显著。

