激素性股骨头坏死血管新生相关基因的鉴定及其靶向中药成分筛选验证
肖 振,李盛华
1.甘肃中医药大学,甘肃 兰州 730000
2.甘肃省中医院,甘肃 兰州 730050
激素性股骨头坏死(steroid induced osteonecrosis of femoral head,SONFH)是一种常见的进行性骨病,80%的患者会在1~4年内出现髋关节塌陷,最终需行人工关节置换,给社会家庭带来沉重负担[1]。SONFH的发生是由于免疫相关疾病过度使用糖皮质激素(glucocorticoid,GC)造成。GC 诱导的骨内皮细胞凋亡可激活血栓形成并减少血管生成[2]。骨内皮细胞包括骨微血管内皮细胞(bone microvascular endothelial cells,BMECs)和内皮祖细胞(endothelial progenitor cells,EPCs),在维持血管稳态以及股骨头血供中起着重要的作用。由骨内皮细胞受损引起的血管生成受损、细胞凋亡异常、血栓形成和脂肪栓塞被认为是SONFH 的关键发病机制[3-8]。研究发现,骨细胞不能在距离血管超过100 mm 处存活,所以学者们普遍认为血管发育总是先于成骨[9]。多项研究表明,血管内皮损伤与SONFH 密切相关,来自SONFH患者的BMECs 具有抑制迁移、血管生成受损和凋亡活性增加的特点[10-11]。另外,通过血管造影观察血管化大转子的骨移植治疗股骨头坏死能明显改善股骨头的血液灌注,并大幅改善患者髋关节活动功能[12]。因此,改善骨内皮细胞形态及功能是防控SONFH 发生和发展的重要调节因子。
血管生成是支持SONFH 修复的关键因素。研究发现使用普伐他汀和淫羊藿苷能促进血管新生,预防SONFH 的发生[13-14]。银杏叶提取物能增加SONFH 模型小鼠血管内皮细胞的活性,抑制甲强龙诱导的内皮细胞凋亡和功能丧失,逆转激素对磷酸化磷脂酰肌醇-3-羟激酶(phosphorylated phosphatidylinositol-3-hydroxykinase,p-PI3K)、磷酸化蛋白激酶B(phosphorylated protein kinase B,p-Akt)和磷酸化内皮型一氧化氮合酶(phosphorylated endothelial nitric oxide synthase,p-eNOS)表达水平的抑制,预防骨坏死[15]。本研究基于生物信息学分析筛选SONFH 中与血管生成相关的差异表达基因,进一步通过基因本体(gene ontology,GO)和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)富集分析,确定SONFH 发病机制,以及核心基因的表达、功能、相互作用及信号通路,并进一步筛选靶向中药活性成分,为靶向修复骨内皮细胞和探索SONFH 的治疗靶点提供新思路。
1 材料与方法
1.1 SONFH 与血管新生相关的差异表达基因(differentially expressed genes,DEGs)的筛选
从GEO数据库检索“steroid induced osteonecrosis of the femoral head”或“SONFH”获得GSE123568和GSE74089 数据集。GSE123568 包含10 个对照样本和30 个SONFH 样本,GSE74089 包含SONFH 和对照各4 个样本。检索Genecards 数据库获得SONFH靶基因2174 个。再通过检索“endothelial cells”和“glucocorticoid”,获得GSE25269 数据集,包含2 个对照组内皮细胞样本和2 个地塞米松干预的细胞样本。使用Prel 语言处理数据集,R 软件的svg 包对数据集去批次处理,通过limma 包限定P<0.05 获得DEGs,制做热图进行可视化分析。
1.2 关键基因的筛选及GO 和KEGG 富集分析
将各数据集DEGs 导入venny2.1 软件,获得SONFH 中与血管新生相关的关键基因。进一步使用David 软件获取GO 富集和KEGG 通路相关信息。
1.3 关键基因的PPI 网络构建与核心基因的筛选
通过STING 平台和Cytoscape 3.9.0 软件,深入了解SONFH 中差异表达血管新生相关基因的内在联系。使用MCODE 插件对基因进行聚类分析,使用CytoHubb 插件获取核心基因。
1.4 鉴定与SONFH 相关的核心基因
为了验证核心基因筛选的可靠性,使用GSE123568 数据集鉴定选定的核心基因的表达水平。进一步使用CTD 数据库验证核心基因与SONFH 之间的相互作用关系。
1.5 靶向核心基因的中药活性成分筛选
CTD 数据库是比较毒理基因组学数据库,采用CTD 数据库搜索靶向作用于核心基因的中药活性成分(限定interactions≥2)。
1.6 分子对接
在TCMSP 平台、ZINC 数据库搜索与核心基因作用指数最高的中药活性成分的3D 结构(mol2 格式),在PDB 数据库中输入核心基因Uniprot ID,下载相关靶蛋白的pdb 格式文件,经PyMOL 去水加氢后,使用Autodock vina1.1.2 软件进行分子对接,再用PyMOL 软件将结果可视化。
1.7 体外实验验证
1.7.1 细胞及试剂 人BMECs 购自ICELL(上海)生物技术股份有限公司,白藜芦醇(resveratrol)、3-MA(PI3K 抑制剂)购自MCE 上海皓元生物医药科技有限公司,注射用甲泼尼龙琥珀酸钠(methylprednisolone sodium,MPS,辉瑞制药有限公司),实验时将MPS 溶于ECM 培养基,3-MA 和白藜芦醇分别溶于 DMSO,原液浓度均为 100 mmol/L,后续实验使用内皮细胞培养基(endothelial cell medium,ECM)稀释至合适浓度。0.1%胰蛋白酶-EDTA、细胞计数试剂盒8(cell counting kit 8,CCK-8)、RIPA 裂解液(北京索莱宝科技有限公司);蛋白酶和磷酸酶抑制剂(Thermo Fisher Scientific公司,美国);Matrigel基质胶(BD Biosciences公司,美国);Transwell 小室(24 孔培养板)、96 孔培养板(Corning 公司,美国);血管内皮生长因子(vascular endothelial growth factor,VEGF)兔抗多克隆抗体(1∶1000)、PI3K 兔抗多克隆抗体(1∶1000)、Akt 兔抗多克隆抗体(1∶1000)、磷酸甘油醛脱氢酶(reduced glyceraldehyde-phosphate dehydrogenase,GAPDH)兔抗多克隆抗体(1∶5000);辣根过氧化物酶(horseradish peroxidase,HRP)标记羊抗兔二抗(1∶5000)均为ImmunoWay 公司产品。
1.7.2 白藜芦醇对MPS 干预后BMECs 增殖的影响使用ECM 培养制备BMECs 混悬液,细胞数2×105个/mL,加入96 孔板中,每孔100 μL,空白组不加细胞仅加100 μL ECM。过夜贴壁后,对照组加入ECM,处理组分别用终浓度25、50、75、100、200 μmol/L 白藜芦醇+20 μg/mL(终质量浓度)MPS[16]处理24、42、72 h 后,每孔加入10 μL CCK-8 避光孵育2 h。酶标仪(BioRed,美国)检测450 nm 处的吸光度(A),计算细胞活力。实验重复3 次。
细胞存活率=(A处理-A空白)/(A对照-A空白)
1.7.3 白藜芦醇对MPS 干预后BMECs 迁移的影响
(1)划痕实验:将细胞以2×105个/孔接种于6孔板内,分为6 组:对照组、模型(10 mg/mL MPS)组、3-MA 抑制剂(10 mg/mL MPS+5 mmol/L[16]3-MA+100 μmol/L 白藜芦醇)组及白藜芦醇低、中、高剂量(10 mg/mL MPS+50、100、200 μmol/L白藜芦醇)组。细胞在无血清培养基中饥饿8 h 后,用200 μL 移液管吸头刮去内皮细胞,洗涤未附着的细胞,每组给予相应药物,培养0、24 h 后拍照,计算划痕愈合率。实验重复3 次。
划痕愈合率=(0 h 划痕宽度-24 h 划痕宽度)/0 h 划痕宽度
(2)Transwell 迁移实验:分组和给药同划痕实验,消化细胞并用PBS 洗涤3 次去除血清影响,用无血清培养基调整细胞密度为1×105个/mL,每孔加入200 μL 细胞悬液于Transwell 小室内,24 孔板内加入750 μL 含10% FBS 的ECM 培养基。每组给予相应药物,孵育24 h 后,Transwell 小室用甲醇固定,0.1%结晶紫染色;随后用棉签去除每个小室内部未迁移细胞,倒置显微镜下观察。随机取3 个视野计数迁移细胞并取均值,实验重复3 次。
1.7.4 蛋白质印记分析 分组和给药同划痕实验,BMECs 给予相应处理48 h 后,通过RIPA 裂解缓冲液(含蛋白酶和磷酸酶抑制剂1∶100)提取蛋白质,紫外分光光度计测定蛋白浓度并稀释浓度至10 mg/mL。加入5×上样缓冲液混合均匀,在95 ℃下加热5 min 导致蛋白质变性。使用8% SDS-PAGE 分离胶分离40 μg 蛋白质样品,然后将其转移到PVDF膜上,用10%脱脂牛奶封闭2 h,然后一抗在随后的4 ℃下孵育过夜。之后,与其相应的二抗进行孵育。用电化学发光法观察条带。Image Lab 3.0 软件用于量化条带灰度值。实验重复3 次。
1.8 统计学处理
使用GraphPad Prism 9.0.0 统计分析,实验数据以±s表示,多组间比较采用单因素方差分析,两组间比较采用独立样本t检验,P<0.05 表示差异有统计学意义。
2 结果
2.1 SONFH 与血管新生的DEGs 的确定
数据集和平台信息见表1,通过GEO2R 获得差异表达基因,以P<0.05 为条件筛选DEGs,GSE123568 包含12 796 个,GSE74089 包含12 120个,Genecards 包括2354 个,其中GSE123568 和GSE74089 的数据经Perl 语言处理合并及R 软件(svg 包)矫正后,使用ggplot2 包将数据可视化,见图1,SONFH 差异基因火山图及热图见图2。综合各数据集共获得SONFH 的DEGs 963 个,见图3-A。同样筛选GSE25269(P<0.05)数据集获得与血管生成相关的2373 个DEGs,前50 个DEGs 热图见图3-B。

图2 SONFH 的DEGs 火山图和聚类热图Fig.2 Volcano map(A)and clustering heat map(B)of DEGs of SONFH

表1 数据集基本信息Table 1 Basic information of data set

图1 GEO 数据矫正Fig.1 GEO data correction
2.2 关键基因的筛选
将SONFH 中与血管生成相关的基因定义为关键基因。将各数据集DEGs(P<0.05)导入venny 2.1 软件,获得118 个SONFH 中与血管新生相关的DEGs(图3-C)。其中74 个在SONFH 中表达上调,44 个在SONFH 中表达下调。
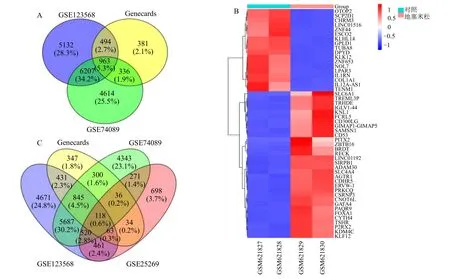
图3 SONFH 和血管新生相关的DEGs 及关键基因的筛选Fig.3 SONFH and angiogenesis related DEGs and screening of key genes
2.3 关键基因GO 和KEGG 富集分析
使用DAVID 数据库进行关键基因的GO 富集(图4-A、B、D)和KEGG 通路富集分析,GO富集中生物过程主要涉及正调控血管生成、细胞黏附、炎症、细胞增殖、迁移和伤口愈合等;细胞组分主要涉及细胞外间隙、细胞外基质和胞外区;分子功能涉及蛋白质结合、血小板衍生生长因子和蛋白酶结合等。KEGG 主要富集到PI3K 信号通路、黏附斑信号通路、细胞外基质受体互作通路和Ras 相关蛋白1(Ras-related protein 1,Rap1)信号通路等,关键基因与通路的桑基气泡图见图4-C。
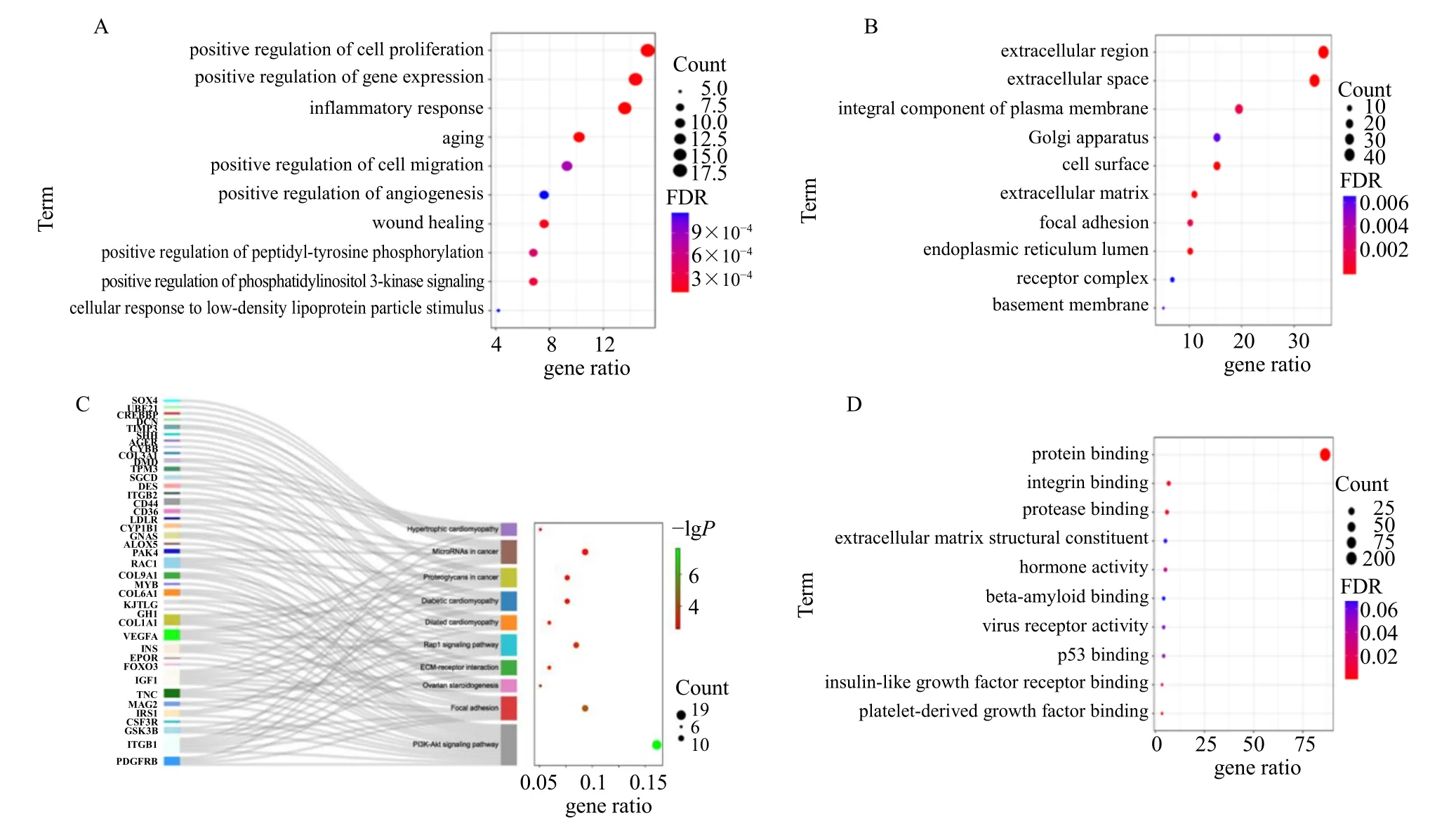
图4 关键基因的GO 和KEGG 富集分析Fig.4 GO and KEGG enrichment analysis of key genes
2.4 关键基因蛋白质相互作用网络(proteinprotein interaction network,PPI)及核心基因筛选
将DEGs 导入STRING 平台,隐藏无连接的节点,获得包含102 个节点和443 条边的PPI网络,再导入Cytoscape,使用NetworkAnalyzer 工具计算节点属性,节点大小对应度(degree)大小,见图5。再使用Cytoscape 的MCODE 插件寻找关键的子网络6 个,见图6-A~F,其主要子网络(图6-A)涉及vegf 激活的血小板衍生生长因子受体信号通路对细胞增殖、一氧化氮介导的信号转导调节、冠状血管形态发生和细胞黏附的正调节。

图5 关键基因PPI 网络(节点大小对应度值大小)Fig.5 PPI network of key genes(node size correspondence degree value size)
通过Cytoscape 软件中的CytoHubba 插件筛选关键基因中最大中心度(maximal clique centrality,MCC)评分前10 位的基因,定义为核心基因。通过筛选依次为血管内皮生长因子(vascular endothelial growth factor,VEGFA)、白蛋白(albumin,ALB)、胰岛素(insulin,INS)、胰岛素样生长因子1(insulin-like growth factor 1,IGF1)、透明质酸的受体(CD44)、整合素β-1(integrin beta-1,ITGB1)、Thy-1 膜糖蛋白(Thy-1 membrane glycoprotein,THY1)、血小板衍生生长因子受体β(platelet-derived growth factor receptor beta,PDGFRB)、受体型酪氨酸蛋白磷酸酶 C(receptor-type tyrosine-protein phosphatase C,PTPRC)和胶原蛋白α-1(collagen alpha-1(I)chain,COL1A1),见图6-G。进一步对核心基因富集通路分析,结果显示通路主要富集到PI3K-Akt、黏附斑、Ras 和Rap1 信号通路等(图7),与关键基因富集通路大致相同。

图6 PPI 网络基因簇模块(A~F)与核心基因(G)Fig.6 Gene cluster module of PPI network(A—F)and core genes(G)

图7 核心基因富集通路图Fig.7 Enrichment pathway map of core genes
2.5 SONFH 血管新生相关的核心基因的筛选及鉴定
通过验证GSE123568 数据集鉴定选定的10 个核心基因的表达水平,发现核心基因表达均差异明显(P<0.05,图8-A),尤其PTPRC、CD44、IGF1和VEGFA的差异最为显著,其中CD44、ITGB1和PTPRC表达上调,其余皆表达下调。进一步受试者工作特征(receiver operating characteristic,ROC)分析显示PTPRC、CD44、IGF1、PDGFRB、ITGB1和VEGFA的曲线下面积(area under curve,AUC)值分别为0.897、0.837、0.777、0.770、0.767 和0.703(图8-B)。

图8 核心基因在SONFH 中的表达情况Fig.8 Expression of core genes in SONFH
再使用CTD 数据库验证核心基因与SONFH 之间的相互作用关系(图9),结果发现COL1A1、IGF1、VEGFA和PTPRC与SONFH 作用指数较高,提示可能为干预修复SONFH 的重要靶点。

图9 核心基因与SONFH 相互作用指数Fig.9 Interaction index of core genes and SONFH
2.6 靶向核心基因的中药活性成分筛选
CTD 数据库中靶向作用于核心基因的中药活性成分(interactions≥2)见表2。结果显示白藜芦醇、姜黄素、雌二醇和槲皮素等与核心基因相互作用指数较高,提示这些活性成分可能是作用核心基因促进血管新生修复SONFH 关键药物成分。

表2 靶向作用核心基因的中药活性成分Table 2 Active components of traditional Chinese medicine targeting core genes
2.7 分子对接
通过Autodock vina 软件分子对接,显示靶向核心基因的主要中药活性成分白藜芦醇与VEGFA、PTPRC、ITGB1、PDGFRB、IGF1和CD44结合能均小于-5 kcal/mol(1 kcal=4.2 kJ),结合稳定,结合能依次为-6.2、-6.1、-5.9、-5.6、-5.2 和-5.3 kcal/mol。白藜芦醇与各蛋白形成氢键丰富,结构构象稳定,如与VEGFA通过氨基酸残基SER-9、GLY-42、GLY-41、LYS-103 形成4 个氢键;与PTPRC通过氨基酸残基SER-828/SER-829、ARG-834、GLY-833、HIS-797、GLN-872 形成6 个氢键;与PDGFRB通过氨基酸残基SER-40、SER-39、SER-77、ARG-19、ARG-37、PTR-1 形成6 个氢键;与ITGB1通过残基ARG-309、THR-310、SER-233 形成3 个氢键;与IGF1通过氨基酸残基GLY-19、GLN-15 形成2个氢键;与CD44通过氨基酸残基SER-109、ILE-26、GLU-37 形成3 个氢键(图10),结果提示白藜芦醇有可能通过核心基因VEGFA、PTPRC、ITGB1、PDGFRB、IGF1 和CD44发挥修复SONFH 的作用。

图10 白藜芦醇与核心基因结合位点Fig.10 Sites of resveratrol binding to core gene
2.8 白藜芦醇对MPS 干预后BMECs 的影响
2.8.1 对BMECs 增殖的影响 CCK8 检测显示,白藜芦醇浓度为100 μmol/L 且作用48 h,能显著改善MPS 对BMECs 活性的抑制,见图11。

图11 白藜芦醇对MPS 干预后BMECs 活力的影响(n=3)Fig.11 Effect of resveratrol on BMECs activity after MPS intervention(n = 3)
2.8.2 对 BMECs 迁移的影响 划痕实验和Transwell 实验结果(图12)表明,基于划痕愈合率和细胞迁移数量两方面,模型组BMECs 的迁移显著低于对照组(P<0.05),白藜芦醇低、中、高剂量组BMECs 的迁移明显高于模型组,白藜芦醇中剂量组明显高于3-MA 抑制剂组(P<0.05)。
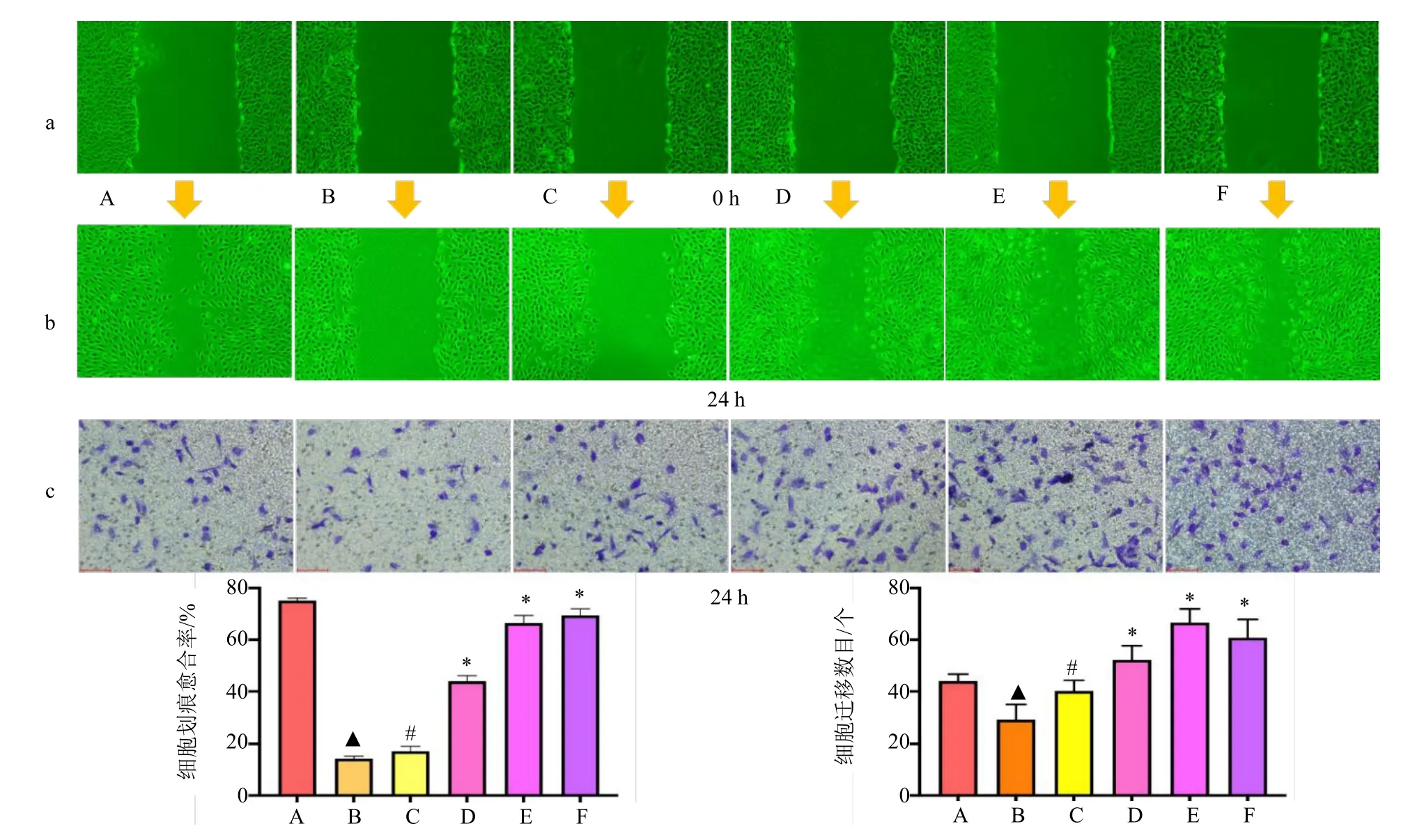
图12 白藜芦醇对细胞迁移的影响(±s,n=3)Fig.12 Effects of resveratrol on cell migration(±s,n=3)
2.8.3 对细胞蛋白表达的影响 Western blotting 检测结果(图13)显示,与对照组比较,模型组PI3K/Akt/VEGF 通路蛋白表达降低,其中PI3K 表达水平降低显著(P<0.05);与模型组比较,白藜芦醇低、中、高剂量组中Akt、VEGF 蛋白相对表达量均明显升高(P<0.05),白藜芦醇中、高剂量组PI3K 蛋白相对表达量明显升高(P<0.05),而3-MA抑制剂组较白藜芦醇中剂量组通路蛋白表达明显降低(P<0.05)。

图13 白藜芦醇对MPS 诱导降低的BMEC 中PI3K/Akt/VEGF 信号通路蛋白表达的影响(±s,n=3)Fig.13 Effects of resveratrol on PI3K/Akt/VEGF signaling pathway protein expression in MPS induced BMECs(±s,n=3)
3 讨论
SONFH 是难治性骨科疾病,主要由血液供应中断和凝血系统功能障碍引起,导致骨细胞死亡、股骨头塌陷。GC 的使用抑制了血管生成、骨修复和一氧化氮的代谢,通过调节血管活性介质如内皮素-1、去甲肾上腺素和缓激肽来诱导骨内股骨头动脉血管的收缩导致股骨头缺血,以及增加骨内压引起缺血,促进内皮细胞的凋亡,减少流向股骨头的血量[17-20]。骨内皮细胞不仅可以形成微血管系统,为发育中的骨骼提供营养,还可以在体外和体内增强间充质干细胞的成骨分化,促进骨修复。因此,寻找SONFH 中与血管生成相关的基因,在诊断和修复SONFH 方面具有重要作用。
本研究分析了公共数据库中可用的微阵列数据集GSE123568、GSE74089、GSE25269 和Genecards数据库,获得SONFH 的DEGs 共963 个,血管生成相关DEGs 共2373 个,获得SONFH 中与血管生成相关的关键基因118 个,其中74 个在SONFH 中表达上调,44 个在SONFH 中表达下调。这些基因主要富集于正调控血管生成、细胞黏附、炎症、细胞增殖和迁移、伤口愈合等,大部分作用于细胞质和核质。有研究证实细胞因子IL-10 和TNF-α 与SONFH 的发生有关[21]。据报道,促红细胞生成素通过刺激VEGF 的表达来促进血管生成,以保护股骨头免受GC 诱导的骨坏死的侵害[22-23]。细胞黏附相关蛋白Rap1 在SONFH 中下调,对股骨头内微血管内皮细胞黏附及迁移造成障碍,未能对受损血管内皮及时修复,加速骨坏死进程[24]。此外,KEGG 富集分析主要涉及PI3K-Akt 信号通路、黏着斑信号通路、细胞外基质受体互作通路和Rap1 信号通路等。参与这些途径的大多数基因都被上调了。PI3K-Akt是一个重要而复杂的信号通路,其在干细胞调节的细胞存活、增殖、迁移和血管生成中起着核心作用。激活PI3K-Akt 信号通路可显著增强各种组织中内皮细胞的功能[25]。黏着斑激酶(focal adhesion kinase,FAK)是一种非受体蛋白酪氨酸激酶和支架蛋白,可介导许多细胞功能,包括黏附、迁移和侵袭。FAK 抑制剂可减少滑膜成纤维细胞的侵袭和迁移,因此,抑制FAK 可能有助于改善在SONFH 发展中的骨髓水肿和滑膜炎[26]。黏着斑与细胞生长、形状和运动有关。研究表明,黏着斑是股骨头坏死后未成熟关节软骨中显著丰富的生物学途径[27]。本团队前期研究发现非创伤性股骨头坏死可能与信号通路Rap1/PI3K/Akt 受到抑制导致其表达下降所引起的血管内皮损伤有关[24]。细胞外基质受体互作通路与血管生成、软骨生成和软骨退化有关[28],且在股骨头坏死的髋软骨中显着富集[29]。本研究结果提示PI3K-Akt 信号通路、黏着斑和Rap1 信号通路等参与了SONFH 的发病机制。
10 个核心基因是VEGFA、ALB、INS、IGF1、CD44、ITGB1、THY1、PDGFRB、PTPRC和COL1A1。这些核心基因都可能在SONFH 发生和发展中起到重要作用。VEGFA基因位于染色体6p31.3[30],是编码血管内皮生长因子的成员,与VEGF 受体在胞外结合,刺激细胞内酪氨酸激酶,促进内皮细胞增殖,增加血管通透性。已有研究将VEGFA 启动子区域内的多个遗传多态性与非创伤性SONFH 的疾病状态联系起来。VEGFA 是血管生成的关键介质[31],诱导内皮细胞增殖,促进细胞迁移,抑制细胞凋亡并诱导血管通透。使用VEGF受体拮抗剂可以在动物模型中阻断血管生成并诱导SONFH[32]。IGF1 调控细胞生长、分化,如刺激成骨细胞和内皮细胞的增殖,促进组织再生与修复。IGF1 可逆转地塞米松对PI3K-Akt 信号通路的抑制,并抑制其下游叉头框蛋白O1(forkhead box protein O1,FOXO1)的表达,进而治疗SONFH[33]。CD44 抗原是透明质酸(hyaluronic acid,HA)的受体。通过其与HA 和其他配体(如骨桥蛋白、胶原蛋白和基质金属蛋白酶)的亲和力来介导细胞与细胞、细胞与基质的相互作用,其与HA 的结合在细胞迁移中起作用。PDGFRB 通过促进周细胞和平滑肌细胞向内皮细胞的增殖、迁移和募集,在血管发育中起至关重要的作用[34]。PTPRC 是抗原受体激活T 细胞所需的蛋白质酪氨酸-蛋白质磷酸酶。有研究发现微重力环境中的小鼠股骨头出现了骨吸收,检测髓腔分离的细胞显示早期间充质干细胞造血分化的基因 PTPRC 的表达显著下调[35-36]。COL1A1 在SONFH 模型兔中的表达被抑制,使用葛根素后COL1A1 的表达升高,且SONFH 模型兔的成骨能力增加[37]。目前ALB、INS、CD44和THY1等核心基因在骨坏死中的作用机制尚不清楚,有待于进一步研究。
通过GSE123568 数据集鉴定,发现核心基因尤其是PTPRC、CD44、IGF1和VEGFA的表达差异最为显著。ROC 分析显示PTPRC、CD44、IGF1、PDGFRB、ITGB1和VEGFA的AUC 值均大于0.7,具有较大可能性成为SONFH 潜在生物标志物,Ma等[38]在1 项汉族人群VEGFA与SONFH 的遗传关系的研究中,VEGFA单核苷酸多态性(single nucleotide polymorphisms,SNP)基因型rs2010963与SONFH 显著相关。通过CTD 数据库验证核心基因与SONFH 之间的相互作用关系,发现COL1A1、IGF1、VEGFA和PTPRC与SONFH 作用指数较高,提示可能为干预修复SONFH 的重要靶点。目前已有通过VEGFA 防治SONFH 的研究,有研究发现促红细胞生成素通过刺激VEGFA 的表达,可保护股骨头免受GC 诱导的骨坏死的侵害[39]。CTD 数据库筛选靶向核心基因的中药活性成分,发现白藜芦醇、姜黄素、雌二醇和槲皮素等与核心基因相互作用指数相对较高,为防治SONFH 提供了新的方向。
分子对接显示白藜芦醇与SONFH 中与血管新生有关的核心基因结合稳定,并通过体外细胞实验证实白藜芦醇能显著上调本研究筛选的核心基因VEGFA及PI3K/Akt 信号通路的表达水平,表明白藜芦醇对激素干预的BMECs的损伤具有修复作用,主要通过激活 PI3K/AKT/VEGF 信号通路提高BMECs 的活性并促进细胞的迁移。也有研究发现,白藜芦醇可以改善SOFNH 兔模型中的骨骼血液供应,以保护血管内皮细胞并减少血栓形成[40-41]。研究表明,姜黄素可通过抑制Janus 激酶1/2(Janus kinase 1/2,JAK1/2)-信号转导和转录激活因子1(signal transducer and activator of transcription 1,STAT1)途径抑制SONFH 模型小鼠细胞M1 极化来防止炎症介导的骨细胞凋亡[42],与本研究筛选结果一致,说明姜黄素有很大潜能成为临床治疗SONFH 药物的新选择。
4 结论
通过生物信息学分析鉴定了SONFH 血管新生相关的核心基因和通路,尤其是PTPRC、IGF1、VEGFA、ITGB1、PDGFRB和CD44核心基因和PI3K信号通路、黏附斑信号通路、细胞外基质受体互作通路和Rap1 信号通路等,它们可能与SONFH 发病密切相关;筛选出白藜芦醇最有可能成为预防或逆转骨坏死的潜在药物,并进行了实验验证。本研究有助于理解血管新生在SONFH 发病机制中的作用,为寻找具有SONFH 诊断或治疗价值的生物标志物的相关大样本研究提供参考依据。
利益冲突所有作者均声明不存在利益冲突

