miR-613 抑制胶质瘤增殖及侵袭能力
贺彬 丁晨哲 刘家阳
(1固原市人民医院神经外科,宁夏 固原 756000;2宁夏回族自治区人民医院神经外科)
恶性胶质瘤是中枢神经系统最常见、最具侵袭性的原发肿瘤,约占中枢神经系统肿瘤的30%,脑恶性肿瘤的80%〔1〕。尽管采取了积极的疗法,包括外科手术切除,放疗和化学疗法,但胶质瘤患者的预后仍然很差,主要是由于其明显的恶性增殖和浸润。微小RNA(miRNA)是一类小型非编码RNA,通过靶向3′-非翻译区(3′-UTR)调控信息RNA (mRNA),从而抑制基因表达。由于miRNAs介导靶基因的表达,它们参与了多种生物过程的调控,如细胞增殖、侵袭、凋亡和分化〔2〕。miRNA在胶质瘤起始和进展的调控中也起着关键作用〔3,4〕,miR-613是一种新型的与癌症相关的miRNA,已被证明可抑制包括肝癌〔5〕、宫颈癌〔6〕、大肠癌〔7〕等多种癌症中的肿瘤发生和发展〔8〕。虽然miR-613已被证明可以抑制多种恶性肿瘤细胞增殖和集落形成〔9,10〕,但miR-613在胶质瘤中的功能和潜在机制仍不清楚。本研究旨在探讨miR-613对神经胶质瘤的增殖及侵袭能力的影响和调控机制。
1 材料与方法
1.1细胞培养和细胞转染 U87MG人脑胶质瘤细胞为星形胶质细胞瘤,分级为Ⅳ级(购自中国科学院上海研究所)。细胞在含有10%胎牛血清和5% CO2的RPMI1640培养基(GIBCO,USA)中培养。培养基保持在湿度为95%的CO2培养箱中,温度为37℃。为了进行实验,根据制造商的方案,使用miR-613模拟物(HaiJima生物技术公司)、miR-613抑制剂(HaiJima生物技术公司)、葡萄糖-6-磷酸脱氢酶(G6PD)和miR-613模拟物+G6PD(Lipofectamine 2000,Invitrogen,美国)转染U87MG细胞,分别记为miR-613模拟物组、miR-613抑制剂组、G6PD组、miR-613+G6PD组。培养24~48 h后,收集细胞,用TRIzol提取总核糖核酸。转染72 h后,用Western印迹法测定细胞的蛋白质表达。
1.2样本收集 2015年2月至2018年9月,宁夏回族自治区人民医院神经外科共确诊48例胶质瘤患者,其中男26例,女22例,平均年龄(48.5±12.4)岁。纳入的患者未患其他疾病,也未接受放疗、化疗和激素疗法。根据世界卫生组织(世卫组织)制定的神经系统肿瘤分类〔11〕,神经胶质瘤组织被两名独立病理学家分类为:Ⅰ级(6例;毛细胞型星形细胞瘤),Ⅱ级(18例;弥漫性星形细胞瘤、少突胶质细胞瘤、原生质性星形细胞瘤、中枢神经系统细胞瘤、室管膜瘤),Ⅲ级(14例;间变性星形细胞瘤、间变性细胞瘤、间变性室管膜瘤)和Ⅳ级(10例;胶质神经母细胞瘤,髓母细胞瘤)。Ⅰ级和Ⅱ级为低级别胶质瘤组织,Ⅲ级和Ⅳ级为高级别胶质瘤组织。除此之外,从进行尸检的患者中收集20个正常脑组织样本作为对照,并将所有样本置于液氮中。整个程序得到了医院伦理委员会的批准,所有患者签署了知情同意书。
1.3RNA提取和RT-PCR 用TRIzol试剂(Invitrogen,CA,USA)提取细胞或人体组织中核糖核酸。使用紫外分光光度计在260和280 nm处测量吸光度,并且在260和280 nm的吸光度比率用于评估核糖核酸的纯度。使用逆转录试剂盒(Invitrogen,Carlsbad,CA,USA)合成cDNA,以量化miR-613和G6PD。通过实时荧光定量分析,用THUNDERBIRD SYBR qPCR Mix(Toyobo,Japan),扩增cDNAs,并使用β-肌动蛋白(β-actin)作为内源性对照。聚合酶链反应条件:95℃变性10 s,60℃退火20 s,在72℃延伸34 s。上述步骤循环40次进行扩增。
1.4Western印迹法检测相关蛋白水平 使用RIPA缓冲液裂解总细胞提取物。用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离细胞蛋白质,并转移到聚偏二氟乙烯(PVDF)膜上。一抗包括抗G6PD、抗细胞外调节蛋白激酶(ERK)、抗磷酸化(p)ERK、抗c-Fos和抗β-actin(Santa Cruz Biotechnology,USA)。用Tris-缓冲盐水和TBST洗涤膜3次,每次10 min,加入辣根过氧化物酶结合的二级抗体,并在室温下孵育1 h。之后,用TBST洗涤膜3次,每次10 min,通过增强化学发光显影并拍照。
1.5CCK-8细胞增殖检测 细胞转染24 h后,U87MG细胞用0.25%胰蛋白酶消化,用含10%胎牛血清(FBS)的DMEM培养基培养成单细胞悬液,然后置于每孔含1×104个细胞的24孔板中,在5% CO2培养箱中孵育。使用细胞计数试剂盒-8 (CCK-8,Japan)在24、48、72和96 h测量细胞增殖。此外,将10 μl CCK-8溶液加入100 μl培养基中,细胞在37℃孵育4 h后,检测每个孔在450 nm波长下的光密度。绘制细胞生长曲线,其中横轴代表不同的测量时间,纵轴代表吸收值。
1.6Transwell细胞体外侵袭实验 转染24 h后收集细胞,用浓度为5×105细胞/ml的无血清培养基悬浮。神经胶质瘤细胞的体外侵袭性通过涂有基质凝胶(BD,Biosciences)的8 μm孔的Transwell小室(Corning Incorporated Life Sciences)进行评估。此外,将200 ml细胞悬液加入上腔室,并将10% FBS培养基置于匹配的下腔室中,在37℃下培养24 h。用棉签擦拭上腔室中的非侵入细胞,用多聚甲醛(PFA)固定迁移到下膜中的细胞20 min,并用0.1%结晶紫(Beyotime)染色。使用显微镜(Olympus)在每个孔的6个随机选择的区域观察和计数染色的细胞。实验被独立重复3次。
1.7统计学分析 采用SPSS22.0软件进行t检验、单因素方差分析、χ2检验。
2 结 果
2.1胶质瘤脑组织和正常脑组织中miR-613和G6PD水平比较 与正常脑相比,胶质瘤组织中miR-613的表达显著下调(P<0.05)。与低级别胶质瘤组织比较,miR-613表达在高级别胶质瘤组织显著下调(P<0.05),G6PD基因在胶质瘤组织中高表达,并随恶性程度增加而增加,差异均有统计学意义(P<0.05)。见表1。
2.2miR-613直接抑制胶质瘤中G6PD的表达 与空白对照组和miR-613 NC组比较,miR-613模拟物组,G6PD表达水平显著降低,miR-613显著升高(P<0.05);miR-613抑制剂组G6PD表达水平上调,miR-613显著下调(P<0.05)。见表2和图1。

表1 不同组织中miR-613和G6PD mRNA表达水平比较

表2 各组miR-613和G6PD mRNA表达比较
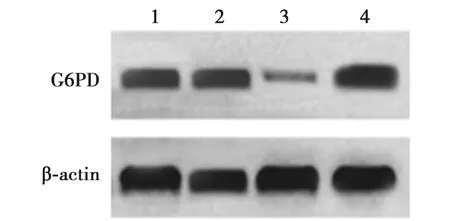
1~4:空白对照组,miR-613 NC组,miR-613模拟物组,miR-613抑制剂组图1 miR-613直接抑制G6PD在胶质瘤中表达
2.3miR-613通过靶向G6PD抑制ERK途径 与空白对照组相比,miR-613组pERK、c-Fos和G6PD蛋白表达水平均显著降低(P<0.05)。与miR-613组相比,miR-613+G6PD组和G6PD组的pERK、c-Fos和G6PD蛋白水平显著增加(P<0.05)。与miR-613+G6PD组相比,G6PD组的pERK、c-Fos和G6PD蛋白水平显著增加(P<0.05)。见图2、 表3。
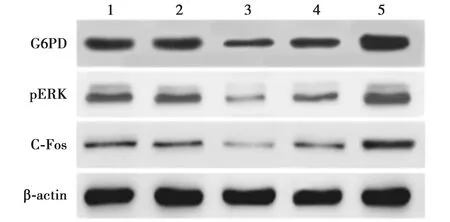
1~5:空白对照组,miR-613 NC组,miR-613组,miR-613+G6PD组,G6PD组图2 Western印迹法检测各组相关蛋白表达水平

表3 各组细胞中蛋白相对表达水平
2.4miR-613靶向G6PD抑制胶质瘤细胞增殖和侵袭 与空白对照组相比,miR-613组48、72、96 h OD450值及侵袭细胞数均显著降低(P<0.05);与miR-613组相比,G6PD组和miR-613+G6PD组48、72、96 h 的OD450值及侵袭细胞数均显著升高(P<0.05);与miR-613+G6PD组相比,G6PD组48、72、96 h 的OD450值及侵袭细胞数显著升高(P<0.05)。见表4、图3。

表4 细胞中各个时间点不同组别胶质瘤细胞的OD450 nm相对值及侵袭细胞数比较
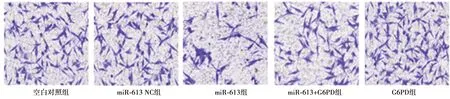
图3 miR-613通过靶向G6PD抑制胶质瘤细胞侵袭(结晶紫染色,×200)
3 讨 论
胶质瘤是一种预后差的原发性恶性脑肿瘤,最常见的亚型(胶质母细胞瘤)的中位生存时间只有14个月〔12〕。胶质母细胞瘤起始细胞能抑制T细胞的增殖,增强免疫抑制调节性T细胞的凋亡〔13〕。miRNA的失调已成为恶性神经胶质瘤的主要特征,一些miRNA可能是胶质瘤诊断和预后的潜在新生物标记〔14,15〕。部分miRNAs已被证明参与抑制胶质瘤的进展和发展,是胶质瘤的潜在治疗靶点〔15〕。既往研究表明miR-613在多种类型的癌症中下调,并作为肿瘤抑制因子发挥作用〔5,6,8,10,16~18〕。如miR-613通过靶向formin样蛋白2抑制结肠直肠癌细胞增殖、迁移和侵袭,并在G1期诱导细胞周期停滞〔18〕。miR-613在骨肉瘤细胞中过表达,通过调控细胞周期阻滞在G0/G1期,显著抑制肿瘤细胞的增殖和集落形成,损害细胞的迁移和侵袭能力,进而通过抑制c-MET抑制上皮-间充质转化〔19〕。miR-613在体外显著抑制甲状腺癌细胞的生长、迁移和侵袭,在体内通过靶向鞘氨醇激酶2抑制肿瘤生长〔20〕。本研究中,miR-613在胶质瘤组织中的表达显著降低,在高级别胶质瘤组织中的表达显著降低。miR-613的异常表达可能与人脑胶质瘤的发生有关。此外,本研究还发现G6PD蛋白在胶质瘤组织中的表达水平高于正常脑组织。G6PD是miR-613的直接靶标〔8〕,而G6PD过表达被证明在食管癌中逆转了miR-613的作用〔16〕。在多种类型的恶性肿瘤中均存在G6PD活性的异常上升〔21~24〕。G6PD的主要作用是通过戊糖磷酸途径产生核糖和还原性等效的烟酰胺腺嘌呤二核苷酸磷酸(NADPH)。G6PD是维持细胞生长和发育的典型管家酶。G6PD活性减弱或功能失调会阻碍正常细胞增殖及胚胎和器官发育〔25,26〕。快速生长的癌细胞已经进化出多种机制来激活G6PD,以支持NADPH生成和脂肪酸及核酸合成的细胞需求〔27,28〕。本研究结果显示胶质瘤脑组织中的miR-613表达水平下降,而G6PD的水平上升,并且MiR-613直接抑制胶质瘤中G6PD的表达。
ERK通路在胶质瘤细胞的生长和增殖中起着至关重要的作用。ERK信号通路可影响包括转录因子和其他与细胞周期进程、分化和蛋白质翻译相关的激酶的磷酸化。参与ERK信号转导的分子的异常表达被认为在癌症的发展过程中发挥重要作用〔29〕。例如,Alves等〔30〕利用结肠模型证明,上调ERK信号通路可使G6PD诱导自噬,从而促进结直肠癌的生存。并且ERK信号可以被一些结合上游分子或下游受体的因素所抑制。本研究结果提示G6PD可能是miR-613的直接靶点,参与了miR-613抑制增殖和侵袭的抑制作用。
综上所述,miR-613在胶质瘤中下调,而miR-613过表达与胶质瘤细胞ERK信号通路降低相关,从而抑制胶质瘤细胞的增殖和侵袭。本研究为胶质瘤的发病机制提供了新的认识,为胶质瘤的治疗提供了一个潜在的有效靶点。

