蚕品种对不同发育阶段蚕体、蚕沙及蚕茧稳定同位素特征的影响
续文婕 胡慧萍 戴贤君 贾丽玲 郑海玲 周 旸 潘家荣,*
(1中国计量大学生命科学学院,浙江 杭州 310018;2中国丝绸博物馆,浙江 杭州 310002)
我国种桑、养蚕、缫丝、织绸的历史悠久,可以追溯至新石器时代晚期,素有“丝国”的美称[1]。丝绸文化作为中华文明的重要标志,大量文献和考古实例证实了中国是丝绸的起源地[2]。但当今国际社会仍有部分学者持怀疑态度,提出的证据是在印度河流域遗址中发现距今4 000多年的蚕丝纤维残留,提出印度丝绸起源论[3]。因此,为丝绸起源于我国提供理论依据,建立一种有效、稳定的蚕丝及其织物的产地溯源体系极为重要。
稳定同位素技术具有示踪、整合和指示等功能,准确性和灵敏度较高,近年来已发展成为农产品产地溯源的有效手段之一[4-5],在乳制品[6-8]、大米[9-10]、茶叶[11-13]、肉类[14-16]等农产品产地溯源中取得了良好成效。然而,多种因素如采样地点与采样时间、样品处理方式、品种等会直接干扰产地溯源模型的鉴别准确率。如Zhao等[17]分析对比了奶牛泌乳阶段、采样时间对中国各省份牛奶样品中δ13C、δ15N、δ2H、δ18O 值的影响,发现不同泌乳阶段的牛奶样本中稳定同位素比值差异不显著,对牛奶产地溯源无影响,而采样时间会对牛奶产地溯源产生影响。刘志等[18]研究5种烘干方式对西湖龙井茶中δ13C、δ15N、δ2H、δ18O值的影响,发现不同烘干方式可能引起茶叶中单个稳定同位素比值的变化,但多因素椭圆置信区间测试结果表明不同烘干方式茶叶间不存在显著性差异。赵珊等[19]研究不同发育期及授粉方式对甜瓜中稳定同位素比值的影响,发现在同一发育时期,不同授粉方式的甜瓜果实中δ13C、δ15N、δ2H、δ18O 值无显著差异。Zhang 等[20]对中国7 个地区的扇贝样品的δ13C、δ15N 值进行测定,结果表明,不同产地、季节和品种的扇贝样品中稳定同位素比值存在显著性差异,在进行产地溯源时需要保证扇贝样本品种的一致性。近年来,稳定同位素技术在纺织考古领域中的应用得到迅速发展,尤其是古代纺织品来源的确定,Von Holstein等[21]对现代和古代羊毛角蛋白的δ13C、δ15N、δ2H 值进行测定,发现羊毛角蛋白样品的δ13C、δ15N、δ2H 值可以对产地进行有效鉴别,羊毛角蛋白的降解并不会导致样本中稳定同位素组成出现显著性差异。在丝绸溯源中,尚无蚕茧中稳定同位素特征是否受品种因素影响的研究。
本研究通过桑蚕饲养试验,探讨在外界环境与饲喂桑叶一致的条件下,5 种桑蚕品种(菁松×皓月、皓月×菁松、D5、D7和D18)不同龄期的蚕体、蚕沙以及蚕茧样本中碳、氮、氢、氧稳定同位素比值的变化,并评估品种对蚕茧产地溯源模型准确性和稳定性的影响,以期利用稳定同位素指纹分析技术实现对不同产地蚕茧的精准溯源。
1 材料与方法
1.1 试验材料
本试验选用5个桑蚕品种,其中杂交品种2个,组合分别为菁松×皓月(JH)和皓月×菁松(HJ),地方品种3个,分别为D5、D7 和D18,由浙江省农业科学院蚕桑与茶叶研究所提供。其中,菁松×皓月(正反交)是中国农业科学院蚕业研究所育成的优质、高产、多丝量蚕品种,是我国多个蚕区的主推品种[22]。喂食桑叶采自浙江省农业科学院桑叶园,小蚕食用嫩叶采自枝条近顶端,叶薄呈黄绿色;大蚕食用成熟叶采自枝干下端,叶厚呈暗绿色,桑叶的稳定同位素比值如表1 所示(δ15N存在显著性差异)。

表1 桑蚕不同发育时期喂食桑叶的稳定同位素比值Table 1 The stable isotope ratio in mulberry leaves for different developmental stages of silkworm
1.2 仪器与设备
Delta V Advantage 稳定同位素比质谱仪、Flash 2000 HT 元素分析仪,美国Thermo Fisher Scientific 公司;LT-DBX120 F 电热恒温鼓风干燥箱,立德泰勀(上海)科学仪器有限公司。
1.3 试验方法
1.3.1 饲养与采样 蚕蚁从未感光状态开始培养,1~3 龄期的小蚕喂食嫩桑叶,4~5 龄期大蚕喂食成熟叶。按正常程序进行饲养。随机采集各龄期眠蚕蜕皮后48 h 的蚕体和蚕沙样本,由于1龄蚕沙产量少,体积小,难以收集,故主要采集2~5龄蚕沙。
1.3.2 样品处理 将采集的蚕体、蚕沙和桑叶样品于70 ℃烘干至恒重,将烘干后样品置于研钵内充分研磨,过100 目筛,密封保存待测。随机采集不同品种蚕茧样本各5个作为试验对象,将其置于110 ℃烘箱中烘干至恒重,剪成1 mm×1 mm碎片,待测。
1.3.3 稳定同位素测定与计算
1.3.3.1 碳、氮稳定同位素测定 称取0.2 mg 待测样品于锡囊(3.3 mm×5 mm)中,通过自动进样器进入元素分析仪中,以CO2和N2为参考气,燃烧炉温度为960 ℃;色谱柱温度为50 ℃;氦气吹扫流速为200 mL·min-1,在此条件下样品中的碳元素和氮元素转化为纯净的CO2和N2,经氦气稀释后进入同位素比质谱仪检测。选用标准品IAEA-CH-7(δ13C=-32.151‰)和IAEA-310(δ15N=47.2‰)对样品测试结果进行校正,为保证测试结果的准确性,每隔12个样品插入1个标准品,每个样品重复测定3次取平均值。
1.3.3.2 氢、氧稳定同位素测定 称取0.2 mg 待测样品于银杯(3.3 mm×5 mm)中,通过自动进样器进入元素分析仪中,以H2和CO为参考气,燃烧炉温度为1 380 ℃;色谱柱温度为50 ℃;氦气吹扫流速为100 mL·min-1,样品在玻璃碳管内经高温裂解产生CO 和H2,恒温色谱柱内分离,经氦气稀释后进入同位素比质谱仪检测。选用标准品IAEA-CH-7(δ2H=-100.3‰)和IAEA-601(δ18O=32.3‰)对样品测试结果进行校正,为保证测试结果的准确性,每隔12个样品插入1个标准品,每个样品重复测定3次后取平均值。
1.3.3.3 稳定同位素比值计算 按照以下公式计算稳定同位素比值:
式中,R样品为待测样品中某种元素的重同位素与轻同位素丰度之比,即13C/12C、15N/14N、2H/1H、18O/16O;R标准为标准品中重同位素与轻同位素丰度之比,其中δ13C 的相对标准为VPDB,δ15N 的相对标准为Air,δ2H和δ18O的相对标准为VSMOW。
1.4 数据处理
利用SPSS 26.0 软件进行独立样本T 检验和单因素方差分析(one-way ANOVA),利用MATLAB R2016a软件进行椭圆联合置信区间(elliptical joint confidence region,EJCR)测试。
2 结果与分析
2.1 不同时期蚕体和蚕沙中稳定同位素的特征及品种对其的影响
2.1.1 不同龄期蚕体和蚕沙的稳定同位素比值变化由表1可知,不同龄期桑蚕喂食的桑叶间δ13C、δ2H、δ18O值无显著差异;大蚕期喂食桑叶的δ2H、δ18O 值相较于小蚕期喂食桑叶略有降低;不同成熟度桑蚕喂食的桑叶间δ13C 值差异极小,相比于小蚕期喂食桑叶,大蚕期喂食桑叶的δ13C值分布更加集中、稳定,与前人研究结果相一致[23]。不同成熟度桑蚕喂食的桑叶间的δ15N值具有显著性差异,大蚕期喂食桑叶中δ15N均值(-2.58‰)显著低于小蚕期桑叶中δ15N均值(-0.46‰),说明桑叶叶片发育过程中会优先贫化15N。
由表2 可知,不同品种家蚕幼虫的δ13C、δ15N、δ2H和δ18O值在不同生长发育阶段的变化趋势不同。不同品种、不同龄期蚕体与摄食桑叶的碳、氮、氢、氧稳定同位素分馏值见图1。结果表明,家蚕对摄食桑叶的δ13C、δ15N、δ2H 和δ18O 值表现出不同的富集和贫化效应。蚕体δ13C 值的均值变化范围为-30.33‰~-27.26‰,与喂食桑叶中的δ13C 值相近,随着龄期的增加总体呈现先增后减的变化趋势,1~3 龄期的蚕体δ13C 值缓慢升高并逐渐趋于饲喂桑叶的δ13C 值。在3~4 龄期,尽管大蚕期饲喂桑叶的δ13C 值与小蚕期相近,但蚕体的δ13C值明显降低,至4~5龄期趋于稳定。桑蚕饲喂过程中,蚕体与桑叶的碳稳定同位素分馏值介于-2.72‰~0.31‰之间,除3龄期蚕体呈现弱富集效应外,其他龄期蚕体均表现出不同程度的贫化效应,其中4~5 龄期蚕体的贫化效应较大。对于δ15N,随着龄期的增加,不同品种蚕体δ15N 值的变化呈波动上升趋势,蚕体与桑叶的氮稳定同位素分馏值在-0.76‰~4.33‰之间,除3 龄期的蚕体对摄食桑叶呈现弱贫化效应外,其他各龄期均表现出不同程度的富集效应,其中4~5 龄期家蚕对摄食桑叶有明显的富集效应。1~3 龄期喂食桑叶的δ2H值明显低于初期蚕体,且蚕体δ2H值变化趋势不明显,对摄食桑叶的δ2H 富集程度较高。虽然大蚕期喂食桑叶δ2H 值与小蚕期喂食桑叶相比变化不明显,但是随着龄期的增加,不同品种蚕体总体呈急剧降低的趋势,对δ2H 的贫化效应随龄期的增加而增大。家蚕不同生长阶段饲喂桑叶的δ18O 值基本不变,蚕体δ18O值随龄期变化波动小,表现出明显的贫化效应,蚕体与摄食桑叶的氧稳定同位素分馏值介于-6.49‰~-3.47‰。
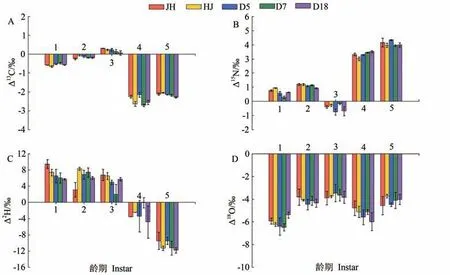
图1 不同龄期蚕体与饲喂桑叶之间的C、N、H、O稳定同位素分馏值Fig.1 Stable isotope fractionation of C,N,H and O between silkworm body and mulberry leaves at different instars
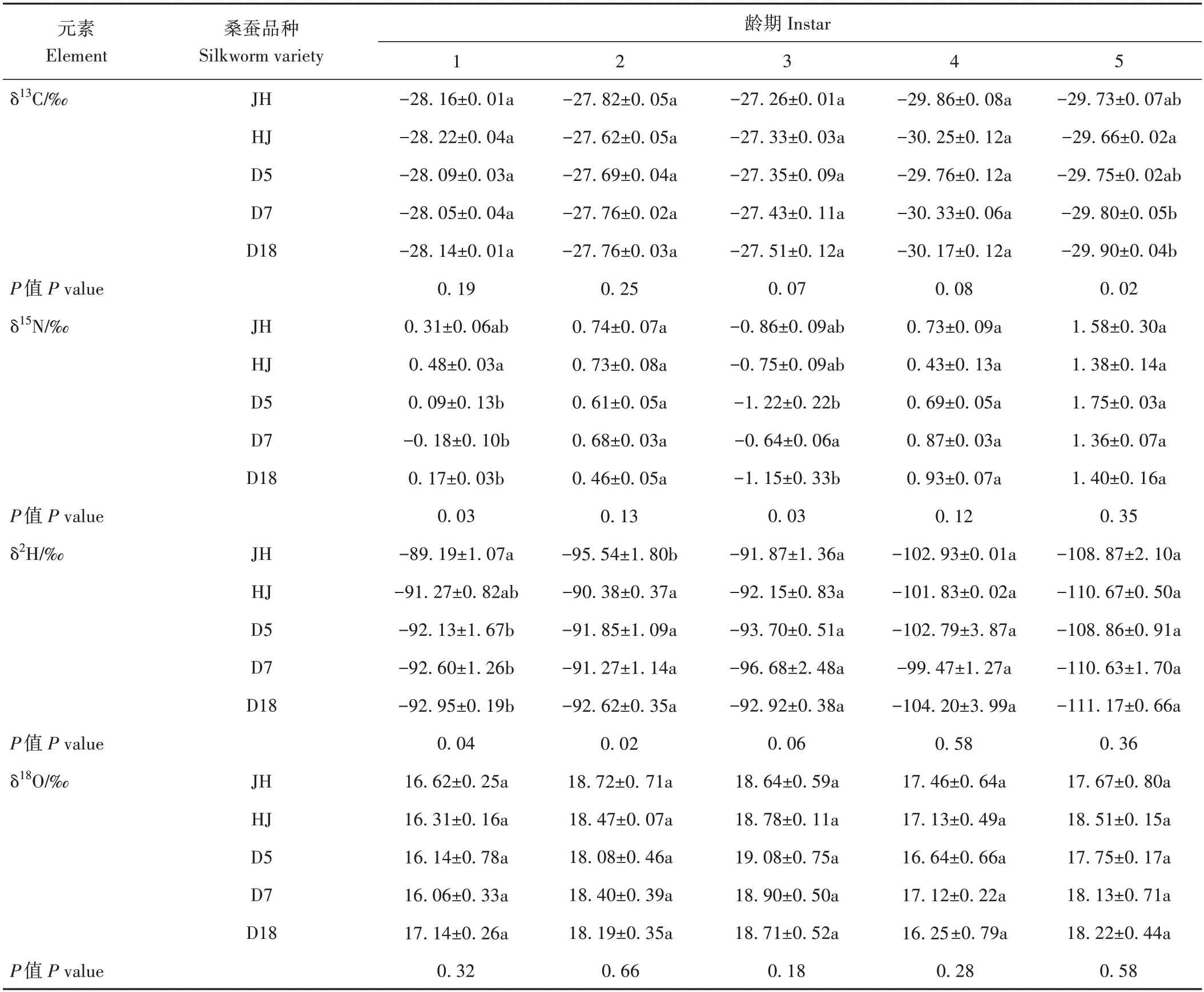
表2 不同品种蚕体在各龄期的δ13C、δ15N、δ2H、δ18O值的显著性差异Table 2 Significant difference of δ13C、δ15N、δ2H、δ18O value in silkworm body from different varieties and at different instars
由表3 可知,不同龄期蚕沙的δ13C、δ15N、δ2H 和δ18O值变化趋势与蚕体相似。
2.1.2 品种对蚕体和蚕沙稳定同位素比值的影响由表2 可知,不同品种之间在1 至4 龄期蚕体样本中的δ13C值无显著差异。而在5龄期,不同品种之间的δ13C差异范围在0.24‰之内。不同品种之间在2、4、5龄期蚕体样本中的δ15N 差异不显著。而在1、3 龄期,不同品种之间的δ15N 值整体差异显著,差异范围分别为0.66‰和0.58‰。不同品种之间在饲养前期(1~2 龄期)的δ2H值整体存在显著差异,但饲养后期(3、4、5龄期),品种间δ2H 值无显著差异。前期主要受蚕种的影响,后期受喂食桑叶的影响,可能导致品种之间δ2H 值无显著差异。各龄期不同品种之间的δ18O值无显著差异。以上结果说明,在蚕饲喂过程中,不同品种之间多数龄期蚕体的稳定同位素组成无显著差异,仅在个别龄期出现显著差异。
同样由表3 可知,不同品种之间在2 龄期和5 龄期的蚕沙样本δ13C 和δ15N 值整体存在显著差异,在3、4龄期,不同桑蚕品种的蚕沙样本间δ13C、δ15N、δ2H 和δ18O值均无显著差异。
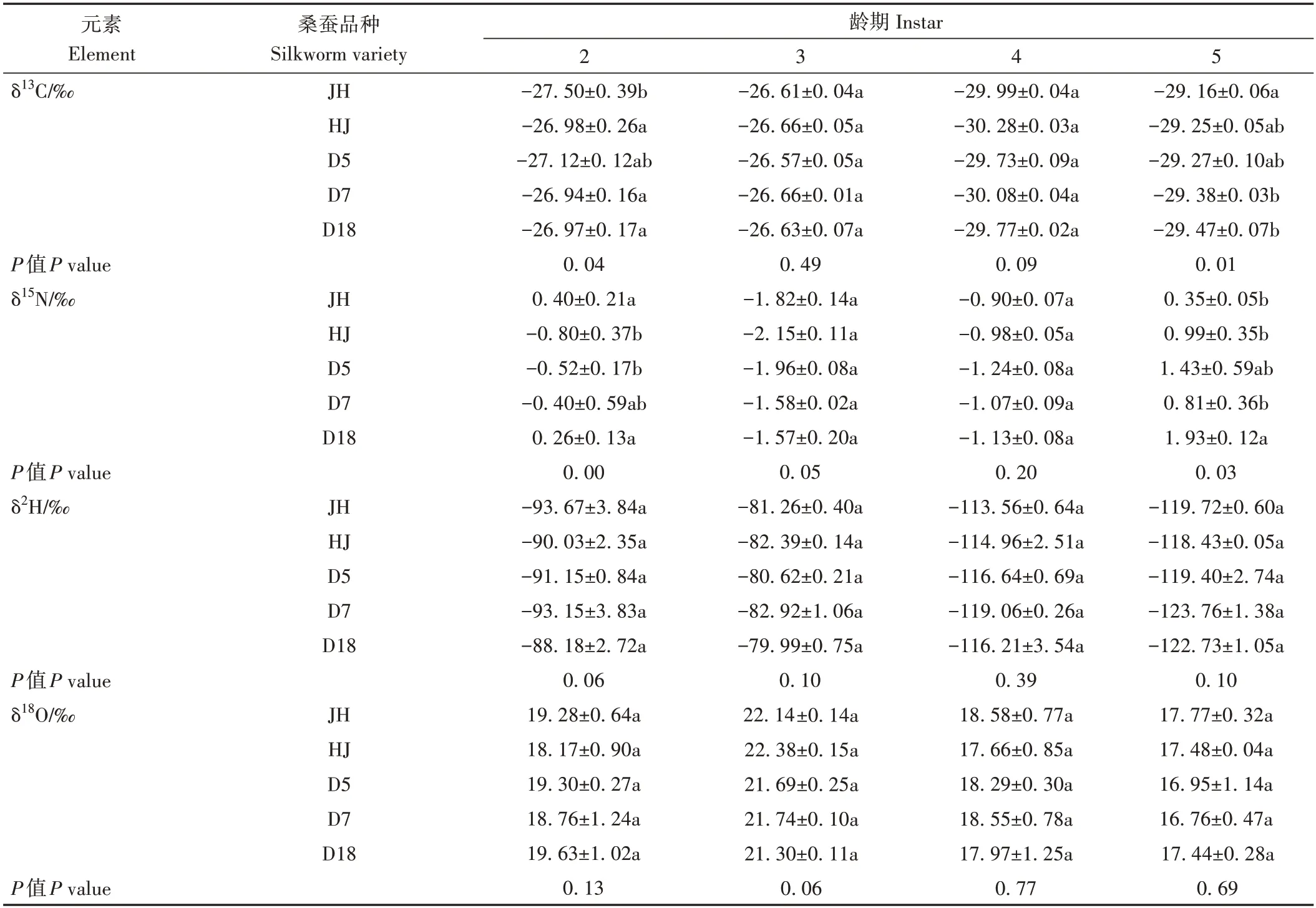
表3 不同品种蚕沙在各龄期的δ13C、δ15N、δ2H、δ18O值的显著性差异Table 3 Significant difference of δ13C、δ15N、δ2H、δ18O value in silkworm excrement from different varieties and at different instars
2.1.3 蚕体和蚕沙的相关性分析 对蚕体和蚕沙样本的δ13C、δ15N、δ2H、δ18O值分别进行线性相关分析,结果如图2所示。除蚕体样本中的δ18O值与蚕沙样本中的δ18O 值相关性较差外,蚕体和蚕沙样本中δ13C、δ15N、δ2H 稳定同位素指标的相关性较强,相关系数(R2)分别为0.982 8、0.666 6、0.811 7。因此,可将蚕沙代替蚕体进行碳、氮、氢3 种稳定同位素测定,具有试验材料易获得,且能避免活蚕取样对饲养试验产生过度干扰等优点[24]。
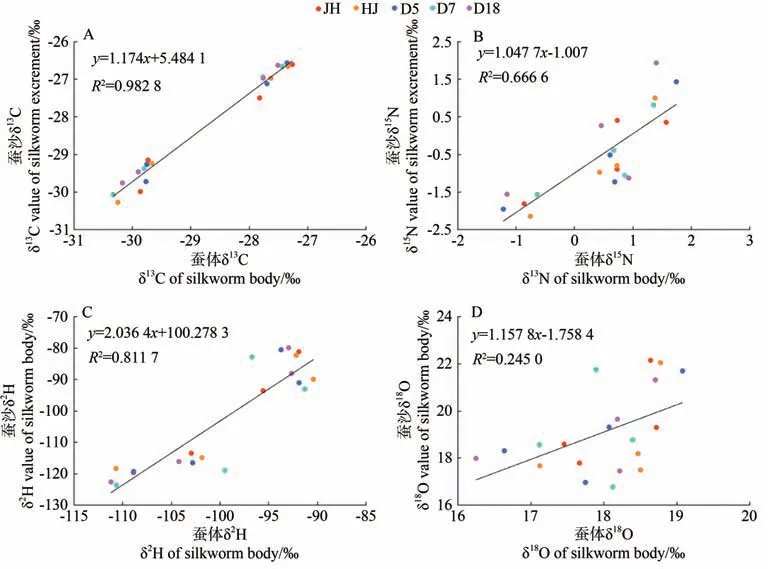
图2 蚕体与蚕沙样本的δ13C、δ15N、δ2H、δ18O相关性分析Fig.2 The correlation analysis plot of δ13C、δ15N、δ2H、δ18O of silkworm body and silkworm excrement
2.2 品种对蚕茧稳定同位素比值的影响
2.2.1 单因素方差分析 由表4 可知,不同品种蚕茧样本间的δ18O值分布在17.30‰~18.11‰之间,无显著差异。而δ13C、δ15N、δ2H值在部分蚕茧样本间出现显著差异,蚕茧δ13C分布在-27.02‰~26.55‰范围内,δ15N值分布在2.51‰~4.23‰范围内,δ2H 值分布在-80.32‰~-72.27‰范围内。如图3 所示,桑蚕品种对蚕茧样本碳、氧稳定同位素的影响较小。D5、D7、D18 对蚕茧中的氮稳定同位素比值影响相似,明显高于菁松、皓月正、反交品种。对于δ2H,除D5品种蚕茧的δ2H 值明显较低外,其他品种蚕茧样本的δ2H值较为接近。
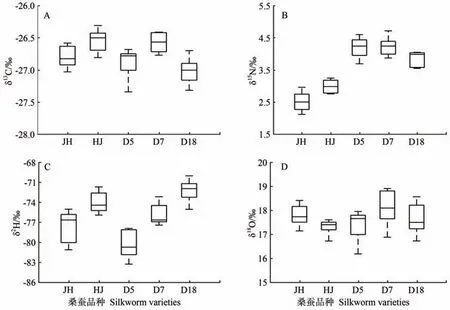
图3 不同蚕茧品种的δ13C、δ15N、δ2H、δ18O单因素方差分析箱线图Fig.3 One-way ANOVA boxplot of δ13C、δ15N、δ2H、δ18O in cocoons of different silkworm varieties
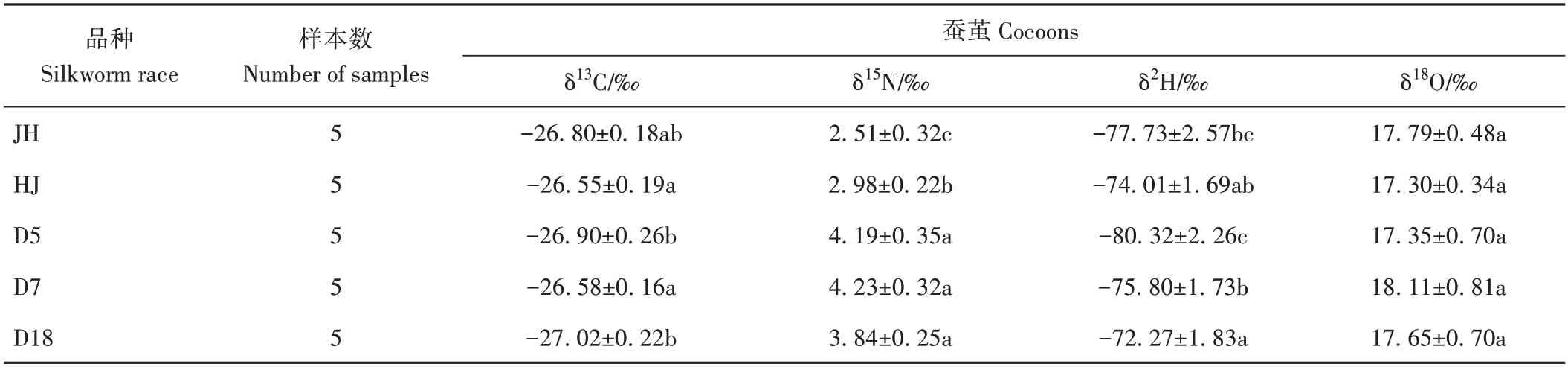
表4 桑蚕品种对蚕茧中δ13C、δ15N、δ2H、δ18O值的影响Table 4 Effects of silkworm varieties on the δ13C、δ15N、δ2H、δ18O value in cocoons
2.2.2 椭圆联合置信区间测试 单因素方差分析初步探索了不同桑蚕品种对蚕茧中δ13C、δ15N、δ2H、δ18O 4 种稳定同位素指标的影响,结果表明不同品种蚕茧的δ18O 值无显著差异,δ13C、δ15N、δ2H 值在部分品种间存在显著差异,但单一稳定同位素指标并不足以全面考察品种带来的影响,单一变量的异常值可能影响样本均值估计的精确度[18]。因此,进一步采用椭圆联合置信区间(EJCR)评估不同桑蚕品种对蚕茧中稳定同位素组成的影响。
由图4-A、B 可知,对蚕茧的δ13C 和δ15N、δ2H 和δ18O 进行双因素EJCR 测试,蚕茧样本总体分布在95%置信椭圆内,仅第14 号样本位于δ2H 和δ18O 双因素置信椭圆的置信限上。由图4-C、D 可知,蚕茧样本总体分布在δ13C、δ15N 和δ2H 与δ13C、δ15N 和δ18O 的三因素置信椭球内,无异常样本。随着耦合指标的增加,第14号样本逐渐逼近置信椭球的期望值,可以认为不是异常样本。虽然不同桑蚕品种对蚕茧样本内单一稳定同位素指标产生影响,但双因素及三因素EJCR测试结果显示蚕茧样本总体分布在95%置信区间内。由此可知,尽管不同桑蚕品种能够引起蚕茧中稳定同位素比值出现变化,但不会导致蚕茧样本间出现显著性差异。
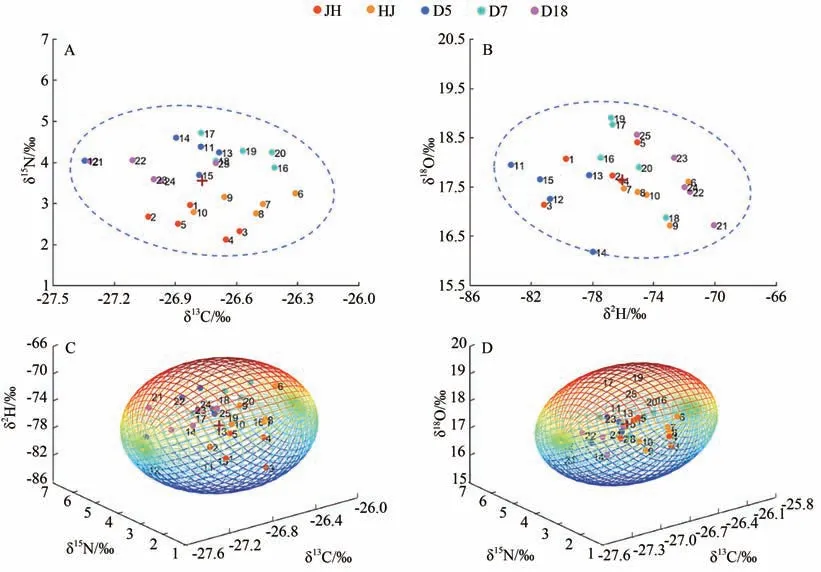
图4 不同品种蚕茧样本的δ13C、δ15N、δ2H、δ18O的椭圆置信区间测试Fig.4 Elliptical joint confidence region of δ13C、δ15N、δ2H、δ18O in cocoons of different silkworm race
3 讨论
我国桑蚕品种繁多,现阶段桑蚕养殖以散户经营为主,且不同桑蚕养殖地区的环境存在差异,导致各地品种出现多、混、杂等现象[25]。已有研究探讨了稳定同位素指纹分析技术在蚕茧产地溯源中的应用[26]。然而对桑蚕品种引起的稳定同位素比值变化及其对溯源准确性的影响仍缺乏相关研究。
本研究探讨了不同桑蚕品种对蚕体、蚕沙样本中稳定同位素比值的影响,以及桑蚕生长发育过程中对摄食桑叶的稳定同位素分馏效应。利用单因素方差分析和椭圆联合置信区间测试全面评估了品种引起的蚕茧中稳定同位素比值差异,以及这种差异对产地溯源的影响。
本研究发现,饲养过程中蚕体对桑叶的稳定同位素分馏效应略有不同,桑叶中δ13C、δ18O 值均高于初始蚕体,δ15N、δ2H 值低于初始蚕体,家蚕摄食桑叶后体内δ13C 大体表现出贫化效应,仅3 龄期蚕体对摄食桑叶的Δ13C 介于0‰~1‰之间,与前人研究报道的相邻营养级间的碳稳定同位素富集效应在0‰~1‰之间相一致[27],且蚕体δ13C的分馏效应不明显,主要是由摄食桑叶中的δ13C 决定的[28]。δ15N 大体呈现显著的富集效应,4、5 龄期蚕体的Δ15N 介于3.01‰~4.33‰之间,与文献报道的相邻营养级间的氮稳定同位素富集效应介于3‰~4‰相一致[29]。蚕体与桑叶的稳定同位素判别值与前人报道的δ13C、δ15N 富集效应存在一定差异,可能是由于小蚕期是家蚕充实体质的重要时期,是蚕体快速生长发育期,需要大量的蛋白质用于躯体构建,大蚕期的家蚕体质量增长率开始趋于平稳,摄入营养物质主要用于蚕丝纤维的合成。δ2H 在小蚕期表现出富集效应,在大蚕期呈贫化效应;δ18O 总体呈贫化效应,受喂食桑叶影响较小。相对于碳、氮稳定同位素而言,氢、氧稳定同位素的影响因素更为复杂[30],桑蚕主要通过桑叶摄取水分,不同龄期桑蚕摄食桑叶的含水量存在差异,小蚕期摄食桑叶的含水量更高,且大蚕期相较于小蚕期的体质量增长率下降,两种因素共同导致了蚕体δ2H、δ18O 分馏效应的差异。不同龄期蚕沙的δ13C、δ15N、δ2H和δ18O变化趋势与蚕体相似。
在蚕生长发育过程中,除少数龄期外,不同桑蚕品种蚕体和蚕沙的δ13C、δ15N、δ2H、δ18O值无显著差异,且蚕体与蚕沙样本的δ13C、δ15N、δ2H 相关性高,可采用非入侵性取样代替活蚕取样。单因素方差分析结果表明,桑蚕品种对蚕茧中的δ18O值无显著影响,对δ13C、δ15N、δ2H影响较显著,可能是由于地方品种吐丝量低,相较于生产品种出现茧偏小、茧层薄的现象,为加强蚕茧对蚕蛹的保护能力,地方品种相较于生产品种中的小分子物质含量更高[31]。单一稳定同位素指标并不足以全面考察品种带来的影响,单一变量的异常值可能会影响样本均值估计的精确度[18],现阶段稳定同位素溯源技术正由单一同位素向多同位素联合分析转变[32-33]。已有研究比较了不同同位素指标组合对判别准确率的影响,结果表明,随着同位素指标的增加,蚕茧产地判别准确率得到显著提升[27]。本研究双因素和三因素EJCR 测试结果表明,不同桑蚕品种对蚕茧中单一稳定同位素比值产生较大影响,但不会导致蚕茧样本出现显著性差异,品种引起的差异可能远小于产地引起的差异,并不足以影响不同产地蚕茧的鉴别,这为基于稳定同位素技术的蚕茧产地溯源提供了理论依据。近年来市场对蚕丝产品的需求趋于多元化,彩色茧家蚕品种的饲育规模不断扩大[34]。彩色茧品种的色素来源于桑叶中的类胡萝卜素和叶黄类色素,以及桑蚕体内合成的黄酮色素[35]。本研究仅探讨了不同白色茧品种对桑蚕及其蚕茧的影响,而有关彩色茧品种对摄食桑叶的同位素分馏效应,不同发育阶段中蚕体、蚕沙的稳定同位素比值变化,以及蚕茧样本中稳定同位素比值可能出现的变化还需进一步探讨。这为进一步加强稳定同位素技术在蚕丝及其织物产地溯源中的准确性和有效性提出了亟待解决的新问题。
4 结论
本研究结果表明,蚕体对4 种稳定同位素的分馏效应存在差异,且蚕体与蚕沙在不同龄期的稳定同位素比值变化趋势相似。在相同饲喂条件下,除少数龄期外,不同桑蚕品种之间蚕体和蚕沙样本的稳定同位素组成总体不存在显著差异,且蚕体和蚕沙样本的δ13C、δ15N、δ2H 值存在较强的相关性。桑蚕品种可能导致蚕茧中单个稳定同位素出现较大变化,但不同品种之间蚕茧稳定同位素比值变化可能远小于产地因素带来的差异。因此,稳定同位素指纹分析技术可应用于不同品种蚕茧的产地溯源。在后续研究中,品种可以不作为主要影响因素,可有效解决采样品种难以控制的困难,大大降低采样难度,提高采样效率。

