利用花生RIL群体进行芽期耐寒性遗传特性分析
薛云云 田跃霞 张 鑫 张蕙琪 李 娜 梁煜莹 张加羽 白冬梅
(山西农业大学经济作物研究所,山西 太原 030031)
花生(Arachis hypogaeaL.)是世界范围内重要的油料和经济作物之一。在国内植物油供给严重紧缺的市场背景下,进一步扩大我国花生生产、拓宽种植区域,能够增加油料供给、提高农民收入、促进乡村振兴[1]。花生是喜温作物,从种子发芽到成熟的整个生育期都容易遭遇低温寒害,其中以芽期危害最为普遍,容易造成种子活力下降、烂种、出苗率低,进而影响花生的产量和品质[2]。有研究学者认为可以利用外源物质来增强花生种子的耐低温能力,如赤霉素[3]、过氧化氢(H2O2)[4]、磷酸二氢钾[5]能够显著提高低温环境下花生的发芽率,但是这种方法需要提前以适宜浓度的外源物质进行浸种,费工费时。因此,培育耐寒性强的花生品种是解决低温寒害的理想途径。
国内外关于花生耐寒性的研究已经取得了一些进展,主要集中在低温胁迫下芽期耐寒性鉴定及其评价体系构建[6-8]、生理生化指标的变化情况[9-11]、转录组及其差异基因表达分析[12-14]等,而利用主基因+多基因混合模型进行遗传分析主要集中在农艺性状[15-17]、品质性状[18-19]及其抗病性[20-21]等,对花生耐寒性遗传特性尚缺乏系统性和突破性分析研究。因此,本研究利用耐寒性强的品种和耐寒性弱的品种杂交,构建了2 个重组自交系(recombinant inbred line,RIL)群体,将这2个RIL 群体及其亲本分别种植于4个环境中,收获后的种子首先进行芽期耐寒性表型鉴定,然后以相对发芽率作为花生芽期耐寒性评价指标[5],利用章元明团队开发的数量性状主基因+多基因混合遗传分析R软件包SEA v2.0[22]对2 个RIL 群体芽期耐寒性进行遗传特性分析,探究该性状的遗传模型和主基因调控数量,旨在为深入开展芽期耐寒性分子机制研究、提高耐寒性分子育种效率提供重要的理论基础。
1 材料与方法
1.1 供试材料
以耐寒性强的花生品种花育44(HY44)为母本,耐寒性弱的花生品种DF12为父本,杂交构建包含有807个家系的F7:8代RIL群体,命名为HD-RIL;以耐寒性强的花生品种远杂9102(YZ9102)为母本,低温敏感花生品系徐州68-4(XZ68-4)为父本杂交构建含有195 个家系的F9:10代RIL 群体,命名为YX-RIL。从HD-RIL 群体中随机筛选出200 个家系,并与双亲作为供试材料,分别于2020年种植于海南乐东(E1),2021年分别种植于山西汾阳(E2)和海南南滨(E3);将YX-RIL群体与双亲分别于2020年种植于山西汾阳(E4)和海南乐东(E1),2021年种植于山西汾阳(E2)。四个环境均设置3次重复,行距35 cm,田间管理措施与常规田一致。
1.2 试验方法与测定指标
利用山西农业大学经济作物研究所花生分子生物实验室建立的花生芽期耐寒性鉴定方法和标准[6],即以相对发芽率作为芽期耐寒性鉴定评价指标。对双亲远杂9102、徐州68-4 及其YX-RIL 群体和双亲花育44、DF12 及其HD-RIL 群体中随机筛选出的200 个家系,在4个环境种植收获的种子进行芽期耐寒性鉴定。
根据公式计算相对发芽率(relative germination rate,RGR):
1.3 数据处理
采用Microsoft Excel 2010 整理数据,并作出频率直方图。
采用SPSS18.0软件对两个RIL 群体4个环境下的相对发芽率进行统计分析。
采用王靖天等[22]提供的主基因+多基因遗传分析R软件包SEAv2.0中的SEA-G3DH群体,对2个RIL群体4 个环境下的芽期耐寒性(相对发芽率)进行遗传分析,根据赤池信息量准则(Akaike’s information criterion,AIC)值[23]和适合性检验结合的方法选择最适模型,AIC 值遵循最小或者较小原则,适合性检验选择统计量达到显著水平个数最少的模型。该程序需要在R环境(https://www.r-project.org/)下运行。
2 结果与分析
2.1 两个群体在不同环境下的耐寒性表现
对两个RIL 群体的4 个亲本在4 个环境下的相对发芽率进行T 检验,发现两个父本的相对发芽率分别极显著低于其对应的母本(表1),说明亲本属于极端材料,可以使用主基因+多基因混合模型进行遗传分析[24]。两个RIL 群体相对发芽率的最小值均低于父本,说明后代群体出现超亲现象。后代家系群体的遗传变异非常丰富,且表现为连续变异,HD-RIL群体在3个环境下的变异系数分别为59.68%、33.44%、39.43%,YX-RIL群体在3个环境下的变异系数分别为63.12%、47.93%、43.94%。两个RIL群体的偏度和峰度的绝对值均小于1,符合典型数量性状分布的特征。图1、2均直观地显示出两个群体相对发芽率符合正态分布特性,可以进行后续的遗传分析。

图1 HD-RIL群体相对发芽率在E1、E2、E3环境中的频率分布Fig.1 Frequency distribution for relative germination rate in HD-RIL population at E1、E2、E3
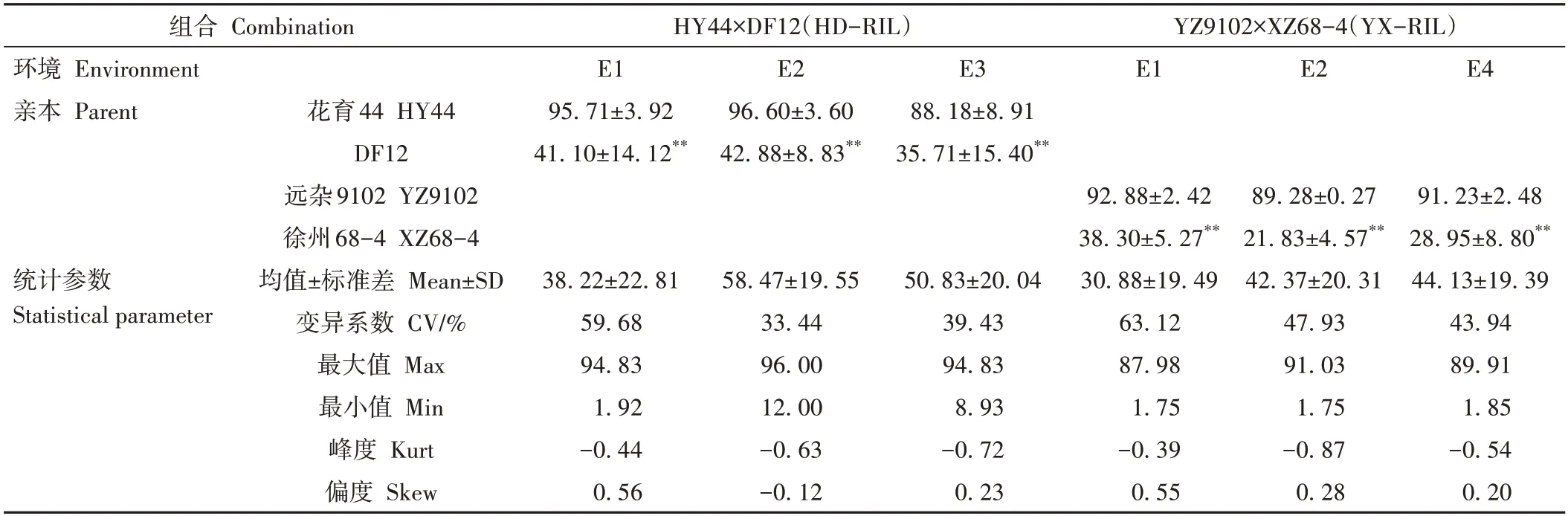
表1 不同群体相对发芽率的统计分析Table 1 Statistical analysis of relative germination rate in different populations/%
2.2 两个RIL 群体不同环境下相对发芽率备选模型的选择
将两个组合的亲本及RIL 群体4 个环境下的相对发芽率输入csv 格式的文件中,该文件第一行显示为群体类型(P1、P2、DH),从第二行起显示为观测值(相对发芽率)。将准备好的csv 格式文件上传到分析软件中,运行该程序,得到一份包含38 个模型的极大似然函数值、AIC 值、P1 和P2 的平均值、RIL 群体的各成分分布平均数及其分布比例、一阶参数的估计值、二阶参数的估计值、适合性检验等数据的分析结果(表2)。
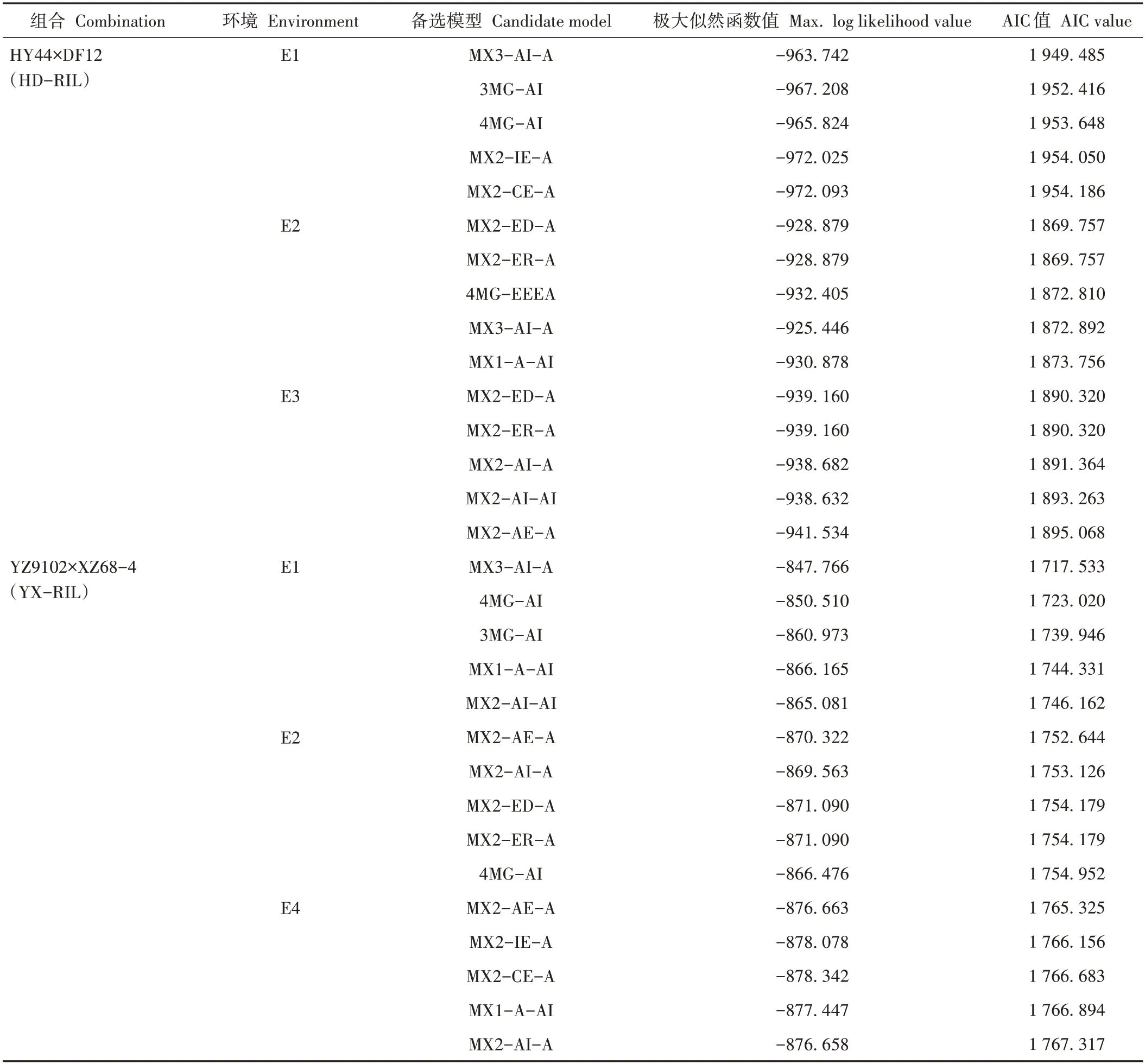
表2 不同群体相对发芽率备选模型的极大似然函数值和AIC值Table 2 MLV and AIC values of candidate models for relative germination rate in different populations
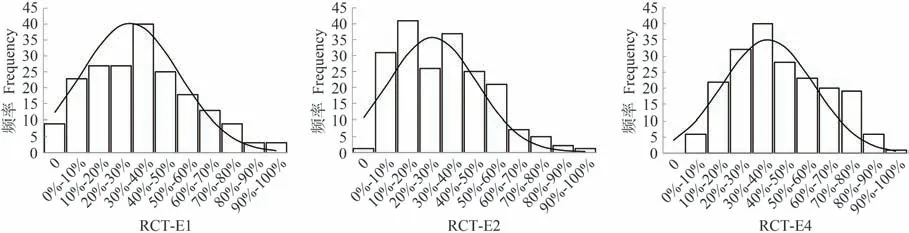
图2 YX-RIL群体相对发芽率在E1、E2、E4环境中的频率分布Fig.2 Frequency distribution for relative germination rate in YX-RIL population at E1、E2、E4
选取AIC 值最小及其接近最小AIC 值的模型作为备选模型。如HD-RIL 群体的相对发芽率在E1 环境中AIC 值最小为1 949.485,对应模型为MX3-AI-A,3MG-AI、4MG-AI、MX2-IE-A、MX2-CE-A 四个模型的AIC 值分别为1 952.416、1 953.648、1 954.050、1 954.186,接近最小AIC值,这5个模型作为备选模型,其他组合的相对发芽率在不同环境中的备选模型选择方法与上述相同。
2.3 适合性检验及其最适模型选择
选好5 个备选模型,对其进行适合性检验(均匀性检验和K-S 检验),结果见表3。HD-RIL 群体在E1 环境中5个备选模型MX3-AI-A、3MG-AI、4MG-AI、MX2-IE-A、MX2-CE-A 统计量达到显著性水平的个数依次为2、5、2、2、2,根据AIC值最小且统计量达到显著性水平个数最少的原则,最适模型为MX3-AI-A,即3 对加性上位性主基因+加性多基因控制;E2 环境中5 个备选模型MX2-ED-A、MX2-ER-A、4MG-EEEA、MX3-AI-A、MX1-A-AI 统计量达到显著性水平的个数依次为0、0、0、0、0,最适模型为MX2-ED-A,即2 对显性上位主基因+加性多基因控制;E3 环境中5 个备选模型MX2-ED-A、MX2-ER-A、MX2-AI-A、MX2-AI-AI、MX2-AE-A 统计量达到显著性水平的个数依次分别为1、1、1、1、0,最适模型为MX2-AE-A,即2 对累加作用的主基因+加性多基因控制。

表3 不同群体相对发芽率备选模型的的适合性检验Table 3 Adaptability test of candidate models for relative germination rate in different population
YX-RIL 群体在E4 环境中5 个备选模型MX2-AE-A、MX2-IE-A、MX2-CE-A、MX1-A-AI、MX2-AIA 统计量达到显著性水平的个数依次为0、0、0、0、0,最适模型为MX2-AE-A,即2 对累加作用的主基因+加性多基因控制;E1 环境中5 个备选模型MX3-AI-A、4MG-AI、3MG-AI、MX1-A-AI、MX2-AI-AI 统计量达到显著性水平的个数依次为0、3、5、0、0,最适模型为MX3-AI-A,即3 对加性上位性主基因+加性多基因控制;E2 环境中5 个备选模型MX2-AE-A、MX2-AI-A、MX2-ED-A、MX2-ER-A、4MG-AI 统计量达到显著性水平的个数依次为1、1、0、0、2,最适模型为MX2-ED-A,即2 对显性上位主基因+加性多基因控制。
2.4 两个群体相对发芽率最适模型的遗传参数估计
由表4 可知,HD-RIL 群体在E1 环境中,控制相对发芽率的第1 对主基因的加性效应值(da)为-9.26,第2 对主基因的加性效应值(db)为-3.41,第3 对主基因的加性效应值(dc)为-9.24,3 对主基因的加性效应值均为负数,具有负向效应,3 对主基因中两两主基因之间的加性效应互作值[iab(i*)、iac、ibc]分别为7.51、13.33、7.53,3 对主基因之间的加性效应互作值(iabc)为6.76,|da|+|db|+|dc|<|iab|+|iac|+|ibc|+|iabc|,说明控制相对发芽率的3 对主基因的上位性效应大于加性效应,以上位性效应为主,多基因加性效应值([d])为-12.16,为负向效应,主基因遗传率(h2mg)为86.72%。E2 环境中,第1 对主基因的加性效应值(da)为-0.15,第2 对主基因的加性效应值(db)为-23.64,说明第2 对主基因的加性效应占据主导地位,多基因加性效应值([d])为-14.88,主基因遗传率(h2mg)为74.35%,多基因遗传率(h2pg)为14.16%。E3 环境中,第1 对主基因的加性效应值(da)为-5.63,2 对主基因的加性互作效应值[iab(i*)]为13.58,多基因加性效应值([d])为-14.97,主基因遗传率(h2mg)为64.20%。
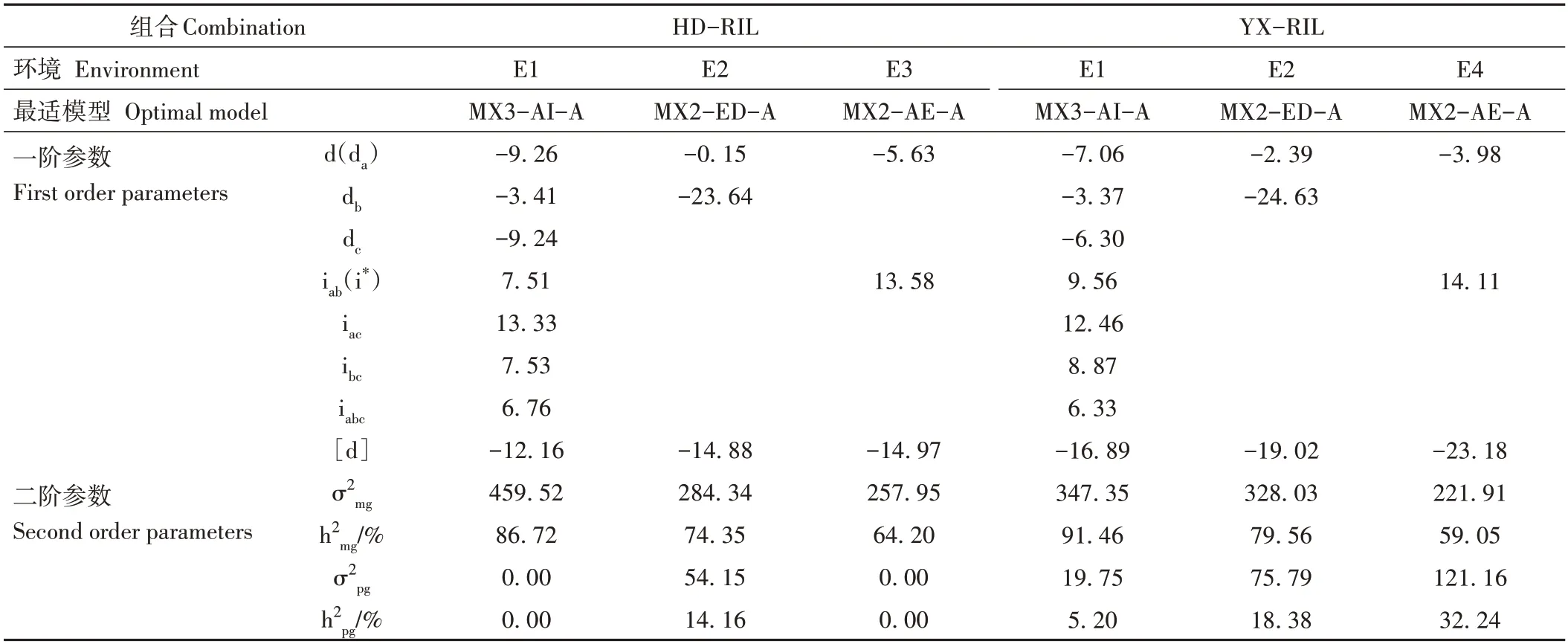
表4 不同群体相对发芽率最适模型的遗传参数Table 4 The estimates of genetic parameters of the optimal models for relative germination rate in different population
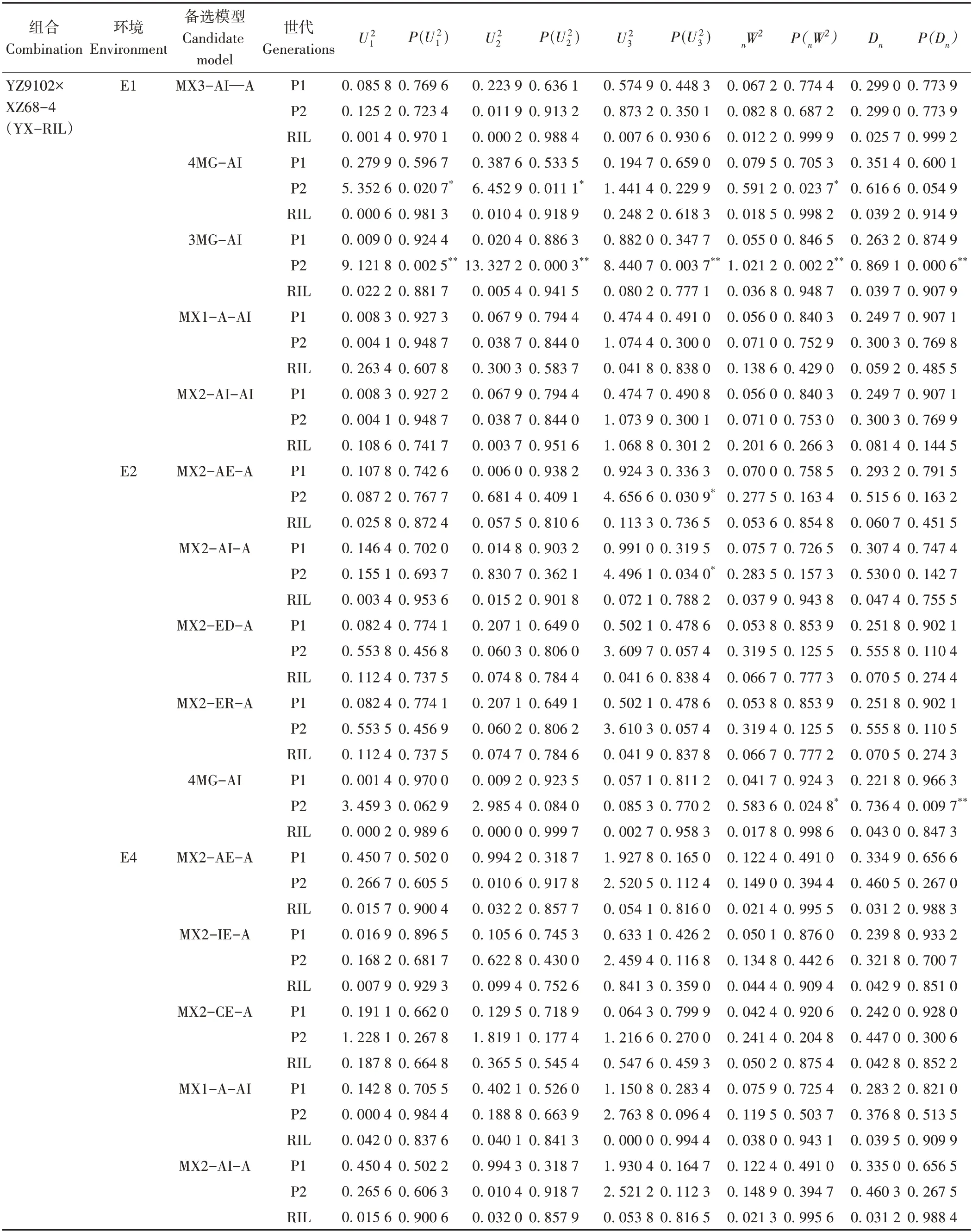
表3(续)
YX-RIL 群体在E4 环境中,控制相对发芽率的第1对主基因的加性效应值(da)为-3.98,2对主基因的加性互作效应值(iab)为14.11,多基因加性效应值([d])为-23.18,主基因遗传率(h2mg)为59.05%,多基因遗传率(h2pg)为32.24%。E1 环境中,控制相对发芽率的第1 对主基因的加性效应值(da)为-7.06,第2 对主基因的加性效应值(db)为-3.37,第3 对主基因的加性效应值(dc)为-6.30,3对主基因的加性效应值均为负数,具有负向效应,3 对主基因中两两主基因之间的加性效应互作值[iab(i*)、iac、ibc]分别为9.56、12.46、8.87,3 对主基因之间的加性效应互作值(iabc)为6.33,|da|+|db|+|dc|<|iab|+|iac|+|ibc|+|iabc|,说明控制相对发芽率的3 对主基因的上位性效应大于加性效应,以上位性效应为主,多基因加性效应值([d])为-16.89,为负向效应,主基因遗传率(h2mg)为91.46%,多基因遗传率(h2pg)为5.20%。E2 环境中,第1 对主基因的加性效应值(da)为-2.39,第2 对主基因的加性效应值(db)为-24.63,说明第2对主基因的加性效应占据主导地位,多基因加性效应值([d])为-19.02,主基因遗传率(h2mg)为79.56%,多基因遗传率(h2pg)为18.38%。
3 讨论
前人研究表明,在花生耐寒性育种中仅利用栽培花生来培育品种会增加耐寒性育种的难度,如果利用野生花生来改良栽培花生的耐寒性[25],育种成功率会大幅度提高。本研究采用的两个RIL 群体的母本花育44和远杂9102均具有野生花生的基因[26-27],可以在后代家系群体筛选出耐寒性强且综合性状优良的花生品系,为拓宽耐寒性花生育种的遗传背景提供材料基础。
本研究利用主基因+多基因混合模型分析软件中SEA-G3DH 群体对两个RIL 群体的耐寒性性状指标相对发芽率进行遗传分析,发现4 个环境中的最适模型并不一致,两个群体耐寒性性状在E1环境中均表现为3 对加性上位性主基因+加性多基因控制,在E2 环境中均表现为2 对显性上位主基因+加性多基因控制,HD-RIL 群体在E3 环境中与YX-RIL 群体在E4 环境中耐寒性性状均表现为2 对累加作用的主基因+加性多基因控制,同一环境下不同群体表现一致,同一群体在不同环境下表现不同,更能说明花生芽期耐寒性易受到环境的影响。Wynne 等[28]认为自花授粉的花生可以通过纯合的基因来固定加性效应,由此可知,在后续耐寒性花生育种中可以利用这种加性效应。
决定作物遗传性状的基因是由遗传效应较大的主基因和遗传效应较小的多基因组成的[29-30]。利用主基因+多基因混合遗传模型对表型性状进行遗传分析不仅可以预估基因的整体效应,还能估算出主基因和多基因各自的效应值[31]。将遗传分析结果与数量性状基因座(quantitative trait locus,QTL)初定位结果进行比对,可以互相验证彼此的准确性。刘海龙等[32]对花生RIL 群体的耐低温性状进行QTL 初定位,发现4 个主效QTL。本研究发现耐寒性性状由2 对或者3 对主基因+加性多基因控制,可能原因为研究材料的遗传背景不同,且试验环境不一致。下一步可利用HDRIL 群体和YX-RIL 群体对耐寒性性状进行QTL 初定位,为全面了解耐寒性性状的遗传规律提供理论基础。
4 结论
两个群体耐寒性性状在E1 环境中均表现为3 对加性上位性主基因+加性多基因控制,在E2 环境中均表现为2 对显性上位主基因+加性多基因控制,HDRIL 群体在E3 环境中与YX-RIL 群体在E4 环境中耐寒性性状均表现为2 对累加作用的主基因+加性多基因控制。说明耐寒性性状由2 对或者3 对主基因+加性多基因控制,而且以主基因控制为主。

