超声预处理对海参性腺蛋白酶解物结构特性的影响
李海静,王 松,刘红玉,夏秀芳,*
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.大庄园肉业集团股份有限公司,黑龙江 绥化 151100)
海参性腺作为海参的内脏,是海参加工过程中的一种副产品。由于加工过程中利用率较低,海参性腺常常被丢弃,不仅会造成资源浪费,而且可能导致环境污染[1]。海参性腺中蛋白质含量极高(约为55%),是优质的动物蛋白质来源[2]。目前,酶解法因酶解后溶液中无有毒化学物质残留,是提取海参副产物中蛋白质的主要方法[3]。但是传统的酶解法存在酶解时间长、酶利用率低和底物转化率低等缺点[4-5]。因此,研发新的加工方法对于提高酶解率至关重要。
超声波作为一种安全、环保、高效和无毒的新兴物理加工技术,已广泛应用于改善蛋白质的结构特性[6-9]。超声产生的空化、热效应和机械效应会破坏蛋白质分子间的氢键和疏水相互作用等,使卷曲的蛋白质分子结构展开[10-12]。当蛋白质展开时,会暴露出新的酶解位点,增加底物与酶接触的机会,从而促进酶解,提高蛋白质利用率[4,13]。此外,超声预处理导致蛋白结构的展开促使连接蛋白之间的肽键更大程度地暴露于酶,增加了酶与肽键作用的可能性,进而有利于酶分子与底物接触并发挥作用[14]。
本研究利用不同时间(0、5、15、25、35 min,200 W)超声预处理海参性腺蛋白酶解物,探究其侧链、二级和三级结构、表面疏水性、粒径和微观结构等的变化情况,确定出最佳的超声预处理时间,以期为超声技术在海参性腺蛋白开发利用方面提供理论依据。
1 材料与方法
1.1 材料与试剂
海参性腺 大连水产有限公司;中性蛋白酶(酶活力81 000 U/g) 北京索莱宝科技有限公司。
磷酸氢二钠、磷酸二氢钠、8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS) 美国Sigma公司;所用试剂均为分析纯。
1.2 仪器与设备
超声波细胞粉碎机 宁波新芝生物科技股份有限公司;721型紫外-可见分光光度计 上海元析仪器有限公司;F-4600荧光光谱仪 日本Hitachi公司;MS3000激光粒度分析仪 英国马尔文仪器有限公司。
1.3 方法
1.3.1 样品制备
将海参性腺冻干并研磨成粉末,过60 目筛。取100 g粉末添加400 mL正己烷和50 mL乙醇(8∶1,V/V),搅拌1 h。4 ℃、8 000×g离心10 min,获得沉淀后,按上述方法重复操作两次。将脱脂后的海参性腺粉在室温下自然风干,置于-20 ℃贮存。
1.3.2 超声预处理
用蒸馏水将脱脂海参性腺粉(蛋白质量分数约为42.86%)配制成一定质量浓度(1 g/100 mL)的蛋白溶液并置于双层烧杯中。对溶液进行超声处理,处理参数:频率20 kHz;功率200 W[13];时间0、5、15、25、35 min;间歇模式:超声2 s和间歇2 s(防止局部过热。根据预实验所测水解度得到:未超声组水解度为7.98%,超声1 s和间歇3 s组水解度为8.15%,超声2 s和间歇2 s组水解度为10.11%,超声3 s和间歇1 s组水解度为9.06%)。超声处理后,蛋白溶液置于4 ℃保存待进一步处理。
1.3.3 酶解处理
参照Li Haijing等[15]的方法进行酶解处理。用1 mol/L NaOH溶液将超声预处理后的蛋白质溶液pH值调节至7.0,添加中性蛋白酶(添加量为4 500 U/g)后在50 ℃下进行酶解。酶解终止时,将混合物在100 ℃下煮沸10 min致中性蛋白酶失活。酶解液冷却至室温后,于10 000×g下离心30 min。通过双缩脲法测定上清液的蛋白质量浓度约为10~12 mg/mL。将上清液冻干成粉末,并在-20 ℃下贮存作进一步分析。
1.3.4 侧链结构的测定
根据Li Haijing等[15]的方法测定海参性腺蛋白酶解物的紫外-可见光谱,用0.01 mol/L磷酸盐缓冲液(pH 7.0)将1.3.3节冻干的粉末配制成0.2 mg/mL的溶液。用紫外-可见分光光度计将样品溶液在240~360 nm范围内进行扫描。并以磷酸盐缓冲液为对照。
1.3.5 二级结构的测定
根据Li Wenwen等[16]的方法使用傅里叶变换红外光谱测定海参性腺蛋白酶解物的二级结构,并使用Peak Fit Version 4.12软件对二级结构进行分析,根据酰胺I带(1 700~1 600 cm-1)各指定峰的相对面积计算海参性腺蛋白酶解物二级结构相对含量。
1.3.6 三级结构的测定
参考张熙[17]的方法并略作修改,使用荧光分光光度计测定海参性腺蛋白的三级结构。将冻干样品溶于0.01 mol/L磷酸盐缓冲液(pH 7.0)中制备1.0 mg/mL样品溶液,并在25 ℃条件下进行测定。测定条件:激发波长290 nm、狭缝宽度5 nm、发射波长310~400 nm。
1.3.7 表面疏水性的测定
根据Li Fangfei等[18]的方法测定海参性腺蛋白酶解物的表面疏水性,并略作修改。用磷酸盐缓冲液(0.01 mol/L、pH 7.0)将海参性腺蛋白酶解物溶液分别稀释至0.2、0.4、0.6、0.8、1.0 mg/mL。然后,将20 μL ANS(8.0 mmol/L)溶液添加到4 mL海参性腺蛋白溶液中,避光反应10 min。在激发和发射波长分别为390 nm和470 nm的条件下测定。
1.3.8 粒径分布的测定
参照Li Fangfei等[19]的方法测定酶解物的粒径分布。将海参性腺蛋白酶解物用蒸馏水配制成1.0 mg/mL蛋白溶液,在室温条件下用激光粒度仪测定样品的粒径分布。
1.3.9 微观结构的观察
参照Li Haijing等[15]的方法观察海参性腺蛋白酶解物的微观结构。冻干的海参性腺蛋白酶解物涂在双面导电胶上并在原料涂层上喷金约10 min,用扫描电子显微镜在5 000 倍的放大倍数下观察其形态。
1.4 数据处理与分析
每个实验重复3 次,每次3 个平行。所得数据使用IBM SPSS Statistics 22.0软件的Duncan检验进行单因素方差分析,P<0.05表示差异显著性。用Origin 2019软件作图。
2 结果与分析
2.1 超声预处理对海参性腺蛋白酶解物侧链结构的影响
蛋白质残基侧链基团(如色氨酸、酪氨酸和苯丙氨酸等)对紫外光有很强的吸收作用,色氨酸、酪氨酸和苯丙氨酸的紫外吸收峰分别在279、275 nm和257 nm波长处[20]。海参性腺蛋白酶解物侧链结构的变化可以通过苯丙氨酸在257 nm波长处的紫外-可见光谱反映。如图1所示,随着超声预处理时间的延长(0~15 min),蛋白质的紫外吸光度明显增加,当超声时间为15 min时,蛋白质的紫外吸光度增加了7.30%。这可能是因为超声时间的延长产生了更强的空化作用,破坏了蛋白质分子间的相互作用,导致蛋白质结构的展开和重排,暴露出更多的芳香氨基酸,从而使紫外吸收强度增加[21]。当超声时间从15 min延长到35 min时,蛋白质的紫外吸光度呈现下降的趋势,Huang Liuru等[22]也发现超声处理20 min和30 min后大豆分离蛋白的紫外吸收强度低于超声10 min后的紫外吸收强度,这可能是因为超声时间的延长导致一些疏水基团的嵌入或形成更大的聚集体,引起蛋白质表面发色基团数量减少,导致紫外吸光度下降。因此,适当的超声预处理时间(15 min)有利于海参性腺蛋白酶解物侧链结构的展开。

图1 超声预处理对海参性腺蛋白酶解物紫外吸收光谱的影响Fig.1 Effect of ultrasound pretreatment on the UV spectrum of sea cucumber gonad protein hydrolysates
2.2 超声预处理对海参性腺蛋白酶解物二级结构的影响
傅里叶变换红外光谱通过基线校正、反卷积、二阶导数和吸光度曲线拟合来分析蛋白质二级结构的变化[23],其中,酰胺I 带(1 600~1 700 cm-1)能够反映α-螺旋(1 648~1 664 cm-1)、β-折叠(1 615~1 637 cm-1和1 682~1 700 cm-1)、β-转角(1 664~1 681 cm-1)和无规卷曲(1 637~1 648 cm-1)的含量[24-25]。不同超声预处理时间对海参性腺蛋白酶解物二级结构及相对含量的影响如图2所示,随着超声预处理时间的延长,α-螺旋相对含量先降低后升高,在15 min时达到最小值(降低了9.98%),β-折叠相对含量的变化呈现相反的趋势,在15 min时增加了50.72%。α-螺旋是蛋白质较常见的稳定二级结构,其主要是通过分子内氢键来维持蛋白质分子内的有序排列。超声波空化作用导致蛋白质结构展开,暴露了疏水区域,使分子内氢键发生断裂而减少,从而引起α-螺旋结构含量的减少[15]。β-折叠结构含量的增加可能是因为超声预处理破坏了维持海参性腺蛋白高级结构的次级键(如氢键、静电相互作用和范德华力等),从而引起蛋白结构的展开[26]。然而,过长时间的超声预处理会中断分子间的相互作用,引起蛋白质分子聚集,从而使α-螺旋相对含量的升高和β-折叠相对含量的降低[27]。王喜波等[25]指出β-折叠含量还与蛋白质的疏水相互作用有关,其降低表明蛋白质疏水基团暴露,疏水性增强。
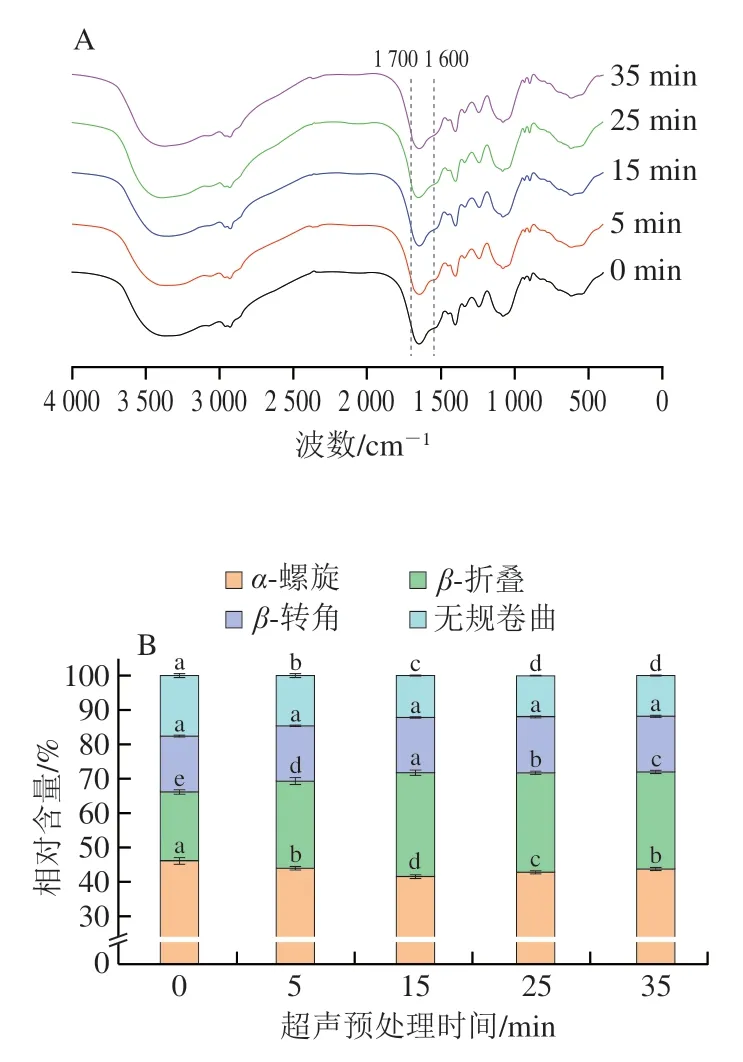
图2 超声预处理对海参性腺蛋白酶解物二级结构红外光谱(A)和相对含量(B)的影响Fig.2 Effect of ultrasound pretreatment on the infrared spectrum (A)and secondary structure composition (B) of sea cucumber gonad protein hydrolysates
超声预处理显著降低了海参性腺蛋白酶解物无规卷曲相对含量(P<0.05),而对β-转角相对含量影响不显著(P>0.05)。这一结果与戴泽川等[28]的结论一致,其同样发现随着超声时间的延长,虾肌肉蛋白的无规卷曲比例减小。超声波可以使无规卷曲的聚集结构发生解离,引起其含量下降,从而转化为β-折叠(0~15 min)或α-螺旋(15~35 min)结构,导致后两者含量升高[29]。
2.3 超声预处理对海参性腺蛋白酶解物三级结构的影响
蛋白的内源荧光光谱可以表征蛋白质中色氨酸残基的数量,直观反映蛋白质三级结构的变化情况[30]。如图3所示,在340 nm波长处附近观察到所有样品有一个荧光发射峰,不同超声预处理时间的海参性腺蛋白酶解物荧光发射峰位置变化不明显,但荧光强度有明显变化。样品的荧光强度随超声预处理时间的延长呈现先升高后降低的趋势,在15 min时有最大荧光强度(比0 min时增加了4.50%)。荧光强度的升高可能是超声预处理使蛋白质发生伸展,暴露了埋藏在蛋白质内部的色氨酸残基,引起蛋白质表面的色氨酸残基含量增加,从而表现出更强的荧光强度[20]。Zou Ye等[31]也认为超声预处理(20 kHz、100 W、10 min)可以使鸡肝水溶性蛋白质结构展开,破坏蛋白质分子的疏水键,诱导蛋白质分子内更多疏水基团暴露,从而导致荧光强度增加。随着超声时间的继续延长,荧光强度明显下降,这可能是过长时间的超声处理会使蛋白质分子发生交联、聚集,已经暴露的色氨酸基团重新内包于蛋白质内部,引起蛋白质空间位阻增加,导致荧光猝灭[17]。

图3 超声预处理对海参性腺蛋白酶解物荧光光谱的影响Fig.3 Effect of ultrasound pretreatment on the fluorescence spectrum of sea cucumber gonad protein hydrolysates
2.4 超声预处理对海参性腺蛋白酶解物表面疏水性的影响
表面疏水性可以表征蛋白分子表面暴露疏水基团的数量,是评价蛋白质分子构象变化的重要参数[32]。超声预处理时间对海参性腺蛋白酶解物表面疏水性的影响如图4所示,随超声预处理时间的延长(0~15 min),蛋白表面疏水性呈升高的趋势,当超声时间为15 min时,蛋白质的表面疏水性比0 min时增加了13.42%。Jiang Lianzhou等[27]利用超声(频率20 kHz、功率300 W、超声4 s间歇2 s)处理黑豆分离蛋白,结果发现黑豆分离蛋白表面疏水性随超声处理时间的延长(12~24 min)而升高。这可能是超声空化效应能够使蛋白氢键和分子间作用力断裂,诱导蛋白质结构展开,导致分子内部的疏水基团和区域暴露于周围的极性环境,使得荧光探针更容易与之结合,从而引起表面疏水性升高[15]。随着超声预处理时间的继续延长(15~35 min),表面疏水性开始降低。这可能是蛋白质在疏水作用的驱动下相互靠近并发生了聚集,导致暴露的疏水基团重新被包埋在蛋白内部[32]。此外,王笑宇等[33]认为超声波的作用不足以破坏蛋白质分子核心的疏水作用,过度超声(500 W、15 min)可能会使蛋白质分子结构更加疏松,导致一些亲水肽链上的基团更容易发生水合作用,使得表面疏水性降低。

图4 超声预处理对海参性腺蛋白酶解物表面疏水性的影响Fig.4 Effect of ultrasound pretreatment on the surface hydrophobicity of sea cucumber gonad protein hydrolysates
2.5 超声预处理对海参性腺蛋白酶解物粒径的影响
d0.1、d0.5和d0.9分别表示粒径累积分布(0~100%)中10%、50%和90%所对应的粒径。d3,2为粒径对表面积加权平均值(表面积平均粒径),d4,3为粒径对体积加权平均值(体积平均粒径),可以用来反映粒径的变化[34]。粒径分布和平均粒径可以反映出蛋白因结构改变发生的聚集行为[18]。超声预处理时间对海参性腺蛋白酶解物粒径分布的影响如图5和表1所示,随超声预处理时间的延长,海参性腺蛋白酶解物的体积平均粒径(d4,3)和表面平均粒径(d3,2)均先减小后增大,其中超声预处理时间为15 min时两者达到最小(36.2 nm和34.3 nm),显著低于对照组(P<0.05)。粒径分布范围也呈现类似的趋势。超声处理使蛋白粒径减小归因于超声空化效应产生的微射流和高剪切应力破坏了蛋白质分子间的相互作用,使蛋白质分解成更小的碎片[15]。田然等[35]认为,超声空化和声流的综合效应还可以增加蛋白质颗粒的碰撞速度和强度,促使大的蛋白聚集体被裂解成更小的碎片,从而引起蛋白质粒径减小。d0.1、d0.5和d0.9的变化趋势与d4,3和d3,2的变化趋势相似,表明适当时间的超声预处理(15 min)可以减小海参性腺蛋白酶解物的粒径,防止蛋白质聚集。这可能是因为适当时间超声预处理产生的机械剪切力使海参性腺蛋白分子被粉碎,导致粒径变小,而过长时间的超声作用会导致蛋白质分子重新聚集。此外,齐宝坤等[36]指出,蛋白质的表面疏水性与粒径之间呈显著负相关,即蛋白质粒径越小,其表面疏水性越大,本实验结果与其所得结论一致。当超声时间超过15 min时,海参性腺蛋白酶解物的粒径随超声预处理时间的延长而增大,这可能是因为过长时间的超声处理会产生较强的空化效应,生成过量自由基,从而加速蛋白质分子的运动,使蛋白质分子之间碰撞的机会增加,导致一些蛋白质分子聚集并形成较大的颗粒[37-38]。李笑笑[39]也认为超声处理使大豆分离蛋白粒径增大是超声处理促使部分蛋白质分子相互联接,并重新聚合所致。
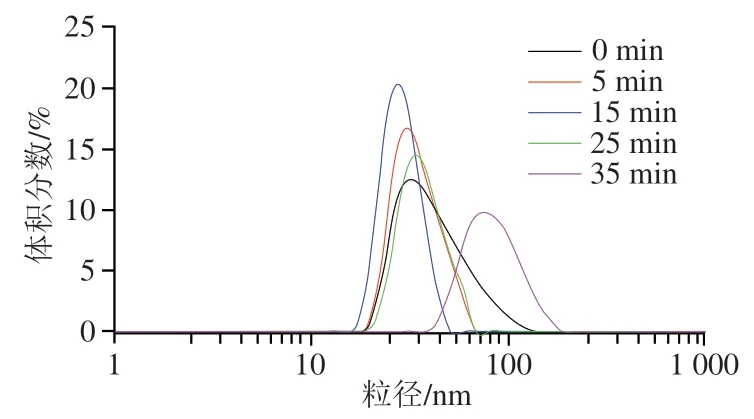
图5 超声预处理对海参性腺蛋白酶解物粒径分布的影响Fig.5 Effect of ultrasound pretreatment on the particle size distribution of sea cucumber gonad protein hydrolysates

表1 超声预处理对海参性腺蛋白酶解物平均粒径的影响Table 1 Effect of ultrasound pretreatment on the average particle size of sea cucumber gonad protein hydrolysates
2.6 超声预处理对海参性腺蛋白酶解物微观结构的影响
超声预处理时间对海参性腺蛋白酶解物微观结构的影响如图6所示,未经超声处理的海参性腺蛋白酶解物显示出许多不规则片段、小孔洞和大聚集体。随着超声预处理时间的延长(0~15 min),海参性腺蛋白酶解物组织结构出现了更多的细小孔洞,样品质地更加疏松,颗粒变小且均匀,这与粒径分析结果一致。此现象表明超声空化效应产生的微射流和高剪切应力能够有效破坏蛋白质紧密结构,使蛋白质组织结构变得疏松多孔,增强了酶与底物的相互作用,从而提高了酶解效率[40-41]。刘运[42]发现马铃薯蛋白经过超声预处理后,其颗粒变得细小,比表面积增大,从而使蛋白与酶有接触位点数量增加,酶解效率得以提高。随着超声预处理时间的继续延长(25~35 min),海参性腺蛋白酶解物出现了较多大的团聚体,表明过长时间的超声处理反而使蛋白质发生了聚集,这与荧光和表面疏水性分析结果一致。邸红艳[43]的研究也表明超声辅助提取核桃粕蛋白60 min后,原本比较分散的部分蛋白质又重新聚集。

图6 超声预处理对海参性腺蛋白酶解物微观结构的影响(×5 000)Fig.6 Effect of ultrasound pretreatment on the microstructure of sea cucumber gonad protein hydrolysates (×5 000)
3 讨论
海参性腺富含蛋白质、多糖、精氨酸、赖氨酸等营养物质,但在海参的加工过程中,海参性腺通常作为下脚料被丢弃,造成了资源浪费和环境污染[44]。大量研究表明蛋白酶可以促进海参性腺的水解,从而获得更容易被人体吸收的蛋白水解物[45-47]。然而,常规酶解法存在着时间长和效率低等问题[4],超声波作为一种无损、绿色的新兴加工技术可以有效提高酶解速率和酶利用率[48]。因此,本研究通过对海参性腺蛋白酶解物侧链结构、二级结构、三级结构、表面疏水性、粒径分布和微观结构进行分析,探究超声预处理对海参性腺蛋白酶解物结构特性的影响,以期提高海参性腺蛋白的酶解效率。
然而,超声处理在改善蛋白结构特性方面并不总是具有积极作用。本实验结果表明:较长时间超声预处理(25~35 min)的海参性腺酶解物紫外吸收强度、荧光强度和表面疏水性均低于短时间超声预处理(0~15 min)样品,这可能是过度的超声处理导致展开的蛋白质变性,再次发生折叠或聚集,一些疏水基团被包埋于蛋白内部[49]。黄朝汤[50]得到了与本研究不同的结果,即经短时间超声预处理(0~20 min)的小麦蛋白水解物紫外吸光度和荧光强度均低于长时间超声预处理(40~80 min)样品,推测可能是较短时间的超声处理产生较低强度的空化效应,不足以使蛋白质结构展开,一些疏水基团仍包埋于蛋白质内部[51]。因此,针对不同的实验原料及研究对象,应确定适宜的超声预处理参数。
4 结论
不同时间的超声预处理能不同程度地改变海参性腺蛋白酶解物的结构,随着超声预处理时间的延长,海参性腺蛋白质结构先展开后发生聚集。其中,15 min超声预处理能最大程度地促进海参性腺蛋白结构的展开,暴露出更多的酶解位点和疏水基团。经超声预处理15 min的蛋白颗粒最小。因此,适当的超声波预处理(15 min)能够促进海参性腺蛋白酶解物结构的展开和提高酶解作用,减少聚集体的形成,从而提高海参性腺的利用价值。本研究可为超声波在海参及其副产品中的应用提供一定的理论依据和技术支持。

