Cr掺杂对β-MnO2晶体结构和性能的影响*
丁欣颖, 王鹏成, 刘静怡, 温元斌, 卿晨
(云南师范大学 物理与电子信息学院,云南省光电信息技术重点实验室,云南 昆明 650500)
1 前言
制备简单、价格低廉、环境友好、适合大规模生产以及高电压、高容量、低毒性的二氧化锰(MnO2)[1-2]已被广泛研究并应用于各种储能系统.二氧化锰晶体由MnO6八面体组成,其中每个Mn离子与八面体中的氧离子配位,八面体通过其边缘或角相连接,形成了不同晶型的晶体结构,包括α-MnO2(2×2隧道)[3]、β-MnO2(1×1隧道)[4]、γ-MnO2(1×2和1×1隧道)[5]、λ-MnO2(尖晶石型)[6]和δ-MnO2(层状结构)[7].水系锌离子电池[8-9]由含锌的水电解液、锌金属负极和能够可逆脱嵌Zn2+的正极材料组成,理论计算证明,Cr-O结合键的强度(461 kJ·mol-1)大于Mn-O结合键的强度(362 kJ·mol-1)[10],可以增强β-MnO2在Zn2+脱嵌过程中的电子转移性能,同时抑制Jahn-Teller效应[11-12]引起的结构变形,进而减少Mn的溶解,提升锌离子电池的循环寿命;本文设计在β-MnO2中掺杂Cr来提高其作为锌离子电池正极材料的性能,通过一步水热法合成MO和CMO材料,研究了Cr掺杂对β-MnO2晶体结构及其作为锌离子电池正极材料性能的影响.
2 实验
将25 mL的0.1 M MnSO4溶液和25 mL的0.1 M (NH4)2S2O8溶液混合均匀,转移至容积为100 mL的高温反应釜中,置于鼓风干燥箱中140 ℃保持12 h,自然冷却至室温后,收集沉淀物并使用去离子水和无水乙醇交替洗涤三次,80 ℃下干燥12 h,即可制备出β-MnO2.保持其他条件不变,在上述溶液中额外加入Cr(NO3)3·9H2O,使溶液中Mn元素和Cr元素物质的量之比为19∶1,制备得到5 % Cr掺杂的MnO2.
将制备的正极材料、聚偏二氟乙烯(PVDF)和导电剂(Super P Li∶碳纳米管9111=4∶1)按照8∶1∶1的比例在N-甲基-2-吡咯烷酮(NMP)中混合制成均匀浆料,随后均匀涂覆在不锈钢箔表面,在80 ℃下真空干燥12 h,切割成直径为12 mm的正极圆片,平均质量负载为1.84 mg·cm-2.使用锌金属片作为负极,以Whatman GF/D (两层)作为隔膜,电解液中ZnSO4和MnSO4浓度分别为2 M和0.1 M,采用CR2025型纽扣电池壳组装成纽扣电池.将组装好的纽扣电池在室温下静置4-6 h,室温下对电池进行循环伏安法(CV)、恒电流充放电性能和倍率性能测试.
3 结果与分析
3.1 MnO2结构表征
3.1.1 X射线衍射分析
图1(a)所示为水热法制备的MO和CMO的X射线衍射结果.图1(a)与JCPDS NO.24-0735一致,表明合成的样品结构与β-MnO2相同,尖锐清晰的衍射峰表明样品结晶性良好.图1(b)为(110)晶面衍射峰,CMO(110)晶面的衍射峰相比MO向左偏移,说明CMO(110)晶面的间距相比MO增大,有利于Zn2+在β-MnO2晶体隧道结构中的扩散.
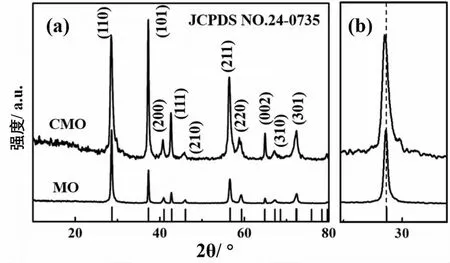
图1 MO和CMO的(a)XRD谱图和(b)(110)晶面局部放大图
3.1.2 透射电镜表征
为了进一步观察MO与CMO的结构差异,对MO和CMO样品进行透射电子显微镜(TEM)和高分辨透射电子显微镜(HRTEM)测试(如图2).从图2(a)和(b)可以看出样品均为纳米棒结构;图2(c)是CMO的高分辨透射图,清晰的晶格条纹说明样品为单晶.图2(c)中CMO的0.312 nm晶面间距稍大于JCPDS NO.24-0735中(110)晶面的晶面间距(0.311 nm),进一步表明Cr的引入使(110)晶面间距增大.

图2 (a)MO和(b)CMO的TEM图像,(c)CMO的HRTEM图像
3.1.3 光电子能谱分析
为考察Cr掺杂对MO结构的影响,对MO和CMO进行光电子能谱(XPS)测试.MO和CMO的XPS全谱如图3(a)所示,两个样品均检测出Mn和O元素,分别位于642.20 eV和530.10 eV处;Cr元素峰位于577.08 eV.图3(b)-(d)分别为MO和CMO样品中Mn 2p、O 1s和Cr 2p的XPS图谱.图3(b)中两个Mn 2p1/2峰分别出现在约653.68 eV和657.14 eV处,Mn 2p3/2峰值可进一步拟合为642.17 eV和645.54 eV,说明两个样品中的Mn均表现为Mn3+和Mn4+的价态.图3(c)所示的O 1s的两个特征峰值出现在529.58 eV和530.84 eV,分别对应于Mn-O-Mn和Mn-O-H[13-14]两种不同位点的O元素.图3(d)中,CMO出现Cr 2p的两个特征峰(576.91 eV和586.38 eV),表明Cr元素进入MnO2晶格中.
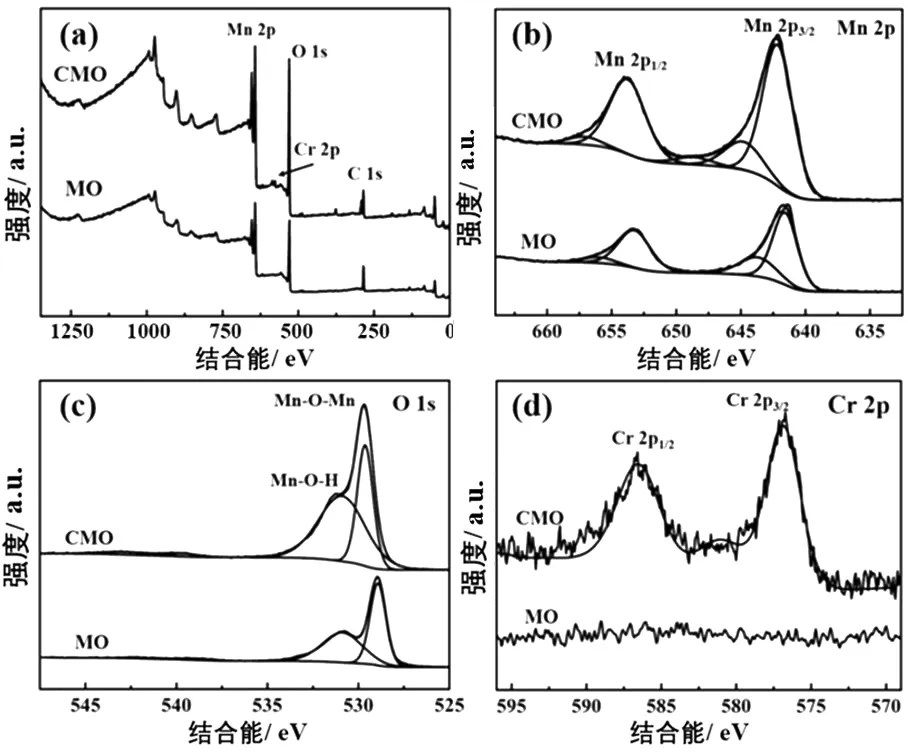
图3 MO和CMO的X射线光电子能谱(XPS)图谱
3.2 MnO2电极的锌离子电池性能研究
3.2.1 循环伏安曲线与比容量分析
通过对以MO和CMO材料为正极的水系锌离子电池进行循环伏安测试(CV),分析了电极材料在充放电过程中的氧化还原反应过程.图4为在0.5 mV·s-1扫描速率下MO与CMO的CV对比图,电压测试范围为1.0-1.8 V.从图4可以看出MO和CMO分别在1.06 V和1.19 V,1.08 V和1.23 V出现两个还原峰电位,分别对应于Zn2+和H+嵌入MO和CMO电极的过程,在此过程中初始的Mn4+还原为Mn2+;在充电过程中,分别在1.65 V和1.69 V,1.63 V和1.68 V出现两个氧化峰电位,分别对应于Zn2+和H+脱出电极的过程,在此过程中Mn2+被氧化成Mn4+进而形成MnO2.

图4 MO和CMO电池的循环伏安曲线
利用新威电池测试系统测量了MO和CMO电池前两圈的比容量,获得图5所示曲线(电流密度设定为0.1 A·g-1,电压范围在1.0-1.8 V).从图5可以看出MO电池在第一圈放电比容量为123 mAh·g-1,第二圈充电比容量为139 mAh·g-1;CMO电池在第一圈放电比容量高达180 mAh·g-1,第二圈充电比容量为178.5 mAh·g-1,Cr的引入提升了Zn2+在晶体结构中的脱嵌,从而提高了水系锌离子电池的比容量.
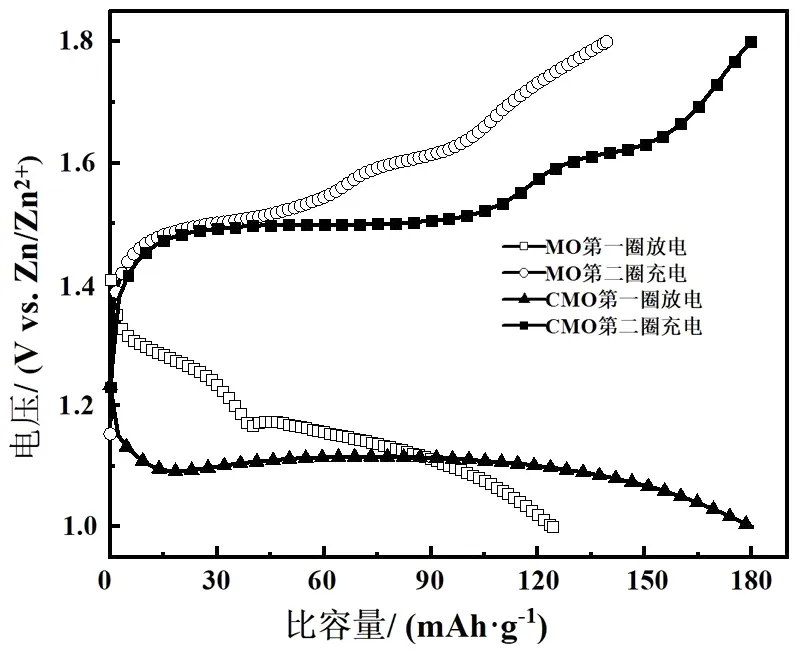
图5 MO和CMO在0.1 A·g-1电流密度下前两圈的比容量曲线
进一步测试了MO和CMO电池分别在0.1-1、0.2-1、0.4-1、0.6 A·g-1和0.8 A·g-1(10个循环)的电流密度下的倍率性能,结果如图6所示.当电流密度增大时,MO和CMO电池放电比容量均出现明显下降,这是由于随着电流的增大,放电时间缩短,Zn2+没有完全进入到电极材料的隧道结构中,此外在充放电过程中存在一定量Mn溶解,导致锰氧八面体结构的坍塌,也会引起容量的下降.当Cr元素掺入β-MnO2中替代了其中Mn时,由于Cr-O结合键键能强于Mn-O结合键键能,使得锰氧八面体的结构稳定性加强,有利于Zn2+在β-MnO2晶体中的脱嵌,使得CMO电池的倍率性能相比MO电池增强.
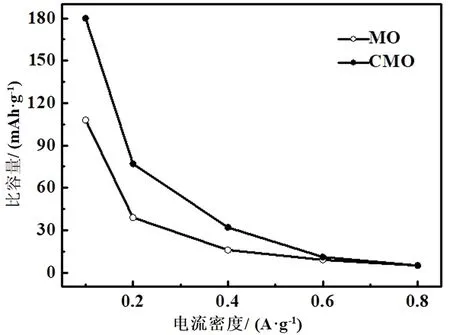
图6 MO和CMO在不同电流密度下的比容量
3.2.2 充放电循环寿命测试
MO和CMO电池前100圈的循环寿命性能如图7所示,测试的电流密度为0.1 A·g-1.由图7可知,MO电池在0.1 A·g-1的电流密度下首圈放电比容量仅为123 mAh·g-1,100圈后的比容量严重衰减至26 mAh·g-1,容量保持率只有21%;而CMO电池的首圈放电比容量高达180 mAh·g-1,循环100圈后,电池的放电比容量为68 mAh·g-1,容量保持率为38%,说明Cr的掺入显著提升了β-MnO2作为锌离子电池正极材料的循环寿命.
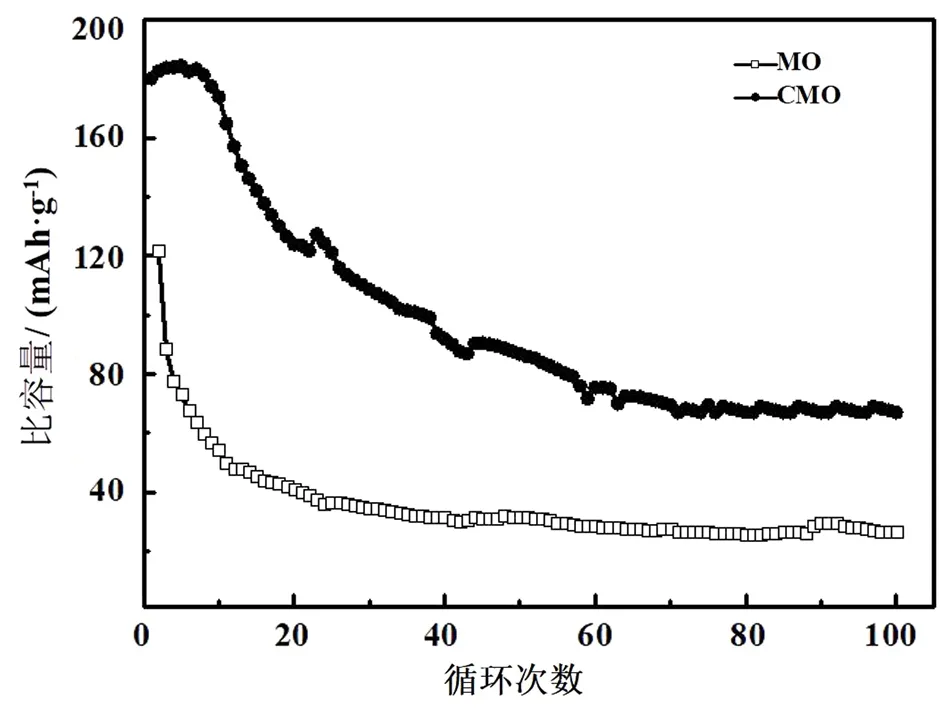
图7 0.1 A·g-1电流密度下MO和CMO的100圈循环寿命测试
4 结语
利用水热法合成了一维纳米棒结构的β-MnO2和Cr掺杂的β-MnO2,通过XRD、TEM和XPS对其结构进行了表征分析,并测试以其为正极材料的水系锌离子电池的性能.实验结果表明,Cr的引入扩大了β-MnO2的晶面间距,促进了锌离子在β-MnO2隧道结构中的扩散,同时抑制了Jahn-Teller效应引起的结构变形,减少了β-MnO2中Mn的溶解和相变,提升β-MnO2作为水系锌离子电池正极材料的比容量及充放电过程中的循环稳定性,为优化β-MnO2作为水系锌离子电池正极的性能提供了理论指导.

