经食管超声心动图引导下复杂房间隔缺损封堵的安全性研究
徐成玉,向艏博,左明良,陈秋佚,冯雪涛,薛 鸿,向 波,于 涛
(1.四川省广汉市中医院超声科,四川 广汉 618300;2.四川大学华西临床医学院,四川 成都 610041;3.四川省心血管病临床医学研究中心,四川 成都 610072;4. 成都市第一人民医院心功能科,四川 成都 610000)
既往先天性心脏病继发孔型房间隔缺损(atrial septal defect, ASD)多采用透视下经皮封堵,因其较外科修复可避免体外循环,具有减少胸部疤痕,住院时间短,术后并发症少等优势,目前已成为部分继发孔ASD介入治疗的首选[1]。然而,其需要较大放射装备,医生和患者均射线损伤,输送装置较长且前端不可弯曲等不足。近年来,随着外科微创技术的发展,输送装置可调弯鞘的出现,新的术式——经食管超声心动图(transesophageal echocardiography, TEE)引导经胸微创封堵术及经颈静脉ASD封堵因其无射线辐射,手术路径短,术中即可查看效果等优点,得到越来越多医生的认可[2~5]。由于复杂病变如ASD残端较短(除主动脉端外)或腔静脉型ASD,是导致封堵器脱落的最常见原因[6,7];缺损过大,超过25 mm,亦为临床挑战[8]。本文拟采用TEE引导下,对后缘及下缘不足或缺损过大的房间隔缺损患者行经颈静脉或经胸小切口封堵,探索其安全性、可行性,为手术适应证的选择提供依据。
1 资料与方法
1.1 一般资料收集2016年1月至2021年1月我院下后缘不足或过大房间隔缺损患者42例。纳入标准:房间隔缺损后缘或下缘残端<5 mm,或同时合并主动脉侧边缘不足(<5 mm),或缺损直径≥30 mm。排除标准:年龄<18岁,合并重度肺动脉高压。其中男10例,女32例,年龄(33.0±11.8)岁,活动后心慌心累29例,缺损大小(32.2±6.6)mm,其中缺损≥30 mm 20例,4例缺损≥38 mm;单纯边缘不足22例,其中下后缘不足19例,下后缘不足+前缘不足3例,同时合并残端不足18例; 28例为椭圆形。所有患者均知情同意。本研究经我院伦理委员会批准。
1.2 方法
1.2.1 超声检查分别于术前及术中使用Philip EPIQ 7C及CX50型彩色多普勒超声诊断仪,探头S5-1,X7-2t。术前根据Akagi[9]从经胸超声心动图(transthoracic echocardiography,TTE)三个标准切面即四腔心切面房室瓣水平(前下缘)和上缘,短轴切面主动脉(前上缘)和后缘(右上肺静脉),双腔切面上下腔静脉残端(后上缘、下后缘)进行评估(心室收缩末期测量)。术中TEE三维确定缺损形状,进一步明确缺损大小、边缘及圆形指数(缺损最大径/最小径)。如圆形指数>1.5为椭圆形,残端<5 mm被认为残端不足[10]。四腔心切面或双腔右房面测量房间隔总长度。根据超声心动图检查测量指南测量右心房(RA)、右心室(RV)、左心房(LA)、左心室(LV),主肺动脉(MPA),血流动力学参数[11]包括肺动脉瓣前向血流速度(PSV);三尖瓣反流速度(TRV);二尖瓣前向血流速度峰值E(MVE);二尖瓣前向血流速度峰值A(MVA);二尖瓣瓣环E′(MVE′);二尖瓣瓣环A′( MVA′),E/E′。
1.2.2 手术方法所有患者于TEE引导下行经颈静脉或经胸小切口房间隔封堵术。患者取仰卧位,经颈静脉或经胸小切口[7]。经颈静脉者使用可调弯鞘,导丝通过右颈内静脉进入右房后给予全身化肝素1 mg/kg,可调弯鞘通过导丝穿过房间隔进入左房。1例巨大房间隔缺损经颈静脉入路封堵术中超声图像见图1。经胸小切口者自右前乳腺下胸廓切开约2 cm,打开心包,悬吊暴露右房,1.5~2 cm荷包线缝合。注入肝素100 U/kg,选择合适的输送鞘及封堵伞,沿导丝将输送鞘送入左心房。TEE引导下打开左右伞盘,观察封堵器形状,观察各边缘房间隔残端与封堵器伞盘是否位于左右心房两侧,其腰与房间隔残端是否贴合,是否有残余分流;实时观察各瓣膜情况,并行牵拉试验。对于经胸小切口封堵,下后缘残端不足,TEE引导下行局部缝线加固封堵法,如无异常释放封堵器。术后均口服阿司匹林1~2 mg/kg,共3~6月。患者出院时复查超声心动图、心电图、胸片检查,了解有无心包积液、心律失常等并发症,观察封堵器位置及心脏重构情况,术后常规随访。
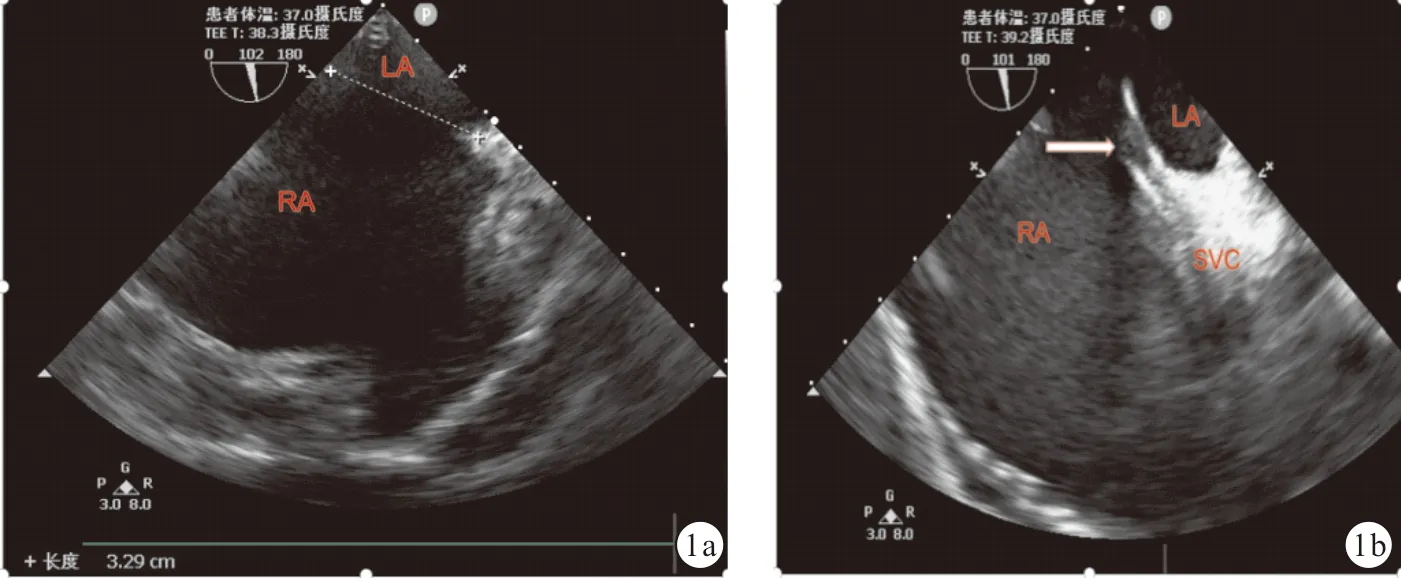
图1 1例巨大房间隔缺损术中超声图像 a:巨大房间隔缺损(≥30 mm);b:TEE引导下,经颈静脉入路,可调弯鞘经上腔静脉弯曲进入左心房(箭头所示)。SVC:上腔静脉
1.3 统计学方法采用SPSS 19.0软件进行统计学分析。计量资料以均数±标准差表示,组间比较采用配对t检验。P< 0.05 为差异有统计学意义。
2 结果
2.1 术中情况42例患者中,经颈静脉封堵22例,经胸小切口封堵20例。封堵成功41例,其中1例术后24小时内封堵器脱落至RA,急诊经胸小切口选用大伞封堵成功,见图2。1例术后24小时内封堵器脱落,急诊行开胸手术治疗。术前三尖瓣反流31例,术中TEE均显示反流不同程度较少。
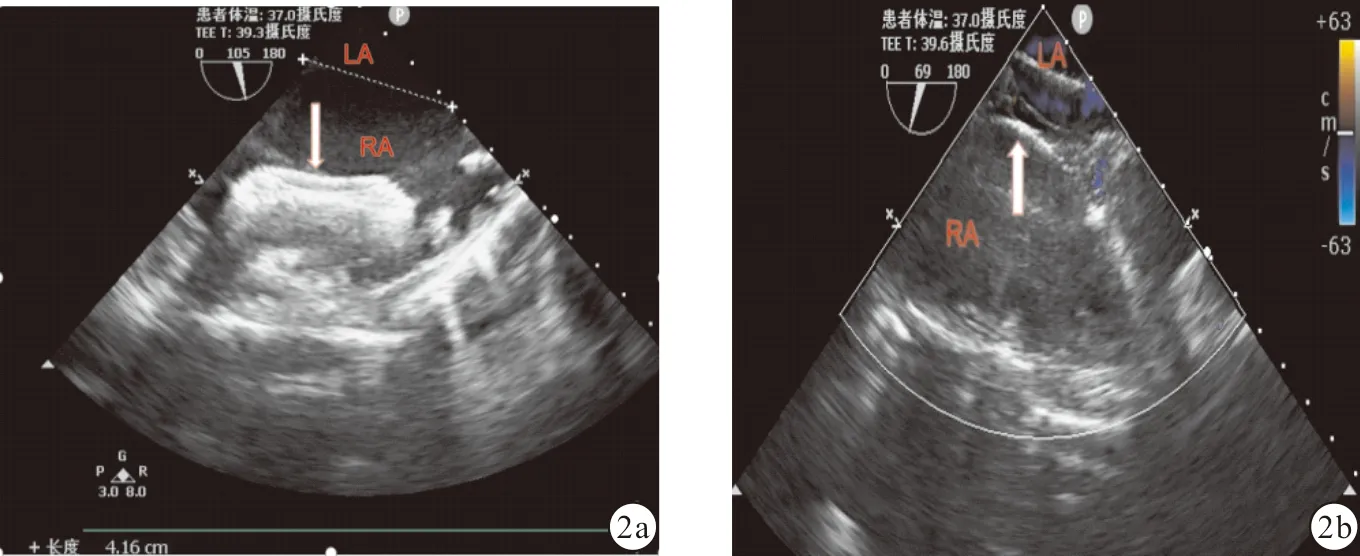
图2 典型病例房间隔封堵超声影像 a:TEE引导下经颈静脉封堵24小时内封堵器脱落至右房(箭头所示);b:经胸小切口TEE引导下再次封堵,下后缘加固
2.2 封堵前和术后出院前心脏结构比较与封堵前比较,术后出院前检查RA、RV减小,LA、LV增大,差异有统计学意义(P<0.05)。见表1。
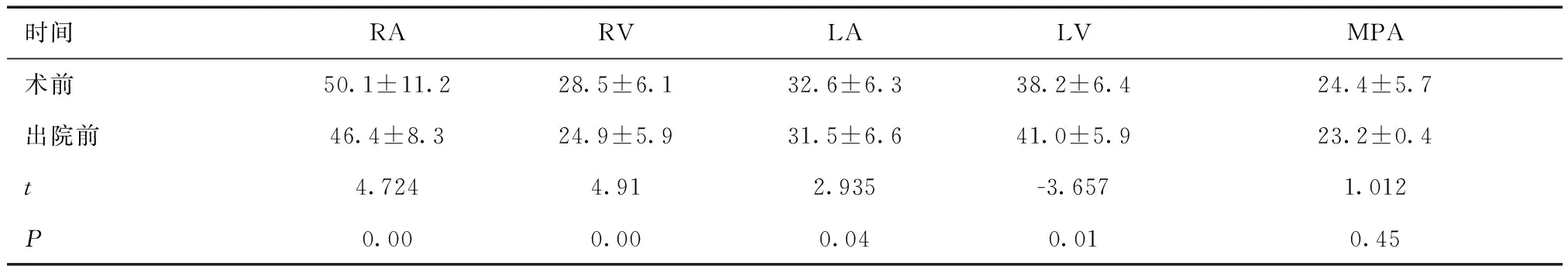
表1 封堵前后心脏结构比较 (mm)
2.3 封堵前与术后出院前血流动力学比较与封堵前比较,术后出院前PSV、TRV,MVE′及MVA′均降低,差异有统计学意义(P<0.05)。见表2。

表2 封堵前后血流动力学比较
2.4 随访情况术后6月随访,41例封堵成功的患者无封堵伞脱落及死亡病例,无封堵器腐蚀发生,2例残余少量分流随访6月消失。2例术后合并心包积液,其中1例中量心包积液行引流术,1例少量心包积液随访半月后消失。术后出现房性早搏2例,随访6月消失,无新增心律失常等并发症发生。
3 讨论
自1976年Mills和King实现经皮封堵继发孔ASD以来[12],该技术已成为临床医生首选有效且安全的方法。且其麻醉和住院时间短,并发症少[9]。然而,并非所有缺损均适合经皮封堵,患者自身情况、缺损大小及缺损位置,是影响封堵适应症的重要因素。
既往报道,房间隔缺损残端不足、尤其下腔静脉或后缘不足,常常是不能封堵的重要原因[13,14]。后下缘缺失常常导致封堵器栓塞或残余分流[15]。Ohno等[16]发现,1/3患者因残端不足(下腔静脉和/后缘)而行外科补片修复,且外科体外循环下修复下腔静脉缘不足的ASD患者是可靠、并发症少[17]。本研究发现,通过经胸小切口封堵,缝线加固于下腔静脉近右下肺静脉处,术后无残余分流,右心房室明显减小,左心房室有增大趋势,三尖瓣反流速度降低。与Wang等结果一致[18],证实该方法可行、安全有效。
房间隔缺损过大被认为不适于封堵,最大径不能超过38 mm,>30 mm即被认为是巨大挑战。Ohno等[16]发现,1/2患者因缺损太大(>36 mm)行外科修复手术;同时也是导致腐蚀、房室瓣反流、完全性房室传导阻滞或心动过缓的危险因素[19]。本研究中,通过术前准确测量房间隔伸展径,全程TEE引导封堵,TEE实时观察无房室瓣反流加重及无冠状静脉窦受阻提示适合封堵。1例患者术后第二天封堵器脱落,经胸小切口封堵选择较大封堵器再次封堵后成功。
房间隔缺损测量通常为缺损最大径,而通常缺损并非圆形。本研究显示巨大缺损形状多数为椭圆形;如其中一例最大长径40 mm,其短径18 mm,表明单一的径线并不能反映ASD的真实形状和面积[20]。此外,房间隔足够的伸展径容纳封堵器亦是重要因素。本研究中,1例封堵器脱落,是房间隔伸展径不够长。在选择封堵器的时候,不能使用过大的封堵伞,是导致失败的主要原因。
全超声引导下先天性心脏病封堵,是近十年来迅速发展的技术手段。从最初TTE/TEE仅用于补充X射线成像,到应用于实时三维TTE辅助ASD封堵减少DSA照射时间及手术时间[21];到非透视下全超声(TTE/TEE)引导下先天性心脏病封堵[22];从股静脉入路,到颈静脉短路径、可调弯鞘输送器封堵[4,22]、经胸小切口微创封堵。经胸小切口微创封堵可用于因下腔静脉缘残端较短、软的经股静脉ASD封堵不成功患者[3]。本研究中,TEE全程引导封堵过程,实时显示导丝及输送鞘位置,引导可调弯鞘向左后方弯曲进入左房,监测封堵器释放的整个过程。无辐射、全TEE引导ASD封堵被证实具有可行、安全和有效。
总之,对于复杂病变,如巨大缺损或残端不足,可根据缺损大小、形状和位置,选择经颈静脉或经胸小切口封堵。为扩大封堵适应证提供依据,但对经验积累要求较高[23,24]。需要大样本量和增加随访时间以证实其远期效果,如封堵器诱导的晚期房性心律失常、房室瓣反流、心肌组织反应[8]。

